
1 семестр ФИБС / Химия Яльмяшева / ЛР7
.pdfМИНОБРНАУКИ РОССИИ САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ ЭЛЕКТРОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ «ЛЭТИ» ИМ. В.И. УЛЬЯНОВА (ЛЕНИНА) Кафедра физической химии
ОТЧЕТ по лабораторной работе №7
по дисциплине «Химия» Тема: Коррозия и защита металлов
Студентка гр. 1587 |
|
Сысоева С.Р |
|
Преподаватель |
|
|
Кириллова С.А |
Санкт-Петербург
2021
2
Цель работы: изучение влияния некоторых факторов на протекание процессов химической и электрохимической коррозии и методов защиты металлов от коррозии.
Основные теоретические положения
Коррозия – это окислительно-восстановительный процесс самопроизвольного разрушения металлов и металлических сплавов вследствие их взаимодействия с агрессивной окружающей средой. Восстановителем является разрушающийся металл, а окислителем – вещества из окружающей агрессивной среды. Коррозия металлов – нежелательный процесс, так как в результате коррозии металлы окисляются (переходят в окисленную (ионную)
форму) и теряют свои свойства, что приводит в негодность металлические материалы и конструкции. Коррозия металлов имеет место в большей или меньшей степени всюду, где эксплуатируются металлические изделия и конструкции, и наносит значительный ущерб в различных сферах деятельности человека (как в отраслях промышленности, так и в быту). По механизму протекания различают два типа коррозии металлов: химическую и электрохимическую.
Химическая коррозия – это взаимодействие металлов с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекают без пространственного разделения процессов окисления и восстановления. Не возникает электрического тока между отдельными участками поверхности металла. При таком взаимодействии окислитель, отнимая у металла валентные электроны, одновременно образует с ним химическое соединение. Основными, наиболее распространенными видами химической коррозии являются:
– газовая – протекает под воздействием сухих горячих газов (где невозможна конденсация влаги на поверхность металла), обуславливается возможностью
3
взаимодействия при данной температуре металла с агрессивными компонентами коррозионной среды (кислородом, серой, галогенами и другими окислителями);
– жидкостная – протекает в безводной среде жидких неэлектролитов: фенол,
хлороформ, жидкое топливо (бензин, керосин, нефть), смазочные масла.
Электрохимическая коррозия – это самопроизвольное разрушение металлов в электролитически проводящих средах (в растворах или расплавах электролитов, на воздухе, в почве и т. п.).
При электрохимической коррозии окисление металла и восстановление окислительного компонента коррозионной среды пространственно разделены и представляют собой различные стадии процесса окисления-восстановления,
скорости которых зависят от электродных потенциалов.
Пространственное разделение процессов окисления и восстановления обусловлено возникновением разности потенциалов на электрохимически неоднородной (гетерогенной) поверхности металлов или при контакте разнородных металлов. Причинами электрохимической неоднородности поверхности металла могут служить наличие примесей в металле, структурная неоднородность металла, неоднородность внутренних напряжений в металле,
различная обработка отдельных его участков, неодинаковые условия окружающей среды, в которых находятся различные участки поверхности металла (различный доступ воздуха к участкам, различная концентрация электролита, различная температура).
Металл (или участок металла) с более отрицательным электродным потенциалом выступает в качестве анода. На аноде протекает процесс
окисления металла, который можно записать: Me0 – nē Men+
Менее активный металл (участок металла) является катодом. На катоде
протекает процесс восстановления. Катодные процессы протекают с участием
4
молекул и ионов среды, и отличаются в зависимости от среды, в которой
протекает коррозия:
–в кислой среде: 2Н+ + 2ē = Н2
–в кислой среде с участием растворенного кислорода: О2 + 4ē + 4Н+ = 2H2O
–в нейтральной и щелочной среде: 2Н2О + 2ē = Н2 + 2ОН–
–в нейтральной и щелочной среде с участием растворенного кислорода: О2 + 4ē + 2H2O = 4ОН
Основные методы защиты от коррозии:
Нанесение защитных покрытий.
Самый распространенный метод защиты металлов от электрохимической коррозии – нанесение различных защитных металлических и неметаллических покрытий или превращение поверхностного слоя металла в инертное химическое соединение, стойкое к воздействию окружающей среды.
Неметаллические покрытия (лаки, краски, эмали и др.) являются самым распространенным видом защиты металлов от коррозии. Основная роль неметаллического покрытия как средства защиты металлов от коррозии сводится к изоляции металлической поверхности от внешней коррозионной среды.
Неорганические покрытия – пассивация металлов. Большинство металлов окисляются кислородом воздуха с образованием на поверхности оксидных пленок. При защите металлов от коррозии целесообразно улучшать самопроизвольно образующуюся на поверхности металла защитную оксидную пленку искусственным путем, создавая пленки, обладающие более высокой коррозионной стойкостью, чем основной металл.
Пример: оксидирование алюминия и магния, оксидирование (воронение)
стальных изделий – на поверхности металла образуются защитные оксидные пленки; фосфатирование стальных и железных изделий, слаболегированных чугунов, цинка, алюминия и его сплавов – образуются фосфатные пленки.
5
Снижение агрессивности коррозионной среды.
Понижение агрессивности среды путем ее соответствующей обработки широко используется для предотвращения коррозионных разрушений металлоконструкций. В случае газовой коррозии металлов сводится к созданию атмосферы, исключающей термодинамическую возможность протекания химической реакции взаимодействия металлов с компонентами газовой среды.
В случае электрохимической коррозии обработка коррозионной среды сводится к уменьшению содержания в ней деполяризатора или введения в нее замедлителей (ингибиторов) коррозии металлов. Уменьшение содержания деполяризатора достигается нейтрализацией кислых растворов, вызывающих коррозию с водородной деполяризацией, или удалением из раствора электролита кислорода, вызывающего коррозию с кислородной деполяризацией.
Принцип действия значительного числа ингибиторов заключается в адсорбции ингибитора на корродирующей поверхности и последующем торможении катодных или анодных процессов электрохимической коррозии.
Пример: Защиту ингибиторами применяют в системах с постоянным или мало обновляемым объемом коррозионной среды, например, в резервуарах,
цистернах, паровых котлах, системах охлаждения, некоторых химических аппаратах, травильных ваннах для снятия окалины, а также при хранении и транспортировке металлических изделий.
Повышение коррозионной стойкости металлов и сплавов легированием.
К числу мер борьбы с коррозией, основанных на повышении коррозионной стойкости металлов, можно отнести термообработку и коррозионностойкое легирование. Термообработка способствует гомогенизации структуры металла,
снятию внутренних напряжений, предотвращению выпадения карбидов по границам зерен, что повышает коррозионную стойкость металла.
Создание коррозионностойких сплавов достигается легированием – введением в
их состав различных добавок (хрома, никеля, титана, молибдена, меди, кремния,
алюминия, бериллия и др.), которые в большинстве случаев уменьшают анодную
6
активность сплава за счет его пассивации в определенных коррозионных средах либо переводят местную коррозию металла в менее опасную сплошную коррозию.
Пример: Основным легирующим элементом, который обеспечивает коррозионную стойкость стали является Cr. Хром – самопассивирующий элемент. Коррозионная стойкость повышается в результате образования плотной пленки оксида Cr2O3. Cr основной элемент для всех коррозионностойких сталей.
По каким признакам кроме механизма протекания классифицируют
процессы коррозии?
По виду коррозионной среды и условиям Газовая коррозия, подземная коррозия, атмосферная коррозия,
биокоррозия, контактная коррозия, радиационная коррозия, коррозия под напряжением, фреттинг-коррозия, межкристаллитная коррозия, щелевая коррозия
Классификация по типу коррозионной деструкции
1.Сплошная коррозия – ржавчине подвергается поверхность целиком
(равномерная, неравномерная)
2.Избирательная коррозия — ржавеет один из компонентов сплавов или обособленная структурная секция (например, реакция обесцинкования латуни).
3.Местная коррозия — разрушению подвергаются сепаратные пятна целостного объекта.
Термодинамические и кинетические аспекты протекания коррозии.
Термодинамика указывает на принципиальную возможность протекания
процесса, однако ничего не говорит о его скорости и механизме.
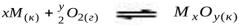
7
Кинетика, напротив, позволяет описать механизм, оценить скорость и указать влияние различных факторов на скорость реакции. Таким образом,
термодинамический и кинетический подходы взаимно дополняют друг друга.
Причиной коррозии металлов и сплавов является их термодинамическая неустойчивость, которая определяется уменьшением в ходе реакции значения энергии Гиббса реакции ( <0), при заданных условиях.
<0), при заданных условиях.
Чем отрицательнее значение, тем больше возможность коррозионного процесса,
и, следовательно, меньше термодинамическая стабильность металла.
Выражение для зависит от вида коррозионной среды. В условиях химической коррозии (газовая, в среде неэлектролита) стандартное изменение энергии Гиббса связано с константой равновесия:
 (1)
(1)
Термодинамический фактор химической коррозии рассмотрим на примере газовой коррозии в атмосфере кислорода. В общем виде схему процесса можно записать так:
Поскольку процесс коррозии является гетерогенным и рассматривается как равновесный, на значение константы равновесия будет оказывать влияние только давление (концентрация) газообразных компонентов системы. Исходя из этого, имеем следующий вид выражения закона действующих масс для данной реакции (при использовании атмосферы как единицы давления):
 , (2)
, (2)
где  - относительное равновесное парциальное давление кислорода.
- относительное равновесное парциальное давление кислорода.
Выражение для при нестандартных условиях имеет вид:
 , (3)
, (3)
где – изменение изобарно-изотермического потенциала (Дж/моль) при любых температурах и парциальных давлениях (концентрациях) компонентов реагирующей системы;  – изменение изобарно-изотермического
– изменение изобарно-изотермического

8
потенциала (Дж/моль) при стандартных условиях (С = 1 моль/л; p = 1 атм; T = 298 K).
Таким образом, для рассматриваемой реакции имеем:
|
|
|
|
|
, (4) |
|
|
где |
- относительное неравновесное давление кислорода. |
|
|||||
Изменение |
стандартной энергии |
Гиббса |
для |
этого |
процесса равно |
||
стандартной энергии |
Гиббса образования |
оксида |
из |
простых |
|||
веществ |
, |
т.к. |
по определению |
простых |
веществ |
||
(M и O2) равна нулю. приведены в справочных таблицах и для большинства оксидов меньше нуля, что говорит об их термодинамической устойчивости, т.е.
о возможности химической коррозии большинства металлов в атмосфере кислорода при стандартных условиях.
Эти уравнения позволяют оценить возможность протекания процесса окисления.
Важнейшим |
параметром |
коррозионного |
процесса |
является |
||||
его скорость. Подходы |
к |
определению |
скорости |
химической |
и |
|||
электрохимической коррозии различны. Это различие определяется, прежде всего, отличием механизмов этих процессов.
Скорость коррозии металлов и металлических покрытий в атмосферных условиях определяется комплексным воздействием ряда факторов:
наличием на поверхности фазовых и адсорбционных пленок влаги,
загрязненностью воздуха коррозионно-агрессивными веществами,
изменением температуры воздуха и металла,
образованием продуктов коррозии и так далее.
Оценка и расчет скорости коррозии должны основываться на учете
продолжительности и материальном коррозионном эффекте действия на металл
наиболее агрессивных факторов.
9
При химической коррозии на поверхности металла формируется твердая пленка продуктов (чаще всего оксидов) взаимодействия металла с компонентами среды.
Обычно скорость газовой коррозии определяется отношением прироста толщины пленки на единице поверхности к единице времени:
 (13)
(13)
Скорость коррозии непостоянна во времени и в значительной мере определяется свойствами образующейся пленки продуктов окисления и в первую очередь ее толщиной и сплошностью.
С увеличением толщины пленки значительно затрудняется диффузия коррозионных агентов, ионов металла и электронов в слое продуктов коррозии.
Следовательно, образующаяся пленка будет тормозить дальнейшее развитие коррозионного процесса. Однако это будет наблюдаться только в том случае,
если пленка будет обладать защитными свойствами.
Защитные свойства пленки проявляются в том случае если она:
1.является сплошной и беспористой;
2.обладает высокой адгезией к металлу;
3.пленка и металл имеют сопоставимые значения коэффициента линейного термического расширения;
4.обладает химической инертностью по отношению к агрессивной среде;
5.обладает высокой твердостью и износостойкостью.
Первостепенное значение для защитных свойств имеет условие сплошности,
сформулированное Пиллингом и Бедвордсом. Согласно условию сплошности, молярный объем образовавшегося оксида (V(MxOy)) должен быть больше израсходованного на это объема металла (V(M)):
 >
>
Количественной характеристикой сплошности пленки является отношение
объемов 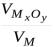 , которое называют фактором Пиллинга-Бедвордса ( ):
, которое называют фактором Пиллинга-Бедвордса ( ):

10
 , (14)
, (14)
где  – молярная масса металла;
– молярная масса металла;
 – плотность металла;
– плотность металла;
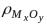 – плотность оксида металла;
– плотность оксида металла;
 – число атомов металла в оксиде;
– число атомов металла в оксиде;
– молярная масса металла.
Условия возникновения равномерной и местной коррозии.
Равномерная коррозия – это форма коррозии, при которой поверхность металла разрушается практически равномерно. Частичные реакции (растворение металла и восстановление кислорода) статистически распределены по поверхности, что приводит к более или менее равномерному растворению металла и равномерному образованию продуктов коррозии (например, красной ржавчины на стали). Равномерная коррозия протекает, например, на поверхности незащищенной углеродистой стали и на поверхности оцинкованной стали при определенных атмосферных условиях.
Местная коррозия - Местная коррозия в большинстве случаев проявляется в виде образования на поверхности труб точечных каверн. Местная коррозия,
наблюдаемая на элементах, расположенных в однородном грунте, не опасна до тех пор, пока термическая устойчивость не достигнет предела ниже допустимого. Местная коррозия наблюдается часто при коррозионном поражении стали в воде. Коррозия может распространяться пятнами, когда отдельные довольно большие пораженные участки углубляются на сравнительно небольшую величину; точками, когда коррозия концентрируется на отдельных небольших по площади участках поверхности; язвами, когда глубокие разрушения представляют собой отдельные ямки или раковины
