
Виноградов_Противоэпилептические_средства
.pdfПротивоэпилептические средства
Эпилепсия относится к числу весьма распространенных хронических заболеваний: согласно статистике, ею страдает примерно 1 % населения, и эта цифра имеет тенденцию роста.
Эпилепсия проявляется в разных формах, что отражается на выборе средств лечения.
В РФ принята весьма сложная Международная классификация (1989) эпилепсии и эпилептических синдромов.
Для описания фармакологии собственно противоэпилептических средств (ПЭС) (при разных проявлениях болезни дополнительно используются препараты и других фармакологических классов) достаточно выделить несколько основных (групповых) форм болезни:
1. Генерализованные припадки.
а) Генерализованные тонико-клонические судороги, или «большие»
судорожные припадки (grand mal) в виде приступов судорог с потерей сознания, падением с ушибами и травмами, в том числе головы, последующим выпадением этого периода из памяти, возможным прикусыванием языка.
Судороги длятся несколько минут и протекают непрерывно или в виде повторяющихся пароксизмов с короткими интервалами; дыхание останавливается.
Затем наступает расслабление мышц, дыхание постепенно восстанавливается, возможно западение языка с нарушением газообмена (необходимо приподнять и повернуть голову на бок, прижать язык).
В момент судорожного приступа какие-либо воздействия бесполезны и опасны, так как могут вызвать усиление и удлинение приступа.
После приступа еще до восстановления сознания обычно наступает короткий сон.
Повторные приступы судорог через несколько часов или более кратких интервалов времени свидетельствуют о возможном развитии смертельно опасного эпилептического статуса, требующего немедленной терапии с помощью противосудорожных препаратов, вводимых парентерально.
Средством выбора сегодня считается диазепам (сибазон, реланиум).
б) Абсансы, или «малые» припадки (petit mal), при которых больной на
короткое время (3—15 с) теряет сознание, выключается из окружающего мира, взгляд его неподвижен, наступает атония или подергивание отдельных мышц без судорог, возможно падение и травма.
Несмотря на менее грозную картину приступов по сравнению с предыдущей формой, отклонения психики при абсансах прогрессируют быстрее.
в) Другие формы генерализованных припадков — миоклонические,
атонические, клонические приступы и др.
2. Парциальные (очаговые, фокальные) припадки происходят
обычно на фоне сохраненного сознания и без признаков судорог или миоклонуса.
У больного внезапно возникают различные зрительные, слуховые или двигательные, вегетативные нарушения.
Иногда припадки протекают с нарушением психических функций в виде эмоционально-аффективных расстройств (с немотивированным беспокойством, агрессивностью и пр.), расстройств памяти и мышления, с ощущением уже виденного или слышанного или, наоборот, никогда не виденного и не слышанного, нарушением поведения, включая внешне осмысленные и упорядоченные действия (например, поездки на транспорте), полностью выпадающие в дальнейшем из памяти больного.
Возникновение болезни связывают с повреждением вещества мозга — группы нейронов и трофически связанных с ней клеток нейроглии.
Причинами могут быть:
-черепно-мозговые травмы (чаще всего),
-инфекционно-воспалительные процессы (менингиты, арахноидиты, энцефалиты),
-локальные и общие расстройства мозгового кровообращения (инсульты, энцефалопатии разной природы и т. п.),
-токсические повреждения.
Определенную роль играет:
-наследственная предрасположенность к судорожным реакциям,
-гипоксия плода,
-травма при родах.
В очаге повреждения часть нейронов погибает, но между ними и по периферии остаются жизнеспособные, но функционально и морфологически измененные нейроны — они и образуют эпилептогенный очаг.
Локализация очага (разные отделы коры, гиппокамп, миндалина) и его связи (аксонов, дендритов) с определенными зонами коры больших полушарий — двигательной, зрительной, слуховой, лобными долями, височными и другими — определяет и форму приступов, и их симптоматику.
В патогенезе эпилепсии независимо от локализации эпилептогенного очага сейчас выделяют три основных фактора:
1) изменение свойств мембран нейронов очага — нарушение функции энерго-
зависимого натриевого «насоса» и «откачки» ионов натрия и кальция из клетки.
В результате повышается возбудимость мембраны и для возникновения распространяющегося потенциала действия нужен лишь минимальный дополнительный вход ионов натрия через потенциалзависимые натриевые каналы.
Нейроны эпилептогенного очага взаимно возбуждают друг друга (установлено, что в очаге их должно быть не менее 10) и генерируют серии автоматических разрядов, не требующих дополнительной активации извне по афферентным связям.
В таламокортикальной области в возникновении таких разрядов, провоцирующих малые припадки эпилепсии, участвуют низкопороговые кальциевые каналы Т-типа;
2)выпадение или резкое ослабление физиологического тормозного контроля за интенсивностью и длительностью потока импульсов в цепях нейронов внутри эпилептогенного очага и вне его в воспринимающих зонах коры — этот контроль осуществляется с помощью ГАМКергических нейронов через рецепторы к ГАМК в передающей цепи нейронов;
3)освобождение повышенных количеств медиаторов из окончаний аксонов клеток эпилептогенного очага вследствие длительного и повторного их возбуждения.
Активация воспринимающих нейронов в различных зонах коры (с которыми у них есть функциональные связи и у которых есть соответствующие рецепторы) — к таким медиаторам относят прежде всего возбуждающие аминокислоты — глутамат и аспартат, им может быть также ацетилхолин.
В зависимости от того, в каких зонах коры располагаются воспринимающие нейроны (двигательной, зрительной, в лобных долях и др.), формируются конечная картина и симптоматика приступа (припадка).
Такова в упрощенном виде картина нарушений, которые лежат в основе разных форм эпилепсии.
Она же удовлетворительно объясняет механизм действия широко применяемых и перспективных ПЭС.
Относительно успешная фармакотерапия эпилепсии (генерализованной судорожной формы) началась в 1912 г. с эмпирического применения фенобарбитала, который и сегодня сохранил свое значение.
Лишь в 1938 г., с большой задержкой (синтезирован в 1907 г.), в практику лечения был введен фенитоин (дифенин), который в отличие от фенобарбитала лишен снотворного и седативного действия, считавшегося залогом успеха.
Однако весьма активный и осмысленный поиск новых ПЭС, опирающийся на сложившиеся представления о патогенезе эпилепсии, начался лишь в последние
25—30 лет.
Противоэпилептические средства (ПЭС) классифицируют в
зависимости от их принадлежности к тому или иному классу химических соединений:
1.Барбитураты и их производные — фенобарбитал, бензобарбитал (бензонал), примидон (гексамидин).
2.Производные гидантоина — фенитоин (дифенин).
3.Производные карбоксамида (иминостильбены) — карбамазепин (тегретол), окскарбазепин (трилептал).
4.Производные сукцинимида — этосуксимид (суксилеп).
5.Производные бензодиазепина — клоназепам.
6.Производные жирных кислот — вальпроевая кислота (депакин, финлепсин).
7.Препараты других групп — топирамат (топамакс), ламотриджин (ламиктал), габапентин (нейронтин), прегабалин (лирика).
Кроме собственно ПЭС, при лечении эпилепсии как дополнительные применяются препараты других фармакологических классов.
Так, с учетом роли избытка ионов кальция в цитоплазме нейронов эпилептогенного очага в патогенезе припадков дополнительно используют блокаторы кальциевых каналов в мембране (нимодипин).
Важное значение сейчас придают также агрессивным свободным радикалам, которые образуются в физиологически измененной ткани эпилептогенного очага, повреждают мембраны клеток, усиливают деструктивные изменения, увеличивают очаг и препятствуют процессу восстановления.
Для противодействия этим повреждениям в терапию эпилепсии включают антиоксиданты (токоферол и др.).
При нарушениях оттока спинномозговой жидкости из желудочков мозга и повышении внутричерепного давления при арахноидитах — мочегонное средство ацетазоламид (диакарб), специфически снижающее продукцию жидкости (ликвора).
Механизм действия разных ПЭС различается, но в целом он связан с воздействием препаратов на то или иное из описанных выше звеньев патогенеза припадков.
По механизму действия ПЭС подразделяются на следующие группы:
1. Средства, блокирующие потенциалзависимые натриевые каналы.
Эти препараты восстанавливают свойства нейронных мембран в очаге в результате нормализации потенциала покоя, блокады (по типу местных анестетиков тормозят деинактивацию натриевых каналов) входящих токов ионов через натриевые каналы, подавления автоматизма нейронов эпилептогенного очага.
Подобным прямым действием обладают: фенитоин, карбамазепин и
окскарбазепин, топирамат, ламотриджин, вальпроевая кислота.
2. Средства, блокирующие нейрональные кальциевые каналы Т-типа.
Подавляют эпилептическую активность таламических нейронов, в которых деполяризующий ток ионов кальция через медленные низкопороговые кальциевые каналы Т-типа участвует в генерации и проведении импульсов при малых припадках эпилепсии (абсансах).
К таким препаратам относятся этосуксимид (препарат выбора для лечения
малых припадков), а также отчасти вальпроевая кислота и топирамат.
3.Средства, усиливающие тормозные ГАМКергические влияния вЦНС.
Такой механизм оказался наиболее результативным (по числу базовых ПЭС).
Усиление (восстановление) ослабленного тормозного контроля за интенсивностью и продолжительностью потоков возбуждающих импульсов в цепях нейронов с помощью включения тормозного ГАМКергического контроля достигается несколькими путями:
а) за счет повышения чувствительности ГАМК-рецепторов в нейронных цепях к их медиатору.
Поскольку ГАМКА-рецептор представляет собой сложный комплекс и кроме собственно рецептора для ГАМК с хлорным каналом включает несколько участков, являющихся рецепторами для бензодиазепинов и барбитуратов, воздействие на них возможно с помощью препаратов этих двух групп.
В результате ГАМКА-рецептор начинает работать, и через открывшийся канал внутрь нейрона поступают ионы хлора, вызывая гиперполяризацию нейронной мембраны и снижение возбудимости эпилептогенного очага.
Таким способом действуют клоназепам, фенобарбитал, бензобарбитал, примидон, топирамат.
б) путем торможения биохимических механизмов инактивации ГАМК, в ре-
зультате чего возрастает концентрация тормозного медиатора в синаптической щели и продолжительность его действия — ингибитором инактивирующего ГАМК фермента (ГАМК-аминотрансферазы) является вальпроевая кислота.
в) непрямым агонистическим действием на ГАМК-рецепторы, связанным со способностью усиливать высвобождение ГАМК из пресинаптических окончаний и создавать в тормозных синапсах нужную концентрацию медиатора, надежно и долго активирующего ГАМК-рецепторы с их хлорными каналами.
Предполагается, что таким механизмом действия могут обладать габапентин и прегабалин, которые имеют структурное сходство с ГАМК, однако свойствами медиатора не обладают.
Вероятно, могут влиять и на метаболизм ГАМК.
4. Средства, угнетающие действие возбуждающих аминокислот на нейроны эпилептогенного очага — в механизме действия ряда ПЭС имеется такой компонент.
Это ламотриджин, барбитураты (фенобарбитал и др.), топирамат.
Считают, что ламотриджин препятствует избыточному выбросу возбуждающих аминокислот (прежде всего глутамата) терминалями активирующих нейронов.
Барбитураты и топирамат блокируют глутаматные рецепторы, что в комплексе с другими механизмами действия препаратов приводит к подавлению активности эпилептогенного очага.
ПЭС различаются между собой:
-по эффективности при том или ином виде припадков, а также при каждом из них,
-по переносимости в терапевтически необходимых дозах.
Некоторые из них обладают широким спектром (универсальным) действия.
Эффективность препаратов при генерализованных тонико-клонических припадках (наиболее тревожный вариант болезни) хорошо коррелирует с их активностью при парциальных припадках, хотя индивидуальные проявления болезни могут вносить существенные поправки.
Имеет значение также раннее или запоздалое начало фармакотерапии, соблюдение режима приема препаратов и т. п.
Каждый пропущенный до лечения или не предупрежденный припадок усугубляет патологические изменения в эпилептогенном очаге, затрудняет достижение ремиссии.
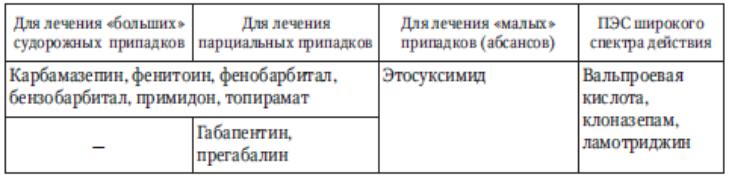
Деление ПЭС на четыре группы (табл. 41) имеет важное значение для их выбора.
Так, фенитоин и фенобарбитал предупреждают судорожные припадки, но могут увеличить частоту абсансов.
Этосуксимид контролирует абсансы, но может провоцировать генерализованные судорожные приступы.
Поэтому большое значение приобретают препараты широкого спектра действия.
Таблица 41
Клиническая классификация противоэпилептических средств
Мировой опыт лечения эпилепсии вполне согласуется с выделением базовых ПЭС, практически одинаковых во всех странах.
В ряду препаратов, применяемых для лечения той или иной формы болезни, существует примерно одинаковая (с минимальными различиями) рубрикация препаратов 1, 2, 3-го выбора.
Она позволяет достаточно уверенно выбирать препарат в начале лечения, т. е. после установления первичного диагноза, заменять один препарат на другой, а при необходимости проводить комбинированную терапию (табл. 42).
Таблица 42
Последовательность (ранжирование) выбора ПЭС в зависимости от типа эпилептического припадка (препараты 1, 2, 3-го выбора и т. д.)

* В рекомендациях разных авторов первые 2—3 ПЭС часто меняются местами. Здесь приведен наиболее частый вариант приоритетов. Окончательный выбор зависит от реагирования больного, переносимости того или иного ПЭС и других причин.
При прочих равных условиях монотерапия любой формы эпилепсии всегда предпочтительнее комбинированного лечения.
Она позволяет лучше учесть индивидуальные особенности фармакокинетики, раньше и точнее диагностировать побочные реакции и осложнения, часто исключает труднопрогнозируемое взаимодействие препаратов.
Побочные эффекты при длительном применении ПЭС наблюдаются редко.
Большинство ПЭС вызывают однотипные дозозависимые расстройства, такие как:
-нарушения зрения,
-головокружение,
-атаксия (шаткость походки),
-седативный эффект,
-сонливость,
-изменения со стороны крови (лейкопения и др.),
-тошнота,
-рвота.
Карбамазепин, окскарбазепин, ламотриджин в терапевтических дозах практически не оказывают седативного действия.
Фенитоин может вызывать гиперплазию десен, избыточное оволосение (гирсутизм), кожную сыпь.
Вальпроевая кислота чаще других оказывает гепатотоксическое действие.
Многие ПЭС (барбитураты, фенитоин, карбамазепин) индуцируют активность ферментов печени, которые отвечают за метаболизм как самих препаратов, так и других лекарственных средств.
С этим свойством связано постепенное ослабление и уменьшение длительности действия, т. е. развитие привыкания к ПЭС, в том числе при их комбинированном применении.
Лечение эпилепсии начинают с назначения 1/3 средней рекомендованной дозы препарата для данной категории больных, затем ее повышают на 1/3 каждые последующие 5—7 дней до полной.
Это позволяет больному лучше адаптироваться к ПЭС, а при плохой переносимости (без серьезных побочных реакций) принимать суточную дозу в 4—6 приемов.
Если побочные реакции не сглаживаются, а нарастают, это служит показанием к замене препарата на другой из этой же группы.
Замена всегда осуществляется постепенно в течение 3—7 дней, т. е. постепенно уменьшают суточную дозу (число приемов) первого ПЭС и увеличивают дозу второго.
Показанием к комбинированной терапии является сочетание нескольких форм припадков и недостаточная эффективность каждого из средств выбора для монотерапии одной формы эпилепсии.
Наиболее оправдавшими себя комбинациями при лечении парциальных припадков считают:
-карбамазепин + фенитоин;
-карбамазепин + фенобарбитал (или примидон);
-карбамазепин + вальпроевая кислота.
При лечении тонико-клонических судорожных форм эпилепсии рекомендуются:
-карбамазепин (или фенитоин) + вальпроевая кислота;
-карбамазепин (или фенитоин) + примидон.
При этих двух формах болезни используют и ряд других менее популярных комбинаций.
При лечении абсансов выбор невелик: если больной не поддается контролю с помощью этосуксимида или вальпроевой кислоты (препараты выбора), успешной обычно бывает терапия комбинацией этих двух ПЭС.
При комбинированной терапии, помимо фармакокинетического взаимодействия ПЭС, существует опасность внезапного появления серьезных осложнений на препарат, который ранее хорошо переносился при монотерапии, а также вероятность нейротоксического действия (атаксия, дизартрия, расстройства сознания и др.) двух препаратов, имеющих общие точки приложения в синапсах мозга.
Поскольку успешный лечебный эффект требует достижения и очень длительного поддержания терапевтической концентрации ПЭС в крови, допускающего минимальные отклонения в течение суток, к препаратам предъявляется требование медленной элиминации, т. е. высоких значений Т1/2.
Этому требованию удовлетворяют практически все ПЭС.
К тому же они должны обладать достаточно хорошей биодоступностью.
Большинство ПЭС относительно быстро всасываются после перорального приема и достигают пиковой концентрации в крови через 3—4 ч.
Соответственно Т1/2 у них варьирует между 30 и 50 ч, а фенобарбитала — до 100 ч.
Относительно малое значение Т1/2 у примидона не имеет значения, так как он является пролекарством и в печени превращается в фенобарбитал, который и оказывает лечебное действие.
Для стабилизации суточной концентрации в крови препаратов с низкими значениями Т1/2 (вальпроевая кислота) выпускают таблетки с продленной резорбцией (ретард-таблетки), которые достаточно принимать дважды в сутки.
Следует иметь в виду, что почти все ПЭС обезвреживаются в печени и при этом индуцируют синтез обезвреживающих их ферментов.
Индукция небезгранична, и спустя 2—4 нед. с учетом ступенчатого увеличения дозировок до эффективных в эти же сроки достигается стационарная концентрация ПЭС в крови.
За этот срок обычно удается определить и переносимость терапии больным.
Случаи индивидуальной непереносимости по аллергическому типу (кожная сыпь, тошнота, рвота, острые неврологические симптомы и пр.) на разные ПЭС наблюдаются редко и требуют срочной замены препарата.
Особенно ответственной задачей является лечение детей, страдающих эпилепсией (чаще судорожными формами).
Успешность фармакотерапии эпилепсии выражается в сокращении числа припадков до полного их исчезновения.
