
8.Антибиотики (копия)
.pdfАНТИБИОТИКИ
Возбудителями инфекционных болезней являются бактерии, риккетсии, хламидии, микоплазмы, простейшие, грибы, вирусы, прионы.
Выделяют болезни, вызываемые простейшими, гельминтами, насекомыми и клещами, которые относятся к так называемым инвазионным, или паразитарным.
Патогенез инфекционной болезни отражает основные этапы развития инфекционного процесса.
Цель лечения инфекционного процесса - ликвидация причины (возбудителя) или блок механизма развития инфекционного заболевания.
Для этиотропной терапии используют химиотерапевтические средства, характеризующиеся направленным избирательным действием на патогены и обладающие низкой токсичностью для человека.
По спектру действия выделяют химиотерапевтические средства:
•антибактериальные;
•противогрибковые;
•противовирусные;
•противопротозойные;
•противоглистные.
Антибактериальные химиотерапевтические средства:
•антибиотики;
•синтетические антибактериальные средства;
•противосифилитические средства;
•противотуберкулезные средства.
Антибиотики - это химиотерапевтические вещества биологического происхождения, избирательно угнетающие жизнедеятельность микроорганизмов либо останавливая их рост, либо вызывая их гибель.
Для классификации антибиотиков используют различные принципы.
В зависимости от источников получения выделяют две группы антибиотиков:
•природные (биосинтетические) - продукты жизнедеятельности микроорганизмов и низших грибов;
•полусинтетические (химические производные природных антибиотиков, получаемые искусственным путем с помощью химического синтеза).
По химическому строению выделяют следующие группы антибиотиков (рис. 17.1):
•β-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы, монобак-тамы);
•макролиды и азалиды;
•аминогликозиды;
•тетрациклины;
•полимиксины;
•полиеновые антибиотики;
•препараты хлорамфеникола (Левомицетин*);
•гликопептидные антибиотики;
•антибиотики разных химических групп.

Рис. 17.1. Локализация действия антибактериальных средств
По характеру действия на бактериальную клетку антибиотики можно разделить на две группы:
•бактерицидные (вызывающие гибель бактерий);
•бактериостатические (останавливающие рост и деление бактерий).
Характер действия противомикробных средств следует учитывать при клиническом применении антибиотиков.
Совместное назначение бактериостатического ЛС с бактерицидным может привести к антагонистическому эффекту.
Например, бактериостатический препарат тетрациклин угнетает синтез белка на рибосомах и таким образом замедляет рост и деление клетки.
При назначении тетрациклина с ингибитором синтеза клеточной стенки бензилпенициллином тетрациклин будет ослаблять действие последнего, эффективного в отношении только растущих бактерий.
В противоположность, два бактерицидно действующих препарата могут усиливать действие друг друга.
Например, комбинация бензилпенициллина и антибиотика-аминогликозида может приводить к усилению эффектов препаратов, потому что бензилпенициллин нарушает синтез клеточной стенки бактерий и облегчает проникновение в клетку плохо проходящего через мембраны аминогликозида.
Бактерицидный или бактериостатический характер действия антибиотиков на микрофлору определяется особенностями механизма их действия.
Установлено, что противомикробное действие антибиотиков развивается в основном как следствие нарушения:
• синтеза клеточной стенки;

•проницаемости цитоплазматической мембраны;
•синтеза белка;
•синтеза РНК.
Таблица 17.1. Механизм и характер антимикробного действия антибиотиков
|
|
|
|
|
|
|
|
|
Механизм действия |
|
|
Антибиотики |
|
Преимущественный характер |
|
|
|
|
|
антимикробного действия |
|
||
|
|
|
|
β-Лактамные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Бактерицидный |
|
|
|
|
|
|
антибиотики |
|
|
|
|
Нарушение синтеза |
|
|
Гликопептидные |
|
Бактерицидный |
|
|
|
|
антибиотики |
|
|
||
|
клеточной стенки |
|
|
Циклосерин |
|
Бактерицидный |
|
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
Бацитрацин |
|
Бактерицидный |
|
|
|
|
|
|
|
||
|
|
|
|
Полимиксины |
|
Бактерицидный |
|
|
Нарушение проницаемости |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
цитоплазматической |
|
|
|
|
|
|
|
|
|
Полиеновые |
|
Бактерицидный |
|
|
|
мембраны |
|
|
|
|
||
|
|
|
|
антибиотики |
|
|
|
|
|
|
|
Макролиды |
|
Бактериостатический |
|
|
Нарушение внутриклеточного |
|
|
Тетрациклины |
|
Бактериостатический |
|
|
|
|
|
|
|||
|
|
|
Линкозамиды |
|
Бактериостатический |
|
|
|
|
|
|
|
|||
|
синтеза белка |
|
|
Хлорамфеникол |
|
Бактериостатический |
|
|
|
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
Аминогликозиды |
|
Бактерицидный |
|
|
|
|
|
|
|
||
|
Нарушение синтеза РНК |
|
|
Рифампицин |
|
Бактерицидный |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
При сопоставлении характера и механизма действия антибиотиков (табл. 17.1) видно, что бактерицидный эффект дают преимущественно те антибиотики, которые нарушают синтез клеточной стенки, изменяют проницаемость цитоплазматической мембраны или нарушают синтез РНК в микроорганизмах.
Бактериостатическое действие характерно для антибиотиков, нарушающих внутриклеточный синтез белка.
По спектру антимикробного действия антибиотики можно разделить:
•на препараты широкого спектра (действующие как на грамположительные, так и на грамотрицательные бактерии):
- тетрациклины; - хлорамфеникол;
- аминогликозиды; - цефалоспорины;
- полусинтетические пенициллины;
•на препараты с преимущественным действием на грамположительные бактерии:
-биосинтетические пенициллины;
-макролиды;
•на препараты с преимущественным действием на грамотрицательные бактерии: - полимиксины; - монобактамы;
•противогрибковые антибиотики.
По клиническому применению выделяют:
•основные антибиотики (препараты выбора), с которых начинают лечение до определения чувствительности к ним возбудителя заболевания;
•резервные антибиотики, которые применяют при устойчивости микроорганизмов к основным антибиотикам или при непереносимости последних.
В процессе применения антибиотиков к ним может развиться устойчивость (резистентность) микроорганизмов - снижение чувствительности культуры микроорганизмов к действию антибактериального вещества, т.е. способность микроорганизмов размножаться в присутствии максимально безопасной для макроорганизма терапевтической дозы антибиотика.
Резистентность микроорганизмов к антибиотикам может быть:
1)природной;
2)приобретенной.
Природная устойчивость связана с генетически обусловленным отсутствием у микроорганизмов «мишени» для действия антибиотика или недоступностью «мишени» вследствие первично низкой проницаемости клеточной стенки, а также ферментативной инактивацией антибиотика.
При наличии у бактерий природной устойчивости антибиотики клинически неэффективны.
Например, грамотрицательные микроорганизмы устойчивы к действию ванкомицина.
Под приобретенной устойчивостью понимают свойство отдельных штаммов бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые подавляют основную часть микробной популяции.
Приобретенная устойчивость связана либо со спонтанными мутациями в генотипе бактериальной клетки с последующим отбором устойчивых штаммов микроорганизмов, либо с передачей плазмид от естественно устойчивых бактерий к чувствительным видам.
Приобретенная устойчивость бывает первичной и вторичной.
Первичная устойчивость выявляется у отдельных вариантов культуры до начала лечения антибиотиками (например, отдельные штаммы золотистого стафилококка устойчивы к бензилпенициллину).
Вторичная устойчивость, как правило, развивается во время применения антибиотиков.
Генетические механизмы устойчивости возникают в результате хромосомных мутаций и обмена генетическим материалом.
Хромосомные мутации, как правило, происходят в генах, которые кодируют белки, являющиеся «мишенями» для ЛС, или в генах, кодирующих транспорт или метаболические системы лекарственного вещества.
Эти мутации могут быть переданы в дочерние клетки (вертикальная передача).
Кроме того, бактерии могут приобрести устойчивость путем получения генетического материала от других бактерий (горизонтальная передача).
Например, MRSA (Methicillin Resistant Staphylococcus Aureus) и ванкомицин-рези-стентный энтерококк вызывают очень опасные нозокомиальные (внутрибольничные) инфекции, так как эти бактерии приобрели гены устойчивости.

Биохимические механизмы устойчивости бактерий к антибиотикам (табл. 17.2):
•ферментативная инактивация препаратов;
•структурные изменения «мишени» действия антибиотиков;
•активное выведение антибактериальных препаратов из микробной клетки;
•снижение проницаемости клеточной стенки бактерий;
•формирование метаболического «шунта».
Таблица 17.2. Механизмы резистентности к антибиотикам
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Препараты, устойчивость к |
|
|
|
|
|
||||
|
Препараты, устойчивость |
|
|
|
которым связана с пониженным |
|
|
|
Препараты, устойчивость к |
|
||||
|
к которым обусловлена |
|
|
|
их накоплением в клетках |
|
|
|
которым обусловлена |
|
||||
|
модификацией «мишени» |
|
|
|
возбудителя |
|
|
|
ферментативной |
|
||||
|
действия |
|
|
|
|
|
|
|
|
|
|
инактивацией |
|
|
|
|
|
|
↓ проницаемости |
|
|
|
↑ активное |
|
|
|
|
||
|
|
|
|
|
клеточной стенки |
|
|
|
выведение |
|
|
|
|
|
|
β-Лактамы |
|
|
|
β-Лактамы |
|
|
|
β-Лактамы |
|
|
|
β-Лактамы |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
Аминогликозиды |
|
|
|
|
|
|
|
|
|
|
|
Аминогликозиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Клиндамицин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тетрациклины |
|
|
|
Тетрациклины |
|
|
|
Тетрациклины |
|
|
|
Тетрациклины |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Макролиды |
|
|
|
|
|
|
|
|
|
|
|
Макролиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Рифампицин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хлорамфеникол |
|
|
|
|
|
|
|
|
|
|
|
Хлорамфеникол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Сульфаниламиды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Фтoрхинoлoны |
|
|
|
Фтoрхинoлoны |
|
|
|
Фтoрхинoлoны |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Устойчивость микроорганизмов к антибиотикам может иметь групповую специфичность, т.е. резистентность развивается не только к применяемому препарату, но и к другим препаратам из той же химической группы.
Такая устойчивость называется перекрестной.
Соблюдение принципов рационального применения химиотерапевтических средств позволяет уменьшить вероятность возникновения устойчивости.
Принципы рациональной химиотерапии
1. Определение возбудителя инфекциoнного заболевания.
При этом полиэтиологические болезни (сепсис, пневмония, гнойный менингит) могут быть вызваны разными возбудителями, микробиологические методы выделения возбудителя требуют времени, в то время как назначение антимикробного средства не может быть отсрочено.
Химиотерапию начинают эмпирически с препарата широкого антимикробного спектра действия.
2.Определение чувствительности микроорганизма, выделенного от больного, к химиотерапевтическому средству.
Выбор наиболее безопасного и эффективного средства с учетом особенностей макроорганизма, течения заболевания и клинической фармакологии препарата.
3.Противомикробную терапию необходимо начинать как можно в более ранние сроки, когда микробные клетки находятся в стадии активного роста и наиболее чувствительны к действию препарата.
Чем больше число микроорганизмов, тем сложнее борьба с ними.
Раннее начало лечения ограничивает возможность распространения инфекции.
4. Выбор оптимального пути введения препарата и лекарственной формы.
Вместе локализации инфекции необходимо создать адекватный уровень препарата с целью обеспечения наибольшего контакта химиотерапевтического средства с возбудителем заболевания.
Вэтой связи введено понятие минимальной ингибирующей (подавляющей) концентрации - показателя чувствительности (устойчивости) микробов к антисептическим или химиотерапевтическим средствам, представляющего собой минимальную концентрацию
вещества, подавляющую рост определенного микроорганизма.
5. Применение ударных доз в начале лечения с соблюдением режима дозирования и длительности терапии.
Лечение продолжают дозами с учетом тяжести инфекции, массы тела и возраста больных, функции печени и почек, точно соблюдая интервал между введениями.
Необходимо, чтобы в местах локализации возбудителя создавалась и постоянно поддерживалась концентрация препарата, достаточная для подавления жизнедеятельности этого возбудителя и предотвращения развития лекарственной устойчивости микроорганизмов.
6. Определение оптимальной продолжительнoсти антимикробной терапии.
Необходимо доводить курс лечения до конца во избежание рецидива болезни или развития устойчивых штаммов микроорганизмов или перехода заболевания в хроническое течение.
7. Рациональная комбинированная химиотерапия.
Сочетанное применение антимикробных средств с разными механизмами действия повышает эффективность лечения и уменьшает вероятность развития устойчивых форм микроорганизмов.
АНТИБИОТИКИ, НАРУШАЮЩИЕ СИНТЕЗ КЛЕТОЧНОЙ СТЕНКИ
Клеточная стенка - структура, присущая только бактериям, грибам и растениям.
Основу клеточной стенки бактерий составляет пептидогликан (мукопептид, муреин).
Пептидогликан представляет собой гигантскую полимерную молекулу, покрывающую клетку.
Защитный слой пептидогликана располагается над цитоплазматической (внутренней) мембраной микробной клетки.
У грамотрицательных бактерий пептидогликан «покрыт» внешней оболочкой - липополисахаридной наружной мембраной, препятствующей проникновению антибиотиков в клетку.
Пептидогликан состоит из цепочек, образованных повторяющимся комплексом двух аминосахаров - N-ацетилмурамовой кислоты и N-ацетилглюкозамина.

К каждой молекуле N-ацетилмурамата присоединяется олигопептид.
Между олигопептидами соседних цепочек при участии транспептидазы образуются пептидные мостики (сшивки).
Таким образом, пептидогликан образует прочный каркас.
Синтез пептидогликана можно представить в виде трех стадий:
•синтез мономеров;
•полимеризация мономеров;
•полимерное перекрестное сшивание.
К антибиотикам, нарушающим синтез клеточной стенки бактерий, относят:
•β-лактамные антибиотики;
•гликопептидные антибиотики;
•циклосерин;
•бацитрацин;
•производные фосфоновой кислоты.
β-Лактамные антибиотики
β-Лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы и монобактамы) - это ЛС, имеющие в составе молекулы β-лактамное кольцо (рис. 17.2), которое необходимо для реализации противомикробной активности этих соединений.
Рис. 17.2. Химическая структура бензилпенициллина
При расщеплении β-лактамного кольца бактериальными ферментами (β-лактамазами) антибиотики утрачивают антибактериальную способность.
Сходство химической структуры β-лактамов обусловливает одинаковый механизм действия.
Благодаря структурному сходству с D-ala-D-ala aнтибиотики этой группы связываются с активным центром фермента транспептидазы - пенициллинсвязывающими протеинами (penicillin-binding protein).
Угнетая транспептидазу бактерий, они препятствуют образованию пептидных связей при синтезе клеточной стенки микроорганизмов, нарушают синтез пептидогликана клеточной стенки бактерий на последней стадии (рис. 17.3).
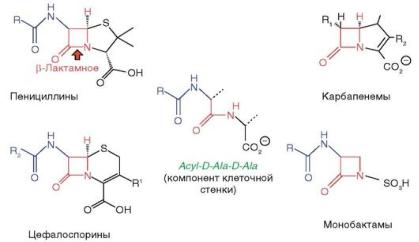
Рис. 17.3. Структурное сходство предшественника клеточной стенки acyl-D-Ala-D-Ala c ß- лактамными антибиотиками
Кроме того, β-лактамы, угнетая эндогенный ингибитор аутолизинов, повышают активность аутолизинов.
Аутолизины необходимы для расщепления пептидогликана при делении клетки.
Ингибирование транспептидазы и активация аутолизинов приводят к аутоци-толизу и гибели клетки.
Растущие бактерии активно синтезируют пептидогликан и являются мишенью для действия β- лактамных антибиотиков.
Пенициллины
В основе строения пенициллинов лежит 6-аминопенициллановая кислота.
Пенициллины отличаются друг от друга строением радикала боковой цепи, присоединенного к остатку аминогруппы 6-аминопенициллановой кислоты.
Выделяют:
•природные (биосинтетические);
•полусинтетические пенициллины.
Природные пенициллины
Природные (биосинтетические) пенициллины образуются различными видами плесневых грибов рода Penicillium.
Механизм антибактериального действия пенициллинов (рис. 17.4) связан:
•с блокадой фермента транспептидазы, обеспечивающей соединение цепей пеп-тидогликана с помощью пентаглициновых мостиков, завершающей стадии синтеза пептидогликанового полимера;
•активацией аутолизинов, играющих ключевую роль в расщеплении пептидогликана при делении бактериальных клеток.
В результате происходит нарушение структуры пептидогликана микробной клетки и последующая гибель бактерий, что обусловливает бактерицидный эффект.
Природные пенициллины относятся к группе антибиотиков с преимущественно грамположительным спектром действия.

Они эффективны в отношении:
•грамположительных кокков (стрептококков, пневмококков; стафилококков, не продуцирующих β-лактамазу);
•грамположительных палочек (коринебактерий дифтерии, бацилл сибирской язвы; листерий);
•грамотрицательных кокков (менингококков и гонококков);
•анаэробов (клостридий столбняка и газовой гангрены);
•актиномицетов;
•спирохет (бледной трепонемы, лептоспир, боррелий).
Рис. 17.4. Механизм действия пенициллинов
Природные пенициллины применяют:
•при тонзиллофарингите (ангине);
•скарлатине;
•роже;
•остеомиелите;
•бактериальном эндокардите;
•очаговой и крупозной пневмонии;
•абсцессе легких;
•дифтерии;
•менингите;
•газовой гангрене;
•столбняке;
•актиномикозе;
•клещевом боррелиозе (болезни Лайма).
Препараты этой группы - средства выбора при лечении сифилиса и профилактики обострений ревматических заболеваний.
Приобретенная устойчивость к биосинтетическим пенициллинам связана с продукцией β- лактамаз или наличием дополнительного пенициллинсвязывающего белка.
Резистентность чаще всего встречается среди стафилококков, вырабатывающих β-лактамазы, разрушающие β-лактамные циклы молекулы бензилпенициллинов.
Классификация природных пенициллинов:
•препараты для парентерального введения (кислотонеустойчивые):
•короткого действия - бензилпенициллин (Бензилпенициллина натриевая соль♠) и бензилпенициллина калиевая сoльρ;
•длительного действия - бензилпенициллин (Бензилпенициллина новокаиновая соль♠); бензатина бензилпенициллин (Бициллин-1♠); бензатина бензилпени-циллин + бензилпенициллин прокаина (Бициллин-5♠);
•препараты для энтерального введения (кислотоустойчивые) - феноксиметилпе-нициллин.
Бензилпенициллин (Бензилпенициллина натриевая соль♠) и бензилпенициллина калиевая сoльρ - хорошо растворимые препараты бензилпенициллина.
В значительной степени они разрушаются соляной кислотой желудочного сока, поэтому применяются парентерально.
Препараты создают высокие концентрации в легких, почках, слизистой оболочке кишечника, суставах, перитонеальной и плевральной жидкости.
В небольших количествах проходят через плаценту и проникают в грудное молоко, но плохо проникают через ГЭБ и гематooфтальмический барьер.
Однако при воспалении оболочек мозга проницаемость через ГЭБ увеличивается.
При внутримышечном введении препараты накапливаются в крови в максимальных количествах через 30-60 мин и практически полностью выводятся из организма через 3-4 ч, в связи с чем внутримышечные инъекции препаратов необходимо проводить через каждые 3-4 ч.
Неoбхoдимoсть частых инъекций натриевой и калиевой солей бензилпенициллина послужила поводом для создания препаратов с пролонгированным действием («де-по-пенициллины»).
Вследствие плохой растворимости в воде эти препараты образуют с водой суспензии, их вводят только внутримышечно.
Препараты медленно всасываются из места введения и создают депо в мышечной ткани, что позволяет поддерживать концентрацию антибиотика в крови значительное время и сократить частоту введения препарата .
Продолжительность действия пролонгирoванных пенициллинов:
•бензилпенициллин (Бензилпенициллина новокаиновая соль♠) - 12-18 ч;
•бензатина бензилпенициллин (Бициллин-1♠) - 7-10 дней;
•бензатина бензилпенициллин + бензилпенициллин прокаина (Бициллин-5♠) - 1 мес.
