
методичка по Общей фармакологии
.pdfДефект бутирилхолинэстеразы выявляется во время хирургических операций с применением суксаметония йодида.
При отсутствии самостоятельного дыхания после истечения срока действия миорелаксанта продолжают искусственную вентиляцию легких (ИВЛ) и переливают донорскую кровь, содержащую активный фермент.
Безопасность лекарственных средств для различных этнических групп зависит от метаболического статуса популяций - количества людей с определенным фенотипом метаболизма лекарств.
Данные фармакологической метаболической паспортизации необходимо учитывать как в моноэтнических странах, так и в странах, населенных различными национальными и расовыми группами.
ВЛИЯНИЕ НА ДЕЙСТВИЕ ЛЕКАРСТВ. СРЕДСТВ БИОРИТМОВ (ХРОНОФАРМАКОЛОГИЯ)
Хронофармакология изучает влияние биоритмов на кинетику и эффекты лекарственных средств.
При назначении лекарств учитывают циркадианный (околосуточный с периодом 20-28 ч), околочасовой (3-20 ч), инфрадианный (28-96 ч), недельный, месячный и сезонный биоритмы.
Установлено влияние биоритмов на интенсивность около 300 функций:
-возбудимость нервных центров,
-секрецию гормонов,
-деятельность сердечно-сосудистой системы, почек, печени.
Чувствительность клеток к действию лекарств, обусловленная влиянием биоритмов (хронестезия), зависит от:
-периодических колебаний количества и аффинитета циторецепторов,
-скорости биохимических процессов,
-нервного и гормонального контроля.
Наибольшее влияние на эффекты лекарственных средств оказывает циркадианный (околосуточный) биоритм.
В этом ритме различают:
►акрофазу - время, когда активность циторецепторов, интенсивность метаболических реакций, работа клеток и органов выражены в максимальной степени;
►батифазу - время, когда эти показатели значительно снижаются;
►амплитуду - отклонение процессов от максимального до минимального значений.
Самая высокая частота сердечных сокращений (ЧСС) регистрируется в 1516 ч, дыхание учащается в 13-16 ч, систолическое АД повышается в 15-18 ч.
Утром активируются, а вечером тормозятся психические процессы.
Некоторые лекарственные средства назначают с таким расчетом, чтобы в акрофазе их концентрация в плазме оказалась максимальной.
Опиоидный анальгетик морфин эффективнее подавляет боль в 16 ч, во время ее наибольшей интенсивности.
Нитроглицерин лучше купирует приступ стенокардии утром.
Препараты глюкокортикоидов назначают в утренние часы, когда активирована секреторная функция коры надпочечников и возрастает чувствительность глюкокортикоидных рецепторов.
Утром глюкокортикоиды оказывают терапевтическое действие в меньших дозах, поэтому после прекращения их приема слабее выражен синдром отмены.
Противоопухолевые средства целесообразно принимать в 20 ч.
В это время суток опухолевые клетки интенсивно пролиферируют.
При бронхиальной астме сопротивление бронхов минимальное в 12 ч, возрастает -
в 23-24 ч.
Это обусловлено ночным повышением чувствительности м-холинорецепторов и Н1-рецепторов гладких мышц бронхов.
Для профилактики приступов удушья средства, расширяющие бронхи, рекомендуют назначать в 20-22 ч.
Секреция и кислотность желудочного сока увеличиваются ночью, поэтому антацидные и гастропротективные средства принимают в течение дня и обязательно на ночь, м-холиноблокатор пирензепин и блокаторы Н2-рецепторов назначают в 19-20 ч.
Анксиолитики и седативные средства следует принимать во время наибольшей тревоги, больной должен сам подобрать режим приема.
Действие психостимуляторов необходимо синхронизировать с высоким физиологическим ритмом в утреннее время.
Фармакологическое действие лекарственных средств может качественно изменяться в зависимости от времени их приема.
У больных ХСН прием фуросемида в 10 ч вызывает в основном диуретический эффект, в 13 ч - натрийуретический, в 17 ч - калийуретический.
Потенциально гепатотоксические и нефротоксические средства принимают в батифазе функций печени и почек, чтобы ослабить побочное действие.
Циркадианные биоритмы модифицируют также фармакокинетику.
Противогрибковое средство гризеофульвин и сульфаниламиды больше всасываются из кишечника в кровь примерно в 12 ч дня.
Железо полнее всасывается и усваивается в вечерние часы.
При приеме препаратов железа в первой половине дня его концентрация в крови повышается незначительно, но усиливается раздражающее влияние на кишечник.
Индометацин и лития карбонат интенсивнее выделяются с мочой ранним утром, что связано с суточными колебаниями рН мочи.
В свою очередь, лекарственные средства могут изменять естественные биоритмы и вызывать появление новых физиологических ритмов - фармакогенный ритм.
Навязанный лекарственным средством ритм можно использовать для коррекции нарушенного естественного ритма, но возникает риск развития побочных эффектов.
Дисбаланс биоритмов в организме человека получил название десинхроноз.
Он возникает при:
-резкой смене режима дня,
-перелете через несколько часовых поясов,
-переводе стрелок часов на летнее или зимнее время,
-злоупотреблении алкоголем, снотворными и психотропными средствами.
Десиндроноз может стать причиной депрессии и тревожных расстройств.
На действие лекарственных средств влияют сезонные ритмы.
При хирургических и неврологических заболеваниях психостимуляторыадаптогены (препараты женьшеня, элеутерококка, родиолы, аралии) в большей степени улучшают состояние пациентов в январе-марте, а в летнее время их адаптогенное влияние намного слабее.
Назначение лекарственных средств с учетом биоритмов позволяет повысить эффективность и ослабить нежелательные проявления фармакотерапии.
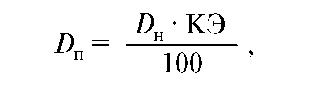
ЭФФЕКТЫ ПРИ ПОВТОРНОМ ПРИЕМЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Кумуляция
Кумуляция (от лат. cumulatio - увеличение, скопление) - накопление в организме молекул лекарственных средств (материальная кумуляция) или их эффектов (функциональная кумуляция).
Материальная кумуляция характерна для липофильных лекарственных средств с низким печеночным и/или почечным клиренсом и длительным периодом полуэлиминации.
В клинической практике необходимо учитывать кумуляцию фенобарбитала, бромидов, дигоксина, антикоагулянтов непрямого действия.
Кумуляция имеет как положительное, так и отрицательное значение.
Положительное значение связано с пролонгированием действия лекарственных средств, возможностью их редкого приема.
Например, больные ХСН избавлены от необходимости принимать сердечный гликозид дигоксин ночью.
Отрицательное значение заключается в опасности интоксикации из-за суммирования введенных доз лекарственных средств.
Для того чтобы предотвратить интоксикацию кумулирующими лекарствами, необходимо рассчитать поддерживающую дозу таким образом, чтобы количество принятого вещества было равно количеству, элиминируемому из организма за сутки.
Для расчета используют коэффициент элиминации - долю выводимого за сутки лекарственного средства в процентах:
где DП - поддерживающая доза; DH - нагрузочная (начальная) доза; КЭ - коэффициент элиминации.
Относительная материальная кумуляция связана не с фармакокинетическими свойствами лекарственных средств, а с недостаточностью систем их элиминации.
Она развивается при заболеваниях печени и почек, а также у детей и пожилых людей.
При патологии печени возможна кумуляция активных метаболитов лекарственных средств.
Функциональная кумуляция характеризуется сохранением фармакодинамических эффектов после элиминации вещества из организма.
Примером функциональной кумуляции служат хронический алкоголизм при злоупотреблении этанолом.
Привыкание
Привыкание (толерантность) - ослабление эффектов лекарственных средств при повторном приеме.
Для возобновления терапевтического действия необходимо повышение дозы.
Обычно диазепам оказывает противотревожное действие при приеме 5-10 мг/сут, но на фоне привыкания доза может возрастать до 1000 мг/сут.
В основе привыкания лежат фармакокинетические и фармакодинамические механизмы.
Известны следующие фармакокинетические механизмы привыкания.
► Изменение активности ферментов метаболизма.
Индукция метаболической трансформации сопровождается привыканием, если лекарственные средства преобразуются в неактивные продукты.
Ингибирование вызывает привыкание к пролекарствам, требующим метаболической активации.
► Повышение активности гликопротеина Р.
Гликопротеин Р, удаляя лекарственные средства из эпителия кишечника, гепатоцитов, нефроцитов, эндотелия гистогематических барьеров, препятствует их резорбтивному действию.
При высокой активности гликопротеина Р развивается множественная лекарственная устойчивость.
Фармакодинамические механизмы привыкания могут быть следующими: ► десенситизация (уменьшение чувствительности) циторецепторов:
•гетерологическая - ослабление реакции циторецепторов на многие вещества под влиянием одного агониста;
•гомологическая - ослабление реакции только на агониста, вызывающего десенситизацию;
► уменьшение количества, мобильности и фиксация циторецепторов в клеточной мембране (down-регуляция): количество циторецепторов становится меньше из-за нарушения транскрипции генов, деградации матричной рибонуклеиновой кислоты (РНК), протеолиза и секвестрации в клетке;
► нарушение выделения нейромедиаторов (агонисты циторецепторов
тормозят выделение нейромедиаторов по принципу отрицательной обратной связи: опиоидные анальгетики уменьшают выделение эндогенных пептидов - энкефалинов, β-эндорфина и динорфина); ► уменьшение возбудимости чувствительных нервных окончаний - такой
механизм лежит в основе привыкания к слабительным средствам при их длительном применении;
► включение компенсаторных механизмов регуляции функций.
Терапевтическое действие антигипертензивных средств ослабляется либо в связи с тахикардией и ростом минутного сердечного выброса, либо из-за ухудшения почечного кровотока, уменьшения диуреза и увеличения объема циркулирующей крови (ОЦК).
Известно привыкание вследствие обучения.
В таких ситуациях жизненный опыт и повышенная бдительность позволяют исправлять внешние проявления нарушений, вызываемых химическими веществами: больные хроническим алкоголизмом обучаются ходить по прямой линии после приема этанола, несмотря на функциональные расстройства в двигательной сфере.
Тахифилаксия (от греч. tachys - быстрый, phylaxis - бдительность, охрана) - особый вид привыкания, характеризуется быстрым, в течение нескольких часов, привыканием к лекарственным средствам.
Тахифилаксия чаще всего обусловлена истощением ресурсов медиатора в синаптических окончаниях.
Адреномиметик непрямого действия эфедрин повышает выброс медиатора норадреналина из секреторных гранул в адренергических синапсах и тормозит его нейрональный захват.
Это сопровождается опустошением гранул и ослаблением гипертензивного действия эфедрина.
Привыкание к разным эффектам лекарственных средств может развиваться не одновременно.
При длительном приеме фенобарбитала ослабляется его снотворное действие, но сохраняется противосудорожная активность.
При перекрестном привыкании применение одного лекарственного средства ведет к уменьшению реакции на другое.
Злоупотребление психоактивными веществами, пристрастие и зависимость
Злоупотребление подразумевает не связанный с рекомендациями
врача прием психоактивных веществ с целью улучшения психического статуса или избавления от боли и неприятных ощущений.
Злоупотребление необязательно сопровождается развитием зависимости: практически здоровые люди эпизодически употребляют спиртные напитки в больших количествах.
Наркомания (от греч. narke - оцепенение) представляет собой форму
зависимости от психоактивных веществ, включенных в официальный список наркотиков (опиоиды, каннабиноиды, амфетамины, галлюциногены и др.).
Токсикоманию вызывают другие психоактивные вещества (летучие органические растворители, клеи, репелленты и др.).
С медицинской точки зрения понятия «наркомания» и «токсикомания» во многом совпадают.
Они могут взаимно трансформироваться.
Наркомании и токсикомании помимо медицинского значения имеют социальный и юридический аспекты - злоупотребление психоактивными веществами социально опасно и уголовно наказуемо.
Пристрастиехарактеризуется непреодолимым стремлением к
повторному приему психоактивных веществ для достижения эйфории (положительное подкрепление) или устранения психического и физического дискомфорта (отрицательное подкрепление).
Проявления эйфории (от греч. eu - хорошо, phero - переношу) - чувство удовлетворения, эмоциональная разрядка, приятные галлюцинации.
Психоактивные вещества могут повышать работоспособность и жизненные силы или вызывать легкое успокоение, приятное расслабление, умиротворение.
При зависимостиот психоактивных веществ возникает стойкая и систематическая потребность в их повторном приеме.
Повреждаются механизмы, отвечающие за формирование и контроль познавательной, эмоциональной и социальной деятельности.
Психоактивные вещества даже при однократном употреблении изменяют психофизиологическое состояние и способствуют формированию зависимости.
На этапе психической зависимости лишение психоактивного
вещества вызывает абстинентный синдром (от лат. abstinentia - воздержание) преимущественно в виде психопатологических нарушений:
-депрессии,
-раздражительности,
-несдержанности,
-агрессии,
-инсомнии,
-страха,
-амнезии,
-парестезии,
-прострации.
Психическая зависимость не создает непосредственной угрозы жизни больных, но определяет прогрессирующее течение и неблагоприятный прогноз.
Эта проблема усугубляется тем, что основное клиническое выражение психической зависимости - болезненное влечение к приему психоактивных веществ - относится к фармакорезистентным психопатологическим состояниям и плохо поддается лечению.
При физической зависимостипрекращение приема
психоактивного вещества или введение его антагониста сопровождается развитием тяжелого абстинентного синдрома: возникают не только психопатологические расстройства, но и комплекс неврологических и соматовегетативных нарушений по типу синдрома отдачи (нарушения функций противоположны тем, которые вызывает психоактивное вещество).
Известно, что морфин устраняет боль, вызывает сон, угнетает дыхательный центр.
При лишении морфина у больного с физической зависимостью появляются спонтанная боль, инсомния и одышка.
Прекращение приема веществ с коротким действием сопровождается быстрым развитием тяжелой абстиненции, лишение длительно действующих веществ приводит к менее тяжелой абстиненции в поздние сроки.
Острый период абстиненции обычно длится 4-5 нед.
После возобновления приема психоактивного вещества абстинентный синдром проходит.
Привыканиек психоактивным веществам развивается по фармакокинетическим и фармакодинамическим механизмам.
Например, очередной прием 500 мг морфина через 10 дней систематического злоупотребления переносится без симптомов интоксикации, тогда как терапевтическая доза морфина - всего 10 мг.
Привыкание к эйфорическому эффекту формируется быстрее, чем к действию на жизненно важные органы - дыхательную систему и систему кровообращения.
Это может стать причиной тяжелого отравления, так как зависимый человек, стремясь достичь эйфории, принимает психоактивное вещество во все более высоких дозах.
На финальной стадии наркомании и токсикомании формируется полиорганная недостаточность с выраженными истощением, сердечно-сосудистой, дыхательной, почечной недостаточностью, нарушением функций печени, диспепсией.
У больного развивается тяжелая энцефалопатия, его личность быстро деградирует.
Зависимость от психоактивных веществ обусловлена функциональными и морфологическими нарушениями в префронтальной коре, лимбической системе, стриатуме и среднем мозге.
В этих структурах мозга расположена система положительного подкрепления.
Если животному вживить микроэлектроды в указанные структуры и дать возможность произвольно раздражать их электрическим током, то оно будет делать это безостановочно в течение неограниченно длительного времени вплоть до полного истощения и гибели.
Психоактивные вещества вызывают дисфункцию всех нейрохимических систем головного мозга.
Для формирования зависимости наибольшее значение имеет влияние на дофаминергические нейроны вентральной области покрышки и прилегающего ядра переднего стриатума.
Эти структуры связаны между собой и активируют лимбическую систему и префронтальную кору.
Психоактивные вещества изменяют кругооборот дофамина: стимулируют выброс из пресинаптического депо и тормозят нейрональный захват.
Активация D-рецепторов сопровождается усилением функций системы положительного подкрепления и приятными эмоциональными переживаниями.
Дофамин постепенно инактивируется ферментами.
Истощение ресурсов нейромедиатора выражается ухудшением настроения, ощущением вялости, слабости, переживанием скуки, эмоциональным дискомфортом.
Компенсаторно усиливается синтез дофамина, уменьшается активность ферментов его метаболизма, в первую очередь МАО, образуются дополнительные D- рецепторы, включаются в функционирование латентные синапсы и проводящие пути.
Несмотря на компенсаторные механизмы, содержание дофамина в центрах положительного подкрепления остается минимальным.
Кокаин, амфетамин, опиоиды активируют преимущественно дофаминергические нейроны прилегающего ядра стриатума, никотин повышает выделение дофамина в вентральной области покрышки.
Этанол влияет на обе системы положительного подкрепления.
Этанол, опиоидные анальгетики, снотворные средства, анксиолитики вызывают психическую, физическую зависимость и привыкание.
Кокаин, психостимуляторы, каннабиноиды (продукты индийской конопли - марихуана, гашиш, анаша) вызывают психическую зависимость.
При злоупотреблении диэтиламидом лизергиновой кислоты (ДЛК, LSD) формируются психическая зависимость и привыкание.
Зависимость может развиваться от одного психоактивного вещества (кокаина, этанола), от фармакологической группы (бензодиазепиновых анксиолитиков, опиоидов) или от нескольких веществ с различными механизмами действия (полинаркомания).
При полинаркомании комфортное состояние наступает только при приеме нескольких психоактивных веществ.
При перекрестной зависимости одно психоактивное вещество поддерживает психическую зависимость, первоначально вызванную другим, а также купирует абстинентный синдром при его лишении.
