
- •ВЛИЯНИЕ НА ЦНС
- •Кора больших полушарий
- •Гипоталамус и железы внутренней секреции
- •Средний мозг
- •Продолговатый мозг
- •Дыхательный центр
- •Центр блуждающего нерва
- •Рвотный центр
- •Сосудодвигательный центр
- •Спинной мозг
- •ВЛИЯНИЕ НА СЕРДЕЧНО-СОСУДИСТУЮ СИСТЕМУ
- •ВЛИЯНИЕ НА ОРГАНЫ С ГЛАДКОЙ МУСКУЛАТУРОЙ
- •ХРОНИЧЕСКОЕ ОТРАВЛЕНИЕ НАРКОТИЧЕСКИМИ АНАЛЬГЕТИКАМИ
- •2. ТРАНКВИЛИЗАТОРЫ (лат. tranquillium - спокойствие, покой), или АНКСИОЛИТИКИ (лат. anxius - тревожный, полный боязни, охваченный страхом, греч. lysis - растворение)
- •3. АНТИДЕПРЕССАНТЫ (греч. anti- против, лат. depressio — подавление)
- •4. ПСИХОСТИМУЛЯТОРЫ (психо - + лат. stimulo — возбуждать, побуждать)
- •5. НООТРОПНЫЕ СРЕДСТВА (греч. noos - душа, мысль, tropos - направление)
- •6. НОРМОТИМИЧЕСКИЕ СРЕДСТВА (СОЛИ ЛИТИЯ)
- •7. ГАЛЛЮЦИНОГЕНЫ (лат. hallutinatio - бред, genos — происхождение), ПСИХОТОМИМЕТИКИ (психо - + греч. mimeticos — способный к подражанию), или ПСИХОДИСЛЕПТИКИ (психо - + греч. приставка dys-, означающая расстройство, нарушение, + lepticos)
- •Антипсихотическое действие
- •Психоседативное действие
- •Влияние на вегетативные функции
- •Гипотермическое действие
- •Противорвотное действие
- •Ортостатическая гипотензия
- •Влияние на сердечную деятельность
- •Изменение секреции гормонов
- •Блокада М-холинорецепторов
- •Влияние на моторику
- •Производные фенотиазина
- •Производное бутирофенона
- •Антипсихотические нейролептики — дофаминоблокаторы
- •1. Производные фенотиазина с пиперазиновым радикалом
- •2. Производное бутирофенона
- •3. Производные замещенного бензамида
- •СУЛЬПИРИД
- •Атипичные нейролептики
- •Транквилизаторы (лат. tranquillium - спокойствие, покой), или Анксиолитики (лат. anxius - тревожный, полный боязни, охваченный страхом, греч. lysis - растворение)
- •Противопоказания к применению:
БОЛЕУТОЛЯЮЩИЕ (АНАЛЬГЕЗИРУЮЩИЕ) СРЕДСТВА
Чувство боли выработалось в процессе эволюции как сигнал о грозящей опасности.
В этом смысле оно играет, несомненно, положительную роль, так как заставляет организм сосредоточить все силы на устранении причины, вызывающей боль, а вместе с ней иногда и угрозы жизни.
При определенных заболеваниях болевой синдром может приобретать доминирующее значение и резко утяжелять течение основного патологического процесса (инфаркт миокарда, почечная колика и др.).
Во всех этих случаях прибегают к назначению болеутоляющих средств.
Последние принято делить на две группы: а) опиоидные (или наркотические) анальгетики;
б) неопиоидные (или ненаркотические) анальгетики.
Наркотические анальгетики растительного и синтетического происхождения избирательно подавляют восприятие боли и повышают ее переносимость, уменьшают эмоциональную окраску и вегетативное сопровождение боли, вызывают лекарственную зависимость.
Слово «анальгезия» — утрата болевой чувствительности — происходит от греческих слов an — отрицание и algos — боль.
Острое болевое ощущение в ответ на повреждающие раздражители имеет сигнальное значение для организма, участвует в формировании адаптационных реакций.
Патологическая боль при соматогенных и нейрогенных болевых синдромах утрачивает сигнальную функцию, становится длительной или даже постоянной, приобретая характер болезни.
Примеры соматогенных болевых синдромов — посттравматическая, послеоперационная, миофасциальная боль, боль при воспалении суставов, инфаркте миокарда, злокачественных опухолях.
Нейрогенные болевые синдромы — невралгия тройничного и языкоглоточного нервов, фантомно-болевой синдром, таламическая боль, каузалгия.
Природным источником наркотических анальгетиков является опий (греч. opos — сок) — высохший млечный сок снотворного мака (Papaver somniferum).
Родина этого растения — Малая Азия.
Впервые опий упоминается в клинописных табличках Шумера (IV тысячелетие до н. э.).
Действие опия на человека описал греческий врач Теофраст (372 — 287 до н.э.).
В Средние века популярность опия как обезболивающего средства возродили Парацельс (1493 — 1541) и Томас Сиденхем (1624 — 1689).
Снотворный мак выращивают по разрешению ООН в разных странах, в том числе в республиках СНГ.
В мире ежегодно производится около 2000 т опия, из них для медицинских целей используется 800 т.
Термином «опиаты» обозначают только природные вещества, получаемые из опия (морфин, кодеин).
К опиоидам относят синтетические препараты наркотических анальгетиков.
Понятие о ноцицептивной, антиноцицептивной системе. Механизм передачи болевого импульса.
В формировании боли у человека и животных участвует ноцицептивная система (лат. nocere—повреждать, cepere—воспринимать), осуществляющей восприятие, проведение и обработку информации о различных повреждающих раздражителях.
участвует ноцицептивная система (лат. nocere—повреждать, cepere—воспринимать), осуществляющей восприятие, проведение и обработку информации о различных повреждающих раздражителях.
Повреждающие раздражения воспринимают ноцицепторы — периферические сенсорные нейроны с аксоном и дендритами, активируемые повреждающими стимулами, которые широко представлены:
- в коже, -подкожной клетчатке, -надкостнице, -суставах, -мышцах, -
-внутренних органах.
Ноцицепторы активируются мощным механическим (укол, щипок, удар) или температурным стимулом (нагревание, охлаждение), а также действием альгогенов — химических соединений, вызывающих болевое ощущение в минимальных дозах.
Ноцицепторы имеют неодинаковую чувствительность к термическим, механическим и химическим факторам.
Часть ноцицепторов активируется исключительно на химические стимулы, другие — на механические и/или температурные действия.
Ряд ноцицепторов («молчащие» ноцицепторы) при нормальных состояниях не отвечают ни на один из этих стимулов, они индуцируются только после их повреждения или воспаления соседних органов.
Распространение возбуждения от периферических окончаний ноцицепторов происходит посредством миелинизированных-волокон и немиелинизированных—С-афферентов.
Миелинизированные ноцицепторы имеют большую скорость проведения и, способствуют проявлению «первичной» боли—быстрой, острой, резкой, колющей.
С-волокна имеют меньшую скорость проведения. Считают, что с ними связана «вторичная» боль — отсроченная, жгучая, тупая.
Вы, наверное, замечали, что на одну и ту же температуру (например, когда моем руки) мы реагируем по разному: иногда нам кажется, что вода слишком горяча, иногда - недостаточно теплая.
Это связано с нашим состоянием и с состоянием нашей болевой чувствительности.
Первичным центром, воспринимающим болевые импульсы являются задние рога спинного мозга, здесь происходит переработка информации и передача в структуры головного мозга по спиноталамическому, спиноретикулярному и спиномезенцефалическому контралатеральным трактам.
Спиноталамический путь оканчивается на специфических вентробазальных ядрах таламуса.
Спиноретикулярный и спиномезенцефалический пути достигают неспецифических ядер таламуса после переключений в продолговатом и среднем мозге.
Из специфических ядер таламуса болевые импульсы поступают в соматосенсорные области коры больших полушарий.
Болевой поток их неспецифических ядер таламуса возбуждают кору лобной доли.

Рис. 8.1. Пути проведения боли.

НР - ноцицептивное раздражение; Серот. - серотонинергические волокна; Норадр. - норадренергические волокна; Энк. - энкефалинергические волокна; минус - тормозной эффект.' 1 - околоводопроводное серое вещество; 2 - большое ядро шва; 3 - голубое пятно; 4 - большеклеточное ретикулярное ядро; 5 - гигантоклеточное ретикулярное ядро; 6 - парагигантоклеточное ядро.
Соматосенсорные зоны оказывают локализацию боли.
Лобная кора формирует эмоционально-аффективные проявления боли и связанные с ней психические переживания.
Т.О., ноцицептивная система состоит из 2-х путей проведения болевых импульсов - специфического и неспецифического.
Специфический неоспиноталамический путь - малонейронный, быстрый,
проводит пороговую эпикритическую («быстрая», «первая», «предупредительная» боль).
Неспецифический палеоспиноталамический путь - проводит пропатическую («медленная», «тягостная», «древняя») боль.
Возникает под действием сильных, «разрушительных», «масштабных» раздражителей.
а) пороговая боль— это уровень раздражения, причиняемого нервной системе, при котором человек чувствует боль.
Болевой порог индивидуален для каждого, один и тот же уровень раздражения может выразиться как в незначительной, так и в сильной боли для разных людей.
б)боль подпороговая, но длительная (например, при онкологических заболеваниях; боли в спине и суставах — чаще всего симптом таких заболеваний, как остеохондрозы и артрозы, которые развиваются медленно, годами).
Так же медленно нарастает поток болевых сигналов, и организм успевает адаптироваться.
Нервные окончания в позвоночнике или суставах сигнализируют о неполадках, но мозг, привыкший к этим сигналам, не реагирует на них остро, не пропускает в сознание.
Такие боли называют подпороговыми: они есть, но мы их просто не воспринимаем и не ощущаем.
Когда же боль становится настолько сильной, что наше тело уже не может ее не замечать, это значит, что разрушительные процессы в суставах зашли достаточно далеко.
Общим нейромедиатором для специфического и неспицефичекого путей является глутаминовая кислота.
Антиноцицептивная система - нарушает восприятие боли, проведение болевого импульса и формирование реакций.
Болевые импульсы возбуждают нейроны антиноцицептивной системы, что ведет по принципу обратной связи к угнетению передачи болевых сигналов.
Ноцицептивная и антиноцицептивная системы регулируют болевую чувствительность в процессе постоянного взаимодействия.
Основные нейроны антиноцицептивной системы локализованы в околоводопроводном сером веществе среднего мозга.
Их аксоны образуют нисходящие пути к продолговатому и спинному мозгу и восходящие пути к ретикулярной формации, таламусу, гипоталамусу, лимбической системе, базальным ганглиям и коре.
Медиаторами этих нейронов являются пентапептиды: мет-энкефалин и лей-энкефалин, имеющие в качестве концевых аминокислот соответственно
метионин и лейцин.
Энкефалины возбуждают опиатные рецепторы.
В энкефалинергических (опиатергических) синапсах опиатные рецепторы находятся на постсинаптической мембране, но эта же мембрана является пресинаптической для других синапсов - болевых, т.е. через неё должны выделяться трансмиттеры, передающие "болевое" возбуждение с одного болевого нейрона на другой.
Опио́идные реце́пторы (опиатные рецепторы) — разновидность рецепторов нервной системы, относящихся к рецепторам, сопряжённым с G белком.
Основная их функция в организме — регулирование болевых ощущений.
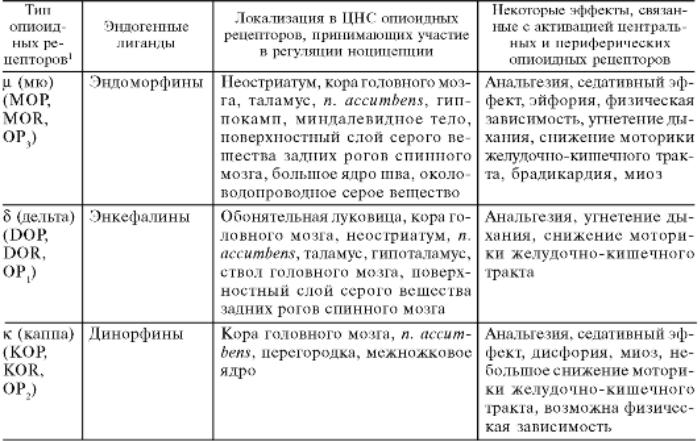
В настоящее время различают основные группы опиоидных рецепторов: μ- (мю), δ- (дельта), κ- (каппа) и ноцицептивные рецепторы.
Опиатные рецепторы широко распространены в головном, спинном мозге, а также в желудочно-кишечном тракте и других органах
Таблица 8.1. Типы опиоидных рецепторов: эндогенные лиганды, локализация, эффекты
Опиоидные рецепторы.
Выделяют четыре основных типа опиоидных рецепторов:
-мю- (имеют подтипы мю1 и мю2),
-дельта,
-каппа-
-сигма-.
Эндогенными лигандами (медиаторами) — активаторами (агонистами) этих рецепторов — являются особые пептиды (опиоидные пептиды): мет-энкефалин, лей-энкефалин, бета-эндорфин, динорфин и др.
Усиленный выброс эндогенных противоболевых пептидов отмечается только при возникновении сильных болевых ощущений.
ОР различаются по своему функциональному значению, имеют разную преобладающую локализацию и количественное представительство в тех или иных структурах мозга и других органах; отличаются сродством к разным эндогенным лигандам, опиоидным анальгетикам и антагонистам ОР (табл. 45).
Опиоидные пептиды и наркотические анальгетики взаимодействуют с метаботропными опиоидными рецепторами трех типов — µ, κ и δ:
•µ-опиоидные рецепторы вызывают:
- супраспинальную (µ1) и спинальную (µ2) анальгезию,
-седативный эффект,
-эйфорию,
-лекарственную зависимость,
-гипотермию,
-регулируют процессы обучения и памяти,
-регулируют аппетит,
-суживают зрачки,
-угнетают дыхательный центр (µ2),
-увеличивают тонус гладкой мускулатуры (µ2);
•к-опиоидные рецепторы вызывают:
-супраспинальную (к3) и спинальную (к1) анальгезию,
-седативный эффект,
-психотомиметический эффекты,
-спазм гладких мышц,
-регулируют питьевую и пищевую мотивации,
-угнетают дыхание,
-повышают диурез (к,);
•δ-опиоидные рецепторы вызывают:
-супраспинальную (δ1, δ2) и спинальную (δ2) анальгезию,
-гипотермию,
-регулируют познавательную деятельность,
-регулируют настроение,
-регулируют двигательную активность,
-регулируют обоняние,
-регулируют моторику желудочно-кишечного тракта,
-регулируют функции сердечно-сосудистой системы,
-угнетают дыхание,
-оказывают центральное гипотензивное действие.
№ |
Подтип |
Локализация |
Физиологическая роль |
п/п |
|
|
|

|
|
|
|
|
|
|
1. |
В ЦНС: наибольшая концентрация - в |
|
|
|
|
|
|
|
||||||||||
|
(выдел |
|
обонятельной луковице, новой коре, хвостатом |
|
|
|
|
|
|
|
|||||||||||||||
|
ено |
|
2 |
|
и |
добавочном |
ядрах; |
в |
незначительном |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
количестве – в таламусе, гипоталамусе, стволе |
|
|
|
|
|
|
|
|||||||||||
|
субтип |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
1 |
и |
|
мозга. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
а: |
|
|
Располагаются, в основном, пресинаптически. |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
2) |
|
|
|
2. |
ЖКТ: наибольшие концентрации - в |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
фундальной части желудка (в мышцах |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
сфинктеров, |
|
ауербаховском |
сплетении, |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
непосредственно под слизистой оболочкой); в |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
12-перстной кишке (в слизистой оболочке, в |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
ворсинках и у основания ворсинок); в |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
подвздошной кишке. |
системы |
(Т- и |
В- |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
3. На |
клетках |
иммунной |
|
|
|
|
|
|
|
|||||||||
2. |
|
|
|
|
|
|
|
лимфоциты). |
|
|
|
|
|
|
- |
участвуют в анальгезии; |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
( |
1, |
- |
3 |
– |
только на клетках не |
нейронального |
|
||||||||||||||||
|
|
2, |
|
|
3) |
происхождения (иммуноцитах и микроглиальных |
- |
опосредуют ряд важнейших |
|||||||||||||||||
|
|
|
|
|
|
|
клетках) |
|
(мало |
изучены, |
специфически |
|
физиологических |
функций: |
|||||||||||
|
|
|
|
|
|
|
связывают |
|
эндогенный |
морфин, |
алкалоиды |
|
участвуют |
в |
процессах |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
регуляции |
дыхания |
( |
||||
|
|
|
|
|
|
|
опия); |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
- |
1 |
и |
|
2 |
распространены |
повсеместно |
в |
|
угнетение |
дыхательного |
||||||||
|
|
|
|
|
|
|
|
|
центра |
и |
повышение |
его |
|||||||||||||
|
|
|
|
|
|
|
|
организме: |
|
|
|
|
|
|
|
чувствительности |
|
к |
|||||||
|
|
|
|
|
|
|
- в высоких концентрациях - в хвостатом ядре, |
|
гиперкапнии), |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
новой коре, таламусе, дополнительном ядре, |
|
регуляции деятельности ССС, |
|||||||||||||||
|
|
|
|
|
|
|
|
гиппокампе и амигдале ; умеренное |
|
регуляции аппетита, |
|
||||||||||||||
|
|
|
|
|
|
|
|
количество – в околоводопроводном сером |
|
терморегуляции, |
|
|
|||||||||||||
|
|
|
|
|
|
|
- |
веществе, гипоталамусе, бледном шаре; |
|
|
синтеза |
и |
высвобождения |
||||||||||||
|
|
|
|
|
|
|
в симпатических ганглиях; |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
- |
в |
ЖКТ: |
в |
теле желудка (в подслизистом |
|
ряда гормонов; |
|
|
||||||||||
|
|
|
|
|
|
|
|
(мейснеровом) сплетении, ауэрбаховском |
- |
с |
-рецепторами связано |
||||||||||||||
|
|
|
|
|
|
|
|
сплетении; в 12-перстной кишке, в |
развитие |
привыкания |
к |
||||||||||||||
|
|
|
|
|
|
|
|
подвздошной |
кишке |
(в |
слизстом, |
наркотическим |
веществам |
и |
|||||||||||
|
|
|
|
|
|
|
|
подслизистом слоях, в межмышечном и |
наркомании. |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
подслизистом сплетениях). |
|
|
|
|
|
|
|
|
|
|
||||||||
3. |
|
|
( |
1, |
1. |
В наибольших концентрациях – в коре |
- |
участвуют |
в |
регуляции |
|||||||||||||||
|
|
2, |
|
|
3) |
|
головного мозга, черной субстанции, ядрах |
- |
болевой чувствительности; |
||||||||||||||||
|
|
|
|
2. |
ствола мозга. |
|
|
|
|
|
участвуют |
в |
регуляции |
||||||||||||
|
|
|
|
|
|
|
Незначительные концентрации – в спинном |
|
питьевой |
и |
пищевой |
||||||||||||||
|
|
|
|
|
|
|
3. |
мозге и симпатических ганглиях. |
|
|
- |
мотивации; |
в |
процессах |
|||||||||||
|
|
|
|
|
|
|
В ворсинках плаценты. |
|
|
|
|
участвуют |
|||||||||||||
|
|
|
|
|
|
|
4. |
На ряде иммунных клеток. |
|
|
|
- |
терморегуляции; |
процессах |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
участвуют |
в |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
регуляции |
|
кардио- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
респираторных функций; |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- возможно, активация к- |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рецепторов |
приводит |
к |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
угнетению |
высвобождения |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
антидиуретического |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гормона; |
|
|
|
|
|
Функции опиоидных рецепторов

Функции |
Рецепторы |
Влияние агонистов |
Анальгезия Супраспинальная Спинальная |
µ1, κ3, δ1, δ2 |
Усиление |
|
µ2, κ1, δ2 |
Усиление |
Эйфория и лекарственная зависимость |
µ |
Усиление |
Психотомиметическое действие |
κ |
Усиление |
Седативное действие |
µ,κ |
Усиление |
Дыхание |
µ2, κ, δ |
Угнетение |
Моторика пищеварительного тракта |
µ2,κ, δ |
Обстипация |
Диурез |
κ1 |
Увеличение |
Выделение гормонов: |
µ1 |
Увеличение |
Пролактин |
||
Гормон роста |
2 |
Увеличение |
|
µ и/или δ |
|
По характеру действия на ОР все опиоидергические средства подразделяются на следующие группы:
а) а г о н и с т ы, активирующие все типы ОР, к ним относятся морфин, кодеин,
тримеперидин (промедол), просидол, фентанил, трамадол;
б) ч а с т и ч н ы е а г о н и с т ы, активирующие преимущественно мю-ОР (мю1
больше, чем мю2), — бупренорфин;
в) а г о н и с т ы - а н т а г о н и с т ы, активирующие каппа- и сигма-ОР и бло-
кирующие мю- и дельта-ОР, — буторфанол, налбуфин;
г) а н т а г о н и с т ы, блокирующие все типы ОР, — налоксон, налтрексон.
На клеточном уровне активация ОР проявляется гиперполяризацией мембраны воспринимающей клетки за счет активации калиевых каналов и усиления выхода ионов калия, в результате чего тормозится активация потенциалзависимых кальциевых каналов и уменьшается поступление ионов кальция в клетку.
Кроме того, происходит ингибирование аденилатциклазы и уменьшение образования цАМФ.
Взаимодействие опиоидных анальгетиков и эндогенных опиоидных пептидов с пресинаптическими ОР приводит к торможению высвобождения «болевых» медиаторов из пресинаптических окончаний.
Активация постсинаптических ОР сопровождается снижением возбудимости нервных клеток, воспринимающих болевые импульсы.
Важным компонентом в механизме аналгезирующего действия опиоидов является феномен «растормаживания» подкорковых противоболевых систем и усиление нисходящих тормозных влияний к нейронам спинного мозга, участвующим в передаче боли.
Обезболивающее действие опиоидных анальгетиков-агонистов (морфин и др.) связано с их взаимодействием с мю1-, дельта- и каппа-ОР, частичных агонистов (бупренорфин) — с мю1-ОР, агонистов-антагонистов (буторфанол и др.) - только с каппа-ОР.
На системном уровне обезболивающее действие опиоидных анальгетиков характеризуется:
—относительно малым повышением болевого порога и низкой эффективностью препаратов при надпороговых раздражениях, например при разрезе кожи (требуются большие дозы);
—глубоким угнетением процесса суммации подпороговых болевых раздражений на всех уровнях проведения боли, что, собственно, и составляет физиологическую основу опиоидной аналгезии;
—преимущественной эффективностью при хронических болях, исходящих из внутренних органов с относительно редкими болевыми интерорецепторами, т. е. в условиях, где процесс суммации раздражений особенно важен для их проведения;
—наличием противотревожного и эйфоризирующего действия, которое подавляет ожидание боли, психическую «готовность» к ней, сглаживает восприятие и оценку болевых ощущений.
Анальгезирующими средствами, или анальгетиками ( от греч. algos - боль и an - без), называют лекарственные средства, обладающие специфической способностью ослаблять или устранять чувство боли, т.е. средства, доминирующим эффектом которых является анальгезия, наступающая в результате резорбтивного действия и не сопровождающаяся в терапевтических дозах выключением сознания и выраженным нарушением двигательных функций.
В эту группу входят вещества, способные при резорбтивном действии избирательно подавлять чувство боли за счет влияния на ЦНС, а при регулярном применении — вызывать психическую и физическую зависимость (наркоманию).
Классификация болеутоляющих средств.
А. Опиоидные (наркотические) анальгетики и их антагонисты
1). Классификация по химическому строению
а) алкалоиды опия:
•производные пиперидинфенантрена:
-Морфина гидрохлорид,
-Кодеина фосфат
•производные изохинолина: - Папаверина гидрохлорид
б) препараты опия: - Омнопон
в) заменители морфина:
•производные фенантрена:
-Бупренорфин,
-Нальбуфин
•производные фенилпиперидина:
-Промедол,
-Фентанил,
-Лоперамид,
-Пиритрамид
•производные морфина: - Буторфанол
•производные бензоморфана: - Пентазоцин
•производные циклогексанола: - Трамадол.
2). Классификация по взаимодействию с опиоидными рецепторами (о.р.)
а) агонисты опиоидных рецепторов:
•агонисты –μ о.р.
-Морфина гидрохлорид,
-Промедол,
-Фентанил,
-Пиритрамид
б) агонисты-антагонисты опиоидных рецепторов:
•агонисты κ- и антагонисты μ -о.р.: - Нальбуфен
•агонисты κ- σ- и антагонисты μ-о.р.: - Буторфанол
•агонисты κ - δ - и антагонисты μ-о.р.: - Пентазоцин
•агонисты κ- и антагонисты μ-, δ -о.р.: - Налорфин
•агонисты μ- и антагонисты δ -о.р.: - Бупренорфин
в) антагонисты опиодных резепторов:
антагонисты μ-, κ-,δ - о. р.:
-Налоксон,
-Налтрексон
Препараты можно разделить на три группы:
• анальгетики — полные агонисты (преимущественно µ-опиоидных рецепторов);
• анальгетики с комбинированным действием
(парциальные) агонисты µ-опиоидных рецепторов со свойствами агонистов или антагонистов к-опиоидных рецепторов (средства этой группы слабее угнетают дыхательный центр и обладают меньшим наркогенным потенциалом);
• антагонисты опиоидных рецепторов.
Трамадол состоит из двух энантиомеров.
Один энантиомер взаимодействует с опиоидными µ-рецепторами, другой нарушает нейрональный захват норадреналина и в меньшей степени — серотонина.
Оба энантиомера повышают выделение серотонина из пресинаптических окончаний.
В результате этих эффектов трамадол усиливает сегментарное и нисходящее серотонинергическое тормозящее влияние на передачу ноцицептивных импульсов в задних рогах спинного мозга.
Таблица |
|
|
|
|
|||
|
Наркотические анальгетики и их антагонисты |
|
|||||
|
Препараты |
Коммерческие |
Влияние на опиоидные |
Анальгетическая |
|||
|
|
названия |
|
рецепторы |
активность по |
||
|
|
|
|
|
|
|
отношению к морфину |
|
|
|
µ |
|
к |
δ |
|
|
|
|
|
|
|
|
|
|
|
НАРКОТИЧЕСКИЕ АНАЛЬГЕТИКИ |
|
||||
|
|
ПОЛНЫЕ АГОНИСТЫ |
|
|
|||
|
|
Производные фенантрена |
|
|
|||

МОРФИН |
|
|
|
+++ |
|
+ |
|
|
|
Меньше в 5 — 7 раз |
КОДЕИН |
|
|
|
|
|
|
|
|||
(МЕТИЛМОРФИН) |
|
|
|
++ |
|
+ |
|
|
|
|
ЭТИЛМОРФИН |
|
ДИОНИН |
|
++ |
|
+ |
|
|
|
Такая же |
ПРОМЕДОЛ |
|
|
|
|
|
|
||||
|
|
Производные пиперидина |
|
|
|
|||||
(ГРИМЕПЕРИДИН) |
|
|
|
++ |
|
|
|
|
|
Меньше в 3 — 4 раза |
|
|
|
|
|
|
|
|
|||
ФЕНТАНИЛ |
|
|
|
+++ |
|
|
|
|
|
Больше в 100 — 300 раз |
РЕМИФЕНТАНИЛ |
|
|
|
|
|
|
|
|
||
ПИРИТРАМИД |
|
УЛТИВА |
|
+++ |
|
|
|
|
|
Больше в 100 — 300 раз |
ПРОСИДОЛ |
|
ДИПИДОЛОР |
|
++ |
|
|
|
|
|
Такая же |
|
|
|
|
++ |
|
|
|
|
|
Меньше в 3 — 4 раза |
|
|
Производное |
циклогексанола |
|
|
|
||||
ТРАМАДОЛ |
|
|
|
|
|
|
|
|
|
|
|
|
ПРОТРАДОН ТРАМАЛ |
|
++ |
|
|
|
|
|
Меньше в 3 — 5 раз |
|
|
АНАЛЬГЕТИКИ С |
|
КОМБИНИРОВАННЫМ ДЕЙСТВИЕМ |
||||||
|
|
Производные фенантрена |
|
|
|
|||||
БУПРЕНОРФИН |
|
БУТРАНАЛ |
|
ч |
|
|
|
? |
|
Больше в 25 — 50 раз |
|
|
|
|
|
|
|||||
|
|
НОРФИН |
|
|
|
|
|
|
|
|
|
|
ТОРГЕЗИК |
|
|
|
|
|
|
|
|
БУТОРФАНОЛ |
|
ТРАНСТЕК |
|
ч |
|
+++ |
|
? |
|
Больше в 5 раз |
|
|
БЕФОРАЛ |
|
|
|
|
||||
|
|
МОРАДОЛ |
|
|
|
|
|
|
|
|
НАЛБУФИН |
|
СТАДОЛ |
|
|
|
|
|
|
|
|
ПЕНТАЗОЦИН |
|
НУБАИН |
|
— |
|
++ |
|
|
|
Такая же |
|
|
Производное бензоморфана |
|
|
|
|||||
|
|
ЛЕКСИР ФОРТРАЛ |
|
ч |
|
++ |
|
|
|
Меньше в 3 — 4 раза |
|
|
|
|
|
|
|
||||
|
|
АНТАГОНИСТЫ НАРКОТИЧЕСКИХ АНАЛЬГЕТИКОВ |
||||||||
|
|
Производные фенантрена |
|
|
|
|||||
НАЛОРФИН |
|
АНТОРФИН |
|
— |
+++ |
|
|
|
|
|
НАЛОКСОН |
|
|
— |
|
|
|
|
|||
НАЛТРЕКСОН |
|
НАРКАНТИ |
|
— |
|
— |
— |
|||
|
|
|
|
|
|
— |
— |
|||
Примечание. Влияние на опиоидные рецепторы (1 — 3) — + — полный агонист; Ч — частичный агонист; — — антагонист; ? — действие не установлено.
Механизм действия опиоидных (наркотических) анальгетиков.
Наркотические анальгетики являются лигандами опиоидных рецепторов подобно эндогенным опиоидным пептидам.
Они потенцируют тормозящее влияние опиоидной антиноцицептивной системы на проведение болевых импульсов, преимущественно в центральной части неспецифической проекционной системы.
Наркотические анальгетики нарушают в пластинах 1 и 2 задних рогов спинного мозга выделение медиаторов боли из окончаний аксона первого чувствительного нейрона (его тело находится в спинальном ганглии), вызывают гиперполяризацию нейронов задних рогов; усиливают нисходящий тормозящий контроль над деятельностью спинного мозга, реализуемый через систему вставочных нейронов (медиаторы — серотонин и глицин).
При введении анальгетиков в малых дозах в спинномозговой канал возникает лечебная анальгезия в течение 12 — 20 ч.
Ее механизм — прямая блокада задних рогов спинного мозга (местные анестетики при спинальной анестезии нарушают проведение импульсов в задних корешках до их входа в спинной мозг).
Наркотические анальгетики обладают низкой эффективностью при постампутационной боли, так как пересечение седалищного нерва ведет к гибели первичных афферентов в спинном мозге и деградации опиоидных рецепторов на принадлежащей первичным афферентам пресинаптической мембране.
Анальгетики подавляют суммацию болевых импульсов в таламусе.
В малых дозах они легче устраняют подпороговую, ноющую боль, чем острую боль.
Уменьшают активацию болевыми импульсами эмоциональных и вегетативных центров гипоталамуса, лимбической системы и коры больших полушарий, ослабляют отрицательную эмоциональную и психическую оценки боли.
Больные, принимающие наркотические анальгетики, иногда сообщают, что боль осталась, но они воспринимают ее индифферентно, без тягостных переживаний и страха.
Их внимание переключается на приятные ощущения и размышления.
В последнее время появились сообщения о синтезе опиоидных рецепторов в спинальных ганглиях при воспалении, сопровождающемся болью.
Эти новые рецепторы транспортируются по нервным волокнам в двух направлениях: в спинной мозг, чтобы стать пресинаптическими на окончаниях первичных афферентов, а также в воспаленную ткань.
Поступление опиоидных рецепторов в очаг воспаления зависит от пролиферации иммунокомпетентных клеток.
Остается неясным, какое значение имеют периферические опиоидные
рецепторы для обезболивающего эффекта наркотических анальгетиков.
В перспективе возможно создание агонистов периферических опиоидных рецепторов, не обладающих токсическим действием на ЦНС.
Морфина гидрохлорид.
О п и й – высохший на воздухе млечный сок, выделяющийся из надрезов на незрелых коробочках различных сортов снотворного мака, который выращивают на специальных полях, прямо на корню делают насечки на коробочках мака специальным инструментом, высушивают на воздухе, затем вручную собирают высохший сок.
Состав опия: 20% - алкалоиды; 80% - баластные вещества.
В составе около 20 алкалоидов, 10% из которых приходится на морфин.
Алкалоиды опия по химической структуре делятся на производные пиперидинфенантрена (морфин, кодеин) и изохинолина (папаверин ).
Структуру фенантрена имеют морфин (10%), кодеин (0,5 %) и тебаин (0,2 %).
Из них анальгетиками являются морфин и кодеин (греч. kodeia — маковая головка).
Производные изохинолина папаперин (1 %), носкапин (6 %), лауданозин проявляют свойства миотропных спазмолитиков.
Т.О. первые оказывают центральное анальгезирующее действие, у вторых это действие не выражено, но выражено спазмолитическое действие.
Морфин был выделен из опия ганноверским фармацевтом Вильгельмом Сертюрнером в 1806 г.
Название алкалоида дано по имени Морфея — древнегреческого крылатого бога сна, сына Гипноса (греч. morphe — форма, так как бог являлся в сновидениях в образах людей, животных и природных стихий).
Является основным алкалоидом опия и составляет 10% его массы. В качестве ЛВ применяется морфина г/х.
Механизм болеутоляющего действия наркотических анальгетикв (опиоидов) на примере морфина.
В нервной системе человека имеется сложная антиноцицептивная (противоболевая) система, включающая энкефалиновые пресинаптические тормозящие рецепторы.

Рис. 8.3. Возможные точки приложения действия морфина.
Анальгетический эффект морфина обусловлен его стимулирующим влиянием на опиоидные рецепторы на разных уровнях ЦНС.
1 - влияние на пресинаптические рецепторы первичных афферентов (приводит к снижению высвобождения медиаторов, например субстанции Р, глутамата); 2 - влияние на постсинаптические рецепторы нейронов заднего рога спинного мозга, приводящее кугнетению их активности;
3, 4 - активация антиноцицептивной системы среднего и продолговатого мозга (центральное серое вещество, ядра шва) усиливает нисходящее тормозное влияние на проведение болевых импульсов в задних рогах спинного мозга; 5 - угнетение межнейронной передачи болевых импульсов на уровне таламуса;
6 - при воспалении снижение чувствительности окончаний афферентных нервов. PAG - околоводопроводное серое вещество; LC - голубое пятно; NRM - большое ядро шва; HA - адренергические волокна; Энк. - энкефалинергические волокна; Серот. - серотонинергические волокна; минус - тормозное влияние.
В качестве нейромедиаторов передачи импульса в этих рецепторах выступают олигопептиды: эндорфины и энкефалины, которые связываясь с опиатными рецепторами, оказывают анальгетическое действие.
Механизм болеутоляющего действия морфина выяснен не полностью.
Тем не менее есть все основания считать, что он складывается из следующих основных компонентов:
1)угнетения процесса межнейронной передачи болевых импульсов в центральной части афферентного пути и
2)нарушения субъективно-эмоционального восприятия, оценки боли и реакции на нее.
Механизм болеутоляющего действия морфина обусловлен его взаимодействием с опиоидными рецепторами (μ > κ ≈ δ), агонистом которых он является.
Стимуляция морфином опиоидных рецепторов проявляется активацией эндогенной антиноцицептивной системы и нарушением межнейронной передачи болевых стимулов на разных уровнях ЦНС.
Так, существенное значение имеет прямое угнетающее влияние морфина на спинальные нейроны.
При этом происходит нарушение межнейронной передачи возбуждения на уровне задних рогов спинного мозга.
Важно также действие морфина на супраспинальные ядра, участвующие в нисходящем контроле активности нейронов задних рогов спинного мозга.
В эксперименте показано, что введение морфина в некоторые из этих ядер (например, в околоводопроводное серое вещество, в ретикулярные парагигантоклеточное и гигантоклеточное ядра) вызывает анальгезию.
Важность нисходящей системы доказывается также тем, что разрушение большого ядра шва в значительной степени снижает анальгетическое действие морфина.
Таким образом, угнетающее влияние морфина на передачу болевых импульсов в спинном мозге с первичных афферентных волокон на вставочные нейроны складывается из усиления нисходящих тормозных влияний и прямого угнетающего действия на межнейронную передачу в спинном мозге.
Эти виды действия локализуются как на постсинаптических нейронах, так и на уровне пресинаптических окончаний.
В последнем случае морфин, стимулируя пресинаптические опиоидные рецепторы окончаний первичных афферентов, уменьшает высвобождение медиаторов (например, глутамата, субстанции Р), принимающих участие в передаче ноцицептивных стимулов.
Торможение постсинаптических нейронов обусловлено их гиперполяризацией (за счет активации постсинаптических К+-каналов).
Нарушение морфином межнейронной передачи в спинном мозге снижает интенсивность импульсации, поступающей в восходящие афферентные пути, а также уменьшает двигательные и вегетативные реакции
Изменение восприятия боли связано, по-видимому, не только с уменьшением поступления болевых импульсов к вышележащим отделам, но также с успокаивающим действием морфина.
Последнее, очевидно, сказывается на оценке боли и ее эмоциональной окраске, что имеет важное значение для двигательных и вегетативных проявлений боли.
Роль психического состояния для оценки болевых ощущений очень велика. Достаточно отметить, что положительный эффект плацебо при некоторых болях достигает 35-40%.
ВЛИЯНИЕ НА ЦНС
Кора больших полушарий
Морфин как агонист µ-опиоидных рецепторов вызывает эйфорию и седативный эффект, переходящий в чуткий, поверхностный, богатый сновидениями сон.
Вклад в развитие эйфории вносит также повышенная секреция дофамина в коре больших полушарий, полосатом теле, лимбической системе, гипоталамусе.
Агонисты к-опиоидных рецепторов (пентазоцин, налорфин), подавляя освобождение дофамина, вызывают дисфорию (греч. dys — отрицание, phero — переношу) в виде беспокойства, депрессии, неприятных, странных мыслей, дезориентации, ночных кошмаров, галлюцинаций.
Буторфанол и налбуфин вызывают дисфорию реже и в мягкой форме.
В эксперименте морфин и промедол в токсических дозах оказывают судорожное влияние, ослабляя ГАМК-ергическое торможение в гиппокампе.
В клинике эти анальгетики провоцируют судороги только при очень тяжелой интоксикации. Для купирования судорог эффективны налоксон и налтрексон.
Гипоталамус и железы внутренней секреции
Морфин уменьшает освобождение в гипоталамусе рилизинг-гормонов для гонадотропинов и АКТГ, поэтому вторично подавляет секрецию фолликулостимулирующего, лютеинизирующего гормонов, АКТГ, глюкокортикоидов и тестостерона.
Повышает выделение пролактина, гормона роста и вазопрессина (антидиуретический гормон).
В больших дозах, активируя центр теплоотдачи, вызывает гипотермию.
Средний мозг
Морфин, активируя µ- и к-опиоидные рецепторы в ядрах глазодвигательного нерва, вызывает миоз и легкий спазм аккомодации.
Продолговатый мозг
Дыхательный центр
При введении морфина и других опиоидных анальгетиков всегда имеет место угнетение дыхания той или иной степени.
Оно проявляется в уменьшении частоты и глубины дыхания. Чувствительность дыхательного центра к углекислоте резко снижается.
В связи с гиповентиляцией отмечается накопление CO2 в альвеолярном воздухе и крови; возникает дыхательный ацидоз.
Все это приводит к расширению сосудов мозга и повышению внутричерепного давления.
У бодрствующих больных угнетение дыхания при введении терапевтических доз анальгетиков обычно невелико, но оно резко увеличивается при погружении в сон, наркоз, в бессознательном состоянии.
По времени пик угнетающего действия морфина на дыхание проявляется на 7—10-й минуте после внутривенной инъекции, на 30-й минуте после внутримышечного и на 60—90-й минуте после подкожного введения в
терапевтических дозах.
Активность дыхательного центра и минутный объем вентиляции полностью восстанавливаются через 4—5 ч.
К сожалению, практически все лекарственные вещества, усиливающие опиоидную аналгезию, потенцируют и угнетающее действие препаратов на дыхательный центр.
Опиоидные анальгетики хорошо проникают через плацентарный барьер и могут оказать неблагоприятное действие на дыхательный центр плода.
Это следует иметь в виду при обезболивании родов, поскольку применение анальгетиков (особенно агонистов) увеличивает частоту асфиксии новорожденных.
Угнетение морфином дыхания находит лишь одно полезное применение: он вводится при резко выраженной одышке (сердечная астма, отек легких), в результате которой воздух в основном «гоняется» в мертвом долегочном пространстве и резко расстраивается газообмен.
Большинство опиоидных анальгетиков в равнозначных по болеутоляющему эффекту дозах практически в такой же степени, как и морфин, угнетают дыхательный центр.
Лишь у некоторых новых препаратов удалось достичь диссоциации обезболивающего действия и влияния на дыхание, в терапевтических дозах они мало влияют на легочную вентиляцию (буторфанол, трамадол).
Это,по-видимому, не относится к больным и пострадавшим с уже имеющимися расстройствами дыхания.
Морфин, воздействуя на опиоидные рецепторы µ2, к и δ, ослабляет реакцию дыхательного центра на возбуждающие стимулы со стороны ретикулярной формации, снижает его чувствительность к углекислому газу и ацидозу, при этом сохраняется активирующее влияние каротидных клубочков.
Дыхание становится редким, но компенсаторно углубляется, затем появляется редкое и поверхностное дыхание, при тяжелой интоксикации возникает
периодическое дыхание Чейна — Стокса с последующим параличом дыхательного центра.
Произвольный контроль дыхания сохраняется.
Большинство полных агонистов в эквианальгетических дозах подавляют дыхание аналогично морфину.
Фентанил не только значительно угнетает дыхательный центр, но и вызывает ригидность дыхательной мускулатуры — синдром «деревянной грудной клетки».
Ремифентанил оказывает аналогичное действие только при введении в
большой дозе.
Трамадол и анальгетики с комбинированным действием нарушают дыхание слабее морфина.
Бупренорфин уменьшает вызываемое фентанилом угнетение дыхательного центра без ослабления анальгетического эффекта.
Морфин тормозит функцию экспираторных нейронов, участвующих в
кашлевом рефлексе.
Этот анальгетик назначают как противокашлевое средство в случаях, когда кашель угрожает жизни — усиливает кровотечение при травме или туберкулезе.
Кодеин и этилморфин используют при кашле в комбинации с отхаркивающими средствами.
Вероятно, кодеин подавляет кашель, воздействуя на специфический тип опиоидных рецепторов.
Центр блуждающего нерва
Морфин, возбуждая дорзальное ядро блуждающего нерва, вызывает брадикардию и бронхоспазм (также освобождает гистамин из тучных клеток).
Рвотный центр
Морфин вызывает тошноту у 40 % людей и рвоту у 15 % как стимулятор хеморецепторов триггерной зоны рвотного центра.
Рвота чаще возникает у пациентов, принимающих морфин амбулаторно, чем у больных, находящихся на стационарном лечении.
Это обусловлено повышением чувствительности рвотного центра к раздражениям со стороны вестибулярного анализатора.
Другие наркотические анальгетики обладают слабым рвотным эффектом.
