
Методические материалы для врачей и студентов / Обмен углеводов
.pdf
«Лабораторные методы диагностики и мониторинга нарушений углеводного обмена. Сахарный диабет»
Лабораторные методы диагностики и мониторинга нарушений углеводного обмена. Сахарный диабет.
Метаболизм глюкозы
Глюкоза является одним из важнейших компонентов крови, ее уровень отражает состояние углеводного обмена. Глюкоза равномерно распределяется между плазмой и форменными элементами крови с некоторым превышением ее концентрации в плазме. Содержание глюкозы в артериальной крови выше, чем в венозной, что объясняется непрерывным использованием глюкозы клетками тканей и органов. Определение концентрации глюкозы в крови в клинической практике имеет важнейшее значение для диагностики и мониторирования лечения сахарного диабета (СД).
Углеводы — важнейший источник энергии в организме человека. Поступившие с пищей углеводы расщепляются ферментами ЖКТ до моносахаридов и в такой форме всасываются через стенки тонкой кишки. Глюкоза и метаболиты углеводного обмена воротной вены поступают в печень и ткани организма. Глюкоза может функционировать только внутри клеток, где играет роль источника энергии.
Всосавшаяся в тонкой кишке глюкоза поступает через воротную вену в печень и попадает в гепатоциты. В клетках печени глюкоза фосфорилируется в гексокиназной реакции, превращаясь в глюкозо-6-фосфат (Гл-6-Ф), Гл-6-Ф является субстратом нескольких путей метаболизма: синтеза гликогена, пентозофосфатного цикла, гликолитического распада до лактата или аэробное полное расщепление до СО2 и Н2О. В клетках, способных к глюконеогенезу (клетки печени, почек, кишечника), Гл-6-Ф может дефосфорилироваться Гл-6-фосфатазой и в виде свободной глюкозы поступать в кровь и переноситься в другие органы и ткани. При недостатке кислорода в клетке глюкоза может окисляться в процессе гликолиза с образованием молочной кислоты (лактата). Накопление молочной кислоты в крови (лактат-ацидоз) — причина метаболического ацидоза, который сопровождает многие патологические процессы с недостаточным поступлением кислорода (дыхательная недостаточность) или недостаточным кровоснабжением тканей. Большинство тканей (мозг, эритроциты, хрусталик глаза, паренхима почки, работающая мышца) полностью зависят от прямого поступления глюкозы в клетки и требуют непрерывной подачи глюкозы каждую секунду, так как в них происходит очень быстрая утилизация АТФ. Особенно важна глюкоза для клеток мозга. Клетки нервной системы зависят от глюкозы как от основного энергетического субстрата. В то же время в мозге нет запасов глюкозы, она там не синтезируется, нейроны не могут потреблять другие энергетические субстраты, кроме глюкозы и кетоновых тел, глюкоза практически полностью может исчерпываться из внеклеточной жидкости, так как клетки нервной системы потребляют глюкозу инсулин-независимым путем. Диапазон нормальных значений для сыворотки и плазмы натощак 3,8-6,1 ммоль/л, что соответствует в цельной крови 3,3-5,5 ммоль/л. Разница между сывороткой и цельной кровью обусловлена эритроцитами и лейкоцитами, в которых объем водной фазы меньше, чем в сыворотке крови, а глюкоза растворена только в водной фазе. Для клиницистов, которые зачастую не вникают в соотношения между плазмой и цельной кровью, следует приводить значения к концентрации глюкозы в плазме венозной крови.
Глюкоза представляет собой гидрофильное вещество, поэтому не может свободно проникать в клетку через фосфолипидную цитоплазматическую мембрану. Механизм ее транспорта осуществляется с помощью белков-переносчиков (транспортеров глюкозы). На мембранах клеток имеется два класса транспортеров глюкозы: 1) Na-глюкозный котранспортер, который экспрессируется специальными эпителиальными реснитчатыми клетками тонкой кишки и эпителием проксимальных канальцев нефрона; этот белок осуществляет активный транспорт глюкозы из просвета кишки или нефрона против градиента концентрации путем связывания глюкозы с теми ионами натрия, которые транспортируются ниже градиента концентрации; 2) собственные транспортеры глюкозы — мембранные белки, находящиеся на цитоплазматической мембране всех клеток и осуществляющие транспорт глюкозы ниже градиента концентрации; эти транспортеры глюкозы осуществляют перенос глюкозы не только в клетку, но и из клетки и также участвуют во внутриклеточном передвижении глюкозы; известно 6 транспортных белков для глюкозы — GluT

(GluT-1 — эритроцитарный тип; GluT-2 — печеночный тип; GluT-3 — мозговой тип; GluT-4 — мышечно-жировой тип; GluT-5 — кишечный тип; GluT-7 — локализуется в гепатоцитах). Инсулин и другие факторы (факторы роста, голодание) стимулируют увеличение содержания белковпереносчиков на поверхности цитоплазматических мембран в 5–10 раз. Инсулин практически не влияет на активность GluT-1 и GluT-3, которые осуществляют инсулинонезависимое поглощение глюкозы в ЦНС и других инсулинонезависимых тканях. Увеличение поглощения глюкозы в этих тканях происходит одновременно с повышением ее содержания в крови и межклеточной жидкости, т.е. глюкоза перемещается из межклеточной жидкости, где ее концентрация выше, внутрь клетки, где ее уровень значительно ниже, что обусловлено использованием ее в метаболических процессах. Глюкоза в качестве источника энергии нужна всем клеткам организма человека. Однако потребности клеток в глюкозе могут существенно отличаться. Например, потребности мышечных клеток (миоцитов) минимальны во время сна и велики при выполнении физической работы. Необходимость
вглюкозе не всегда совпадает по времени с приемом пищи. Поэтому в организме человека существуют механизмы, позволяющие запасать поступающую с пищей глюкозу впрок и в дальнейшем использовать по мере необходимости. Большинство клеток организма человека способно запасать глюкозу в ограниченных количествах, но три типа клеток служат основными депо глюкозы. К таким клеткам относятся: 1) печеночные; 2) мышечные; 3) клетки жировой ткани (адипоциты). Эти клетки способны захватывать глюкозу из крови и запасать ее впрок, когда потребность в ней мала, а содержание высоко (после еды). В случае если потребность в глюкозе возрастает, а содержание в крови падает (в перерывах между приемами пищи), они способны высвобождать ее из депо, обеспечивая возникшие в ней потребности организма. Клетки печени и миоциты запасают глюкозу в виде гликогена, который представляет собой высокомолекулярный полимер глюкозы. Если возможности депо недостаточны, глюкоза может быть получена из других источников, например белков или жиров (этот процесс называется глюконеогенез). Процесс синтеза гликогена называется гликогенезом. Обратный процесс превращения гликогена в глюкозу — гликогенолиз. Он стимулируется в ответ на снижение уровня глюкозы в крови. Клетки жировой ткани — адипоциты — также способны запасать глюкозу. В процессе липогенеза они превращают ее
вглицерин, который затем включается в состав триглицеридов (ТГ) (форма депонирования жира). Для обеспечения клеток энергией ТГ могут мобилизовываться из жировых клеток, но только после того как будут исчерпаны запасы гликогена. Поэтому в организме человека гликоген выполняет функцию кратковременного депонирования глюкозы, а жиры — долговременного. После приема пищи, когда уровни глюкозы и жирных кислот в крови высоки, печень синтезирует гликоген и триглицериды, мышечные клетки — гликоген, а адипоциты — ТГ.
Основные механизмы поддержания нормального уровня глюкозы в крови.
Втечение дня организм человека подвержен значительным колебаниям в поступлении и расходовании глюкозы. Тем не менее, ее уровень в крови обычно не поднимается выше 8,0 и не опускается ниже 3,5 ммоль/л. Это обусловлено функционированием нескольких регуляторных систем, обеспечивающих поддержание нормального уровня глюкозы в крови.
Наиболее важными регуляторами уровня глюкозы в крови являются ЦНС и гормоны поджелудочной железы. Центральные механизмы регуляции углеводного обмена находятся в гипоталамусе. В латеральном ядре гипоталамуса имеются глюкорецепторы, которые тормозятся при увеличении уровня глюкозы крови и активируются при ее снижении, приводя к возникновению чувства голода. Помимо потребления пищи в регуляции уровня глюкозы в крови важнейшую роль играют гормоны поджелудочной железы — инсулин и глюкагон. Эндокринная функция поджелудочной железы связана с панкреатическими островками (островками Лангерганса).
Инсулин — основной гормон инкреторного аппарата (т.е. секретирующего гормоны непосредственно в кровоток) поджелудочной железы, представляет собой полипептид, мономерная форма которого состоит из двух цепей: А (из 21 аминокислоты) и В (из 30 аминокислот). Он секретируется β-клетками поджелудочной железы в ответ на повышение концентрации глюкозы в крови. Инсулин обеспечивает снижение уровня глюкозы в крови при помощи следующих механизмов:
• проведения глюкозы из крови в клетки органов и инсулинозависимых тканей (поступление глюкозы в клетки ЦНС и печени не зависит от инсулина, они инсулинонезависимые ткани);
• стимуляции внутриклеточного метаболизма глюкозы до молочной кислоты (гликолиз);
2

•активации образования гликогена из глюкозы в печени и мышцах (гликогенез);
•усиления в жировой ткани транспорта глюкозы (повышает скорость синтеза жирных кислот, угнетает липолиз и способствует увеличению запасов жира);
•ингибирования образования глюкозы из аминокислот (глюконеогенез). Инсулин сравнительно быстро (за 5–10 мин) разрушается в печени (80%) и в почках (20%) под действием фермента глютатионинсулинтрансгидрогеназы.
Глюкагон — полипетид, состоящий из 29 аминокислотных остатков. Он продуцируется α- клетками островков Лангерганса и имеет, так же как инсулин, короткий период полураспада (несколько минут). В противоположность эффекту инсулина действие глюкагона заключается в повышении уровня глюкозы в крови. Он усиливает выход глюкозы из печени тремя путями:
ингибирует синтез гликогена, стимулирует гликогенолиз (образование глюкозы из гликогена) и
глюконеогенез (образование глюкозы из аминокислот).
Адреналин, норадреналин, кортизол и соматотропный гормон (СТГ) также способны повышать уровень глюкозы в крови, т.е. обладают контринсулярной активностью. Адреналин и норадреналин синтезируются мозговым веществом надпочечников и являются гормонами стресса. В печени, адипоцитах, скелетных мышцах они оказывают прямое влияние на мобилизацию глюкозы из депо (из гликогена), способствуя повышению уровня глюкозы в крови для использования в качестве источника энергии при стрессовых ситуациях (стресс → адреналин → гликоген → глюкоза). Одновременно они подавляют секрецию инсулина, т.е. создают почву для того, чтобы глюкоза продолжала поступать к месту ее утилизации, пока действуют стрессовые импульсы.
Глюкокортикоиды (гормоны коры надпочечников, основной их представитель — кортизол) угнетают захват глюкозы многими тканями. В мышцах глюкокортикоиды стимулируют окисление жирных кислот, в печени для получения энергии направляют глицерин и аминокислоты на синтез глюкозы (глюконеогенез), которая превращается в гликоген и депонируется, таким образом, подготавливаются легкодоступные запасы глюкозы. В случае возникновения стрессовой ситуации и поступления большого количества адреналина в кровь эти запасы легко используются.
Соматотропный гормон (гормон роста) угнетает захват и окисление глюкозы в жировой ткани, мышцах и печени и тем самым способствует повышению уровня глюкозы в крови. Помимо этого он способствует синтезу гликогена в печени из других источников (глюконеогенез).
Таким образом, четыре гормона (глюкагон, адреналин, кортизол, СТГ) способствуют повышению уровня глюкозы, не позволяя ему опускаться слишком низко, и только один инсулин предотвращает избыточное увеличение концентрации глюкозы в крови. Это обстоятельство отражает важность постоянного поддержания минимального уровня глюкозы в крови для нормального функционирования головного мозга. Вместе с тем это обстоятельство определяет и то, что
нормальный гормональный ответ на повышение уровня глюкозы в крови зависит от двух факторов: 1) секреции адекватного ситуации количества инсулина, т.е. от нормального функционирования β-клеток поджелудочной железы; 2) количества и функциональной активности (чувствительности) инсулиновых рецепторов на поверхности инсулиночувствительных клеток. Если секреция инсулина будет неадекватна (недостаточна) или функциональная активность инсулиновых рецепторов снизится, концентрация глюкозы в крови будет повышена, что может перейти в заболевание — СД. В свою очередь избыточная секреция инсулина (например, при опухоли β-
клеток поджелудочной железы — инсулиноме) приведет к развитию тяжелой гипогликемии —
состоянию, угрожающему жизни пациента.
|
Гормоны, контролирующие гомеостаз глюкозы |
Гормон |
Механизм действия |
Инсулин |
увеличивает: потребление глюкозы клетками, синтез гликогена, синтез |
|
белков, синтез жирных к-т и триглицеридов; |
|
снижает: глюконеогенез, гликогенолиз, кетогенез, липолиз, катаболизм |
|
белка |
Глюкагон |
увеличивает: гликогенолиз, глюконеогенез, кетогенез, липолиз |
Адреналин |
увеличивает: гликогенолиз, липолиз |
Гормон роста |
увеличивает: гликогенолиз, липолиз |
Кортизол |
увеличивает: глюконеогенез, синтез гликогена, протеолиз |
|
3 |

снижает: потребление глюкозы клетками
Причины патологических изменений уровня глюкозы в крови
При многих патлогических состояниях содержание глюкозы в крови повышается
(гипергликемия) или снижается (гипогликемия). К гипергликемии могут приводить недостаток инсулина или избыток адреналина, кортизола, СТГ или глюкагона. Наиболее часто гипергликемия развивается у больных СД (недостаток инсулина). Однако повышенный уровень глюкозы в крови необязательно свидетельствует о наличии СД. Кроме СД гипергликемия наблюдается при следующих состояниях и заболеваниях: эпидемическом энцефалите, повышении гормональной активности щитовидной железы, коры и мозгового слоя надпочечников, гипофиза; травмах и опухолях мозга, эпилепсии, отравлении окисью углерода, сильном эмоциональном и психическом возбуждении. Гипергликемия может быть следствием некоторых видов лекарственной терапии. Использование в лечении пациента глюкокортикоидов (кортизол), некоторых диуретиков, а также внутривенное введение глюкозосодержащих растворов сопровождается временной гипергликемией. Гипогликемия наиболее часто встречается у больных СД при передозировке инсулина. Гипогликемия у лиц, не болеющих СД, является следствием опухоли β-клеток поджелудочной железы — инсулиномы, которая бесконтрольно синтезирует инсулин в повышенном количестве. Гипогликемию может вызвать дефицит одного из трех гормонов (кортизол, СТГ, катехоламины), повышающих концентрацию глюкозы в крови. Например, недостаточность коры надпочечников, сопровождающаяся дефицитом кортизола, нередко приводит к развитию эпизодов гипогликемии. Иногда гипогликемические состояния наблюдаются у лиц с заболеваниями ЦНС: при распространенных сосудистых нарушениях, остром менингитах, энцефалите, эпидемическом паротите, первичной или метастатической опухоли мягкой мозговой оболочки.
Метаболический синдром Критерии метаболического синдрома. Согласно рекомендациям экспертов Всероссийского
научного общества кардиологов к критериям диагностики относятся основной признак и дополнительные критерии. Основной признак: центральный (абдоминальный) тип ожирения – окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин. Дополнительные критерии:
•артериальная гипертония (артериальное давление (АД) ≥ 140/90 мм Hg);
•повышение уровня триглицеридов (≥1,7 ммоль/л);
•снижение уровня холестерина липопротеинов высокой плотности (ЛПВП) (3,0 ммоль/л);
•гипергликемия натощак (глюкоза в плазме крови натощак ≥ 6,1 ммоль/л);
•нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 часа после нагрузки глюкозой в пределах ≥7,8 и ˂11, 1 ммоль/л.
Наличие у пациента центрального ожирения и двух дополнительных критериев является
основанием для диагностирования у него МС. Метаболический синдром включает нарушение толерантности к глюкозе или сахарный диабет 2 типа, абдоминальное ожирение,
дислипопротеинемию, ишемическую болезнь сердца (ИБС), артериальную гипертензию, гиперурикемию. Указанные патологические процессы являются факторами риска развития атеросклероза, который при сочетании нескольких из них многократно возрастает. Метаболический синдром постепенно и длительное время протекает без явной клинической симптоматики. Зачастую уже развитие осложнений заставляет больных обратиться за медицинской помощью. Важно
диагностировать метаболический синдром на ранних этапах его развития, поскольку уже тогда он представляет угрозу развития в скором времени СД 2 типа и атеросклеротических процессов.
Критерии лабораторной диагностики метаболического синдрома.
Инсулинорезистентность – необходимый критерий диагноза метаболического синдрома. Инсулинорезистентность устанавливается на основании выявление одного из следующих признаков: СД 2 типа, повышение уровня глюкозы крови натощак, нарушение толерантности к углеводам. Пероральный глюкозотолерантный тест (ПГТТ) – самый простой способ определения нарушения чувствительности тканей к инсулину. В ПГТТ проводят определение инсулина и С-пептида натощак и через 2 ч после дачи 75 г глюкозы. Даже при нормальном ответе со стороны глюкозы в ПГТТ
4
существенное увеличение инсулина и С-пептида свидетельствует о наличии инсулинорезистентности. Исследование уровня С-пептида в крови может служить более точным подтверждением гиперсекреции инсулина поджелудочной железой, так как известны некоторые методические ограничения при лабораторном определении иммунореактивного инсулина в крови, который на 50% связывается в печени и имеет время полужизни в крови около 4 минут. С-пептид, отщепляющийся от молекулы проинсулина при ее превращении в инсулин, не связывается клеточными рецепторами на периферии, имеет время полужизни около 30 минут, результат не зависит от наличия гемолиза крови и достаточно точно отражает истинную секрецию инсулина поджелудочной железой.
Сахарный диабет Сахарный диабет — заболевание, которое характеризуется гипергликемией, возникающей
вследствие абсолютной или относительной инсулиновой недостаточности. В результате недостаточности инсулина глюкоза накапливается в крови, так как не может проникать в клетки (за исключением клеток печени и головного мозга). Выделяют два основных типа СД.
СД 1-го типа (инсулинозависимый) встречается у 10–15% всех больных диабетом. Гипергликемия при СД 1-го типа развивается вследствие инсулиновой недостаточности, обусловленной аутоиммунной деструкцией (антителами к собственным клеткам) инсулинопродуцирующих β-клеток поджелудочной железы. СД 2-го типа встречается значительно чаще — в 85–90% случаев. Гипергликемия при данном типе обусловлена не недостаточной продукцией инсулина (у большинства больных концентрация инсулина в крови даже повышена), а неэффективностью его действия на клетки органов и тканей. Этот феномен называется инсулиновой резистентностью. Рост заболеваемости СД 2-го типа наблюдается после 50-летнего возраста, в то время как пик СД 1-го типа отмечается в возрасте 3–5 и 11–14 лет.
Основные различия между СД 1-го и 2-го типа
Сахарный диабет 1-го типа |
Сахарный диабет 2-го типа |
Возникает в детстве |
Возникает у взрослых людей |
Для большинства пациентов характерно острое |
Характерно постепенное развитие заболевания |
начало заболевания |
|
Пациенты имеют худощавый внешний вид |
Заболеванию часто сопутствует ожирение |
Уровень инсулина и с-пептида в крови снижен |
Уровень инсулина и с-пептида в крови в норме |
или не определяется |
или повышен |
На его долю приходится 10–15% больных СД |
На его долю приходится 85–90% больных |
В возникновении генетические факторы имеют |
Генетическая предрасположенность очень часто |
меньшее значение, чем при СД 2-го типа |
носит семейный характер |
Кетоацидоз (накопление в организме продуктов |
Кетоацидоз развивается крайне редко |
метаболизма жирных кислот и их токсическое |
|
действие на организм) может быть первым |
|
проявлением болезни и часто сопровождает |
|
течение заболевания |
|
Больные абсолютно зависимы от инъекций |
Нет абсолютной зависимости от инсулина; в |
инсулина |
большинстве случаев лечение включает диету и |
|
пероральные сахароснижающие препараты |
Начало болезни острое |
Начало болезни постепенное |
Высокая гипергликемия |
Умеренная гипергликемия |
Антитела к клеткам островков выявляются у 80– |
Антитела к клеткам островков отсутствуют |
90 % в первые недели заболевания |
|
Помимо СД 1-го и 2-го типа выделяют и другие специфические типы диабета. СД у таких больных является следствием определенного первичного заболевания (генетического или приобретенного), и такую форму называют вторичным СД.
Основными причинами вторичного СД являются следующие заболевания:
• генетические дефекты β-клеток или действия инсулина;
5
•акромегалия (гигантизм), обусловленная опухолью гипофиза, которая продуцирует избыточное количество СТГ (гормона роста); СТГ нарушает захват глюкозы жировой и мышечной тканями путем подавления действия инсулина и способствует развитию гипергликемии;
•феохромоцитома (как правило, это опухоль мозгового вещества надпочечников) секретирует избыточное количество катехоламинов (адреналин, норадреналин); действие катехоламинов направлено на мобилизацию глюкозы из депо и подавление эффектов инсулина, что приводит к развитию гипергликемии;
•синдром Иценко–Кушинга (гиперплазия коркового слоя надпочечников) сопровождается повышенной секрецией кортизола, который в свою очередь угнетает захват глюкозы многими тканями и способствует развитию гипергликемии;
•хронический панкреатит или операция на поджелудочной железе вызывают повреждение ткани железы (в том числе и β-клеток), приводят к снижению секреции инсулина и развитию гипергликемии;
•токсическое воздействие на поджелудочную железу лекарственных средств или химикатов. Нормально протекающая беременность сопровождается многочисленными гормональными сдвигами, предрасполагающими к гипергликемии и соответственно к развитию СД.
От 1 до 14% беременных женщин страдают преходящим (транзиторным) СД. Диагноз СД, установленный во время беременности, называют гестационным диабетом. У большинства женщин с гестационным СД в конце беременности, когда уровень гормонов возвращается к исходным значениям, проявления болезни исчезают. Тем не менее, примерно у 30–50% женщин с гестационным СД в анамнезе в дальнейшем развивается СД 2-го типа.
Диагностика сахарного диабета
Задачей лабораторного исследования при подозрении на СД служит определение или подтверждение наличия у пациента абсолютной или относительной недостаточности инсулина. Основные биохимические признаки недостаточности инсулина: гипергликемия натощак или выходящее за пределы нормы повышение уровня глюкозы после еды, глюкозурия и кетонурия. При наличии клинических симптомов СД лабораторные исследования необходимы, прежде всего, для подтверждения клинического диагноза. Комитет экспертов ВОЗ рекомендует проводить скрининговое обследование на наличие СД у: • всех пациентов старше 45 лет (при отрицательном результате обследование повторяют каждые 3 года); • пациентов более молодого возраста при наличии ожирения; наследственной отягощенности по СД; этнической/расовой принадлежности к группе высокого риска; пациенток с гестационным диабетом в анамнезе; при рождении ребенка весом более 4,5 кг; артериальной гипертензии; выявленном ранее нарушении толерантности к глюкозе или высокой гликемии натощак. Для скрининга СД определяют уровень глюкозы в крови натощак и концентрацию гликозилированного гемоглобина. Исследование глюкозы в крови Исследование концентрации глюкозы в крови является самым распространенным методом диагностики СД. Глюкоза равномерно распределяется между плазмой и форменными элементами крови с некоторым превышением ее концентрации в плазме. Содержание глюкозы в артериальной крови выше, чем в венозной, что объясняется непрерывным использованием глюкозы клетками тканей и органов. Этим же объясняется и преимущество исследования глюкозы в плазме или сыворотке венозной крови перед ее определением в капиллярной крови для диагностики СД. Венозная кровь дополнительно отражает такой важный момент, как использование глюкозы клетками тканей и органов. Поэтому для диагностики СД предпочтительно определение глюкозы в венозной крови.
Референтные величины концентрации глюкозы в крови
Возраст |
Концентрация глюкозы в плазме крови |
|
|
ммоль/л |
мг/дл |
Новорожденные |
2,8–4,4 |
50–115 |
Дети |
3,9–5,8 |
70–105 |
Взрослые |
3,9–6,1 |
70–110 |
Клинико-диагностические лаборатории должны использовать для определения концентрации глюкозы в крови методы, имеющие аналитическую вариацию не более 3,3% (от 0,23 до 7,0 ммоль/л),
6
а общую неточность ниже 7,9% (т.е. аналитическая погрешность используемого для измерения глюкозы фотометра или анализатора не должна превышать 4,6%). Данным требованиям отвечают
три метода определения глюкозы:
1)глюкозоксидазный метод базируется на объединении ферментативного окисления глюкозы глюкозооксидазой с образованием перекиси водорода, которая впоследствии окисляется пероксидазой с образованием окрашенного продукта; интенсивность окраски регистрируют фотометрически;
2)глюкозогексокиназный метод: глюкоза сначала фосфорилируется АТФ в реакции, катализируемой гексокиназой; образовавшийся глюкозо-6-фосфат затем окисляется глюкозо-6- фосфатдегидрогеназой до 6-фосфоглюконата в присутствии никотинамид-аденин-динуклеотид- фосфата (НАДФ); в процессе этого окисления эквимолярное количество НАДФ восстанавливается до НАДФ-Н; при фотометрировании увеличение спектрального поглощения при 340 нм прямо пропорционально концентрации глюкозы в пробе крови;
3)глюкозодегидрогеназный метод — основан на способности глюкозодегидрогеназы катализировать окисление глюкозы до глюконовой кислоты; количество образовавшегося в ходе реакции НАДФ-Н прямо пропорционально концентрации глюкозы в пробе крови, что регистрируют фотометрически при длине волны 340 нм.
Врач должен знать, что все существующие в настоящее время портативные глюкометры, использующие диагностические тестполоски, не могут обеспечить точность измерения концентрации глюкозы с достаточной аналитической надежностью. Поэтому для диагностики СД у лиц с повышенным риском развития заболевания концентрацию глюкозы в крови необходимо исследовать в лицензированной КДЛ. Портативные глюкометры с тест-полосками могут применяться для установления факта гипергликемии, тяжелой гипогликемии, а также для мониторинга содержания глюкозы в крови у пациентов с установленным диагнозом СД. Глюкометры рекомендуется использовать всем пациентам, получающим инсулин. Пациенты с СД 1- го типа должны измерять концентрацию глюкозы крови по крайней мере 3 раза в день.
Глюкозотолерантный тест Наиболее информативным методом диагностики СД считается динамика изменения уровня
глюкозы в крови пациентов в ответ на сахарную нагрузку — глюкозотолерантный тест (ГТТ; тест на переносимость глюкозы).
ГТТ необходимо проводить больным, если содержание глюкозы в плазме крови натощак составляет у них от 6,1 до 7,0 ммоль/л, а также, если имеются факторы риска в отношении развития СД (СД у близких родственников, рождение крупного плода, нарушение толерантности (переносимости) к глюкозе в анамнезе, ожирение, гипертоническая болезнь).
В течение трех дней до проведения теста больной должен получать диету, содержащую не менее 125 г углеводов (этому требованию отвечают все столы больничного питания). Проба проводится утром после 10–14 ч голодания. Исходную пробу крови берут натощак, затем больной принимает 75 г глюкозы, растворенной в 200 мл воды, а ребенок – из расчета 1,75 г глюкозы на 1 кг веса, но не более 75 г. Повторно кровь берут через 120 мин и исследуют пробы на содержание глюкозы.
Типы кривых содержания глюкозы в крови при проведении ГТТ
7
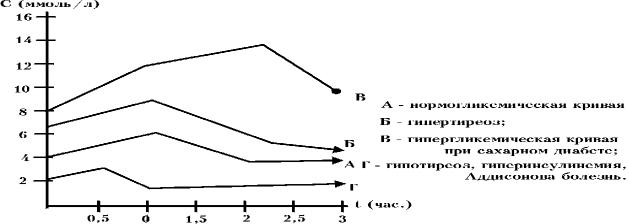
Исследование мочи на глюкозурию
Уздоровых людей глюкоза, попадающая в первичную мочу, почти полностью реабсорбируется в почечных канальцах, и в моче общепринятыми методами не определяется. При превышении величины почечного порога (8,88–9,99 ммоль/л) глюкоза начинает поступать в мочу и возникает глюкозурия.
Глюкоза может обнаруживаться в моче в двух случаях: при значительном увеличении гликемии и при снижении почечного порога для глюкозы — почечном диабете. Очень редко эпизоды умеренной глюкозурии могут наблюдаться у здоровых людей после значительной алиментарной нагрузки продуктами с высоким содержанием углеводов.
Вне зависимости от типа СД без лечения у больных сохраняется гипергликемия. При этом если уровень глюкозы в крови превышает почечный порог, глюкоза начинает выводиться с мочой. В лаборатории обычно определяют процентное содержание глюкозы в моче, что само по себе недостаточно информативно, поскольку величина диуреза и соответственно истинная потеря глюкозы с мочой могут широко варьировать. Поэтому необходимо, чтобы лаборатория выдавала результат с расчетом суточной глюкозурии (в граммах глюкозы). Для этого в лабораторию необходимо направлять всю суточную мочу.
Убольных СД исследование глюкозурии проводят для оценки эффективности назначенной терапии и в качестве дополнительного критерия компенсации СД. Уменьшение суточной
глюкозурии свидетельствует об эффективности лечебных мероприятий.
Критерием компенсации СД 2-го типа (инсулинонезависимого) считается достижение аглюкозурии, т.е. отсутствие глюкозы в моче.
При СД 1-го типа (инсулинозависимом) допускается потеря с мочой 20–30 г глюкозы в сутки.
Убольных СД глюкозурия приводит к развитию некоторых характерных для заболевания клинических симптомов. Благодаря выраженному осмотическому эффекту глюкозы вода начинает поступать вслед за ней в мочу, что приводит к увеличению объема мочи. Это проявляется полиурией
ивозникновением дегидратации (обезвоживания), в результате которых происходит стимуляция центра жажды в гипоталамусе. В итоге пациент ощущает жажду, потребление им воды увеличивается и порочный круг возобновляется. Выраженная гипергликемия у больных СД
сопровождается пятью классическими симптомами:
1) глюкозурией (выведение глюкозы с мочой);
2) полиурией (увеличение количества мочи);
3)никтурией (опорожнение мочевого пузыря ночью);
4)полидипсией (увеличение объема потребляемой жидкости);
5)дегидратацией (обезвоживание организма).
Определение глюкозы в моче для диагностики СД обычно не используют. Тем более что с возрастом почечный порог для глюкозы увеличивается, и у пожилых людей может составлять выше 16,6 ммоль/л, прежде чем появится глюкозурия. В связи с этим у пожилых людей исследование мочи на глюкозу для диагностики СД неэффективно. Однако СД 2-го типа, а также вторичный СД имеют
8
длительный бессимптомный период. В связи с этим СД нередко диагностируют по обнаружению глюкозы в моче при профилактических осмотрах.
Критерии диагностики сахарного диабета
Диагноз СД может быть установлен при наличии одного из приведенных ниже критериев:
•HbA1c ˃ 6,5%;
•клинические симптомы СД (полиурия, полидипсия и необъяснимая потеря массы тела) и случайно выявленное повышение концентрации глюкозы в плазме крови ≥ 11,1 ммоль/л (≥ 200 мг%);
•уровень глюкозы в плазме крови натощак (состояние натощак — это отсутствие приема любой пищи в течение не менее 8 ч) – ≥ 7,1 ммоль/л (≥ 126 мг%);
•через 2 ч после пероральной нагрузки глюкозой (75 г глюкозы) — ≥ 11,1 ммоль/л (≥ 200
мг%).
Для эпидемиологических или скрининговых целей достаточно одного значения уровня глюкозы натощак или 2-часового уровня глюкозы в ходе перорального теста толерантности к глюкозе. Для клинических целей диагноз СД всегда должен быть подтвержден повторным тестированием на следующий день, за исключением случаев несомненной гипергликемии с острой метаболической декомпенсацией или очевидными симптомами. Диагностическое значение имеют следующие уровни глюкозы плазмы венозной крови натощак (ВОЗ рекомендует для постановки диагноза использовать только результаты исследования венозной плазмы):
•нормальное содержание глюкозы плазмы крови натощак составляет до 6,1 ммоль/л (< 110
мг%);
•содержание глюкозы в плазме крови натощак от 6,1 ммоль/л (≥ 110 мг%) до 7,0 (< 128 мг%) определяется как нарушенная гликемия натощак;
•уровень гликемии в плазме крови натощак > 7,0 (> 128 мг%) расценивается как предварительный диагноз СД, который должен быть подтвержден приведенными выше критериями.
При проведении ГТТ важны следующие показатели:
•нормальная толерантность к глюкозе характеризуется содержанием глюкозы в плазме крови через 2 ч после нагрузки глюкозой < 7,8 ммоль/л (< 140 мг%);
•повышение концентрации глюкозы в плазме крови через 2 ч после нагрузки глюкозой — ≥ 7,8 ммоль/л (≥ 140 мг%), но ниже 11,1 ммоль/л (< 200 мг%) свидетельствует о нарушенной толерантности к глюкозе;
•содержание глюкозы в плазме крови через 2 ч после пероральной нагрузки глюкозой > 11,1 ммоль/л (> 200 мг%) свидетельствует о предварительном диагнозе СД, который должен быть подтвержден критериями, приведенными выше.
Для получения достоверных результатов анализа плазма во взятой пробе крови должна быть отделена от форменных элементов в течение 60 мин. Если такой возможности нет, то кровь необходимо забирать в моноветт или вакутейнер с ингибитором гликолиза (натрия фторид).
Диагностические критерии СД и других категорий гипергликемии
Категория |
Концентрация глюкозы, ммоль/л |
|
|
|||||
|
цельная кровь |
плазма |
|
|
||||
|
венозная |
капиллярная |
венозная |
капиллярная |
||||
Сахарный диабет: натощак и/или через 120 |
> |
6,1 |
> |
> 6,1 > 11,1 |
> |
7,0 |
> |
> 7,0 > 12,2 |
мин после приема глюкозы |
10,0 |
|
|
11,1 |
|
|
||
Нарушение толерантности к глюкозе: натощак |
< 6,1 > 6,7 |
< 6,1 > 7,8 и |
< 7,0 > 7,8 |
< 7,0 > 8,9 и |
||||
и через 120 мин после приема глюкозы |
и < 10,0 |
< 11,1 |
и < 11,1 |
< 12,2 |
||||
Нарушенная гликемия натощак: натощак |
> |
5,6 |
и < |
> 5,6 и < 6,1 |
> |
6,1 |
и < |
6,1 и < 7,0 < |
через 120 мин после приема глюкозы |
6,1 < 6,7 |
< 7,8 |
7,0 < 7,8 |
8,9 |
||||
9
Для оценки результатов глюкозотолерантного теста вычисляют два коэффициента – гипер- и гипогликемический. Гипергликемический коэффициент – отношение содержания глюкозы через 30 или 60 мин (берут) наибольшую величину) к ее уровню натощак. В норме этот коэффициент не должен быть выше 1,7.
Гипогликемический коэффициент – отношение содержания глюкозы через 2 ч к ее уровню натощак. В норме этот коэффициент не должен быть менее 1,3.
Осложнения сахарного диабета и их лабораторный мониторинг
Наиболее распространенные осложнения СД — сосудистые поражения, получившие название диабетических ангиопатий. Это понятие включает в себя поражение крупных артерий (макроангиопатии) и мелких сосудов: капилляров, венул, артериол (микроангиопатии). Диабетические ангиопатии являются основной причиной инвалидизации больных диабетом и в большинстве случаев определяют прогноз. Различают следующие виды диабетических
ангиопатий:
•ИБС;
•нарушения мозгового кровообращения;
•облитерирующий атеросклероз артерий нижних конечностей и облитерирующие сосудистые поражения других локализаций;
•диабетическая нефропатия;
•диабетическая ретинопатия.
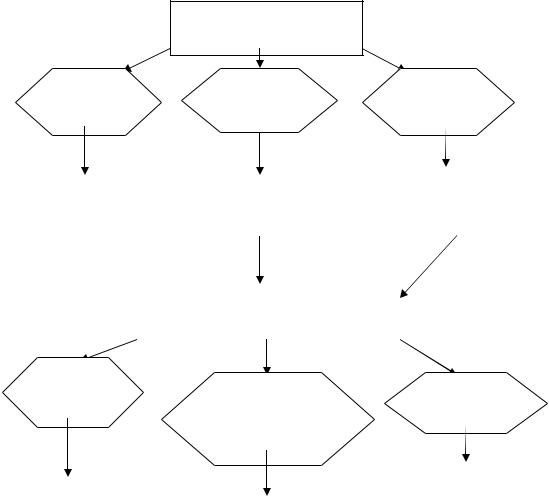
Алгоритм диагностики СД (венозная кровь)
Определение глюкозы в плазме
|
Глюкоза ˂ |
|
|
|
|
Глюкоза 6,1- |
Глюкоза ˃7,0 |
|||||
|
6,1 ммоль/л? |
|
|
|
|
7,0 ммоль/л? |
|
|
ммоль/л |
|||
|
Да |
|
|
|
|
Да |
|
|
Да |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Диабет маловероятен |
|
|
|
Нарушенная гликемия на |
|
|
Возможен |
||||
|
, дальнейшие меропр |
|
|
|
тощак или нарушение тол |
|
|
сахарный диабет |
||||
|
иятия не нужны |
|
|
|
ерантности к глюкозе |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Да |
|
|
Да |
||
|
|
|
Проведение перорального ГТТ с |
|
|
|||||||
|
|
|
75 г глюкозы и контролем |
|
|
|||||||
|
|
|
гликемии через 2 ч |
|
|
|
|
|||||
|
Да |
|
|
|
|
|
|
|
|
|
Да |
|
|
|
|
|
|
|
|
Да |
|
|
|
|
|
|
Глюкоза˂7, |
|
|
|
|
|
|
|
|
Глюкоза ˃11, |
||
|
8 ммоль/л? |
|
|
|
|
Глюкоза ˃7,8 |
|
|
||||
|
|
|
|
|
|
|
ммоль/л, но ˂ |
|
|
1 ммоль/л? |
||
|
Да |
11,1 ? |
|
|
|
Да |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Да |
|
|
Сахарный |
|
|
|
Дальнейшие |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
диабет |
|
||
|
мероприятия не |
|
|
|
|
Наблюдение |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
нужны |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
10 |
|
|
|
|
|
||||
