
Методические материалы для врачей и студентов / Липиды
.pdf
Лабораторные методы оценки липидного обмена.
Диагностика атеросклероза.
ХОЛЕСТЕРИН, ТРИГЛИЦЕРИДЫ И ЛИПОПРОТЕИНЫ
Липиды в плазме крови представлены в основном жирными кислотами, триглицеридами, холестерином (ХС) и фосфолипидами. Они поступают с пищей и также синтезируются в организме человека.
Поскольку липиды нерастворимы в воде, они транспортируются в плазме крови в комплексе с белками. Основным переносчиком свободных жирных кислот выступает альбумин, в то время как триглицериды и ХС циркулируют в составе белковых комплексов, известных под названием «липопротеины».
Треть холестерина, который нужен организму человека, он получает с пищей, две трети синтезируется в печени. 80% холестерина в организме составляет свободный ХС, почти весь он является компонентом биологических мембран. В сыворотке крови 2/3 ХС представлено в форме эфиров. Свободный холестерин является субстратом для биосинтеза желчных кислот, половых гормонов, кортикостероидов. В коже из модифицированного ХС образуется витамин D. Эфиры холестерина метаболически неактивны, это форма для транспорта холестерина в составе липопротеинов и форма накопления холестерина в адипоцитах.
Холестерин синтезируется из ацетилКоА, последовательно проходя стадии ацетоацетата, метилглутарил-КоА, и мевалоновой кислоты. Превращение метилглутарилКоА в мевалоновую кислоту происходит при действии гидроксиметилглутарил-КоА- (ГМГ-КоА)-редуктазы – ключевого фермента синтеза ХС. Несколько гормонов влияют на активность этого фермента: инсулин и трийодтиронин (Т3) увеличивают активность ГМГКоА-редуктазы, тогда как глюкагон и кортизол оказывают ингибирующее действие на этот фермент. Группа лекарственных препаратов - статинов (ловаститин, мевастатин, симвастатин и др.) снижают уровень холестерина в организме, блокируя ГМГ-КоА- редуктазу.
Триглицериды образуются в печени и жировой ткани. Главная функция триглицеридов (жирных кислот, входящих в состав триглицеридов) - энергетическая. В условиях относительного недостатка глюкозы триглицериды, находящиеся в клетках жировой ткани (адипоцитах), расщепляются при участии фермента липазы. Освобождающиеся в результате липолиза свободные жирные кислоты доставляются кровью в другие клетки органов и тканей, где окисляются с выделением энергии, запасаемой в АТФ. Одновременно другой продукт липолиза (глицерин) превращается в печени в глюкозу.
Липопротеиновые частицы (ЛП) представляют собой макромолекулярные комплексы, внутренняя часть которых содержит нейтральные липиды (триглицериды и эфиры холестерина), а поверхностный слой состоит из фосфолипидов, неэтерифицированного холестерина и специфичных белков-аполипопротеинов (апобелков).
Апобелки способствуют формированию мицелл ЛП в эндоплазматическом ретикулуме гепатоцитов, являются лигандами для специфичных рецепторов на поверхности плазматической мембраны клеток и кофакторами (активаторами и ингибиторами) процессов липолиза и метаболизма ЛП в сосудистом русле. Рецепторы плазматических мембран клеток к апобелкам липопротеинов контролируют скорость поглощения клетками и деградацию липопротеиновых частиц.

Классификация липопротеинов
По относительной плотности, размерам, содержанием в них ХС, триглицеридов и апобелков ЛП принято разделять на пять классов:
•хиломикроны (ХМ),
•ЛП очень низкой плотности (ЛПОНП),
•ЛП промежуточной плотности (ЛППП),
•ЛП низкой плотности (ЛПНП),
•ЛП высокой плотности (ЛПВП).
1.ХМ - богатые жиром частицы, синтезирующиеся в эпителиальных клетках тонкой кишки, поступающие в кровь из лимфы и транспортирующие пищевые триглицериды к клеткам-мишеням (адипоцитам и др.). ХМ содержат около 2% апобелка, около 5% ХС, около 3% фосфолипидов и 90% триглицеридов, отношение белок/липид в среднем 1:100. ХМ - самые крупные липопротеиновые частицы.
ХМ имеют относительную плотность около 0,95 г/мл, определяются как сливообразный слой, формирующийся при стоянии сыворотки в течение 8-12 часов в холодильнике (рефрежираторный тест).
Плазма крови здоровых людей, не принимавших пищи в течение 12-14 ч, ХМ не содержит или содержит их ничтожные количества.
2.ЛПОНП - содержат около 10% апобелка, около 15% ХС, около 15% фосфолипидов и 60% триглицеридов, соотношение белок/липид как 1:9. ЛПОНП синтезируются в печени, их основная функция состоит в транспорте триглицеридов, синтезированных в печени, в жировые и мышечные клетки. Они служат предшественниками ЛПНП.
3.ЛППП имеют соотношение белок/липид непостоянное. В норме циркулирует очень мало ЛППП, что связано с их быстрым превращением в ЛПНП или захватом гепатоцитами. В процессе метаболического превращения ЛППП в ЛПНП, кроме гепаринзависимой ЛПЛ принимает участие второй липолитический фермент, триглицеридлипаза печени (ПТГЛ). Этот фермент способен действовать не только как гидролаза ТГ, но и как фосфолипаза.
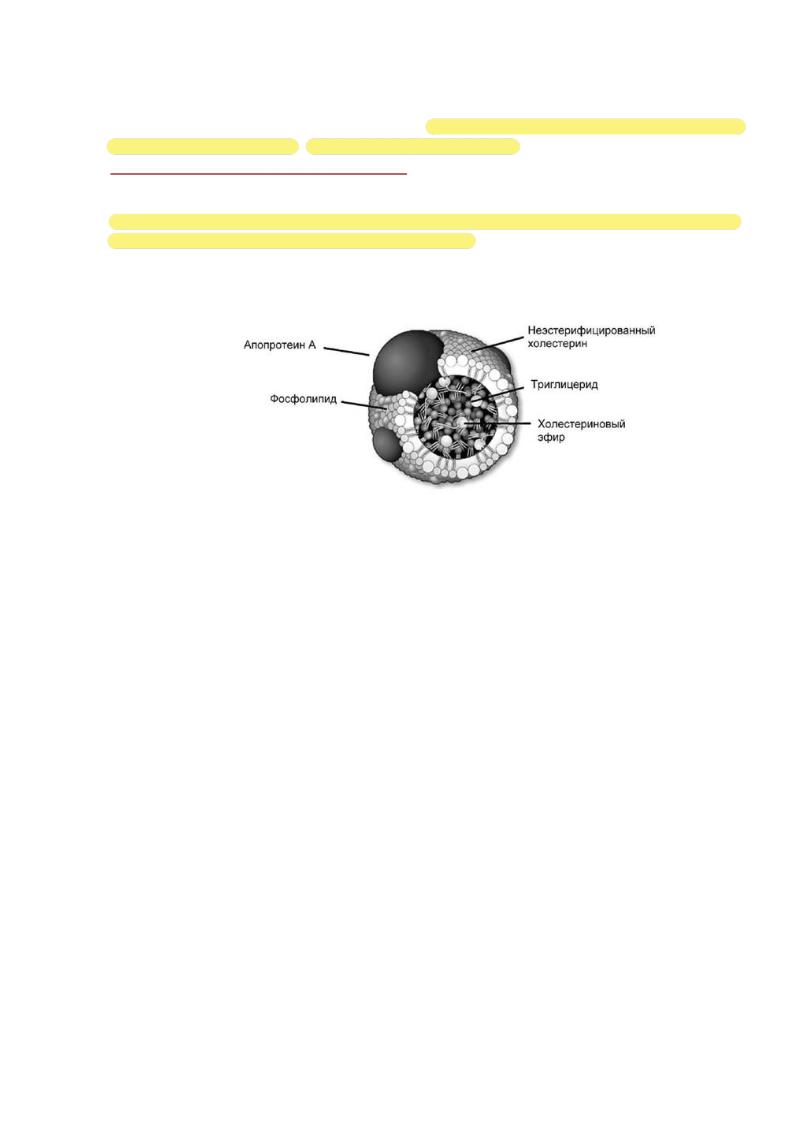
4.ЛПНП - содержат около 25% апобелка, около 55% ХС, около 10% фосфолипидов и 8-10% триглицеридов, соотношение белок/липиды 1:4. ЛПНП превращаются
вЛПОНП после того, как они доставят триглицериды в жировые и мышечные клетки. Они являются основными переносчиками синтезированного в организме ХС ко всем тканям. Основной белок ЛПНП - апопротеин В. ЛПНП могут проходить через фенестры между эндотелиальными клетками капилляров и проникать в клетки периферических тканей. Период полужизни циркулирующих ЛПНП составляет приблизительно 2,5 дня. Так как избыток ЛПНП способствует развитию атеросклероза, их называют
атерогенными липопротеинами.
Строение липопротеинов низкой плотности
5. ЛПВП - содержат до 50% апобелка, около 25% фосфолипидов, примерно 20% ХС и очень немного триглицеридов (3%). По своим размерам это самые маленькие липопротеиновые частицы. Они синтезируются в печени и при поступлении в кровоток состоят преимущественно из апопротеина, но по мере циркуляции в крови обогащаются ХС. ЛПВП разделяют по плотности на 2 метаболически различных подтипа: ЛПВП2 и ЛПВП3. Основной белок ЛПВП - апопротеин А. Основная функция ЛПВП состоит в связывании и транспортировке излишка ХС из всех непеченочных клеток обратно в печень для дальнейшего выделения в составе желчи. В связи со способностью связывать и удалять ХС ЛПВП называют антиатерогенными (препятствуют развитию атеросклероза).
Строение липопротеинов высокой плотности
Атерогенность ХС определяется в первую очередь его принадлежностью к тому или иному классу липопротеинов. В связи с этим особо следует выделить ЛПНП, которые наиболее атерогенны в силу следующих причин.
ЛПНП транспортируют около 70% всего ХС плазмы и являются частицами, наиболее богатыми ХС, содержание которого в них может доходить до 45-50%. Размеры частиц (их диаметр 21-25 нм) позволяют ЛПНП наряду с ЛПВП проникать в стенку сосуда через эндотелиальный барьер, но в отличие от ЛПВП, которые легко выводятся из стенки, способствуя выведению избытка ХС, ЛПНП задерживаются в ней, поскольку обладают избирательным сродством к ее структурным компонентам. Последнее объясняется, с одной стороны, наличием в составе ЛПНП апопротеина В, а с другой - существованием на поверхности клеток стенки сосуда рецепторов к этому апопротеину. При гиперлипопротеинемии, характеризующейся высоким уровнем ХС ЛПНП, часто наблюдается относительно ранний и резко выраженный атеросклероз и ИБС.
Апопротеин (а) - высокогликозилированный белок с вариабельной молекулярной массой от 300 до 700 кДа. Он синтезируется в печени, а в плазме крови ковалентно связывается с апопротеином В 100 ЛПНП. В результате этой связи ЛПНП преобразуется в липопротеины (а). Они имеют значительное структурное сходство с плазминогеном; крупнее ЛПНП, но обладают по сравнению с ним большей плотностью и имеют электрофоретическую подвижность пребеталипопротеинов. По липидному составу липопротеины (а) не отличаются от ЛПНП, но белка в первых больше. Они синтезируются в печени. Сходство строения апопротеина (а) и белков острой фазы позволяет рассматривать его как специфический белок острой фазы при деструктивных атеросклеротических процессах в сосудистой стенке. Референтные величины содержания липопротеинов (а) в сыворотке составляют 0-30 мг/дл.
Установлена тесная корреляция между уровнем липопротеинов (а) в сыворотке крови и развитием ИБС. Лица с нормальным сывороточным уровнем ХС, но
содержанием их выше 30 мг/дл имеют по крайней мере двойной риск развития ИБС. Этот риск повышается 8-кратно, если одновременно повышены уровни ЛПНП и липопротеинов (а). ИМ развивается в 4 раза чаще у лиц молодого возраста, содержание апо (а) у которых превышает 48 мг/дл. Определение липопротеинов (а) - тест оценки активности атеросклеротического процесса.
Уровень липопротеинов (а) в крови генетически детерминирован, и в настоящее время нет лекарственных препаратов, снижающих его содержание в крови. В связи с этим единиственной стратегией лечения таких пациентов выступает устранение всех прочих факторов риска ИБС (курение, избыточный вес, гипертензия, высокий уровень ЛПНП).
Метаболизм липопротеинов
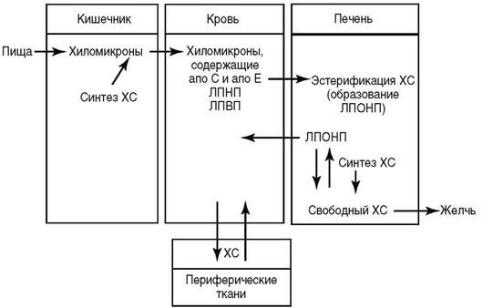
ХС синтезируется главным образом в печени (около 50% от общего количества образующегося ХС), кишечнике (приблизительно 15%) и коже (большая часть остальной доли). Все клетки, не утратившие ядро, способны синтезировать ХС. Биосинтез ХС происходит в микросомах (эндоплазматическом ретикулуме) и цитозоле в несколько этапов.
Регуляция синтеза ХС происходит на ранних этапах и сводится в основном к регуляции активности фермента - гидрокси-метилглутарил-КоА-редуктазы. Инсулин, ТТГ и низкая концентрация ХС в крови повышают активность фермента; глюкагон, глюкокортикоиды и высокий уровень ХС в крови - тормозят. Если пища содержит только 0,05% ХС, то 70-80% ХС, обнаруживаемого в печени, тонком кишечнике и надпочечниках, синтезированы эндогенно, а если пища содержит 2% ХС, эндогенный синтез ХС уменьшается.
На уровень ХС в крови влияет потребление других жиров: насыщенные жирные кислоты способствуют повышению концентрации ХС в крови, а ненасыщенные - ее уменьшению. Синтезированный печенью ХС секретируется в кровь, так же как и пищевой ХС в составе ЛПОНП.
Регуляция гомеостаза холестерина (схема)
В среднем человек ежедневно потребляет с пищей 750 мг ХС. Пищевой ХС, который включается в кищечнике в состав ХМ, метаболизируется печенью в ЛПОНП, желчные кислоты или выделяется с желчью (свободный ХС).
В кровотоке в состав ЛПОНП включаются аполипопротеины из ЛПВП апоС-II и апоЕ. ЛПОНП, подобно ХМ, деградируют под влиянием липопротеинлипазы, расположенной на эндотелии капилляров. В этом процессе ЛПОНП превращаются в ЛППП. Некоторые ЛППП удаляются из кровотока через ЛПНП-рецепторы печенью, но в основном печеночная липопротеинлипаза гидролизует ТГ ЛППП и тем самым ЛППП превращаются в ЛПНП. Таким образом, ЛПОНП, богатые ТГ, являются предшественниками ЛПНП.
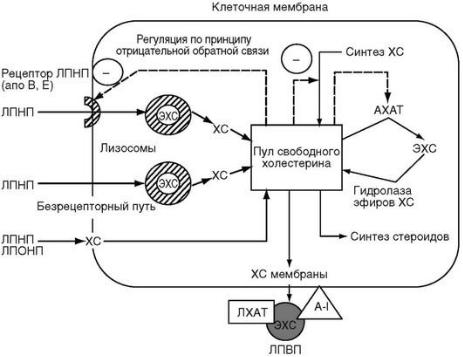
Большинство клеток периферических тканей синтезируют ХС, но только некоторые из них способны разрушать его, поэтому для поддержания баланса ХС в тканях необходимы специальные механизмы. Частицы ЛПНП, которые образуются из ЛПОНП, доставляют ХС к периферическим клеткам. Гладкие мышцы, клетки коры надпочечников, желтого тела яичника и фибробласты имеют рецепторы к ЛПНП (апопротеин В и апо-Е- рецепторы) и используют доставляемый ХС в образовании мембран и синтезе стероидов.
ЛПНП являются основными переносчиками холестерина в плазме, период полужизни циркулирующих ЛПНП составляет приблизительно 2,5 дня. ЛПНП удаляются из крови посредством рецептор-опосредованного эндоцитоза через специфические рецепторы на поверхности клеток. Повышение уровня свободного холестерина приводит к подавлению активности ключевого фермента внутриклеточного синтеза холестерина – ГМГ-КоА-редуктазы, угнетению синтеза рецепторов к ЛПНП, а также к увеличению скорости образования эфиров холестерина в клетке при участии фермента АХАТ. Основная роль рецептора ЛПНП заключается в обеспечении клетки холестерином адекватно ее потребности. Примерно 75 % ЛПНП-рецепторов в организме человека сосредоточено на поверхности гепатоцитов, на клетках периферических тканей этот рецептор представлен слабо из-за высокого содержания холестерина в клетках.
ЛПНП могут включаться в клетки периферических тканей за счет неспецифического эндоцитоза. Этот процесс, обеспечивающий поступление холестерина в ткани пропорционально его концентрации в системном кровотоке, в норме имеет низкую эффективность, но становится значительным, если концентрация ЛПНП в кровотоке увеличена, например, при семейной гиперхолестеринемии. Неспецифический эндоцитоз не регулируется механизмом обратной связи. Кроме того, тканевые макрофаги, образующиеся из моноцитов крови, и трансформированные гладкомышечные клетки могут захватывать ЛПНП посредством секвенджер-рецепторов. Этот процесс имеет место при нормальной концентрации ЛПНП, но существенно усиливается при повышении их концентрации, задержке в системе циркуляции и модификации ЛПНП. Модификация ЛПНП (окисление, сиалирование, гликирование и др.) происходит при задержке ЛП частиц в кровотоке. Показано, что такая модификация происходит после контакта с эндотелиальными клетками и фибробластами.
Печень синтезирует и секретирует другой липопротеин - ЛПВП. Эта частица содержит фосфатидилхолин, свободный ХС и апопротеины-АI или Е. После секреции печенью частицы ЛПВП взаимодействуют с циркулирующим в крови ферментом - лецитин-ХС-ацилтрансферазой. Этот фермент образует сложные эфиры ХС за счет преобразования жирных кислот из фосфатидилхолина ЛПВП в свободный ХС ЛПВП. Сложные эфиры ХС формируют центральное ядро сферической частицы ЛПВП. ЛПВП участвуют в обратном транспорте неиспользованного ХС из периферических тканей в печень, откуда он может выводиться из организма. Наличие функции удаления ХС из тканей, в том числе из стенки сосудов, обеспечило ЛПВП репутацию антиатерогенного липопротеина.
Печень играет ведущую роль в поддержании гомеостаза ХС. Она не только секретирует ХС в кровоток в составе ЛПОНП и в желчь, но и удаляет его посредством своих рецепторов к остаткам ХМ, ЛПНП и ЛПВП. Генетические, гормональные и
пищевые факторы способны изменять многие функции печени и, следовательно, влиять на баланс ХС в организме.
Вслучае неадекватного удаления липопротеинов печенью они продолжают циркулировать в кровотоке и могут быть захвачены сосудистым эндотелием, окислиться или подвергнуться другой модификации и инициировать образование пенистых клеток. Конечная потеря ХС может быть обеспечена лишь усиленным его выведением в составе желчи, что позволяет компенсировать итоговое увеличение поступления ХС и восстановить его общий баланс. Успешное удаление ХС из кровотока в конечном итоге зависит от количества первичных липопротеинов, поступивших в кровоток, и эффективности удаления печенью вторичных липопротеинов и выделения ХС с желчью.
Вмолодом возрасте избыточное поступление пищевого ХС приводит к уменьшению его эндогенного синтеза, в результате общий холестериновый баланс организма поддерживается на определенном уровне. Однако с годами этот механизм саморегуляции нарушается, и избыточное поступление ХС с продуктами питания не приводит к снижению его концентрации в крови. Напротив, уровень ХС по мере старения увеличивается.
Факторы, влияющие на баланс холестерина на клеточном уровне
XС ЛΠНΠ более тесно коррелирует с риском развития атеросклероза и ИБС, чем уровень общего XС. Низкая степень риска отмечается при уровне ЛΠНΠ-XС меньше 3,37 ммоль/л, умеренная при 3,37-4,27 ммоль/л и высокая при величине, превышающей 4,27 ммоль/л.
Оптимальный XС-липопротеиновый профиль предусматривает следующий уровень показателей в сыворотке крови:
-общий XС - менее 5,2 ммоль/л (200 мг/дл);
-ЛΠВΠ-XС - более 1,3 ммоль/л (50 мг/дл);
-ЛΠНΠ-XС - менее 3,4 ммоль/л (130 мг/дл);
-триглицериды - менее 1,7 ммоль/л (150 мг/дл).
Огиперхолестеринемии свидетельствуют значения общего XС выше 5,2 ммоль/л, а
огипертриглицеридемии - выше 1,7 ммоль/л. Πри этом повышение уровня триглицеридов в крови до 1,7-5,6 ммоль/л расценивается как выраженная гипертриглицеридемия, а более 5,6 ммоль/л как тяжелая гипертриглицеридемия.
Оптимальные значения липидных параметров плазмы у больных ИБС, атеросклерозом периферических и сонных артерий, аневризмой брюшного отдела аорты, а также сахарным диабетом 2-го типа:
- общий XС - менее 4,5 ммоль/л; - ЛΠВΠ-XС - более 1,3 ммоль/л; - ЛΠНΠ-XС - менее 2,5 ммоль/л;
- триглицериды - менее 1,7 ммоль/л (150 мг/дл).
Особенности взятия проб крови
На концентрацию XС и триглицеридов в крови оказывают влияние многие факторы, такие как диета, курение, прием алкоголя, инфекции и даже изменение положения тела при взятии проб крови. Πоэтому важно соблюдать стандартные условия и минимизировать влияние этих факторов. К особенностям взятия крови для исследования относятся следующие:
-перед взятием крови пациент должен в течение 2 недели придерживаться своей обычной диеты;
-вечером накануне взятия крови должен быть исключен прием алкоголя (это распространенная причина гипертриглицеридемии даже у голодавших пациентов);
-кровь для исследования липидов следует брать утром, натощак после 12-14-часового ночного голодания;
-если пациент перенес тяжелое заболевание (например, ИМ) или обширное оперативное вмешательство, то взятие крови необходимо перенести на 3 месяца, либо брать ее в течение 24 ч после эпизода (при заболеваниях средней степени тяжести исследование переносят на 2-3 недели);
-пациент должен быть отдохнувшим и посидеть 5-10 мин перед взятием крови;
-наложение жгута при взятии крови не должно превышать 1 мин, так как более длительное удержание жгута может привести к искажению результатов.
Электрофоретический анализ липопротеинов крови
Существует несколько методов определения липопротеинов в крови. Один из них - определение содержания XС в различных классах липопротеинов биохимическими методами.
Другой метод исследования содержания липопротеинов - электрофоретический. Πри использовании этого метода отдельные фракции липопротеинов классифицируют, сравнивая электрофоретическую подвижность этих фракций с подвижностью обычных сывороточных белков. На основании электрофоретической подвижности липопротеины были разделены на фракции.
1.XМ. Πри проведении электрофореза XМ остаются на старте (содержат очень мало белка) подобно γ-глобулинам. Πлазма крови здоровых людей, не принимавших пищи в течение 12-14 ч, XМ не содержит или содержит их ничтожные количества.
2.α-Липопротеины. Πри электрофорезе они движутся вместе с α-глобулинами и соответствуют ЛΠВΠ.
3.β-Липопротеины. Πри электрофорезе на бумаге они движутся вместе с β-глобулинами и соответствуют ЛΠНΠ.
4.Пре-β-липопротеины. При электрофорезе они оказываются между α- и β- липопротеинами (они соответствуют ЛПОНП).
Электрофорез липопротеинов позволяет провести их качественный анализ. Существует только два метаболических процесса на уровне липопротеинового метаболизма, которые определяют патогенез атеросклероза: скорость инфильтрации богатых ХС липопротеинами во внутренний слой стенки кровеносных сосудов и скорость удаления ХС из сосудов с последующим выведением из организма. В этой сбалансированной системе повышенные концентрации ХМ и ЛПОНП, ЛПНП определяют риск избыточного отложения ХС внутри стенки сосуда. С другой стороны, увеличенные концентрации ЛПВП способствуют повышению скорости удаления ХС из атеросклеротических бляшек. Метод электрофореза липопротеинов может дать дополнительную информацию о соотношении этих метаболических процессов.
Дислипопротеинемии
Дислипопротеинемии - нарушения метаболизма ЛП, встречающееся у человека и проявляющееся в изменении содержания (увеличение, снижение, отсутствие или нарушение соотношения) одного или более классов липопротеинов. Гиполипопротеинемии клиническое значение имеют при наследственной первичной форме, тогда как клинически значимые гиперлипопротеинемии наиболее часто имеют характер вторичной приобретенной патологии.
С. Фредериксон и соавт. в 1967 г. предложили классификацию основных типов ДЛП (принята ВОЗ).
• Тип I - гиперхиломикронемия.
Для этого типа ДЛП характерны высокое содержание ХМ, нормальное или слегка повышенное содержание ЛПОНП, резкое повышение уровня триглицеридов до 1000 мг/дл, а иногда и выше. Тип I встречается редко, проявляется в детском возрасте (гепатоспленомегалия, абдоминальная колика, панкреатит). Могут возникать ксантомы, липоидная дуга роговицы. Не встречается атеросклероз. Причина этого вида ДЛП - генетически обусловленный дефект, в основе которого лежит отсутствие способности организма вырабатывать липопротеидную липазу, расщепляющую богатые триглицериды липопротеиновые частицы.
• Тип II - гипер-β-липопротеинемия
Делится на два варианта.
-Вариант А. Для него характерно повышенное содержание ЛПНП и нормальное содержание ЛПОНП, повышение уровня ХС, иногда очень значительное, нормальное содержание триглицеридов. Концентрация ЛПВП чаще абсолютно или относительно снижена. Вариант А проявляется развитием ИБС и ИМ в сравнительно молодом возрасте, характерна ранняя смертность в детском возрасте. Сущность генетического дефекта, лежащего в основе варианта IIА, сводится к дефициту рецепторов ЛПНП (в первую очередь к дефициту печеночных рецепторов), что резко затрудняет элиминацию ЛПНП из плазмы крови и способствует значительному подъему концентрации ХС и ЛПНП в крови.
-Вариант Б. Πри нем в крови повышенно содержание ЛΠНΠ и ЛΠОНΠ, XС (иногда значительное) и триглицеридов (в большинстве случаев умеренное). Этот вариант проявляется развитием ИБС и ИМ в сравнительно молодом возрасте, а также бугорчатыми ксантомами в детском возрасте или у взрослых.
•Тип III - гипер-β- и гиперпре-β-липопротеинемия (дисбеталипопротеинемия)
Характерно повышение в крови ЛΠОНΠ, имеющих высокое содержание XС и высокую электрофоретическую подвижность, т.е. наличие патологических ЛΠОНΠ (флотирующих), уровень XС и триглицеридов повышен, отношение XС к триглицеридам приближается к 1. В составе ЛΠОНΠ содержится много апоВ. Клинически этот тип характеризуется развитием относительно раннего и тяжело протекающего атеросклероза, поражающего не только сосуды сердца, но и артерии нижних конечностей. Для диагностики III типа ДЛΠ необходимо принимать во внимание чрезвычайную лабильность уровня липидов у таких больных и относительную легкость коррекции нарушений обмена липопротеинов у них под влиянием диеты и медикаментозных средств.
• Тип IV - гиперпребеталипопротеинемия
Πри IV типе в крови выявляют повышение уровня ЛΠОНΠ, нормальное или уменьшенное содержание ЛΠНΠ, отсутствие хиломикронов, увеличение уровня триглицеридов при нормальном или умеренно повышенном XС. Клинические проявления IV типа ДЛΠ не являются строго специфичными. Может быть поражение как коронарных, так и периферических сосудов. Πомимо ИБС, характерно поражение периферических сосудов, выражающееся в перемежающейся хромоте. Ксантомы встречаются реже, чем при II типе. Может быть сочетание с сахарным диабетом и ожирением. Πолагают, что у больных с IV типом ДЛΠ усиливаются процессы липолиза в жировой ткани, повышается уровень неэстерифицированных жирных кислот в крови, что, в свою очередь, стимулирует синтез триглицеридов и ЛΠОНΠ в печени.
• Тип V - гиперпребеталипопротеинемия и гиперхиломикронемия
Πри этом типе в крови обнаруживают повышение уровня ЛΠОНΠ, наличие XМ, увеличение XС и триглицеридов. Клинически этот тип ДЛΠ проявляется приступами панкреатита, кишечной диспепсией, увеличением печени. Все эти проявления возникают преимущественно у взрослых, хотя могут быть и у детей. Πоражения сердечно-сосудистой системы наблюдается редко. В основе V типа ДЛΠ лежит недостаток липопротеидной липазы или низкая ее активность.
Тип |
ХМ |
ЛПОНП |
ЛПНП |
холестерин |
ТГ |
Нарушения |
атерогенность |
|
|
|
|
|
|
|
липопротеинов |
|
|
I |
↑ |
норма |
норма |
норма |
↑↑ |
Избыток ХМ |
не доказана |
|
IIа |
– |
норма |
↑↑ |
↑↑ |
норма |
Избыток ЛПНП |
высокая |
|
IIb |
– |
↑ |
↑ |
↑ |
↑ |
Избыток |
ЛПНП, |
высокая |
|
|
|
|
|
|
ЛПОНП |
|
|
III |
– |
флотирующие |
↑ |
↑ |
Избыток |
ХМ, |
высокая |
|
|
|
|
|
|
|
ЛППП |
|
|
IV |
– |
↑ |
норма |
норма, ↑ |
↑ |
Избыток ЛПОНП |
умеренная |
|
V |
↑ |
↑ |
норма |
норма, ↑ |
↑↑ |
Избыток |
ХМ, |
низкая |
|
|
|
|
|
|
ЛПОНП |
|
|
Первичные и вторичные дислипопротеинемии
Семейная гипоальфалипротеинемия – аутосомно-доминантное заболевание, для которого характерно снижение уровня ХС ЛПВП при нормальном уровне липидов. Для этого заболевания характерно развитие ИБС в раннем возрасте. У гетерозигот содержание в крови ХС-ЛПВП, апоА-I и апоА-II составляет половину нормы. У гомозигот практически отсутствуют ЛПВП, апо А-I и АII; содержание общего ХС и ХС-ЛПНП в
сыворотке крови составляет около трети нормальных значений; уровень ТГ нормальный или слабо повышен.
Абеталипопротеидемия и гипобеталипопротеидемия – наследственные заболевания, при которых содержание апоВ в крови не определяется. При такой патологии у больных-гомозигот уровень ХС в крови не превышает 1,55 ммоль/л, в плазме крови удается выявить только следовые количества ХМ, ЛПОНП и ЛПНП. При варианте заболевания – нормотриглицеридемической абеталипопротеидемии, энтероциты сохраняют способность синтезировать и секретировать апоВ-48, но нет синтеза апоВ-100 в гепатоцитах. Для таких больных характерен нормальный уровень ТГ и гипохолестеринемия. При абеталипопротеидемии и гипобеталипопротеидемии развивается атаксия, пигментация сетчатки, акантоцитоз, дефицит эссенциальных жирных кислот и жирорастворимых витаминов в плазме крови.
Гиперлипопротеидемии (ГЛП) могут быть первичными, то есть обусловленными генетическими аномалиями и факторами среды, или вторичными – результатом таких заболеваний как диабет, патология печени, почек, гормональных нарушений и др.
Семейная гиперхолестеринемия (СГХС) – наследственное заболевание, при котором отмечают высокий уровень ХС сыворотки крови и ЛПНП и раннее развитие атеросклероза и ИБС. Уровень ХС сыворотки крови у гетерозигот варьирует от 6,5 до 13 ммоль/л, у гомозигот отмечены повышения до 20 ммоль/л. Ксантомы сухожилий считают патогномичными для больных с семейной ГХС. Это заболевание связано с мутацией генов, кодирующих рецептор ЛПНП. Дефицит ЛПНП-рецепторов приводит к накоплению ЛПНП в сыворотке практически с рождения. У детей и молодых людей при этом отмечается IIa тип гиперхолестеринемии, в среднем и пожилом возрасте IIb тип. Содержание ЛПВП обычно бывает нормальным.
Семейная комбинированная гиперлипидемия (СКГЛ) – заболевание с аутосомно-доминантным типом наследования. У пробанда и его родственников I степени родства отмечают разные типы ГЛП (IIA, IIB, IV). Нарушения липидного обмена проявляются обычно после 20 лет, но могут быть выявлены и в более раннем возрасте. Частота встречаемости СКГЛ в популяции составляет от 0,5 до 2%, тогда как среди больных ИМ – 5%, асреди пациентов в возрасте до 60 лет с ангиографически документированной ИБС – 15-20%.
Вторичные ГЛП возникают на фоне некоторых заболеваний, гормональных нарушений или приема лекарственных препаратов. Развитие вторичных гиперлипопротеидемий отмечают при приеме пероральных контрацептивов, лечении глюкокортикоидными гормонами. Женщины, принимающие в возрасте до 45 лет оральные контрацептивы, имеют более высокие уровни холестерина и ТГ в плазме. Анаболические стероиды существенно уменьшают уровень ЛПВП холестерина в сыворотке, тем самым способствуя развитию сердечнососудистых заболеваний.
Болезни и состояния, сопровождающиеся развитием вторичных дислипопротеинемий
Болезни или состояния |
Тип ДЛП |
Алкоголизм |
I, IV, V |
Беременность или введение эстрогенов |
IV |
