
СИСТЕМА КРОВ² |
РОЗДІЛ VIII |
|
(ТЕГ) — крива, що графічно віддзеркалює динаміку зсідання крові. Тромбоеластограму реєструють спеціальним приладом тромбоеластографом. Принцип методу полягає в тому, що кюветка з венозною кров’ю і зануреним у неї циліндриком обертається. Доки кров рідка, циліндрик зали-
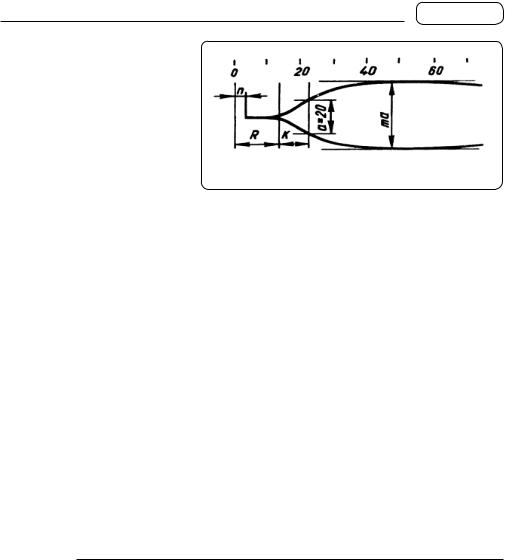
шається нерухомим. З моменту початку зсідання крові і підвищення її в’язкості рухатись починає і циліндрик. Його рух реєструється оптичною системою приладу у вигляді кривої. На тромбоеластограмі виділяють такі показники (мал. 165):
1)час реакції R — інтервал від початку запису до розходження ТЕГ на 1 мм — відповідає І і II фазам зсідання крові, тобто часу утворення тромбопластину і протромбіну і випаданню перших ниток фібрину. Норма — 8—12 хв;
2)час зсідання К — інтервал від моменту закінчення часу реакції до розходження плечей ТЕГ на амплітуду в 20 мм. Інтервал К відповідає III фазі зсідання крові з утворенням фібринового згустка належної еластичності і стійкості. Норма 5—8 хв;
3)максимальна амплітуда mа — найбільша відстань між плечами ТЕГ — характеризує максимальну еластичність згустка. Норма — 46—60 мм.
Основні види патологічних ТЕГ: 1) у разі тромбоцитопенії відзначають зниження і деяке подовження R+К; 2) у разі гемофілії, циркулюючих антикоагулянтів спостерігають різке подовження R+K при нормальній ma; 3) у разі фібринолізу виявляють подальше швидке сходження плечей ТЕГ.
ОСНОВН² КЛ²Н²ЧН² СИНДРОМИ
Синдром анемії
Анемія (anaemia) — патологічний стан, що характеризується зменшенням кількості еритроцитів і зниженням концентрації гемоглобіну або одного із цих показників в одиниці об’єму крові. Виникнення анемії значною мірою позначається на життєдіяльності організму. При анемії спостерігається кисневе голодування органів і тканин — гіпоксія, а також розвивається їх дистрофія. Так, у разі зниження вмісту гемоглобіну до 70 г/л спостерігаються початкові дистрофічні зміни міокарда, а в разі його зменшення до 50 г/л дистрофічні явища мають виражений характер. Якщо анемія виникає внаслідок гіпоксії, в організмі збільшується кількість недоокиснених продуктів обміну
461

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
речовин, спостерігається схильність до ацидозу, що ще більше погіршує трофіку тканин.
Необхідно пам’ятати, що гостра анемія перебігає тяжче, ніж хронічна. Це пов’язано з тим, що компенсаторні механізми, які завжди супроводжують будьяку анемію, не встигають спрацювати під час гострих крововтрат. До компенсаторних механізмів належать: 1) збільшення хвилинного об’єму серця внаслідок тахікардії і наростання швидкості течії крові; 2) перерозподіл крові за рахунок мобілізації її з депо (печінка, селезінка); 3) обмеження кровопостачання периферичних тканин за рахунок збільшення кровопостачання життєво важливих органів; 4) посилення утилізації кисню тканинами, процесів безкисневого (анаеробного) дихання; 5) нейрогуморальна стимуляція еритропоетичної функції кісткового мозку.
Патогенетична класифікація. Залежно від механізму розвитку розрізняють такі види анемії:
·унаслідок крововтрат (постгеморагічна);
·унаслідок порушення кровотворення: 1) залізодефіцитна, спричине-
на нестачею в організмі заліза, необхідного для еритропоезу; 2) В12 (фолієво)- дефіцитна, спричинена нестачею в організмі вітаміну В12 і фолієвої кислоти, потрібних для еритропоезу; 3) гіпо- і апластична, спричинена пригніченням діяльності кісткового мозку токсичними чинниками ендогенного і екзогенного походження; 4) метапластична, що виникає у разі заміщення еритропоетичного ростка кісткового мозку іншою тканиною (метастази пухлин, метаплазія мієломними клітинами тощо);
·спричинена надмірним руйнуванням еритроцитів (гемолітична): 1) спадкова (уроджена) — мікросфероцитна, овалоцитна, що характеризується патологією мембран еритроцитів; дефіцит активності піруваткінази й інших ферментів, що призводять до швидкого гемолізу еритроцитів і характеризуються патологією ферментних систем; гемоглобінопатії — серпоподібноклітинна таласемія, за наявності яких порушуються структура і синтез гемоглобіну; 2) набута, зокрема імунна гемолітична анемія, зумовлена імунними механізмами, які призводять до ушкодження і передчасного руйнування еритроцитів антитілами і лімфоцитами, а також зумовлена механічним ушкодженням еритроцитів (маршова гемоглобінурія тощо) та набуті мембранопатії еритроцитів.
Залежно від того, де переважно відбувається гемоліз еритроцитів, гемолітична анемія (спадкова й набута) поділяється на: 1) анемію з внутрішньоклітинним (позасудинним) гемолізом — у селезінці (проявляється гіпербілірубінемією
іспленомегалією), кістковому мозку і печінці (анемія, зумовлена вродженою морфологічною і функціональною неповноцінністю еритроцитів — мікросфероцитоз, овалоцитоз, аутоімунна анемія); 2) анемія з внутрішньосудинним гемолізом, що буває гострим (у разі різного токсичного впливу, переливання несумісної за групою крові, маршова тощо) і супроводжується наявністю в плазмі крові вільного гемоглобіну і гемоглобінурією; 3) хронічний гемоліз (при хворобі
462

СИСТЕМА КРОВ² |
РОЗДІЛ VIII |
|
Маркіафави—Мікелі), що крім наявності в плазмі крові вільного гемоглобіну, а також гемоглобінурії характеризується гемосидерозом внутрішніх органів.
Залежно від ступеня насиченості еритроцита гемоглобіном, тобто за колірним показником, анемія поділяється на нормохромну (0,85—1,05), гіперхромну (>1,05) і гіпохромну (<0,85). До гіпохромної належить анемія, зумовлена дефіцитом заліза в організмі (хронічна постгеморагічна, гастроентерогенна залізодефіцитна анемія, ранній хлороз тощо). Виникнення В12(фолієво)-дефіцитної анемії пов’язане з нестачею в організмі вітаміну В12. Ця анемія належить до гіперхромної анемії. Гіпо- й апластична анемія зазвичай має нормохромний характер.
Особливості клінічних проявів і перебігу анемічного синдрому залежно від його патогенетичного походження викладено в розділі основних нозологічних форм “симптоматика”.
Синдром лейкемоїдної реакції
Лейкемоїдні реакції — патологічні реакції крові, подібні до змін, що відбуваються при лейкозі, але відрізняються від них тим, що мають тимчасовий реактивний характер і ніколи не перетворюються на пухлину кровотворної тканини, яку вони нагадують. Лейкемоїдним реакціям не властивий закономірний для лейкозу прогресивний ріст злоякісних кровотворних клітин, що є субстратом пухлини.
Лейкемоїдні реакції класифікують залежно від морфологічного складу периферичної крові. Розрізняють лейкемоїдні реакції мієлоїдного типу, а також лімфоцитні, еозинофільні, моноцитні та ін.
Найчастіше лейкемоїдні реакції спостерігаються при запальних процесах інфекційної природи (фіброзно-кавернозний туберкульоз, остеомієліт, сепсис, крупозна пневмонія, інфекційний ендокардит, туляремія) та неінфекційних захворюваннях (діабетична кома, панкреонекроз, рідше — інфаркт міокарда, алергійні дерматити, системні захворювання сполучної тканини, злоякісні новоутворення).
Лейкемоїдні реакції мієлоїдного типу характеризуються лейкоцитозом від 10 до 50 Г/л крові і більше. Відзначається зсув лейкограми ліворуч іноді до промієлоцитів з наявністю всіх проміжних форм. Але на відміну від лейкозу лейкемоїдні реакції не супроводжуються появою в периферичній крові бластних елементів.
За інших типів лейкемоїдних реакцій у периферичній крові можуть домінувати ті чи ті формені елементи (лімфоцити, еозинофільні гранулоцити чи моноцити) на тлі вираженого лейкоцитозу.
У диференціальній діагностиці між лейкемоїдною реакцією та хронічним лейкозом вирішальне значення має дослідження стернального пунктату. На мал. 166 (кольорова вклейка) наведено картину нормального кісткового мозку. У разі лейкемоїдної реакції спостерігають картину «реактивного» кісткового мозку зі збільшенням кількості незрілих клітинних елементів до промієлоцитів.
463

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
Геморагічний синдром
Геморагічний синдром є основою геморагічного діатезу — групи захворювань, при яких спостерігається підвищена схильність до повторних кровотеч, що виникають як спонтанно, так і після незначних травм.
Етіологія і патогенез геморагічного синдрому дуже різноманітні й складні. Деякі види геморагічного діатезу є вродженими, а частина з них виникає внаслідок впливу на організм людини зовнішніх чинників або ж зумовлена аутоімунними процесами в організмі.
Геморагічний діатез спричинюють авітамінози (особливо С і Р), інфекційні захворювання (висипний тиф, сепсис, вірусна геморагічна гарячка тощо), алергійні захворювання, а також хвороби печінки, нирок. За патогенезом геморагічний діатез можна умовно поділити на три великі групи: 1) тромбоцитопенія і тромбоцитопатія — види геморагічного діатезу, виникнення яких зумовлене порушенням ланки тромбоцитного гемостазу за рахунок зменшення кількості тромбоцитів, як при гіперспленізмі чи хворобі Верльгофа, або функціональної неповноцінності їх; 2) коагулопатія — вид геморагічного діатезу, розвиток якого пов’язаний із порушенням плазмової ланки гемостазу через дефіцит чинників зсідання крові; прикладом дефіциту чинників VIII, IX, XI є гемофілія А, В, С; дефіцит чинника Х спричинює хворобу Стюарта—Прауера; 3) вазопатія — геморагічний діатез, що виникає внаслідок ушкодження судинної стінки; прикладом такої вазопатії може бути геморагічний васкуліт (хвороба Шенлейна—Геноха) і спадкова геморагічна телеангіектазія (хвороба Рандю—Ослера).
Синдром гіперспленізму
Гіперспленізм — часто вживаний термін для характеристики збільшення селезінки з одночасним зменшенням у крові вмісту клітин двох чи одного, а інколи й трьох ростків кровотворення. Гіперспленізм завжди є вторинним. Він ускладнює перебіг багатьох захворювань, зокрема хронічного гепатиту, тромбозу селезінкової вени, цирозу печінки, малярії, первинного ураження селезінки тощо. За наявності гіперспленізму відбувається підвищене руйнування селезінкою клітин крові, що призводить до лейкопенії, тромбоцитопенії і анемії. На відміну від гіпопластичної анемії при гіперспленізмі кількість клітин у кістковому мозку не зменшується. Після видалення селезінки при гіперспленізмі склад крові зазвичай нормалізується або суттєво поліпшується.
Синдром дисемінованого внутрішньосудинного зсідання крові (ДВЗ-синдром)
ДВЗ-синдром має ще й іншу назву — тромбогеморагічний синдром, що точніше характеризує цю небезпечну для життя патологію.
464

СИСТЕМА КРОВ² |
РОЗДІЛ VIII |
|
Причиною ДВЗ-синдрому можуть бути септичні стани, усі види шоку, травматичні хірургічні втручання (особливо спрямовані на видалення злоякісних пухлин, операції на паренхіматозних органах), термінальні стани, акушерська патологія, пухлини, колагенози, укуси змій, вживання медикаментів тощо.
Пусковим механізмом розвитку ДВЗ-синдрому є активація вищезгаданими чинниками всіх ланок системи зсідання крові, що на першому етапі призводить до розсіяного внутрішньосудинного зсідання крові з утворенням множинних мікротромбів і блокадою ними кровообігу в органах з виникненням глибоких дистрофічних і деструктивних змін. Окрім того, у зв’язку з масивним тромбоутворенням використовуються чинники зсідання, що призводить до виснаження їх запасів у організмі. Тому на другому етапі розвитку ДВЗ-синдрому починаються масивні кровотечі і крововиливи, зумовлені повним незсіданням крові.
Симптоматика ДВЗ-синдрому складається з ознак основного захворювання, що призвели до його розвитку, глибоких порушень усіх ланок гемостазу з дисемінованим тромбоутворенням і геморагічним синдромом, симптомів порушення мікроциркуляції в органах і системах з дисфункцією їх (гостра недостатність функцій надниркових залоз, інфаркт легень, гостра ниркова недостатність, гепаторенальний синдром тощо), метаболічних порушень.
Діагностика ДВЗ-синдрому досить складна і ґрунтується на результатах лабораторного дослідження, що виконується за допомогою специфічних тестів системи гемостазу.
Перебіг ДВЗ-синдрому може бути гострим, затяжним, рецидивним, хронічним, але прогноз не завжди сприятливий, оскільки лікування складне і не завжди буває успішним. Летальність при гострій формі ДВЗ-синдрому сягає 30— 50 % і більше. Останнім часом завдяки ранній діагностиці і ранньому лікуванню наслідки терапії стають більш сприятливими.
СИМПТОМАТИКА ОСНОВНИХ НОЗОЛОГ²ЧНИХ ФОРМ
Постгеморагічна анемія
Розрізняють гостру і хронічну постгеморагічну анемію.
Гостра постгеморагічна анемія (anaemia posthaemorrhagica acuta). Етіологія. Причиною гострої постгеморагічної анемії є раптові кровотечі, зумовлені ураженням і травмами судин, а також кровотечі травного тракту (виразкова хвороба шлунка і дванадцятипалої кишки, варикозне розширення вен стравоходу при цирозі печінки, пухлини шлунка і кишок), легеневі кровотечі (туберкульоз,
465

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
пухлина, бронхоектатична хвороба, абсцес легені), ниркові кровотечі (пухлина), гінекологічні кровотечі (менорагії, метрорагії) тощо.
Клінічнакартина. Від самого початку гострої кровотечі у хворих з’являються різка слабість, запаморочення, «мушки» перед очима, шум у вухах, часте серцебиття, нудота, а інколи й блювання. У разі масивних крововтрат, що супроводжують травми, хворий може бути в шоковому стані, а в разі масивних внутрішніх кровотеч швидко наростають явища колапсу. На стан хворого впливає не тільки кількість втраченої крові, а й швидкість крововтрати. Під час загального огляду привертає увагу блідість шкірних покривів. Шкіра вкрита холодним липким потом, температура її знижена. Дихання часте, поверхневе. Пульс частий, малого наповнення і напруження, інколи ниткоподібний. Артеріальний тиск знижений. Під час аускультації серця — тахікардія.
У перші години і навіть через 1—1,5 добу після гострої кровотечі показники гемоглобіну і еритроцитів можуть залишатися нормальними, що зумовлено рефлекторним викидом крові з депо у кров’яне русло. Через 2—3 доби внаслідок надходження у кров рідини з тканин (за рахунок гідремії) спостерігається рівномірне зниження концентрації гемоглобіну і зменшення кількості еритроцитів, тобто розвивається нормохромна анемія. Через 4—5 діб після кровотечі у периферичній крові з’являються ознаки нормальної регенерації кісткового мозку — кількість ретикулоцитів може збільшуватися до 4—10 %, інколи можуть траплятися навіть поодинокі нормобласти. Разом із показниками регенерації червоної крові спостерігається лейкоцитоз до 10,0—15,0 Г/л із зсувом формули крові вліво до паличкоядерних і навіть юних нейтрофільних гранулоцитів. У період кровотечі кількість тромбоцитів може зменшуватися (тромбоцитопенія), однак через 2—3 доби після зупинення кровотечі — нормалізується.
Лікування. Насамперед потрібно зупинити кровотечу (у разі зовнішньої кровотечі накласти джгут і провести тампонаду). Якщо кровотеча з внутрішніх органів не зупиняється, вдаються до хірургічного втручання. Одночасно вживають заходів, спрямованих на припинення шоку і колапсу (переливають кров і кровозамінники, призначають серцеві й судинні препарати).
Показаннями до початку трансфузійної терапії є тривала кровотеча, значне зниження артеріального тиску (нижче ніж 90 мм рт. ст.), збільшення частоти пульсу на 20 за 1 хв і більше. Призначають поліглюкін до 2 л на добу. Для поліпшення мікроциркуляції вводять реополіглюкін, альбумін. У тяжких випадках рекомендується переливання цільної крові або еритроцитної маси.
Залізодефіцитна анемія (anaemia sideropriva). Дуже поширене захворювання, при якому знижується вміст заліза в сироватці крові, кістковому мозку і кров’яному депо. Унаслідок цього порушується утворення гемоглобіну, а отже й еритроцитів.
Етіологія. Найчастіше причиною залізодефіцитної анемії є хронічні крововтрати, що призводять до вичерпання в організмі запасів заліза. За добу з їжею в організм надходить 12—18 мг заліза, з яких усмоктується 1—1,3 мг. Якщо
466

СИСТЕМА КРОВ² |
РОЗДІЛ VIII |
|
потреби організму в залізі підвищуються, з їжі може всмоктуватися максимум 2—2,5 мг. Отже, дефіцит заліза настає тоді, коли організм втрачає його понад 2 мг за добу, тобто стільки, скільки його міститься в 4—5 мл крові. Тому незначна, але постійна щоденна втрата цієї і навіть меншої кількості крові неминуче призводить до зменшення запасів заліза в організмі і виникнення залізодефіцитної анемії. Хронічними крововтратами можуть супроводжуватися різні захворювання внутрішніх органів (виразкова хвороба шлунка і дванадцятипалої кишки, рак і поліпоз шлунка і кишок, геморой, пухлини нирок, кавернозний туберкульоз легень, маткові кровотечі). Причиною залізодефіцитної анемії може бути хвороба Рандю—Ослера (спадкова геморагічна телеангіектазія; мал. 167, кольорова вклейка).
Дефіцит заліза в організмі може бути зумовлений недостатнім усмоктуванням заліза внаслідок резекції шлунка (агастральна анемія), резекції значної частини тонкої кишки, особливо її проксимального відділу, захворювань кишок, які перебігають із синдромом недостатності всмоктування, тощо. Певне значення в патогенезі залізодефіцитної анемії має секреторна недостатність шлунка (ахлоргідридна гастрогенна анемія). Однак, як показали результати досліджень, хлоридна кислота шлункового соку хоча до певної міри і запобігає окисненню двовалентного заліза у тривалентне, але не відіграє вирішальної ролі в активації його всмоктування.
Клінічна картина. З одного боку, прояв залізодефіцитної анемії складається із симптомів основного захворювання, що, наприклад, призводить до хронічної крововтрати, а з іншого — характеризується симптомами, виникнення яких пояснюється недостатнім транспортом кисню до тканин (унаслідок анемії) і порушенням унаслідок цього процесів клітинного дихання. Організм тривалий час використовує свої компенсаторні можливості, і тому хворі досить непоганно переносять навіть значну анемізацію. Проте з часом у них розвиваються швидка втомлюваність, слабість, запаморочення, часте серцебиття, легкі парестезії у вигляді повзання мурашок по шкірі.
Під час загального огляду виявляють блідість шкірних покривів і слизових оболонок. Шкіра суха, волосся легко ламається, рано сивіє і випадає. Нігті втрачають свій блиск, мають поперечні складки, ложкоподібні викривлення (койлоніхія), легко ламаються. З’являються тріщини в кутах рота.
З боку органів дихання змін не виявляють, хоча інколи при вираженій анемії може бути задишка. Межі серця залишаються в нормі. Під час аускультації вислуховують гучні тони, на верхівці серця — функціональний систолічний шум. Пульс зазвичай частий. Артеріальний тиск може знижуватися тільки в разі швидкого розвитку анемії. З боку травного тракту з’являються зміни, характерні для основного захворювання.
Зміни картини крові розвиваються за типом прогресивної гіпохромної анемії зі зниженням колірного показника інколи до 0,4. Це залежить від кількості заліза в сироватці крові. У нормі вміст заліза в сироватці крові становить
467

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
12,5—25,06 мкмоль/л. При залізодефіцитній анемії вміст заліза в сироватці може знизитися до 1,8—5,4 мкмоль/л. Кількість еритроцитів може бути нормальною або зниженою до 1,5—2,0 Т/л.
Під час мікроскопічного дослідження (мал. 168, кольорова вклейка) виявляють гіпохромію еритроцитів, їх анізоцитоз (неоднакова величина еритроцитів зі схильністю до мікроцитозу). Буває й пойкілоцитоз (різної форми еритроцити). З боку білої крові є тенденція до лейкопенії з помірним лімфоцитозом і нейтропенією. У більшості випадків кількість тромбоцитів залишається в межах норми. Необхідно відзначити, що при залізодефіцитній анемії кількість ретикулоцитів залишається в межах норми (не більше ніж 2 %). Збільшення кількості ретикулоцитів спостерігається тоді, коли хворий вживає препарати заліза.
Характерною особливістю залізодефіцитної анемії є зниження в кістковому мозку кількості сидеробластів — еритрокаріоцитів, що містять гранули заліза. У нормі 20—40 % еритрокаріоцитів кісткового мозку містять поодинокі гранули заліза. Дослідження сидеробластів кісткового мозку проводять у тяжких для діагностики випадках.
Лікування. Потрібно пам’ятати, що лікар завжди повинен намагатися виявити причину залізодефіцитної анемії перед початком лікування.
Сучасні принципи лікування залізодефіцитної анемії полягають у такому: 1) до складу харчового раціону хворих мають входити продукти, багаті на сполуки заліза (печінка, яловичина, шпинат, яблука); 2) залізодефіцитну анемію необхідно лікувати в основному препаратами заліза для внутрішнього вживання (гемостимулін, ферокаль, ферамід, фероплекс, тардоферон, конферон тощо); 3) препарати заліза призначають парентерально тільки за спеціальними показаннями (порушення всмоктування заліза при ентериті, у разі масивних резекцій тонкої кишки, гастректомії, загострень виразкової хвороби шлунка і дванадцятипалої кишки); 4) хворим на залізодефіцитну анемію гемотрансфузії проводять лише за життєвими показаннями.
В12(фолієво)-дефіцитна анемія. Цей вид анемії розвивається внаслідок дефіциту вітаміну В12 і фолієвої кислоти незалежно від причин цього дефіциту. Уперше хворобу описав Аддісон у 1849 р. У 1872 р. Бірмер вивчив її докладніше і назвав перніціозною, тобто злоякісною, анемією, оскільки прогноз хвороби в ті роки був безнадійним. На честь цих учених тривалий час у літературі вживався термін «анемія Аддісона—Бірмера».
Етіологія і патогенез. У 1929 р. Касл висловив припущення, що для нормального дозрівання еритроцитів необхідна особлива гемопоетична речовина — гемопоетин, який утворюється внаслідок об’єднання «зовнішнього чинника», що надходить з їжею, із «внутрішнім», який є в нормальному шлунковому соку.
Припущення Касла про патогенез анемії Аддісона—Бірмера знайшло повне експериментальне й клінічне підтвердження, а зовнішній і внутрішній чинники та їх роль в організмі добре вивчені. Такими чинниками виявилися відкриті Смітом у 1948 р. вітамін В12 (ціанокобаламін), який є в печінці, нирках, м’ясі, яйцях, і
468

СИСТЕМА КРОВ² |
РОЗДІЛ VIII |
|
гастромукопротеїн, який виділяється додатковими клітинами залоз дна шлунка. У здорових осіб вітамін В12 з’єднується з гастромукопротеїном, унаслідок чого утворюється стійкий до руйнування мікрофлорою кишок комплекс, який усмоктується в клубовій кишці. При анемії Аддісона—Бірмера у хворих відзначається виражений атрофічний гастрит, який зумовлює зникнення з шлункового соку гастромукопротеїну, а без нього вітамін В12, що надходить з їжею, руйнується кишковою мікрофлорою і не засвоюється організмом.
Не менш важливу роль у патогенезі анемії Аддісона—Бірмера відіграє фолієва кислота, яка, як і вітамін В12, належить до вітамінів групи В. Її багато міститься в печінці, нирках, м’ясі, шпинаті, дріжджах, бобах. Фолієва кислота всмоктується у верхньому відділі тонкої кишки. В організмі фолієва кислота депонується переважно в печінці, і перебуває там у неактивному стані. Власне вітамін В12 сприяє утворенню похідних фолієвої кислоти — фолатів, які, ймовірно, і є чинниками, безпосередньо необхідними для нормального кровотворення в кістковому мозку.
У разі дефіциту вітаміну В12 і фолатів порушується еритропоез: замість еритробластів у кістковому мозку виявляються великі клітини ембріонального кровотворення — мегалобласти, які не здатні дозрівати до нормального еритроцита. Більшість їх руйнується в кістковому мозку ще на ранніх стадіях. Лише незначна кількість мегалобластів проходить диференціацію до без’ядерних клітин (мегалоцитів) і надходить у кров’яне русло. Мегалоцити відрізняються від еритроцитів своєю морфологічною і функціональною неповноцінністю. Вони не мають такої високої здатності до перенесення кисню, як еритроцити, і швидко руйнуються. Таким чином, основним наслідком дефіциту вітаміну В12 і фолієвої кислоти в організмі є заміна нормального, еритробластного, типу кровотворення на ембріональний, мегалобластний, що і є морфологічним субстратом В12(фолієво)- дефіцитної анемії.
До дефіциту вітаміну В12 і фолієвої кислоти призводять порушення функції всмоктування (атрофія слизової оболонки шлунка, унаслідок якої відсутня секреція хлоридної кислоти, пепсину і внутрішнього чинника — гастромукопротеїну; гастректомія; резекція частини тонкої кишки; целіакія; хронічний алкоголізм) і підвищення витрат їх в організмі (вагітність, інвазії плоскими глистами).
Клінічна картина. Незалежно від причини дефіциту вітаміну В12 усю клінічну картину В12(фолієво)-дефіцитної анемії можна звести до своєрідної тріади: ураження кровотворної тканини, травної і нервової систем. На В12(фолієво)- дефіцитну анемію хворіють переважно особи похилого віку, частіше жінки. Хвороба починається непомітно. Поступово у хворих з’являються швидка стомлюваність, слабість, часте серцебиття, запаморочення і задишка під час незначного фізичного навантаження.
Хворі частіше бувають огрядними, з одутлим блідо-жовтяничним обличчям. Інколи підвищується температура тіла до субфебрильної. У 25 % хворих із
469

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
дефіцитом вітаміну В12 спостерігаються об’єктивні і суб’єктивні ознаки ураження язика, який стає яскраво-червоним, гладеньким, ніби полірованим, полакованим (гантерівський глосит). На язиці з’являються афти, атрофія сосочків, ділянки почервоніння. Хворі відчувають печіння язика.
Характерною є стерналгія — біль під час постукування по грудині.
Одним із характерних симптомів В12(фолієво)-дефіцитної анемії є ураження нервової системи, переважно бічних стовпів спинного мозку, яке має назву фунікулярного мієлозу. Найбільш ранніми симптомами його розвитку є парестезії
іпорушення чутливості з постійними незначними больовими відчуттями, що нагадують поколювання голкою, відчуття холоду, «ватяних ніг», повзання мурашок, оніміння кінцівок. У тяжких випадках виникають парези і паралічі нижніх кінцівок. Спостерігаються також ознаки розладу ЦНС, порушення сну, емоційна лабільність, втрачаються нюх, слух, порушується смак.
Убільшості хворих із дефіцитом вітаміну В12 різко знижена секреція шлунка, інколи аж до повної ахілії. Під час Х-променевого дослідження шлунка нерідко виявляють порушення евакуаторної функції, сплощені і згладжені складки. Під час фіброгастроскопії виявляють атрофію слизової оболонки шлунка. Треба
мати на увазі, що анемія, у тому числі і В12(фолієво)-дефіцитна, може бути одним із симптомів раку шлунка. У хворих на анемію Аддісона—Бірмера рак шлунка розвивається майже у 8 разів частіше порівняно зі здоровими особами. Тому хворим із цими захворюваннями необхідно періодично проводити Х-променеве
ігастроскопічне дослідження.
Розвиток захворювання відзначається характерними змінами з боку крові. Різко зменшується кількість еритроцитів (до 1,0 Г/л і менше) і знижується рівень гемоглобіну (50—40 г/л). Унаслідок того, що в крові є макроцити, мегалоцити і мегалобласти, що містять більшу кількість гемоглобіну, ніж у нормі, колірний показник завжди перевищує одиницю, тобто анемія за своїм характером є гіперхромною. Дуже характерною особливістю хвороби Аддісона—Бір- мера є наявність у крові ядерних червоних кров’яних тілець — мегалобластів і дегенеративних форм еритроцитів: пойкілоцитів, шизоцитів, еритроцитів із базофільною зернистістю і залишками ядра у вигляді тілець Жоллі та кілець Кебота. Може відзначатися й анізоцитоз: поряд із мікроцитами переважно бувають представлені макроцити і мегалоцити, тобто великі, багаті на гемоглобін еритроцити (мал. 169, кольорова вклейка).
Характерними є зміни з боку білої крові у вигляді лейкопенії з відносним лімфоцитозом. У крові зменшена кількість нейтрофілів, серед яких переважають клітини великих розмірів з гіперсегментованими ядрами. Може спостерігатися зменшення кількості тромбоцитів, що призводить до геморагій. Кількість ретикулоцитів у період загострення хвороби зменшена.
У пунктаті кісткового мозку (мал. 170, кольорова вклейка) кількість клітин червоного ряду різко збільшена. Переважають мегалобласти — великі клітини з великим ядром і відносно невеликою цитоплазмою. Мегалобласти беруть участь
470
