
ДИХАЛЬНА СИСТЕМА |
РОЗДІЛ IV |
|
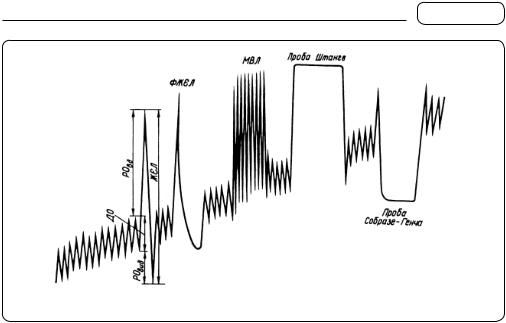
Мал. 36. Спірограма
Імовірніші результати отримують під час проведення спірографії. За допомогою спірографа визначають ДО, хвилинний об’єм дихання (ХОД), максимальну вентиляцію легень (МВЛ), експіраторну форсовану життєву ємність легень (ЕФЖЄЛ) та інспіраторну форсовану життєву ємність легень (ІФЖЄЛ).
Спірограму (СпГ) виконують в умовах основного обміну — уранці натще, у стані повного спокою, після 40—60 хв відпочинку (мал. 36).
Показники легеневого об’єму:
1.ДО — об’єм вдихуваного і видихуваного повітря під час спокійного дихання (у середньому становить 500 мл з коливаннями від 300 до 900 мл).
2.РО — об’єм повітря, що його людина ще може максимально видихнути після звичайного видиху (1500—2000 мл), і додатковий об’єм (ДодО) — об’єм повітря, що його людина може максимально додатково вдихнути після звичайного вдиху (1500—2000 мл).
3.ЖЄЛ — сума ДО, РО і ДодО (3000 — 5000 мл, у середньому — 3700 мл), тобто це той об’єм повітря, що його людина може видихнути під час глибокого видиху після максимального вдиху.
4.ХОД — об’єм повітря, що його людина вдихає і видихає впродовж 1 хв. Щоб його визначити, потрібно ДО помножити на частоту дихання (4000—8000 мл, у середньому — 5000 мл).
Легеневу вентиляцію визначають за частотою дихання і ХОД.
Здорова людина в стані спокою здійснює 14—16 дихальних рухів за 1 хв. Прискорення, сповільнення і порушення ритму дихання впливають на вентиляцію легень.
5.МВЛ — це кількість повітря, яку можуть провентилювати легені впродовж 15 с під час максимально глибокого дихання при частоті близько 50 за 1 хв.
111

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
6.ЕФЖЄЛ (за Вотчалом—Тіффно) визначають, як і ЖЄЛ, тільки в цьому разі необхідною умовою є максимально швидкий форсований видих. У здорових осіб ЕФЖЄЛ на 100—300 мл (8—11 %) менша, ніж ЖЄЛ (за рахунок збільшення опору руху повітря в дрібних бронхах). У разі звуження просвіту бронхів (бронхіт, бронхоспазм, емфізема легень тощо) ця різниця більша і зростає до 1500 мл
ібільше.
7.ІФЖЄЛ визначають під час максимально швидкого, форсованого вдиху. Вона не змінюється при емфіземі, не ускладненій бронхітом, але зменшується в разі порушення прохідності дихальних шляхів.
Для функціонального дослідження дихальної системи можна використовувати дозовані навантаження, наприклад, хворому пропонують у спокійному стані натще після 1—2 хв спокійного дихання зробити глибокий вдих і затримати дихання (проба Штанге), а також у такому порядку затримати дихання на повному видиху (проба Собразе—Генча). У здорових осіб показники цих проб у середньому становлять 30—40 с і 20 с відповідно.
Пневмотахометрія і пневмотахографія — методи для оцінювання стану зовнішнього дихання. За допомогою пневмотахометра вимірюють швидкість проходження повітря під час форсованого вдиху і видиху. У здорових чоловіків швидкість форсованого видиху становить 5—8 л/с, у жінок — 4—6 л/с (за умови спокійного дихання — 300—500 мл/с). Швидкість вдиху дещо менша. За допомогою універсального пневмотахографа можна визначити також тривалість фаз дихального циклу, ХОД, внутрішньоальвеолярний тиск, опір дихальних шляхів рухові повітря тощо. Використовуючи ці методи, можна оцінити стан прохідності бронхів. За наявності хронічних захворювань легень (бронхіальна астма, бронхіт, емфізема легень тощо) показники зовнішнього дихання до і навіть після лікування залишаються низькими.
Функціональний стан дихального апарату (дрібних розгалужень легеневої артерії, що оточують альвеоли) можна до певного ступеня дослідити за допомогою визначення швидкості руху крові в малому колі кровообігу. Одним із таких простих методів є визначення так званого ефірного часу. Для цього беруть 0,3 мл ефіру для наркозу і 0,3 мл ізотонічного розчину натрію хлориду і вводять у ліктьову вену. За допомогою секундоміра визначають час появи запаху ефіру, який відчувають самі хворі (у нормі ефірний час становить 4—9 с). У хворих із захворюваннями легень (хронічна пневмонія, пневмосклероз тощо) швидкість руху крові в малому колі кровообігу сповільнюється, а ефірний час подовжується.
Необхідно пам’ятати, що ці тести змінюються не лише при захворюваннях органів дихання, а й при захворюваннях серцево-судинної системи, ЦНС і крові.
Пікфлоуметрія — вимірювання максимальної пікової об’ємної швидкості форсованого видиху за допомогою пікфлоуметрів — простих дешевих пристроїв (мал. 37), невеликих розмірів і досить зручних у користуванні. Їх можна застосовувати як у лікарні, так і вдома й на робочому місці. Отримані пікфлоуметричні показники порівнюють із показниками, наведеними в інструкції до пристрою.
112

|
ДИХАЛЬНА СИСТЕМА |
РОЗДІЛ IV |
|
|
|
|
|
Крім того, рекомендують орієн- |
|
|
|
туватися на найкращий індивіду- |
|
|
|
альний показник пікової об’ємної |
|
|
|
швидкості видиху, який досяга- |
|
|
|
ється в період ремісії. |
|
|
|
Пікфлоуметрія допомагає в |
Мал. 37. Пікфлоуметр |
|
|
діагностиці обструктивних син- |
|
||
|
|
|
|
дромів, в оцінюванні тяжкості їх, |
|
|
|
ефективності лікування. |
|
|
|
Показники, які характеризують обмін газів (дифузію газів через альвеолярнокапілярну мембрану).
Газовий склад альвеолярного повітря. У альвеолярному повітрі здорової людини натще і в спокої вміст кисню становить 13—15 об%, парціальний тиск — 110 мм рт. ст. Уміст вуглекислоти — 4,9—5,3 об%, парціальний тиск — 40 мм рт. ст.
Поглинання кисню з альвеолярного повітря кров’ю є одним із показників зовнішнього дихання. Його визначають за рівнем нахилу спірограми — підраховують міліметри, до рівня яких піднімається спірограма, далі за масштабом шкали спірографа і швидкістю руху паперу вираховують кількість поглиненого кисню (мл/хв). Здорова людина в спокійному стані і натще за 1 хв поглинає 200—300 мл кисню.
Коефіцієнт використання кисню — кількість кисню, який поглинається людиною з 1 л повітря. Його вираховують діленням кількості кисню, поглиненого за 1 хв, на величину ХОД. У нормі ця величина становить 35—45 мл і залежить від вентиляції легень, проникності легеневих мембран і стану кровообігу в легенях.
Виділення вуглекислого газу. Здорова людина натще у спокійному стані під час звичайного дихання за 1 хв виділяє близько 250 мл вуглекислого газу. Гіпервентиляція легень підвищує концентрацію вуглекислого газу у видихуваному повітрі внаслідок її вимивання з крові і тканин. Під час гіповентиляції вуглекислого газу виділяється менше. Уміст вуглекислого газу у видихуваному повітрі визначають спеціальним апаратом — капнографом. За кривою (капнограмою) можна визначити не тільки кількість вуглекислого газу, а й особливості її виділення.
Дифузна здатність легень — властивість легеневої мембрани пропускати гази (тобто кисень з альвеол у капіляри і вуглекислий газ із капілярів в альвеоли). У здорових осіб у спокійному стані дифузна здатність легень для кисню за 1 хв становить 15 мл (під час фізичного навантаження може збільшуватися до 60 мл і більше). При пневмосклерозі, метастатичному раку легень дифузна здатність легень зменшується.
Проби на виявлення явної і прихованої легеневої недостатності. Визначення споживання кисню і кисневого дефіциту проводять методом спірографії із
113

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
закритою системою і поглинанням вуглекислого газу. Для визначення кисневого дефіциту отриману спірограму порівнюють із спірограмою, зареєстрованою за подібних умов, але в разі наповнення спірометра киснем, після чого виконують відповідні розрахунки.
За допомогою ергоспірографії визначають обсяг роботи, яку може виконати обстежуваний без появи ознак легеневої недостатності, тобто можна вивчити резерви дихальної системи.
Метод спірографії застосовують для визначення споживання кисню і кисневого дефіциту у хворого в спокійному стані та під час виконання певного фізичного навантаження на ергометрі.
Вважають, що легенева недостатність є тоді, коли спірографічний кисневий дефіцит перевищує 100 л/хв або прихований кисневий дефіцит перевищує 20 %, а також тоді, коли змінюється парціальний тиск кисню і вуглекислого газу крові.
Показники вмісту кисню і вуглекислого газу в крові. Газовий склад артеріальної крові також характеризує функцію зовнішнього дихання. Для цього беруть артеріальну кров і досліджують у ній (за допомогою апарата Ван-Слайка) вміст кисню і вуглекислого газу. У здорових осіб артеріальна кров насичена киснем на 95—97 % щодо можливої кисневої ємності в людини. Вміст зв’язаного кисню коливається в межах 18—20 об% (у середньому 19 об%), вуглекислого газу — у межах 40—46 об%.
При емфіземі легень, пневмонії, дифузному пневмосклерозі насичення артеріальної крові киснем значно знижується часом до 50 %. Стан артеріальної гіпоксемії супроводжується підвищенням рівня вуглекислого газу, тобто артеріальною гіперкапнією.
Дані про вміст кисню і вуглекислого газу у венозній крові можна отримати, провівши дослідження крові правого серця під час його катетеризації. Практично для визначення згаданих показників зазвичай користуються венозною кров’ю з ліктьової вени (насичення киснем становить 65—70 % щодо кисневої ємності крові людини, уміст зв’язаного кисню — 12—15, вуглекислого газу — 48—53 об%).
У здорових осіб артеріовенозна різниця щодо зв’язаного кисню 4—7 об%. Для оцінювання показників зовнішнього дихання користуються також таки-
ми радіоактивними газами, як 138Хе, 85Кґ, 15О2.
Лабораторні дослідження
Дослідження харкотиння. Харкотиння — патологічний секрет слизової оболонки дихальних шляхів, нерідко з елементами крові, розпаду тканин, наявністю кристалів, мікроорганізмів, найпростіших, гельмінтів та їхніх яєць тощо. Під час дослідження харкотиння насамперед визначають його фізичні властивості (макроскопічне дослідження), потім виконують мікроскопічне дослідження нативних і забарвлених препаратів, бактеріоскопічне дослідження. Часом, якщо під час проведення звичайного бактеріоскопічного дослідження збудника
114

ДИХАЛЬНА СИСТЕМА |
РОЗДІЛ IV |
|
захворювання не виявляють, застосовують спеціальне бактеріологічне дослідження — посів харкотиння на спеціальні поживні середовища або виконують експериментальне зараження тварин.
Фізичні властивості харкотиння. Для дослідження беруть свіже, ранкове харкотиння, зібране до споживання їжі і після полоскання рота. Хворий повинен збирати харкотиння в чисту плювальницю з кришкою.
Харкотиння спочатку оглядають у прозорій банці, а потім у чашках Петрі. Під час проведення макроскопічного дослідження харкотиння визначають
такі фізичні властивості: кількість, запах, характер, консистенцію, колір, наявність різних домішок і реакцію.
Добова кількість харкотиння може бути від кількох мілілітрів до 1—2 л. Виділення великої кількості харкотиння, особливо після зміни положення тіла хворого, можливе за наявності бронхоектазій та прориву абсцесу легені.
Інколи запах харкотиння може бути смердючим, наприклад, у хворих із гнильними процесами в легенях або бронхах (абсцес, гангрена легень, бронхоектазії, рак легень у стадії розпаду).
За характером харкотиння може бути слизистим, слизисто-гнійним, гнійним, слизисто-кров’янистим, слизисто-гнійно-кров’янистим, кров’янистим і серозним.
Слизисте харкотиння — безбарвне, в’язке (гострий бронхіт); серозне — також безбарвне, рідке, пінисте (набряк легень); слизисто-гнійне — в’язке з жовтим або зеленкуватим забарвленням (хронічний бронхіт, бронхіальна астма, туберкульоз тощо); гнійне харкотиння — однорідно гомогенне, напіврідке, брудно-зеленого забарвлення (прорив абсцесу легені). Кров’янисте харкотиння утворюється при деструктивних процесах у легенях та легеневих кровотечах (туберкульоз, рак, бронхоектазії, абсцес, геморагічний діатез тощо).
Іноді харкотиння буває змішаним — слизисто-гнійним із прожилками крові (бронхоектазії), серозно-кров’янистим, пінистим (набряк легень), слизистокров’янистим (інфаркт легені, застій крові у малому колі кровообігу), гнійнокров’янистим (абсцес, гангрена легень).
Уразі повільного виділення крові з гемоглобіну утворюється гемосидерин, який надає харкотинню іржавого відтінку (крупозна пневмонія). Вихід еритроцитів із кров’яного русла реr diapedesin може відбуватися внаслідок розвитку вираженої гіперемії.
Ухворих на рак легень вигляд харкотиння нагадує малинове желе. Бронхіальна астма (наприкінці нападу ядухи) супроводжується виділенням світлого, безбарвного склоподібного харкотиння.
Якщо виділяється значна кількість харкотиння, воно за своєю консистенцією буває зазвичай рідке, а якщо його виділяється мало, то, навпаки, — в’язке й тягуче (залежить від кількості слизу). Особливо в’язким харкотиння виявляється у хворих на бронхіальну астму та крупозну пневмонію (на початку її розвитку).
Для диференціальної діагностики має значення поділ харкотиння на шари. Тришарове харкотиння трапляється при розвитку гнійно-деструктивних процесів
115

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
(верхній шар — слизисто-гнійний, середній — серозний, нижній — гнійний). Двошарове харкотиння характерне звичайному і гнійному бронхіту, туберкульозу легень (верхній шар — серозний, нижній — гнійний).
Реакція харкотиння лужна, але якщо додається домішка шлункового соку, вона стає кислою, завдяки чому можна диференціювати кровохаркання від кривавого блювання.
Деякі елементи харкотиння можна побачити неозброєним оком, наприклад слизисті спіралі Куршмана, що мають вигляд білуватих ниток (зліпки слизу з дрібних бронхів, які утворюються у хворих на бронхіальну астму під час спазму дрібних бронхів і виділяються після його припинення), зліпки фібрину з бронхів (виявляються при фібринозному бронхіті), грудочки завбільшки з просяне зерно з неприємним запахом (скупчення продуктів жирового, клітинного і бактеріального розпаду, які містять у собі туберкульозні бацили), гнильні кірки Дітріха (подібні до сочевиці, не містять туберкульозних бацил, після роздавлювання мають смердючий запах і характерні для гангрени, абсцесу, гнильного бронхіту), часточки ракових пухлин, міхури ехінокока, зерна актиномікозу, харчові маси, сторонні предмети, які потрапили в бронхи.
Ухаркотинні можуть траплятися домішки жовчі (у разі сильної жовтяниці або прориву ехінококової кісти печінки в бронх).
Мікроскопічне дослідження харкотиння. Досліджують як забарвлені, так
інезабарвлені (нативні) препарати. Для цього підозрілу грудочку харкотиння кладуть на предметне скло і притискують накривним склом так, щоб утворився рівномірний нетовстий шар. Нативний препарат вивчають під мікроскопом при малому й великому збільшенні (для диференціації формених елементів).
Унативному препараті можна побачити лейкоцити, еритроцити, клітини плоского епітелію (з порожнини рота, тому діагностичного значення не мають), друзи актиноміцетів, елементи ехінокока, кристали жирних кислот і гематоїдину. Можна також побачити елементи, що їх спостерігають при бронхіальній астмі: велику кількість ацидофільних гранулоцитів, кристали Шарко—Лейдена (блискучі безбарвні октаедри з гострими кінцями, які утворюються з білкових продуктів зруйнованих ацидофільних гранулоцитів) і спіралі Куршмана (мал. 38).
Щоб виявити ацидофільні гранулоцити, препарат забарвлюють за методом Романовського—Гімзи (див. «Дослідження крові»). Велика кількість їх (50—90 % від усіх лейкоцитів) спостерігається у хворих на бронхіальну астму, з глистяними ураженнями легень, а також за наявності еозинофільних інфільтратів тощо.
Велике діагностичне значення має виявлення в харкотинні еластичних волокон. Для цього готують відповідний препарат. Харкотиння обробляють їдким калі, що дає змогу зруйнувати всі його складові, за винятком еластичних волокон. Для цього у пробірці змішують 3 мл харкотиння з такою само кількістю 10 % розчину їдкого калі і доводять до кипіння. До вмісту пробірки додають 2—3 краплини 1 % спиртового розчину еозину, центрифугують, осад наносять на предметне скло і притискують накривним скельцем. Еластичні волокна, забарвлені
116

ДИХАЛЬНА СИСТЕМА |
РОЗДІЛ IV |
|
а |
б |
Мал. 38. Мікроскопічне дослідження харкотиння (М.А. Базарнова). Ознаки бронхіальної астми: а — еозинофільні гранулоцити (1) і кристали Шарко-Лейдена (2);
б — спіраль Куршмана (1 — вісь; 2 — мантія)
еозином у рожевий колір, є двоконтурними різко окресленими блискучими нитками, які дуже заломлюють світло і створюють сітку або петлі з їх дихотомічним (у вигляді двох гілок) розгалуженням на кінцях (мал. 39).
Еластичні волокна, що є в харкотинні, вказують на розпад легеневої тканини (туберкульоз, абсцес легень). У хворих із гангреною легень еластичні волокна можуть не виявлятися через розчинення їх особливим ферментом, що виробля-
ється при цьому захворюванні. |
|
Під мікроскопом у разі велико- |
|
го збільшення можна також вияви- |
|
ти альвеолярні клітини (внаслідок |
|
ураження легеневої тканини), альве- |
|
олярні макрофаги — великі клітини |
|
ретикулоендотеліального походжен- |
|
ня (у 2—3 рази більші від лейкоци- |
|
тів). Серед них є «клітини серцевих |
|
вад», що містять бурий пігмент гемо- |
|
сидерин (виявляються в разі застою |
|
в малому колі кровообігу, особливо |
|
за наявності стенозу лівого атріовен- |
|
трикулярного отвору, інфаркту ле- |
|
гень, крововиливів, пневмонії). Щоб |
|
відрізнити їх від пилових клітин, на- |
Мал. 39. Еластичні волокна в харкотин- |
повнених частинками різного пилу, |
ні (нативний препарат — за М.А. Базар- |
виконують реакцію на берлінську |
новою) |
117

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
лазур: до препарату додають кілька крапель 2 % розчину хлористоводневої кислоти і стільки ж 5 % розчину залізисто-ціаністого калію; за кілька хвилин зерна гемосидерину забарвлюються в синій колір.
Нерідко в харкотиння потрапляють клітини злоякісних пухлин значних розмірів і містять у собі великі ядра з мітозами в них — атипові клітини.
Для виявлення друз актиноміцет необхідно взяти щільні грудочки харкотиння завбільшки з піщинку. Під мікроскопом видно друзи, які складаються із центрального клубка, від якого відходять променисті, блискучі нитки з колбоподібними стовщеннями на кінцях. Після фарбування за Грамом нитки забарвлюються у фіолетовий колір, а колбоподібні стовщення — у рожевий.
З інших грибів, що їх можна визначити в харкотинні, найбільше значення мають Саndida albicans, які ушкоджують легені в разі тривалого лікування антибіотиками, особливо у дуже знесилених хворих. У нативному препараті видно дріжджоподібні клітини і міцелій у вигляді бруньок, у якому спори розташовані кільцями.
Кристали гематоїдину виявляють після легеневих кровотеч. Вони мають вигляд бурих ромбоподібних пластинок і пучків зігнутих головок. Іноді в харкотинні можна виявити яйця глистів (thorninx aerophilus).
Бактеріологічне дослідження застосовують для виявлення мікрофлори харкотиння. Для цього прожареною на вогні голкою беруть грудочку харкотиння і переносять його на чисте предметне скло, яке накривають іншим предметним склом. Харкотиння розтирають між двома предметними стеклами і роз’єднують їх. Препарат висушують і після цього його фіксують (мазком униз повільно тричі проводять через полум’я спиртівки чи газового пальника). Відтак препарат забарвлюють: для пошуку мікобактерій туберкульозу — за Цілем—Нільсеном (мал. 40, кольорова вклейка), для пошуку іншої флори — за Грамом.
Забарвлення за методом Ціля—Нільсена. На фіксований мазок харкотиння накладають смужку фільтрувального паперу і наливають карболовий фуксин Ціля. Далі препарат нагрівають над полум’ям до утворення пари, згодом папір знімають, препарат промивають водою, потім опускають на 1 хв у 3 % розчин хлористоводневої кислоти або в 10 % розчин сірчаної кислоти. Після цього препарат промивають водою і впродовж 30 с дофарбовують 0,5 % розчином метиленового синього, знову промивають і висушують. Метод ґрунтується на тому, що мікобактерії туберкульозу важко сприймають барвник, бо у своїх зовнішніх шарах вони містять жировіск. Але після забарвлення вони стійко утримують барвник і не знебарвлюються ні спиртом, ні кислотами (спирто- і кислотостійкі). Туберкульозні бацили мають червоний вигляд на синьому тлі інших елементів мазка.
Якщо виявити мікобактерії туберкульозу складно, користуються методом флотації (збагачення) за допомогою електрофорезу, а також люмінесцентною мікроскопією.
Забарвлення за Грамом. На фіксований мазок кладуть смужку фільтрувального паперу і наливають розчин карболового генціанвіолету. Через 2—3 хв папір знімають, барвник зливають і на 1—2 хв наливають розчин Люголя. Потім
118

ДИХАЛЬНА СИСТЕМА |
РОЗДІЛ IV |
|
розчин Люголя зливають, препарат акуратно просушують і на кілька секунд занурюють у 96 % розчин етилового спирту, після цього промивають водою і впродовж 1 хв забарвлюють додатково розчином карболового фуксину.
Бактерії, які зберігають фіолетовий колір (залишаються забарвленими генціанвіолетом і не знебарвлюються спиртом), називаються грампозитивними (капсульні диплококи Френкеля—Вексельбаума, або пневмококи, стрептококи); ті, що під дією знебарвлення спиртом втратили генціанвіолет і забарвлені фуксином у рожевий колір — грамнегативними (капсульна диплобацила Фрідлендера, дрібна паличка Пфайффера тощо). Невелика кількість усіх цих мікроорганізмів міститься в дихальних шляхах здорових осіб і лише за певних несприятливих умов вони можуть стати патогенними і спричинити в них пневмонію, бронхіт, абсцес.
Якщо бактеріоскопічні методи не дають змоги виявити збудника захворювання, можна застосувати посів харкотиння на відповідні середовища. Це дає змогу визначити також вірулентність і медикаментозну стійкість їх, що необхідно для правильного добору медикаментозних засобів.
У деяких складних випадках, коли виявити збудника захворювання не вдається, харкотинням заражують експериментальних тварин.
Дослідження плевральної рідини. У здорової людини між плевральними листками міститься невелика кількість рідини, подібної до лімфи, яка допомагає ковзанню їх під час дихання. Збільшення кількості плевральної рідини спостерігають у разі порушення (застою) лімфо- і кровообігу в легенях (випіт незапального характеру — транссудат) і розвитку запальних процесів у плеврі (рідина запального характеру — ексудат). Причиною утворення запальної рідини можуть бути різні інфекції та захворювання легень і середостіння — ревматизм, інфаркт міокарда, рак, туберкульоз, лімфоми тощо.
Дослідження плеврального випоту проводять для того, щоб визначити характер рідини, її клітинний склад, за змоги — виявити збудників запального процесу і встановити чутливість їх до антибіотиків.
Для цього проводять макроскопічне, фізико-хімічне, мікроскопічне, а інколи й мікробіологічне дослідження.
Макроскопічне дослідження. Вигляд плевральної рідини залежить від клітинного, а також хімічного її складу. Випіт може бути серозного, серознофібринозного, фібринозного, серозно-гнійного, гнійного, гнильного, геморагічного і хільозного чи хільозоподібного характеру.
Досліджуючи плевральну рідину, насамперед визначають її загальні (фізичні) властивості: колір, прозорість, консистенцію і запах.
Колір. Плевральна рідина здебільшого блідо-жовтого (транссудат) і золотисто-жовтого (серозний ексудат) забарвлення, за наявності жовтяниці — насиченого жовтого кольору. Гнійний ексудат зазвичай зеленуватого забарвлення. У разі утворення геморагічного випоту плевральна рідина стає буруваточервоною, хільозного випоту, який з’являється внаслідок потрапляння лімфи з грудної протоки в порожнину плеври, — набуває молочного відтінку. Такий
119

СПЕЦІАЛЬНА ЧАСТИНА |
ПРОПЕДЕВТИКА ВНУТР²ШНЬО¯ МЕДИЦИНИ |
|
вигляд мають і хільозні ексудати, що зумовлено жировим переродженням формених елементів чи надходженням із крові великої кількості жиру.
Прозорість. Транссудат, а також серозний ексудат прозорі. Помутніння випоту зумовлене наявністю в ньому значної кількості лейкоцитів, еритроцитів, крапель жиру.
Консистенція плевральної рідини може бути рідкою або густою, що залежить від її характеру.
Запах випоту буває неприємним, іноді смердючим, що зумовлено його гнильним характером (абсцеси й гангрена легень).
Фізико-хімічне дослідження плевральної рідини проводять для визначення її відносної густини й кількості білка, що має важливе значення для встановлення характеру досліджуваної рідини, і визначають чи вона є транссудатом, чи ексудатом. Відносну густину визначають урометром. Відносна густина транссудату нижча ніж 1015, ексудату — вища ніж 1015 (1018—1022). Уміст білка в транссудаті (визначають так само, як і в сечі, — за методом Робертса—Стольникова) нижчий ніж 3 % (0,5—2,5 %), у ексудаті — вищий ніж 3,8 %. Інколи вміст білка може бути вищим, ніж 3 %, але досліджувана рідина не є ексудатом. У такому разі необхідно провести реакцію на наявність серозаліцину; для цього застосовують пробу з оцтовою кислотою — пробу Рівальта.
У циліндр, заповнений слабким розчином оцтової кислоти (2 краплі концентрованої кислоти на 100 мл води), додають краплями плевральну рідину. Якщо крапля, осідаючи в рідині, залишає за собою слід у вигляді білої хмарки, подібної до сигаретного диму, досліджувана рідина є ексудатом, який містить особливий білок — серозомуцин (поява білої хмарки свідчить про зсідання білка під впливом оцтової кислоти). Проба Рівальта з транссудатом дає негативний результат.
Мікроскопічне дослідження проводять як на свіжих нативних препаратах, одержаних з осаду після центрифугування рідини, так і на забарвлених за Ро- мановським—Гімзою сухих мазках. У мазках виявляють різні види лейкоцитів: для туберкульозних ексудатів характерна наявність великої кількості лімфоцитів, для емпієми — нейтрофільних гранулоцитів. Велику кількість ацидофільних гранулоцитів виявляють в ацидофільних ексудатах. При раковому плевриті в ексудаті знаходять великі клітини мезотелію з вакуолями, нерідко — велетенські, атипової форми пухлинні клітини і клітини Штернберга (останні виявляють при лімфомі Годжкіна). Для вивчення кокової мікрофлори мазки забарвлюють за Грамом, мікобактерії туберкульозу — за Цілем—Нільсеном.
Мікробіологічне дослідження. При ревматичній пневмонії, раку легень, лімфомі ексудати зазвичай стерильні. Виявити мікобактерії туберкульозу в серозному ексудаті дуже складно. У такому разі посів або прищеплення пунктату морським свинкам інколи дає позитивний результат.
Інколи, щоб виявити туберкульозні бацили або клітини злоякісних пухлин у хворих, які не виділяють харкотиння, проводять цитологічне дослідження нативних препаратів і забарвлених мазків із промивних вод бронхів.
120
