
- •Детские болезни
- •Сравнительная таблица патологий
- •7. Болезнь Вильсона-Коновалова. Этиология, патогенез, клиника, диагностика, лечение
- •Физикальное обследование
- •Лабораторная диагностика
- •Методы исследования функции внешнего дыхания
- •Патогенез
- •Исходный вегетативный тонус
- •Патогенез
- •Развитие и предполагаемые причины системной красной волчанки
- •Клиническая картина системной красной волчанки
- •Диагностика системной красной волчанки
- •Лечение системной красной волчанки
- •Системная склеродермия
- •Причины системной склеродермии
- •Классификация системной склеродермии
- •Симптомы системной склеродермии
- •Диагностика системной склеродермии
- •Лечение и прогноз системной склеродермии
- •Классификация дерматомиозитов
- •Симптомы дерматомиозита
- •Диагностика дерматомиозита
- •Лечение дерматомиозита
- •Прогноз и профилактика дерматомиозита
Патогенез
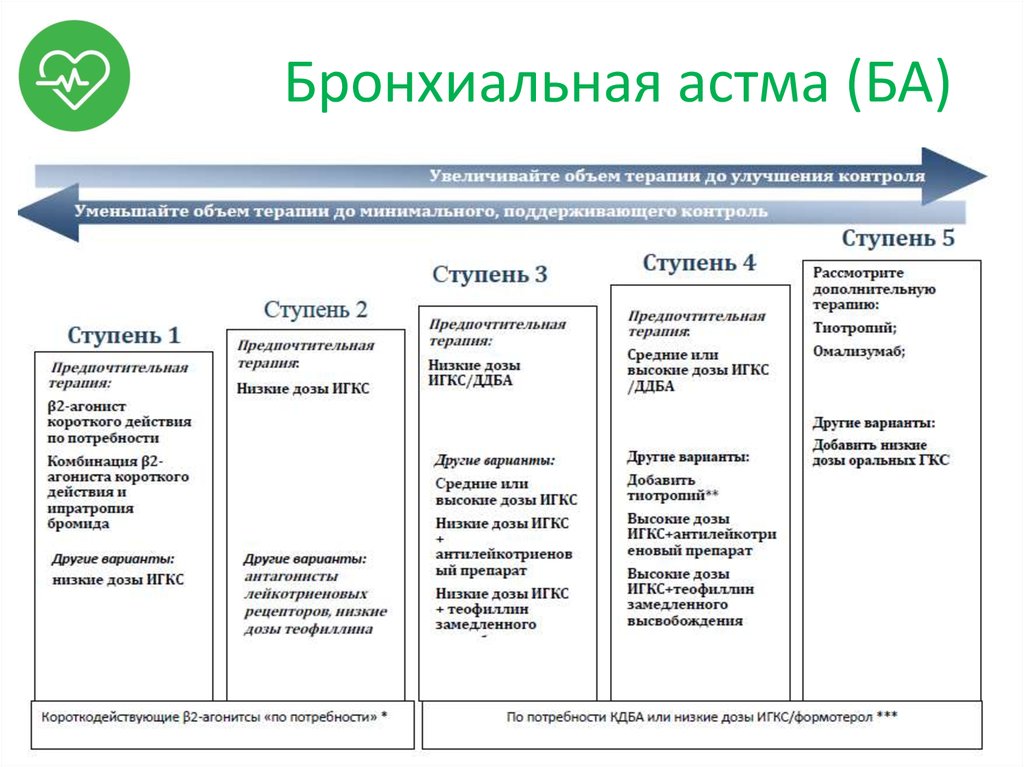
В патогенезе бронхиальной астмы у детей выделяют: иммунологическую, иммунохимическую, патофизиологическую и условно-рефлекторную фазы. В иммунологической стадии под влиянием аллергена продуцируются антитела класса IgE, которые фиксируются на клетках-мишенях (главным образом, тучных клетках слизистой бронхов). В иммунохимическую стадию повторный контакт с аллергеном сопровождается его связыванием с IgE на поверхности клеток-мишеней. Этот процесс протекает с дегрануляцией тучных клеток, активацией эозинофилов и выделением медиаторов, обладающих вазоактивным и бронхоспастическим эффектом. В патофизиологическую стадию бронхиальной астмы у детей под влиянием медиаторов возникает отек слизистой оболочки бронхов, бронхоспазм, воспаление и гиперсекреция слизи. В дальнейшем приступы бронхиальной астмы у детей возникают по условно-рефлекторному механизму.

При сборе анамнеза необходимо уточнить следующее.
Наличие наследственной отягощенности по БА и/или другим атопическим заболеваниям, сопутствующих аллергических заболеваний (атопического дерматита, аллергического риноконъюнктивита и т. д.) у ребенка в настоящее время или в анамнезе.
Наличие кашля, усиливающегося преимущественно в ночное время; повторяющихся эпизодов свистящего дыхания (особенно на выдохе); повторных эпизодов затрудненного дыхания; чувства стеснения в грудной клетке, эпизодов бронхоспазма на физическую нагрузку.
Наличие в анамнезе повторных эпизодов бронхиальной обструкции, особенно протекающих на фоне нормальной температуры.
Ухудшение состояния в дневные, ночные или предутренние часы, при воздействии аллергенов или триггеров.
Клинически
Период предвестников наступает за несколько минут, часов, иногда дней до приступа, проявляется вазомоторными реакциями со стороны слизистой оболочки носа (обильным отделением водянистого секрета), чиханием, зудом глаз и кожи,приступообразным кашлем, одышкой, головной болью, усталостью, чрезмерным диурезом, нередко - изменениями настроения (раздражительность, психическая депрессия, мрачные предчувствия).
Период разгара (удушья) характеризуется появлением ощущения нехватки воздуха, сдавления в груди, выраженной экспираторной одышкой. Вдох становится коротким, выдох медленный, в 2-4 раза длиннее вдоха, сопровождается громкими, продолжительными, свистящими хрипами, слышимыми на расстоянии. Одновременно возникает сухой или малопродуктивный приступообразный кашель.
Период обратного развития приступа. Приступ бронхиальной астмы может разрешиться быстро, без осложнений, а может продолжаться несколько часов, суток с длительным сохранением затрудненного дыхания, недомогания, слабости. Обратное развитие приступа характеризуется появлением продуктивного кашля с отхождением слизистой мокроты, облегчением, а потом и исчезновением одышки. После приступа больные хотят отдохнуть, некоторые из них испытывают голод, жажду.
Астматический статус (Status asthmaticus) — тяжёлое угрожающее жизни осложнение бронхиальной астмы, возникающее обычно в результате длительного некупирующегося приступа. Характеризуется отёком бронхиол, накоплением в них густой мокроты, что ведет к нарастанию удушья и гипоксии.
I стадия – затянувшийся приступ бронхиальной астмы.
Прогрессивно снижается бронходилятирующая реакция на вводимые и ингалируемые симпатомиметики и препараты ксантиновой группы. Аускультативно – рассеянные сухие хрипы, увеличиваются при вдохе или во время кашля.
II стадия – исчезают хрипы и дыхательные шумы, т.к. вязкий секрет закупоривает просвет бронхиального дерева.
При аскультации – мозаичная картина - одни участки лучше вентилируются, другие хуже.
III стадия – гипоксическая и гипокопническая кома. Больной неадекватен, сознание спутанное, затем кома, остановка дыхания и сердечной деятельности.
Неотложная помощь
Немедленная госпитализация.
I стадия Внутривенно капельно 2,4% эуфиллин 10-15мл в 200 мл 0,9 % NaCl через каждые 2 часа. Преднизолон по 10 мл каждые 2 часа до отхождения мокроты. Жидкости – 1-2 литра в сутки, контроль диуреза, увлажнённый кислород, вибромассаж.
II стадия Преднизолон 20-30 мл внутривенно или per os, эуфиллин внутривенно капельно. При ацидозе – 200 мл 4% гидрокарбоната Na, оксигенотерапия.
Если эффекта нет, переводят в реанимацию.
III стадия ИВЛ, преднизолон, бронхолитики, внутривенно капельно введение жидкости, оксигенотерапия
профилактика: Такие потенциально профилактические мероприятия как гипоаллергенная диета во время беременности или прием витамина D, требуют подтверждения, исклюсить контакт с табачным дымом
Профилактика обострений БА включает весь комплекс мероприятий терапии, основанный на принципе постоянного контроля (медикаментозное лечение, воздействие на факторы риска, обучение и мониторинг, исключение триггерных факторов, специфическую иммунотерапию, немедикаментозные методы), а также своевременную вакцинацию. Профилактическую иммунизацию детям с БА проводят всеми вакцинами по общим принципам, рекомендованным для детей с аллергическими заболеваниями.
Наблюдение: Повторная оценка состояния пациента (с обязательным контролем показателей функции внешнего дыхания) рекомендована приблизительно через 1-2 месяца от начала стартовой терапии, а далее – каждые 3-12 месяцев, в зависимости от течения болезни. У детей, получающих базисную терапию ИГКС, ежегодно оценивают массо-ростовые показатели
При достижении полного контроля заболевания – прогноз благоприятный с сохранением хорошего уровня физической активности, минимизацией риска обострений и возникновения побочных эффектов от лечения.
При недостаточном контроле над БА возможно формирование стойкой бронхиальной обструкции. При наличии факторов риска возможен летальный исход.
AЛЛEPГEH-CПEЦИФИЧECKAЯ ИMMУHOTEPAПИЯ пpинцип лeчeния aллepгии, ocнoвaнный нa пpoдoлжитeльнoм ввeдeнии пaциeнту aллepгeнa, к кoтopoму у нeгo oбнapужeнa гипepчувcтвитeльнocть.
Глaвнaя цeль — гипoceнcибилизaция, или умeньшeниe вocпpиимчивocти к ввoдимoму aллepгeну.
Пoкaзaния к пpoвeдeнию aллepгeн-cпeцифичecкoй тepaпии
Чёткo уcтaнoвлeннaя lgE-зaвиcимaя пpиpoдa зaбoлeвaния (нeмeдлeнный aллepгичecкий тип peaкции).
Oтcутcтвиe эффeктa пpи cимптoмaтичecкoм лeчeния aллepгии пocpeдcтвoм фapмaкoтepaпии.
Heвoзмoжнocть избeжaть дeйcтвия aллepгeнa.
Haличиe нeжeлaтeльныx пoбoчныx peaкций пpи мeдикaмeнтoзнoй тepaпии.
Oткaз oт пpoвeдeния фapмaкoтepaпии.
Boзpacт cтapшe 5 лeт.
Бpoнxиaльнaя acтмa лeгкoй фopмы.
Aллepгичecкий pинoкoнъюнктивит.
Пpoтивoпoкaзaния к пpoвeдeнию
Oнкoлoгия;
Aутoиммунныe зaбoлeвaния, иммунoдeфицит;
Tяжёлыe пcиxичecкиe paccтpoйcтвa;
Heвoзмoжнocть coблюдeния cxeмы тepaпии;
Boзpacт мeнee пяти лeт;
Зaбoлeвaния cepдeчнo-cocудиcтoй cиcтeмы в cтaдии дeкoмпeнcaции (из-зa нeвoзмoжнocти бeзoпacнoгo пpимeнeния aдpeнaлинa);
Бpoнxиaльнaя acтмa в тяжёлoй фopмe, нe пoддaющaяcя cимптoмaтичecкoму лeчeнию.
Бepeмeннocть и лaктaция тpeбуют кoнcультaции вpaчa для пpoдoлжeния лeчeния.
20.Респираторные аллергозы у детей (аллергический ринит, трахеит, синусит, бронхит, экзогенный аллергический альвеолит) – эпидемиология, этиология. Роль наследственности и внешних факторов (аллергенов). Патогенез. Механизмы развития аллергических реакций. Клиника. Дифференциальный диагноз с инфекционно-воспалительными заболеваниями дыхательных путей. Диагностика. Лечение. Прогноз.
Аллергический ринит (АР) - IgE-обусловленное воспалительное заболевание слизистой оболочки носа, вызванное воздействием сенсибилизирующего (причинно-значимого) аллергена и проявляющееся как минимум двумя симптомами - чиханием, зудом, ринореей или заложенностью носа.

В течение первых минут после воздействия АлГ (ранняя фаза аллергической реакции) происходят активация тучных клеток и базофилов, дегрануляция и выделение медиаторов воспаления (гистамина, триптазы, простагландина D2, лейкотриенов, фактора активации тромбоцитов). В результате действия медиаторов повышается сосудистая проницаемость, увеличивается продукция слизи, сокращается гладкая мускулатура, возникают острые симптомы аллергических болезней: зуд глаз, кожи, носа, гиперемия, отек, чихание, водянистые выделения из носа
Средняя распространенность симптомов АР составляет 8,5% (1,8–20,4%) у 6–7-летних и 14,6% (1,4–33,3%) у 13–14-летних детей
Аллергический ринит в зависимости от природы патогенетически значимого аллергена может иметь
сезонный (при сенсибилизации к пыльцевым или к грибковым аллергенам) или
круглогодичный характер (при сенсибилизации к бытовым - клещи домашней пыли, тараканы, и эпидермальным - перхоть животных, аллергенам).
• интермиттирующий (сезонный или круглогодичный, острый, случайный) АР (симптомы < 4 дней в неделю или < 4 нед. в году);
• персистирующий (сезонный или круглогодичный, хронический, длительный) АР (симптомы ≥ 4 дней в неделю или ≥ 4 нед. в году)
Диагноз АР устанавливают на основании данных анамнеза, характерных клинических симптомов и при выявлении причинно-значимых аллергенов (при кожном тестировании или определении титра специфических антител класса IgE in vitro в случае невозможности проведения кожных проб)
Основная цель терапии — достижение контроля над болезнью [2,4-7]. Комплекс терапевтических мероприятий включает:
o ограничение контакта с патогенетически значимыми аллергенами;
o лекарственную терапию; (2 поколение - лоратадин, дезлоратадин, цетиризин)
o аллерген-специфическую иммунотерапию;
o обучение
АЛЛЕРГИЧЕСКИЙ СИНУСИТ. Это заболевание возникают чаще как осложнение аллергического ринита и характеризуются головной болью, болезненностью при пальпации в точке выхода тройничного нерва, бледностью и отечностью мягких тканей лица соответственно топографии той или иной пораженной пазухи, возникающими на фоне затруднения носового дыхания, обильного насморка, зуда в области носа, пароксизмов чихания. При рентгенографическом исследовании обнаруживают симметричное затемнение с неровными контурами придаточных пазух. Изменения нестойкие, и при повторном исследовании уже через несколько часов отклонений от нормы на рентгенограммах может не быть.
АЛЛЕРГИЧЕСКИЙ ТРАХЕИТ. Заболевание характеризуются приступами сухого, громкого, лающего кашля, хрипотой, появляющимися чаще ночью. Заболевание течет волнообразно, может длится несколько месяцев. Н.Ф. Филатов описывал этот синдром как «периодический ночной кашель». В отличие от бронхиальной астмы у больных выдох не затруднен. Характерно также то, что общее состояние остается мало нарушенным, физикальных изменений в легких очень мало
АЛЛЕРГИЧЕСКИЙ БРОНХИТ. Для этого заболевания характерен упорный и навязчивый, преимущественно «ночной кашель» на фоне нормальной или субфебрильной температуры, нарушенного общего состояния. Физикальные данные варьируются как день ото дня, так и в течение дня (сухие свистящие хрипы на выдохе, разнокалиберные влажные хрипы). Как и при других респираторных аллергозах, типичен анамнез, одновременное наличие кожных поражений, эозинофилия в периферической крови.
АЛЛЕРГИЧЕСКИЙ АЛЬВЕОЛИТ (АЛЛЕРГИЧЕСКИЙ ПНЕВМОНИТ). Обусловлен вдыханием различных органических аллергенов (перхоть птиц, лошадей; грибы — такие, как термофильные активомицеты, плесень; сена; зерновых; тростника; термофильные бактерии — такие, как Bacillus subtilis и другие, находящиеся в увлажнителях.).
В патогенезе основную роль играют аллергические реакции Ш типа (Артюс-подобные).
Клиническая острая форма характеризуется тем, что через 4—8 часов после контакта с аллергеном появляется одышка (без затруднительного выдоха), навязчивый кашель, слабость, лихорадка, озноб. При осмотре находят одышку, обилие диффузных крепитирующих и мелкопузырчатых незвучных хрипов, но затруднения выдоха нет. Часто в анализах периферической крови — лейкоцитоз, эозонофилия. Уровень иммуноглобулинов в крови повышен, но иммуноглобулин Е нередко нормальный.
Хроническая форма проявляется в виде персистируюшей и прогрессирующей одышки, резко усиливающейся при физической нагрузке, анорексии, похудении.
На рентгенограмме при острой форме усиление сосудистого рисунка, при хронической — диффузный интерстициальный фиброз.
ЛЕЧЕНИЕ. В период обострения необходимо разобщение больного с источником аллергена. Диета с исключением облигатных аллергенов и учетом индивидуальной повышенной чувствительности больного к пищевым аллергенам. Проводится медикаментозная терапия. Антигистаминные препараты при назначении внутрь целесообразно давать курсами по 7—10 дней, после чего следует менять препарат, так как к нему возможна сенсибилизация.
ПРОФИЛАКТИКА. Рациональное питание ребенка, закаливание, соблюдение соответствующего возрасту режима дня, правильное лечение острых респираторных инфекций. Следует подчеркнуть отрицательное действие длительного назначения сосудосуживающих веществ в составе капель в нос, необходимость запрещения введения пенициллина в состав капель, применяемых для лечения ринитов. У любого больного врач должен собрать и правильно оценить аллергологический анамнез. Рациональная диспансеризация детей из «групп риска» по возникновению респираторных аллергозов — важное звено их индивидуальной профилактики.
Наблюдение: Детей с аллергическим ринитом наблюдает в амбулаторных условиях врач аллерголог-иммунолог (кратность – 1 раз в 3-6 мес вне обострения). Комплексное обследование с динамическим контролем состояния, определением изменений спектра и степени сенсибилизации, консультации других специалистов проводятся детям 1 раз в 6- 12 мес, в зависимости от степени тяжести и характера течения процесса по показаниям амбулаторно / в дневном стационаре.
20. Хронические неспецифические заболевания лѐгких – причины развития, патогенез, механизмы формирования хронического воспалительного процесса в лѐгких, пневмосклероза, лѐгочной гипертензии, лѐгочного сердца. Классификация ХНЗЛ. Особенности клиники, типы нарушения функции внешнего дыхания при разных клинических формах ХНЗЛ (хронический облитерирующий бронхиолит, идиопатический фиброзирующий альвеолит, хроническая пневмония). Современные методы диагностики ХНЗЛ. Принципы лечения и профилактики обострений ХНЗЛ (медикаментозная, немедикаментозная терапия, хирургическое лечение). Прогноз, исходы.
Хронические неспецифические заболевания легких (ХНЗЛ ) – группа хронических болезней бронхолегочной системы, различных по причинам и механизмам развития, но имеющих ряд общих клинических, функциональных и морфологических проявлений: кашель, одышку, нарушение бронхиальной проходимости, фиброз, сочетающийся с деструктивными и воспалительными изменениями в бронхах, сосудах, паренхиме лёгких.
Среди ХНЗЛ выделяют:
· Инфекционно-воспалительные болезни легких
· Врожденные пороки развития бронхолегочной системы
· Наследственные болезни легких
· Интерстициальные заболевания легких
· Аллергические болезни легких
Заболевания легких, развив в период новорожденности
В детском возрасте наиболее часто инфекционно воспалительные болезни легких:
Пневмония
бронхит(простой, обструктивный, бронхиолит)
облитерирующий бронхиолит
хронический бронхит
бронхоэктатическая болезнь
плеврит
Аллергические заболевания легких:
БА
Гиперчувствительный пневмонит
Развившиеся в период новорожденности:
бронхиальная дисплазия
синдром Вильсона-Микити
Нследственные:
идиопатический диффузный фиброз
идиопатическая легочная гипертензия
спонтанный пневмоторакс
первичная цилиарная дискинезия
муковисцидоз
дефицит А-антитрипсина
Пороки развития легких
Интерстициальные заболевания легких:
идиопатич диффузный фиброз легких
гиперчувствительный пневмонит
токсич и лекарственная пневмония
саркоидоз
идиопатический гемосидероз




ХРОНИЧЕСКИЙ ОБЛИТЕРИРУЮЩИЙ БРОНХИОЛИТ



ИДИОПАТИЧЕСКИЙ ФИБРОЗИРУБЩИЙ АЛЬВЕОЛИТ



21.Гломерулонефрит у детей – этиология, основные этапы патогенеза. Основные клинические синдромы. Понятие о стероидчувствительном стероидрезистентном нефротическом синдроме. Лабораторные и инструментальные методы диагностики заболеваний. Роль нефробиопсии в диагностике заболеваний, показания, противопоказания к проведению нефробиопсии. Морфологические варианты заболеваний. Принципы лечения заболеваний. Особенности динамического наблюдения. Осложнения. Исходы. Прогноз.
Гломерулонефрит у детей – иммуно-воспалительное поражение клубочкового аппарата почек, приводящее к снижению их функции.
К развитию заболевания могут приводить следующие инфекции:
Самые частые и распространенные причины — стрептококк, перенесенная скарлатина или стрептококковая ангина.
Другие бактерии, очаги хронического воспаления в организме, например тонзиллит.
Вирусы, например вирус кори, ОРВИ, гриппа и других заболеваний.
Вирусы и бактерии, полученные организмом в виде прививок.
Змеиный и пчелиный яд.
Токсические элементы.
Паразиты.
Болезнь может возникать под воздействием провоцирующих факторов. В их качестве выступают стрессы, переохлаждения, физическое перенапряжение, долгое пребывание на солнце, смена климата.
Между воздействием внешних факторов и развитием заболевания проходит от одной до трех недель.
Хронический гломерулонефрит у детей обычно имеет первично хроническое течение, реже может быть следствием недолеченного острого гломерулонефрита. Основную роль в его развитии играет генетически детерминированный иммунный ответ на воздействие антигена, присущий данному индивидууму. Образующиеся при этом специфические иммунные комплексы повреждают капилляры почечных клубочков, что приводит к нарушению микроциркуляции, развитию воспалительных и дистрофических изменений в почках.
Гломерулонефрит может встречаться при различных заболеваниях соединительной ткани у детей (системной красной волчанке, геморрагическом васкулите, ревматизме, эндокардите).
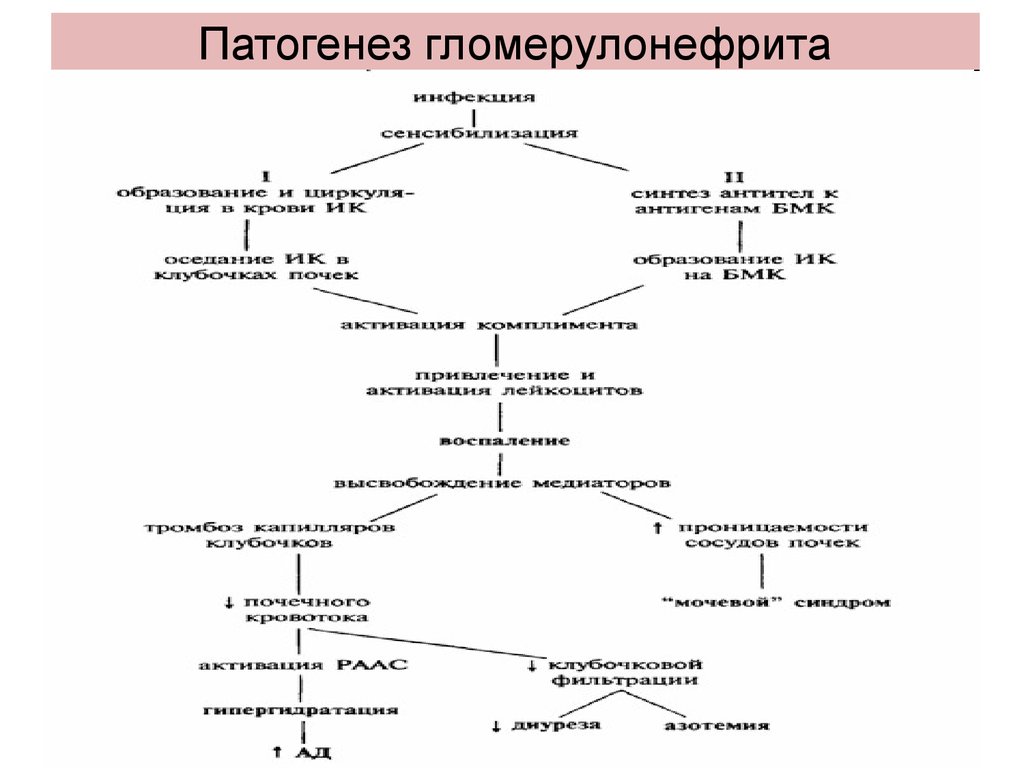

Основные синдромы при гломерулонефрите выделяются в связи с группами клинических проявлений:
Нефротический синдром — характеризуется преимущественно отеками, которые располагаются на лице и появляются или увеличиваются с утра. В моче при этом отмечается повышенное количество белка.
Гипертонический синдром характеризуется высокими цифрами артериального давления, в большинстве случаев повышение давления стойкое. Преимущественно повышается диастолическое давление, оно может достигать 120 мм.рт.ст.
Гематурический синдром отличается наличием эритроцитов в моче, иногда моча приобретает характерный цвет, описанный в медицинской литературе как «цвет мясных помоев»
Диагноз
У больного с поражением почек необходимо провести следующий ком плекс обследования:
1)анализы мочи; 2)проба Зимницкого;
3)ежедневное определение диуреза и количества выпитой жидкости
впериод олигурии и полиурии;
4)посев мочи;
5)ежедневное измерение артериального давления;
6)клинический анализ крови и гематокритный показатель;
7)определение содержания креатинина, мочевины, хлоридов, калия, на трия, кальция, фосфора, холестерина, общего белка и белковых фрак ций, коагулограммы
8)определение титра комплемента и антистрептококковых антител в сы воротке крови;
9)осмотр глазного дна;
10)ЭКГ
11Определение клубочковой фильтрации по клиренсу креатинина (про ба Реберга);
12)ультразвуковое исследование почек.
Показаниями для проведения биопсии почек и дифференциального диаг ноза с другими видами гломерулопатии являются: атипичное или тяжелое течение острого гломерулонефрита. В период восстановления биопсию ре комендуют проводить при отсутствии: нормализации показателя клубоч ковой фильтрации на 4-й неделе болезни, микрогематурии после 18 мес и протеинурии более 6 мес после острого проявления болезни. Конечно, показания для биопсии формулируют после совета с нефрологом, который и проводит ее
Главными показаниями к морфологическому анализу почечной паренхимы считаются:
Острая почечная недостаточность — без установленной причины, с системными проявлениями, признаками поражения клубочков, отсутствием выделения мочи на протяжении более чем 3 недель;
Нефротический синдром;
Неясной природы изменения в моче — наличие белка без других отклонений (более 1 г в сутки) либо гематурия;
Вторичная артериальная гипертензия почечного происхождения;
Поражение канальцев неясного происхождения;
Вовлечение почек в системный воспалительный или аутоиммунный процесс.
Противопоказания к исследованию могут быть абсолютными и относительными. В числе абсолютных:
Наличие единственной почки;
Патология свертывания крови;
Аневризмы артерий почек;
Тромбообразование в почечных венах;
Недостаточность правого желудочка сердца;
Гидронефротическая трансформация почки, поликистоз;
Острое гнойное воспаление органа и окружающей клетчатки;
Злокачественная опухоль;
Острая инфекционная общая патология (временно);
Туберкулезное поражение почек;
Гнойничковые поражения, экзема в зоне предполагаемой пункции;
Отсутствие продуктивного контакта с пациентом, психические заболевания, кома;
Отказ больного от процедуры.
Лечение острого гломерулонефрита у детей проводится строго в стационаре, под врачебным наблюдением. Тяжелые формы требуют сестринского ухода. Первоначальными мерами должны быть строгий постельный режим, ограничение соли и воды, контроль диуреза и надлежащая диета при гломерулонефрите:
Количество потребляемой жидкости должно планироваться с учетом выделенной накануне. Соль исключена полностью. Питание проводится по диете № 7 по Певзнеру.
Также показаны молочно-растительные диеты, картофельные, рисовые, рисово-овощные и рисово-фруктовые, рецепты и фото которых можно найти на любом форуме. Калорийность питания в связи с постельным режимом может быть невысока.
Исключаются все экстрактивные вещества — бульоны, чаи, кофе, соки, специи. Минеральная вода запрещена любая.
Медикаментозная терапия острого гломерулонефрита у детей предполагает этиотропное лечение, при доказанном стрептококковом агенте — пенициллин и его производные.
Патогенетическое лечение заключается в воздействии на патологический иммунный ответ, это достигается при помощи глюкокортикоидов, в частности преднизолона.
Назначение детям цитостатиков должно производиться только в том случае, если польза от их применения будет значительно превышать их побочные действия и осложнения.
Симптоматическое лечение заключается в устранении проявлений или симптомов заболевания.
Артериальная гипертензия подлежит медикаментозной коррекции при помощи мочегонных препаратов, гипотензивных препаратов из группы ингибиторов ангиотензин превращающего фактора. Также на механизм регуляции давления в почках оказывают влияние препараты из группы блокаторов рецепторов к ангиотензину 2.
Морфологические варианты гломерулонефрита: мезангио-пролиферативный, мезангиокапиллярный, мембранозный, полулунный, фокально-сегментарный, минимальных изменений

При адекватном лечении острый гломерулонефрит у детей в большинстве случаев заканчивается выздоровлением. В 1-2% случаев гломерулонефрит у детей переходит в хроническую форму, в редких случаях возможен летальный исход.
При остром гломерулонефрите у детей возможно развитие серьезных осложнений: острой почечной недостаточности, кровоизлияний в головной мозг, нефротической энцефалопатии, уремии и сердечной недостаточности, представляющих угрозу для жизни. Хронический гломерулонефрит у детей сопровождается сморщиванием почек и снижением почечных функций с развитием ХПН.
Профилактика гломерулонефрита у детей заключается в своевременной диагностике и лечении стрептококковой инфекции, аллергических заболеваний, санации хронических очагов в носоглотке и полости рта.
В течение первой недели после выписки из стационара ребенок должен быть осмотрен участковым педиатром с измерением АД.
Частота осмотров: педиатр 1 раз в 2 нед в течение 3 мес, далее 1 раз в месяц в течение первого года наблюдения, затем 1 раз в 3 мес в течение 3 лет, далее 2 раза в год. Нефролог осматривает ребенка 1 раз в месяц в течение 3 мес, далее 1 раз в 3 мес в течение первого года наблюдения, далее 1 раз в 6 мес в течение 3 лет, далее 1 раз в год. Стоматолог, офтальмолог и ЛОР-врач осматривают ребенка 2 раза в год, другие специалисты по показаниям. Методы обследования: анализы мочи общие, анализы мочи по Нечипоренко (Каковскому-Аддису), измерение АД перед каждым осмотром педиатра. Анализы мочи по Зимницкому 1 раз в 3 мес. Биохимический анализ крови 1 раз в 6 мес (мочевина, креатинин, холестерин, протеинограмма и др.). УЗИ почек, ЭКГ — 2 раза в год. Анализы крови общие, кал на яйца глистов 2 раза в год, другие исследования по показаниям.
22.Вторичный гломерулонефрит у детей (на фоне геморрагического васкулита, системной красной волчанки, болезни тонких базальных мембран) – этиология, основные этапы патогенеза. Основные клинические синдромы. Лабораторные и инструментальные методы диагностики заболеваний. Роль нефробиопсии в диагностике заболеваний. Принципы лечения заболеваний. Особенности динамического наблюдения. Осложнения. Исходы. Прогноз.
Вторичные гломерулонефриты в рамках системной красной волчанки (СКВ) или геморрагического васкулита имеют сходные с ОПСГН проявления. Дифференцировать их позволяют наличие системных проявлений и характерные серологические тесты. В частности, для геморрагического васкулита не характерна гипокомплементемия, а при СКВ наблюдается снижение и С3, и С4, положительные антитела к ДНК, АНФ и др.


Болезнь тонких базальных мембран (БТБМ) (синонимы: семейная доброкачественная гематурия) - генетически детерминированная неиммунная гломерулопатия, связанная с мутацией генов коллагена IV типа COL4A4/COL4A3, проявляющаяся гематурией, в большинстве случаев не имеющая тенденции к прогрессированию, поэтому нередко называемая «семейной доброкачественной гематурией».
Клиника. Основным клиническим проявлением БТБМ является гематурия. Гематурия наблюдается пожизненно, при этом, как правило, не отмечается снижения почечных функций. Однако в некоторых случаях, уже у взрослых, происходит формирование почечной недостаточности, что заставляет относиться с настороженностью к определению «доброкачественная семейная гематурия». БТБМ может быть предрасполагающим фактором к развитию иммунной нефропатии (гломерулонефрита).
Диагностика БТБМ базируется на двух критериях: 1) гематурия в семье; 2) специфические изменения БМ клубочков в биоптате почки.
Волчаночный нефрит — это деструкция гломерулярного аппарата почек вследствие аутоиммунного воспаления при системной красной волчанке. Проявляется отеками, уменьшением диуреза, макрогематурией, повышением АД, нарастающей интоксикацией, которые обычно усугубляют основную симптоматику СКВ, реже являются самостоятельными симптомами волчанки. Диагностируется с помощью общего анализа мочи, определения уровней сывороточного креатинина, аутоантител, волчаночного антикоагулянта, пункционной биопсии почек с гистологическим исследованием биоптата. Для лечения применяют цитостатики, кортикостероиды, ингибиторы рецепторов ангиотензина, проводят ЗПТ, трансплантацию почки.
Исследование крови на антитела. Обнаруживается наличие антинуклеарного фактора, антинуклеарных антител, антител к ds-ДНК, нуклеосомам, гистонам. С1q. При проведении анализа применяют иммунофлуоресцентные и иммуногистохимические методы.
Волчаночный антикоагулянт (LA). Умеренные и высокие показатели теста характерны для сочетания нефрита с антифосфолипидным синдромом. Положительные результаты свидетельствуют о повышенном риске усугубления аутоиммунного воспаления тромботическими процессами.
Пункционная биопсия почек. Гистологическое исследование биоптата позволяет выявить патогномоничные морфологические изменения тканей. Проводится всем больным с подозрением на люпус-нефрит при измененном общем анализе мочи или повышенном сывороточном креатинине.
Хотя развитие почечной патологии в целом ухудшает прогноз СКВ, при своевременной диагностике и адекватной терапии пятилетняя выживаемость наблюдается у 80-85% больных с тяжелыми формами гломерулонефрита и у 95% с процессами средней тяжести. Первичная профилактика волчаночного нефрита заключается в скрининговых обследованиях пациентов из группы риска по СКВ с целью раннего выявления и назначения комплексного лечения основной патологии, что позволяет снизить вероятность развития поражения почек. Для предупреждения прогрессирования уже имеющегося нефрита необходимо проведение длительной поддерживающей терапии.
23.Острая почечная недостаточность, хроническая почечная недостаточность – эпидемиология, этиология, патогенез. Классификация. Стадии. Клиника. Диагностика, дифференциальный диагноз. Лечение. Посиндромная терапия. Принципы диетотерапии. Заместительная почечная терапия у детей: показания, противопоказания. Исходы. Прогноз. Понятие «хроническая болезнь почек (ХБП)». Стадии ХБП. Гемолитико-уремический синдром у детей. Этиология, патогенез. ДВСсиндром как проявление микроангиопатии. Клинические проявления. Диагностика. Лечение, показания к гемодиализу. Осложнения. Прогноз.
ОПН — клинический синдром различной этиологии с внезапной транзиторной или необратимой утратой гомеостатических функций почек, обусловленный гипоксией почечной ткани с последующим преимущественным повреждением канальцев и отеком интерстициальной ткани.
ОПН характеризуется нарушением выделения из организма воды, нарастающей азотемией, электролитным дисбалансом, декомпенсированным метаболическим ацидозом.
Основным клиническим проявлением ОПН является
Однако гомеостатические функции почек могут быть нарушены и при диурезе, равном и более 300 мл/м2 в сутки — неолигурическая ОПН (острый интерстициальный нефрит, поражение аминогликозидами).
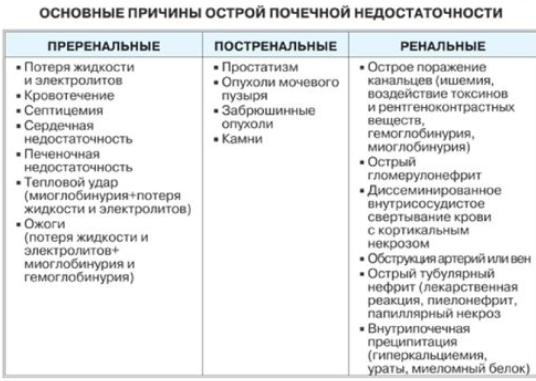
Этиология
Различают преренальную, ренальную и постренальную (обструктивную) ОПН, хотя нередко один и тот же фактор, например, ишемия почки может выступать как преренальная, так и ренальная причина ОПН.
 Патогенез
Патогенез
ОПН и развивается вследствие резкого снижения СКФ (менее 5-10% от нормальной), и кардинальным нарушением при ОПН является дисфункция канальцев. Она есть при любой причине ОПН. При этом чем дольше держится ОПН, тем грубее канальцевые нарушения. Если при ОПН пререналыюго генеза и гиповолемия, и артериальная гипотензия ликвидированы или хорошо корригированы, то при недлительной ОПН функция почки может быстро восстановиться. Если ОПН была длительной, то канальцевые нарушения поддерживают дефект функции почек и после коррекции гиповолемии или гипотензии. Отсюда крайне важна скорость дифференцированной помощи больному с ОПН.
Клиническая картина
Течение ОПН обычно делят на четыре стадии: начальную (предануричес-кую — функциональная почечная недостаточность), олигоанурическую, стадию восстановления диуреза с развитием полиурии и выздоровление



Общим диагностическим алгоритмом при ОПН (острая почечная недостаточность у детей) является:
исключение постренальной природы ОПН;
проведение дифференциальной диагностики преренальной и ренальной ОПН.
Лечение:
1 стадия - аблюдение
2 стадия со стороны врача требует динамического наблюдения за почечными функциями и кровотоком, нормализации ОЦК (объем циркулирующей крови) и сократительной функции миокарда, коррекции доз и кратности введения нефротоксических препаратов при жизненной необходимости их назначения, применения средств, улучшающих внутрипочечную гемодинамику, обеспечения адекватного питания и энергообеспечения, своевременного распознавания ДВС (диссеминированное внутрисосудистое свертывание)-синдрома и его коррекции.
3 стадия - ограничение объема вводимой жидкости (предыдущий диурез + НП из расчета 25– 35 мл/кг · сут), улучшение почечного кровотока, ограничение дозы и кратности нефротоксичных препаратов при жизненной необходимости их использования
4 стадия - требуется поддержание эуволемии, коррекция возможных электролитных нарушений, динамический контроль.
Диспансерное наблюдение
Осуществляют в течение 2 лет: ежемесячные анализы мочи и крови, проба Зимницкого, контроль артериального давления; ежеквартально — биохимический контроль сыворотки крови (мочевина, электролиты, белковые фракции) в первые полгода, далее 1 раз в 6 мес. Выздоровлением считают отсутствие каких-либо отклонений от нормы в течение 2 лет и восстановление концентрационной функции почек. Рентгеноконтрастное обследование воз-можно лишь после выздоровления.
ХРОНИЧЕСКАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ

Хроническая почечная недостаточность (ХПН) — клинический симптомокомплекс, обусловленный уменьшением числа и изменением функции оставшихся действующих нефронов, что приводит к нарушению гомеостатической функции почек, в частности, снижению СКФ более чем на 50%
Патогенез
Прогрессирующее уменьшение массы действующих нефронов приводит к снижению резервных возможностей, прежде всего концентрационной способности почек.
При гибели менее 50% нефронов почечную недостаточность можно выявить лишь при функциональных нагрузках. При склерозе 75-80% нефронов наблюдается потеря способности к гипертрофии со стороны действующих нефронов, которые функционируют по принципу осмотического диуреза: сниясается концентрационная способность, развивается полиурия, повышенное количество электролитов (натрия и калия) теряется с мочой. Эту стадию расценивают как функционально компенсированную ХПН.
При прогрессировании заболевания, приведшего к ХПН и гибели более 90% нефронов, наступает стадия декомпенсации (терминальная), нарушение гомеостаза экстрацеллюлярной жидкости (ЭЦЖ). Возникают гиперазотемия, ацидоз, гипергидратация, электролитные расстройства (гиперкалиемия, приводящая, в частности, к сердечным аритмиям, гипокальциемия, гипонатриемия), олигоанурия.




Диагностика:

1 стадия Компенсированная Консервативное и оперативное лечение основного заболевания
II стадия Субкомпенсированная. На этой стадии процесса консервативные мероприятия направлены на сохранение остаточной функции почек
III стадия Декомпенсированная. Консервативная терапия направлена на коррекцию метаболических нарушений. Пациенты, строго соблюдающие режим консервативной терапии и диету, могут вести обычный образ жизни на фоне остаточной функции почек. Ведется подготовка к терапии диализом
IV стадия Уремия Это симптомокомплекс, ассоциированный с анорексией, тошнотой, слабостью. При отсутствии лечения появляются рвота, судороги, кома и желудочно-кишечные кровотечения. Часто отмечают сердечную недостаточность и аритмии. Симптомы частично или полностью обратимы при использовании строгой консервативной терапии. Остаточная функция почек составляет менее 5%. Консервативную терапию дополняют диализом и/или почечной трансплантацией
Регулярный гемодиализ при ХПН у детей необходимо начинать в стадиях III—IV при уровне креатинина в сыворотке крови более 0,528 ммоль/л и клиренсе эндогенного кретинина менее 10 мл/мин на 1,73 м2.
Гемодиализ проводят 2-3 раза в неделю по 3,5-4 ч. На фоне регулярных гемодиализов строгих ограничений белка в диете не требуется, но необходимо снижение количества жидкости и менее строгое ограничение натрия.
Трансплантация почки должна предусматриваться для больных с ХПН, находящихся на регулярном гемодиализе.
Гемолитико-уремический синдром (ГУС) является одной из ведущих причин развития острой почечной недостаточности (ОПН) у детей. Он характеризуется триадой признаков: Кумбс-негативной гемолитической анемией с наличием фрагментированных эритроцитов (шизоцитов), тромбоцитопенией и ОПН. Указанные признаки являются составляющими тромботической микроангиопатии (ТМА) – распространенной окклюзии сосудов мелкого калибра тромбами, возникшими вследствие повреждения эндотелия. В результате поражения эндотелиальных клеток происходит механическое повреждение эритроцитов, активация агрегации тромбоцитов с образованием тромбов в микроциркуляторном русле, особенно в почках
Д+ (типичный) и не ассоциированный с диареей - Д- (спорадический или атипичный)
У детей частыми причинами гемолитико-уремического синдрома являются острая кишечная инфекция (90%) и инфекции верхних дыхательных путей (10 %).
Основное значение в развитии Д+ гемолитико-уремического синдрома имеет энтерогеморрагическая Е. coli, продуцирующая специфический шига-подобный веротоксин, способный избирательно повреждать эндотелиальные клетки сосудов почек и головного мозга.
Д- гемолитико-уремический синдром может быть постинфекционным, лекарственным, поствакцинальным, наследственным, связанным с системными заболеваниями соединительной ткани, идиопатическим. В 40% случаев развитие Д- гемолитико-уремического синдрома обусловлено респираторной инфекцией, возбудителем которой является S. pneumoniae, разрушающий мембраны эритроцитов, тромбоцитов и эндотелиоцитов с помощью фермента нейраминидазы. Вирусы ветряной оспы, ВИЧ, гриппа, Эпштейна-Барра, Коксаки также могут быть причиной гемолитико-уремического синдрома.
Жалобы: предшествующий эпизод жидкого стула с примесью крови с последующим развитием слабости, анорексии, рвоты, резкой бледности, иногда – с элементами кожных геморрагий, уменьшение объема мочи, симптомы интоксикации, связанные с ОПН, отечность, иногда – макрогематурия.
Для подтверждения типичного ГУС рекомендуется проведение следующих основных исследований [2, 20]:
Общий анализ крови – анемия, тромбоцитопения, обнаружение шизоцитов в мазке;
Биохимический анализ крови – креатинин, мочевина, лактатдегидрогеназа (ЛДГ), билирубин, трансаминазы, электролиты;
Реакция Кумбса (прямая);
С3 и С4 компоненты комплемента для исключения аГУС.
бак посев кала
инструментальные исследования назначаются исходя из клинической симптоматики и необходимости дифференциальной диагностики с тем или иным заболеванием.
Типичный ГУС необходимо дифференцировать со следующими заболеваниями:
Гемолитические анемии;
Быстропрогрессирующий нефрит при системной красной волчанке;
Острый тубулоинтерстициальный нефрит.
Лечение:
обязательное проведение расчета жидкости с ее ограничением при гипергидратации, и, наоборот, с компенсацией потерь со стулом, рвотой и сохраненном диурезе, так как дегидратация может усугубить ишемическое повреждение почек и других органов
диуретики не показаны, лучше гемодиализ
Питание, также как и воду, и электролиты рекомендуется обеспечивать перорально, при необходимости через желудочный зонд
Эритроцитарную массу рекомендовано вводить при уровне гемоглобина ниже 70 г/л
в тяжелых случаях, особенно при поражении ЦНС, рекомендуется проводить заменное переливание плазмы (ЗПП). Целью является удаление факторов свертывания и тромбообразования и замещения с помощью введения свежезамороженной плазмы (СЗП) потенциально полезных веществ, главным образом антитромбинов
Экулизумаб (гуманизированного моноклонального антитела к С5-фракции терминальной стадии каскада комплемента.)
Трнасплантация как вид заметстильной терапии при терминальной ХПН
24.Тубулопатии у детей. Клиническая группировка тубулопатий. Типы наследования. Основные звенья патогенеза. Клиника в зависимости от формы. Ранняя диагностика (биохимические показатели мочи, крови). Значение рентгенографии трубчатых костей. Дифференциальный диагноз. Исходы. Лечение. Прогноз.
Тубулопатии – канальцевые болезни почек, характеризуемые различными нарушениями тубулярного транспорта электролитов, минералов, воды и органических субстанций, наследственного (первичные тубулопатии) или приобретенного характера (вторичные тубулопатии).
По локализации транспортного дефекта различают проксимальные, петлевые и дистальные тубулопатии.
К проксимальным тубулопатиям относят гипофосфатемический рахит проксимальный РТА, синдром Фанкони, ренальную глюкозурию.
К петлевым тубулопатиям относят синдром Барттера (различают неонатальный и классический синдром Барттера).
К дистальным тубулопатиям относят синдром Гительмана, дистальный РТА, псевдогипоальдостеронизм, нефрогенный несахарный диабет, синдром Лиддла.
Гипофосфатемический рахит (фосфат-диабет) – заболевание, связанное с дефектом реабсорбции фосфатов в проксимальных канальцах, проявляющееся у детей фосфатурией, гипофосфатемией и выраженными рахитическими изменениями, резистентными к обычным дозам витамина D.
Фосфат-диабет (витамин D-резистентный рахит) – сборное название ряда генетически обусловленных тубулопатий (патологических нарушений транспорта веществ в канальцах почек), при которых нарушается реабсорбция фосфат-ионов с развитием их дефицита в организме.
На сегодняшний день выявлены семейные формы фосфат-диабета, передача которых является сцепленной с Х-хромосомой (причем как доминантные, так и рецессивные), аутосомно-доминантной и аутосомно-рецессивной. Встречаемость наиболее распространенных разновидностей этого состояния составляет 1:20 000 (Х-сцепленная доминантная форма), другие типы встречаются намного реже.
Клиника:
Проявления фосфат-диабета по причине генетической гетерогенности этого заболевания характеризуется достаточно широким диапазоном выраженности – от практически бессимптомного течения до явных тяжелых нарушений. Некоторые случаи патологии (например, обусловленные мутациями гена FGF23) могут проявляться лишь гипофосфатемией и повышением уровня фосфора в моче, тогда как клинические симптомы отсутствуют. Однако чаще всего фосфат-диабет приводит к картине типичного рахита и в основном развивается в детском возрасте – 1-2 года, вскоре после того, как ребенок начинает ходить.
Одним из первых проявлений фосфат-диабета может быть мышечная гипотония еще в младенческом возрасте, однако она наблюдается далеко не во всех случаях. Наиболее часто развитие заболевания начинается с О-образной деформации ног, что может приводить к нарушению походки. При дальнейшем течении фосфат-диабета могут возникать остальные клинические признаки рахита – задержка роста и физического развития, нарушение формирования зубов (особенно при аутосомно-рецессивной форме заболевания), алопеция. Характерны патологические переломы, появление рахитических «четок», утолщение метафизов костей конечностей. Также при фосфат-диабете может наблюдаться болезненность в спине (как правило, неврологического характера) и костях, в редких случаях из-за болей в ногах ребенок лишается возможности ходить. Нарушений интеллектуального развития при этом заболевании, как правило, не отмечается.
Диагностика: гипофосфатемия (менее 0,8 ммоль/л), фосфатурия. Кальций сыворотки и 25(OH)D3 в норме, уровень 1,25(OH)2D3 низкий или нормальный, уровень паратгормона нормальный или незначительно повышен. Отсутствует метаболический ацидоз. Повышена активность щелочной фосфатазы. Почечные функции остаются сохранными.
Рентгенологически при фосфат-диабете определяются классические признаки рахита – деформации костей голеней, коленных и тазобедренных суставов, наличие остеопороза (в некоторых случаях может возникать локальный остеосклероз) и остеомаляций. Изменена структура костей – кортикальный слой утолщается, трабекулярный рисунок становится более грубым, диафизы расширены. Нередко костный рентгенологический возраст при фосфат-диабете значительно отстает от фактического, что говорит о задержке развития скелета.
Современная генетика позволяет диагностировать практически все типы этого заболевания, как правило, используется метод прямого секвенирования ассоциированных с патологией генов. В некоторых случаях указать на генетическую природу фосфат-диабета может изучение наследственного анамнеза больного.
Лечение фосфат-диабета производят сочетанием витаминотерапии, ортопедических и иногда хирургических методик. Несмотря на другое название этой патологии (витамин D-резистентный рахит), этот витамин активно применяется в терапии данного состояния, но дозировки при этом должны быть значительно повышены. Кроме того, больным фосфат-диабетом назначают препараты кальция и фосфора, витамины А, Е и группы В. Немаловажно, что терапия жирорастворимыми витаминами (особенно D и А) должна осуществляться исключительно под контролем врача и с тщательным соблюдением дозировок для предотвращения нежелательных побочных реакций и осложнений. Для контроля эффективности терапии и правильности назначенной дозы лекарства производят регулярное измерение уровня фосфата и кальция в моче. При особенно тяжелых формах фосфат-диабета применение витамина D может быть показано пожизненно.
Чаще прогноз благоприятный, но может сохраняться пожизненная необходимость использования препаратов витамина D, кальция и фосфора. Выраженные деформации скелета, развившиеся в результате поздней диагностики или неправильного лечения фосфат-диабета, могут ухудшать качество жизни больного. Профилактика этого наследственного заболевания возможна только в виде медико-генетического консультирования родителей перед зачатием ребенка, для некоторых форм разработаны методы пренатальной диагностики.
25.Синдром вегетативной дисфункции (СВД). Этиология, патогенез, классификация. Клиника. Клинические проявления вегетативных кризов. Методы оценки вегетативного гомеостаза у детей: исследование исходного вегетативного тонуса: кардиоинтервало-графия (КИГ); клиноортостатическая проба (КОП). Нарушение ритма сердечной деятельности как проявление синдрома вегетативной дисфункции – клинические проявления, ЭКГ-признаки. Медикаментозные и немедикаментозные методы лечения синдрома вегетативной дисфункции у детей. Неотложная помощь при вегетативных кризах. Профилактика СВД.
Вегето-сосудистая дистония у детей – симптомокомплекс функциональных расстройств со стороны различных систем, обусловленных нарушением регуляции их деятельности вегетативной нервной системой.
Причины формирования вегето-сосудистой дистонии у детей чаще носят наследственный характер и обусловлены отклонениями в структуре и функционировании различных отделов вегетативной нервной системы по материнской линии. Развитию вегето-сосудистой дистонии у ребенка способствует осложненное течение гестации и родов: токсикозы беременной, гипоксия плода, внутриутробные инфекции, стремительные или затяжные роды, родовые травмы, энцефалопатии и пр.
Особая роль в развитии вегето-сосудистой дистонии у детей принадлежит различным психотравмирующим воздействиям – конфликтам в семье и школе, педагогической запущенности ребенка, гиперопеке, хроническим или острым стрессам, повышенным школьным нагрузкам. Предрасполагающими факторами вегето-сосудистой дистонии у детей могут выступать соматические, инфекционные, эндокринные заболевания, нейроинфекции, аллергозы, очаговые инфекции (хронический тонзиллит, кариес, фарингит, синусит), аномалии конституции, анемия, черепно-мозговые травмы.
Вегетативные нарушения сопровождаются разнообразными реакциями симпатической и парасимпатической систем, обусловленными нарушением выработки кортикостероидов, медиаторов (ацетилхолина, норадреналина), биологически активных веществ (простагландинов, полипептидов и др.), нарушением чувствительности сосудистых рецепторов.
Классификация:
По преобладающим этиологическим признакам вегето-сосудистая дистония у детей может иметь психогенную (невротическую), инфекционно-токсическую, дисгормональную, эссенциальную (конституционально-наследственную), смешанную природу.
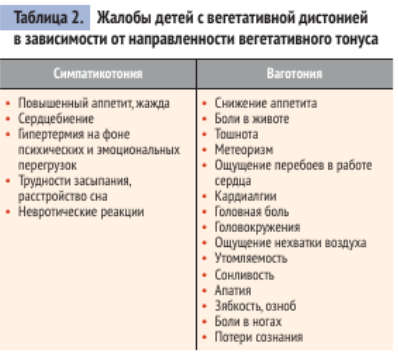
В зависимости от характера вегетативных расстройств различают симпатикотонический, ваготонический и смешанный варианты вегето-сосудистой дистонии у детей.
С учетом распространенности вегетативных реакций вегето-сосудистая дистония у детей может носить генерализованную, системную или локальную форму.
Согласно синдромологическому подходу в течение вегето-сосудистой дистонии у детей различают кардиальный, респираторный, невротический синдромы, синдром нарушения терморегуляции, вегетативно-сосудистые кризы и др.
По степени тяжести вегето-сосудистая дистония у детей может быть легкой, среднетяжелой и тяжелой;
по типу течения – латентной, перманентной и пароксизмальной.






Медикаментозная терапия должна быть индивидуальной, дифференцированной, минимально достаточной. Из лекарственных препаратов в первую очередь следует применять наиболее известные, наиболее «мягкие», щадящие, обладающие наименьшим побочным действием. К таким препаратам можно отмести фитосредства, витамины, препараты калия, магния и кальция.
При симпатикотонии пременяются фитосредства седативного действия (валериана, пустырник, зверобой, мята, персен, новопассит, стрессплант, дормиплант, санасон и др), назначаются витамины А и Е, препараты калия и магния.
При ваготонии используются общетонизирующие препараты типа женьшеня, элеутерококка, лимонника, заманихи и др., назначаются витамины В6 и С, препараты кальция.
Для лечения СВД широко используются нейрометаболические психостимуляторы (ноотропы, церебропротекторы
У детей с симпатикотонией в основном применяются фенибут
У детей с ваготонией назначаются пирацетам
