
- •Детские болезни
- •Сравнительная таблица патологий
- •7. Болезнь Вильсона-Коновалова. Этиология, патогенез, клиника, диагностика, лечение
- •Физикальное обследование
- •Лабораторная диагностика
- •Методы исследования функции внешнего дыхания
- •Патогенез
- •Исходный вегетативный тонус
- •Патогенез
- •Развитие и предполагаемые причины системной красной волчанки
- •Клиническая картина системной красной волчанки
- •Диагностика системной красной волчанки
- •Лечение системной красной волчанки
- •Системная склеродермия
- •Причины системной склеродермии
- •Классификация системной склеродермии
- •Симптомы системной склеродермии
- •Диагностика системной склеродермии
- •Лечение и прогноз системной склеродермии
- •Классификация дерматомиозитов
- •Симптомы дерматомиозита
- •Диагностика дерматомиозита
- •Лечение дерматомиозита
- •Прогноз и профилактика дерматомиозита
Сравнительная таблица патологий
Заболевания |
Признаки |
Гепатит |
Повышение температуры, желтизна кожных покровов оттенка охры. Головная боль, ломота в суставах и мышцах. Слабость, тошнота, рвота. Темная моча, кожный зуд. Болевой синдром. Повышение билирубина, АЛТ, АСТ. |
Холангит |
Лихорадка с ознобом. Тошнота, рвота. Слабость. Кожный зуд, желтуха. Утолщение ногтевых фаланг. Точечная чувствительность в районе желчного пузыря. Повышение билирубина, АЛТ, АСТ, амилазы. Нейтрофилия, лимфоцитоз. |
Застойная печень |
Расширение границ органа. Болевой синдром. Слабость, потеря веса. Тревожность, ухудшение внимания. Отеки нижних конечностей. Желтизна кожных покровов. Одышка и сопровождающий ее кашель. Воспаление лимфоузлов. Повышение билирубина, АЛТ, АСТ. |
Рак печени |
Стремительное развитие. Слабость, потеря веса, изменение стула, диспепсические явления, боли в правом подреберье. Желтуха, сухость кожи и слизистых, зуд. Температура субфебрильная. |
Некроз печени |
Диспепсия, болевой синдром, желтизна кожи и слизистых, лихорадка. Эритема,»сосудистые звездочки», тремор рук. Кал светлый, моча темная. Болевой синдром. Высокий билирубин, АЛТ, АСТ. Снижение альбумина и белка. Моноцитопения, эозинопения. |
Цирроз |
Диспепсия. Желтушность кожи и склер. Снижение веса, увеличение живота. Боли. Эритема, «сосудистые звездочки», изменение формы пальцев и ногтей. Асцит, энцефалопатия. Повышен билирубин. Снижен белок в крови. Нейтрофилия. |
Показаниями к трансплантации: терминальные фазы диффузных болезней печени, фульминантная печеночная недостаточность и новообразования печени.
Показанием к трансплантации печени является необратимая острая или терминальная стадия хронической печеночной недостаточности различной этиологии.


7. Болезнь Вильсона-Коновалова. Этиология, патогенез, клиника, диагностика, лечение
Болезнь Вильсона – Коновалова (синонимы гепатолентикулярная дегенерация, гепатоцеребральная дистрофия) – тяжелое прогрессирующее наследственное заболевание, передающееся по аутосомно-рецессивному типу, в основе которого лежит нарушение экскреции меди из организма, приводящее к избыточному накоплению этого микроэлемента в тканях и сочетанному поражению паренхиматозных органов (прежде всего печени) и головного мозга (подкорковых ядер)
Этиология: Причиной возникновения БВК являются мутации гена ATP7B, который локализован на 13 хромосоме в локусе 13q14.3 и кодирует медьтранспортирующую АТФ-азу Р-типа – ATP7B.
Патогенез:
Основными ферментами, обеспечивающими транспорт меди в организме, являются АТФ-аза 7А и АТФ-аза 7В.
мРНК АТФ-азы 7В обнаружена в гепатоцитах и капиллярах мозга. Этот фермент участвует в выведении меди организма (из крови в желчь) и из головного мозга в кровь. Именно его недостаток вызывает болезнь ВильсонаКоновалова.
Отсутствие АТФ-азы 7В нарушает выделение меди из головного мозга в кровь, из крови в желчь и далее с калом из организма. Ведущим звеном патогенеза является хроническая интоксикация медью. Медь накапливается в печени, селезенке, почках, головном мозге, роговице, хрусталике глаза и других органах. Накопление меди в печени приводит к некрозу гепатоцитов, воспалению, фиброзу, пролиферации желчных протоков и циррозу; в головном мозге – к некрозу нейронов с образованием полостей (кист).
Жалобы: боли в животе различной локализации;
изменение цвета кожи;
носовые кровотечения;
тремор и непроизвольные движения;
слюнотечение, дизартрия, нарушение глотания;
мигренеподобные головные боли;
бессонница;
депрессия;
невротическое поведение;
изменения личности;
психоз.

Лабораторные исследования [1-6]:
общий анализ крови: лейкопения, нормохромная анемия, тромбоцитопения, ретикулоцитоз, ускоренная СОЭ.
общий анализ мочи: при поражении почек можно обнаружить микрогематурию, незначительную протеинурию, гиперкальциурию.
суточная экскреция мочи: гиперкупренилурия, признаки развившейся тубулопатии с признаками: глюкозурией, аминоацидурией, фосфатурией, уратурией, протеинурией.
биохимический анализ крови: снижение церулоплазмина и общей меди, увеличение уровней свободной меди (таблица 1), аминотрасфераз (в 1,5-50 раз); билирубин повышен более чем в 2 раза, преимущественно за счет прямой фракции; уровень щелочной фосфатазы обычно повышен; может быть повышена активность гаммаглютамилтранспептидазы (ГГТП); гипоальбуминемия.
коагулограмма: снижение протромбинового индекса, гипофибриногенемия, снижение тромбинового времени.
пеницилламиновый тест: необходимо исследовать мочу, собранную сразу после приема 500 мг пеницилламина и через 12 часов. У пациентов с болезнью Вильсона-Коновалова суточная экскреция меди будет повышаться до более 1500 мкг/дл/сут (норма <50мкг/сут). У здоровых людей значительного увеличения экскреции меди с мочой не наблюдается.
УЗИ - гепатоспленомегалия+холестаз
Эзофагогастродуоденоскопия: на наличие варикозно расширенных вен пищевода и желудка
Электроэнцефалография – проводится пациентам с тяжелыми нарушениями со стороны ЦНС с эпилептическими приступами, регистрируется эпилептическая активность
МРТ головного мозга: более информативно в диагностике, чем КТ головного мозга. Характерны билатеральные очаги пониженной плотности 3-15 мм в диаметре в области базальных ганглиев (хвостатое ядро, скорлупа и бледный шар), в таламусе, в области зубчатых ядер и коры мозжечка - симптом «морды гигантской панды» [19]. По мере прогрессирования процесса выявляются признаки диффузного атрофического процесса головного мозга с равномерным расширением субарахноидальных пространств и желудочковой системы
Пункционная биопсия печени: 1. для морфологического исследования биоптата печени, где выявляются дистрофические изменения клеток, некрозы, слабую воспалительную инфильтрацию и фиброз различной степени выраженности; 2. Определения концентрации меди в препарате печени - при ГЛД медь находится на уровне 1 000 мкг на 1 г сухого вещества печени.
Лечение:
полупостельный режим – при высокой активности и декомпенсации цирроза
диета, направленная на уменьшение поступления меди в организм - ограничиваются продукты с высоким содержанием меди (печень, креветки, орехи, шоколад, грибы)
Современная патогенетическая терапия ГЛД основана на использовании медьэлиминирующих препаратов [10,11], главным образом Д-пеницилламина, триентина и солей цинка. Д-пеницилламин и триентин – хелатные комплексоны, образующие с медью прочные соединения, которые легко выводятся из организма с мочой. Препаратом выбора при ГЛД является Д-пеницилламин. Лечение начинают с небольшой дозы с постепенным увеличением ее до терапевтической, под контролем выделения меди с мочой. Начальные дозы составляют 250-500 мг/сут с постепенным (каждые 4-7 дней) увеличением дозы на 250 мг до лечебной дозировки 1000-1500 мг/сут, которая дается в 2-4 приема

8. Тромбоцитопении у детей – эпидемиология, этиология, классификация, патогенез. Клиника, диагностика, дифференциальная диагностика геморрагических синдромов. Неотложная помощь при геморрагическом синдроме у детей и подростков. Основные принципы лечения тромбоцитопении у детей. Осложнения. Исходы. Профилактика. Особенности диспансерного наблюдения.

Клиника: геморрагический синдром с петехиально-пятнистым типом кровоточивости в кожу и слизистые.
Носовые, маточные кровотечения + др локализации.
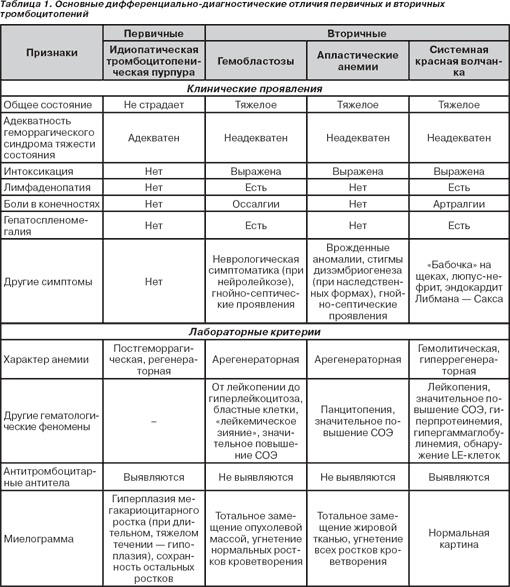
Идиопатическая тромбоцитопеническая пурпура(ИТП) – заб, в основе которого лежит нарушение Тр звена вследствие Тр-пении
По течению: остр(до6 мес)/хроническое
По периоду: обострения/клинической ремиссии/клинико-лабораторной ремиссии
Диагностика: геморрагический синдром, снижение тромбоцитов меньше 30тыс.
Кровотечение по Дьюку больше 4 минут(повышено)
Снижение или отсутствие ретракции кровянного сгустка
Диф. Диагностика с вторичной пурпурой (при гемобластозах, апластической анемии, гиперспленизме)
Лечение: режим постельный
Стол 5
Лечение Тромбоцитопения при отсутствии геморрагического синдрома лечения не требует. При нарастании кожного геморрагического синдрома в процессе наблюдения за больным и/или присоединении кровотечения показана иммуносупрессивная терапия ГК. ГК (преднизолон) как начальная терапия назначается в средней суточной дозе 60 мг/м2 (что соответствует 2 мг/кг в сутки) на 3 недели по 3 раза в день (6, 10, 14) с учетом суточного биоритма — 2/3 суточной дозы ГК даются в утренние часы.
При достижении полной клинико-лабораторной ремиссии доза преднизолона уменьшается по 5-10 мг в 3 дня до полной отмены. Снижение количества тромбоцитов на фоне уменьшения дозы ГК не является показанием к возврату прежней дозы. В случае достижения только клинической ремиссии продолжение терапии ГК в прежней дозе до нормализации количества тромбоцитов нецелесообразно, так как пролонгированное лечение ГК подавляет продукцию тромбоцитов и способствует развитию осложнений.
При неэффективности – цитостатики
В/в Иммуноглобулин G lkz ,kjrfls H”C ctktptyrb
экстренная спленэктомия (по витальным показаниям, прежде всего при внутричерепном кровоизлиянии).
Трансфузии тромбомассы не показаны из-за сенсибилизации и резкого повышения образования антитробоцитарных антител.( однако в тяжелых случаях можно, хватает на 1-2 сут)
Также в период тромбоцитопении с проявлениями геморрагического синдрома резко ограничивается двигательный режим. Проводится симптоматическая терапия:
ангиопротекторы — дицинон per os в/в;
ингибиторы фибринолиза — аминокапроновая кислота 0,2-0,5 г/кг в сутки per os, в/в;
местные способы остановки кровотечений.


Диспансерное наблюдение при острой тромбоцитопенической пурпуре у детей необходимо на протяжении пяти лет. При хронической форме малыша наблюдают, пока он не будет по возрасту переведен во взрослую поликлинику.
Ребенку с тромбоцитопенической пурпурой не дают аспирин и антикоагулянты и/или антиагреганты, запрещено УВЧ, под запретом нитрофураны, УФО.
На протяжении 3-5 лет ребенку нельзя переезжать в страну/регион с другим климатом.
Если геморрагический синдром минимально выражен, а количество тромбоцитов меньше 100 тыс / мкл, то запрещены внутримышечные инъекции детям.
Нужно планово осматривать ребенка, чтобы выявить хронические очаги инфекции, провести их санацию.
Необходима профилактика ОРВИ у детей.
Профилактические прививки больным тромбоцитопенической пурпурой детям проводят только при ремиссии симптомов.
9. Гемофилии у детей – эпидемиология, этиология, классификация, патогенез. Клиника, диагностика, дифференциальная диагностика гемофилий у детей. Основные принципы лечения гемофилий. Неотложная помощь при геморрагическом синдроме у детей и подростков. Осложнения. Исходы. Медико-генетическая консультация. Особенности диспансерного наблюдения.
Гемофилия – это сцепленное с Х-хромосомой врожденное нарушение свёртываемости крови, вызванное недостаточностью или отсутствием фактора свертывания крови VIII (гемофилия А) или фактора IX (гемофилия В).
Распространенность гемофилии в большинстве стран составляет 10-14 больных на 100 000 мужчин. Гемофилия А (ГА) встречается чаще, чем гемофилия В (ГВ), и составляет 80-85%

Клинические проявления ГА и ГВ идентичны. Для клинической картины при гемофилии характерно развитие кровотечений
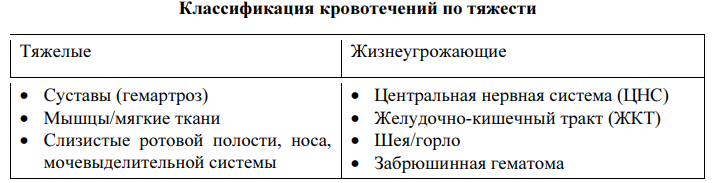
Как правило появляются после 6 мес.
Диагностика гемофилии. Данные семейного анамнеза примерно у 2/3 больных содержат указания на геморрагические проявления у близких родственников по женской линии (у мужчин, реже у женщин).
Физикальное обследование. При тяжёлой и среднетяжелой форме гемофилии выявляется кожный геморрагический синдром различной выраженности в виде множественных экхимозов и гематом. Возможны признаки поражения суставов в виде деформации, отека и локального повышения температуры кожи, позднее – признаки нарушения подвижности суставов, гипотрофия мышц конечности на стороне поражённого сустава, нарушение походки

+скрининг на наличие факторов перед операциями
+пренатальная диагности и определение носителей
Лечение: Частота осмотра пациентов гематологом, ортопедом и стоматологом должна быть не менее 2 раз в год. Остальными специалистами – не менее 1 раза в год.
В основе лечения больных неосложненной формой гемофилии лежит специфическая заместительная терапия концентратами факторов свертывания крови VIII (при гемофилии А) или IX (при гемофилии В).
Препарат вводят с 1-2 лет 2-3 раза в неделю профилактической целью.
Инвалидность с детства, диспансеризация раз в год, б/х крови на печеночные пробы 2раза в год.

10.Геморрагический васкулит – эпидемиология, этиология, классификация, патогенез. Клиника, диагностика, дифференциальная диагностика геморрагического васкулита у детей. Основные принципы лечения геморрагического васкулита. Неотложная помощь при геморрагическом синдроме у детей. Осложнения, исходы, профилактика, особенности диспансерного наблюдения.
Болезнь Шенлейна–Геноха (БШГ) – васкулит, характеризующийся нетромбоцитопенической пурпурой с преимущественной локализацией на нижних конечностях и отложением IgA-депозитов в мелких сосудах (капилляры, венулы, артериолы). Типично вовлечение кожи, кишечника и клубочков почек; нередко сочетается с артралгиями или артритом.
Причины возникновения болезни остаются невыясненными. Болезнь Шенлейна–Геноха – это гиперергическая сосудистая реакция на различные факторы, чаще – инфекционные (стрептококк и другие бактерии, вирусы). В ряде случаев развитию болезни предшествуют вакцинация, воздействие пищевых и лекарственных аллергенов, укус насекомого, травма, охлаждение и т.д
В основе патогенеза БШГ лежит генерализованное иммунокомплексное повреждение сосудов микроциркуляторного русла с отложением гранулярных IgA-депозитов и последующей активацией системы комплемента, гемостаза. В результате ухудшаются реологические свойства крови, усиливается агрегация тромбоцитов и эритроцитов, развивается гиперкоагуляция. В сосудистой стенке возникают асептическое воспаление, деструкция, 7 тромбоз микрососудов, разрыв капилляров, что сопровождается геморрагическим синдромом
Рабочая классификация, принятая в РФ (А.А. Ильин, 1984), включает следующие параметры:
фазы болезни (активная, стихания);
клинические формы (простая, смешанная, смешанная с поражением почек);
клинические синдромы (кожный, суставной, абдоминальный, почечный);
степень тяжести (легкая, среднетяжелая, тяжелая);
характер течения (острое, хроническое, рецидивирующее).
КЛИНИЧЕСКАЯ КАРТИНА
Начало острое. Температура тела субфебрильная, реже – фебрильная.
Поражение кожи Сыпь возникает у 100% больных, обычно – в начале болезни, реже – вслед за абдоминальным или суставным синдромом. Обильная (в тяжелых случаях – сливная) сыпь локализуется преимущественно на коже нижних конечностей, ягодицах, вокруг крупных суставов, реже – на коже верхних конечностей, туловища, лица. По характеру сыпь мелкопятнистая или пятнисто-папулезная, геморрагическая, симметричная, как правило, сочетается с ангионевротическими отеками. Геморрагические элементы появляются волнообразно, оставляют после себя пигментацию, проходят бесследно.
Поражение суставов Наблюдается у 60–80% больных. Проявляется артралгиями, обратимым артритом преимущественно крупных суставов (коленных, голеностопных). Отмечаются болезненность, отек суставов и нарушение функции. Сохраняется от нескольких часов до нескольких дней.
Поражение ЖКТ Обусловлено отеком и геморрагиями в стенку кишки, брыжейку или брюшину. Боли в животе могут предшествовать кожному синдрому на 1-14 дней у 43% пациентов. Проявляется умеренными или сильными схваткообразными болями в животе. Болевые приступы могут повторяться многократно в течение дня и сопровождаться тошнотой, рвотой, жидким стулом с примесью крови. Могут развиться 8 аппендицит, холецистит, панкреатит, желудочно-кишечное кровотечение, язвы, инфаркты кишки, перфорация.
Поражение почек. В большинстве случаев протекает бессимптомно, что является основанием для проведения обследования в течение 6 месяцев после последнего эпизода кожного синдрома или других проявлений БШГ. Микрогематурия без протеинурии, как правило, протекает доброкачественно. Нарастающая протеинурия, развитие нефротического синдрома и/или почечной недостаточности отражают тяжелое течение заболевания. У 20% пациентов с нефротическим и нефритическим синдромом развивается терминальная почечная недостаточность; у 44-50% – артериальная гипертензия или хроническая почечная болезнь. Гистологически нефрит идентичен IgA-нефропатии и включает фокальный сегментарный пролиферативный гломерулонефрит и быстро прогрессирующий серповидный гломерулонефрит.
Течение БШГ чаще острое, с выздоровлением в течение 2 месяца от начала болезни, но может быть затяжным, рецидивирующим на протяжении 6 месяцев; редко длится в течение 1 года и более. Хроническое течение свойственно вариантам с нефритом Шенлейна–Геноха или с изолированным непрерывно рецидивирующим кожным геморрагическим синдромом.
Осложнения
Инвагинация
Кишечная непроходимость
Перфорация кишечника с развитием перитонита
При нефрите: острая почечная недостаточность или ХПН
ДИАГНОСТИКА
Лабораторные исследования
Клинический анализ крови: умеренный лейкоцитоз с нейтрофилезом, эозинофилией, тромбоцитоз.
Биохимические и иммунологические исследования крови: повышение концентрации СРБ, IgА. 9
Клинический анализ мочи: при наличии нефрита – транзиторные изменения мочевого осадка (микро– или макрогематурией, протеинурией).
Биопсия кожи: фибриноидный некроз сосудистой стенки и периваскулярная инфильтрация нейтрофилами с их распадом и образованием лейкоцитарного детрита. Фиксация в сосудистой стенке IgA-содержащих иммунных комплексов, обнаруживаемых при иммуногистохимическом исследовании. Проводится в сложных диагностических случаях.
Биопсия почек: мезангиопролиферативный гломерулонефрит, нефрит с различной интенсивностью формирования «полулуний». Иммуногистохимическое исследование выявляет гранулярные депозиты IgA, реже – IgG, С3-компонента комплемента, фибрина.

Дифференциальный диагноз необходимо проводить со следующими заболеваниями: менингококкцемия, тромбоцитопеническая пурпура, лимфопролиферативные заболевания, лейкоз, опухоли, системная красная волчанка, неспецифический язвенный колит, болезнь Крона, хронический гепатит с внекишечными проявлениями, острый или хронический гломерулонефрит, IgA-нефропатия
ЛЕЧЕНИЕ Немедикаментозное лечение
Режим. В периоды обострения заболевания следует ограничивать двигательный режим ребенка. Исключить психоэмоциональные нагрузки, пребывание на солнце.
Диета. Неспецифическая гипоаллергенная диета. У больных с синдромом Кушинга целесообразно ограничение потребления углеводов и жиров, предпочтительна белковая диета. Употребление продуктов с повышенным содержанием кальция и витамина D для профилактики остеопороза.
Лечебная физкультура. Лечебную физкультуру проводить в соответствии с индивидуальными возможностями больного.
Медикаментозное лечение
Антикоагулянты прямого действия и антиагреганты. Применяют нефракционированный гепарин (D) в дозе 100–250 ЕД/кг/сут под контролем АЧТВ. Дипиридамол (D) в дозе 5 мг/кг/сут, разделенной на 2–3 приема в течение 4–8 нед с постепенной отменой.
Глюкокортикостероиды. Применяют при тяжелом течении заболевания с поражением ЖКТ и кровотечением. Назначают преднизолон (A) per os в дозе 0,7–1,5 мг/кг/сут в течение 45–60 дней с последующим снижением дозы до поддерживающей – 0,2−0,3 мг/кг/сут.


Профилактика:
Первичная не разработана
Вторичная – диспансерное наблюдение, длительная поддерживающая терапия, ограничение псих нагрузок и физических, предохранение от инсоляций, исключение УФО.
ИСХОДЫ И ПРОГНОЗ Выздоровление у 60–65% больных наступает через 2–6 мес; возможно хроническое течение. В случае развития гломерулонефрита ребенок нуждается в наблюдении у нефролога, так как исходом может быть ХПН.
11.Дефицитные анемии у детей (железодефицитная, В-12-дефицитная, фолиеводефицитная). Эпидемиология, этиология, классификация анемий у детей и подростков. Патогенез анемического синдрома. Клиника, лабораторно-инструментальная диагностика. Дифференциальная диагностика дефицитных анемий. Неотложная помощь при анемическом синдроме у детей и подростков. Основные принципы лечения дефицитных анемий. Осложнения. Исходы. Профилактика. Особенности диспансерного наблюдения.
Анемия – патологическое состояние, сопров снижением Нв. (Легкая ст – 90-110г/л, сред ст тяж – 70-90г/л, тяж – менее 70)
Классификация анемий:
Вследствие острой кровопотери
Вследствии дефицитного эритропоэза (железодефицитные, фолиево и в12 дефицитные, белководефицитные) • Гемолитические анемии
Апластические анемии
Дефицитные анемии — группа анемий, происхождение которых связано с дефицитом железа, витаминов, микроэлементов или белка в процессе развития ребенка.
Эти анемии сопровождаются задержкой физического и нервнопсихического развития детей уже на ранних этапах формирования, нарушением становления иммунной системы и других систем и органов растущего ребенка.
Классификация.
Анемии делятся на:
а) дефицитные (железо-, витамино-, микроэлемент-, протеинодефицитные);
б) апластические (наследственные и приобретенные);
в) гемолитические (наследственные и приобретенные);
г) постгеморрагические (острые и хронические);
д) анемии при различных заболеваниях.
По степени тяжести анемии делятся на следующие группы:
а) легкая (гемоглобин снижен до 90 г/л, эритроциты — до 3 ´ 1012/л);
б) средняя (гемоглобин 89–70 г/л, эритроциты снижены до 2,5– 3 ´ 1012/л);
в) тяжелая (гемоглобин менее 70 г/л, эритроциты менее 2,5 ´ 1012/л).
По диаметру эритроцитов (в микронах) анемии делятся на нормоцитарные (7–8 микрон), микроцитарные (менее 7 микрон) и макроцитарные (9–10 микрон).
По цветовому показателю (ЦП) — степени насыщения эритроцитов гемоглобином — гипохромные (ЦП менее 0,85 и МСНС ниже 33 г/ %), нормохромные (ЦП 0,9–1,1 и МСНС 32–36 г/ %) и гиперхромные (ЦП более 1,1 и МСНС более 36 г/ %).
По регенераторной способности костного мозга анемии делятся на регенераторные (число ретикулоцитов — 15–50 ‰, ретикулоцитарный индекс (РИ) более 1, но менее 2), гипорегенераторные (число ретикулоцитов менее 5 ‰, РИ 1 и менее) и гиперрегенераторные (число ретикулоцитов более 50 ‰, РИ более 2).
ЖДА – приобретенное заболевание из группы дефицитных анемий, возникает при дефиците железа, сопровождающееся микроцитарной, гипохромной, норморегенераторной анемией, клиническими проявлениями которой являются сочетание сидеропенического и анемического синдромов
Для сидеропенического синдрома характерны следующие симптомы:
изменения кожи: сухость, появление маленьких пигментных пятен цвета «кофе с молоком»;
изменения слизистых оболочек: «заеды» в углу рта, глоссит, атрофический гастрит и эзофагит;
диспептические явления со стороны ЖКТ;
изменения волос
– раздваивание кончика, ломкость и выпадение вплоть до гнездной алопеции; 3
изменения ногтей
– поперечная исчерченность ногтей больших пальцев рук (в тяжелых случаях и ног), ломкость, расслаивание на пластинки;
изменение обоняния
– пристрастие больного к резким запахам лака, краски ацетона, выхлопных газов автомобиля, концентрированных духов;
изменения вкуса
– пристрастие больного к глине, мелу, сырому мясу, тесту, пельменям и др.;
боли в икроножных мышцах.
Для анемического синдрома характерны следующие симптомы:
снижение аппетита;
шум в ушах; мелькание мушек перед глазами;
плохая переносимость физических нагрузок;
слабость, вялость, головокружение, раздражительность;
обмороки;
одышка;
снижение работоспособности;
снижение когнитивных функций;
снижение качества жизни;
бледность кожи и видимых слизистых оболочек;
изменение тонуса мышц в виде тенденции к гипотонии, гипотония мышц мочевого пузыря с развитием недержания мочи;
расширение границ сердца;
приглушенность сердечных тонов;
тахикардия;
систолический шум на верхушке сердца
ОАК, выполненный на автоматическом анализаторе клеток крови - снижаются средний объем эритроцита – MCV (менее 80 фл), среднее содержание Hb в эритроците – MCН (менее 26 пг), средняя концентрация Hb в эритроците – МСНС (менее 320 г/л), повышается степень анизоцитоза эритроцитов – RDW (более 14%).
Биохимический анализ крови - снижение концентрации сывороточного железа (менее 12,5 мкмоль/л), повышение общей железосвязывающей способности сыворотки (более 69 мкмоль/л), снижение коэффициента насыщения 4 трансферрина железом (менее 17%), снижение сывороточного ферритина (менее 30 нг/мл).
Немедикаментозное лечение
Устранение этиологических факторов;
Рациональное лечебное питание (для новорожденных – грудное естественное вскармливание, а при отсутствии молока у матери – адаптированные молочные смеси, обогащенные железом. Своевременное введение прикорма, мяса, субпродуктов, гречневой и овсяной круп, фруктовых и овощных пюре, твердых сортов сыра; уменьшение приема фосфатов, танина, кальция, которые ухудшают всасывание железа).
Препараты железа (феррумлек, мальтофер 5 мг/кг/сут-4-8недель)
Переливание Ер массы при гемоглобине ниже 60г/л
Первичной профилактикой дефицита железа является правильное, полноценное питание.
Вторичная профилактика дефицита железа – это активное выявление ЛДЖ и ДЖА в процессе диспансеризации, медицинских осмотров, при посещении врача.
Прогноз заболевания благоприятный, излечение должно наступать в 100% случаев.
Основные причины развития витамин-В12-дефицитной анемии:
Снижение поступления витамина В12 с питанием (у грудных детей, чьи матери имеют дефицит витамина В12, строгая вегетарианская диета)
Снижение всасывания (дефицит внутреннего фактора Кастла, резекция желудка, нарушение всасывания в подвздошной кишке вследствие болезней тонкого кишечника, резекции кишечника)
Повышенные потери в кишечнике (глистная инвазия, синдром слепой кишки)
Нарушение транспорта витамина В12 из кишечника в ткани (наследственный дефицит транскобаламина)
Синдром Иммерслунд-Гресбек – сочетание протеинурии с нарушением всасывания комплекса витамина В12 и внутреннего фактора в тонком кишечнике, редкое заболевание
Для клиники дефицита витамина В12 характерна триада: - поражение крови; - поражение ЖКТ; - поражение нервной системы.
Анемия появляется слабостью, быстрой утомляемостью, одышкой, сердцебиением. В результате повышенного разрушения эритроидных клеток (неэффективный эритропоэз) развивается умеренная желтуха за счет непрямого билирубина.
Поражение ЖКТ проявляется анорексией, глосситом, "лакированным" языком. Выявляется снижение желудочной секреции, атрофический гастрит.
В результате поражения периферической нервной системы (фуникулярный миелоз) появляются атаксия, парестезии, гипорефлексия, рефлекс Бабинского, в тяжелых случаях – клонус и кома. У детей раннего возраста развиваются гипотрофия, отставание в росте, раздражительность, хроническая диарея, склонность к инфекциям.
Лабораторная диагностика
Для витамин В12 дефицитной анемии характерны:
-гиперхромия, макроцитоз;
-гиперсегментация нейтрофилов;
-низкий уровень ретикулоцитов;
-высокий уровень сывороточного железа;
-высокий уровень ферритина;
-умеренное повышение непрямого билирубина;
-нормальный уровень фолата в сыворотке крови (более 3 нг/мл);
-нормальный уровень фолата в эритроцитах;
-низкий уровень витамина В12 в крови (менее 100 пг/мл);
-картина мегалобластического кроветворения в костном мозге.
Показания к лечению в стационаре: анемия тяжелой степени. В остальных случаях лечение проводится в амбулаторных условиях.
Рекомендовано проведение заместительной терапии витамина В12.
Витамин В12(Цианокобаламин) назначается в дозе 5 мкг/кг в день детям в возрасте до одного года, 100—200 мкг в день детям после года, 200—400 мкг в день подросткам. Курс лечения составляет 4 недели. Поддерживающая терапия: еженедельное введение препарата в той же дозе в течение 2 мес, затем последующие 6 мес препарат вводится 2 раза в месяц.
Первичная профилактика заключается в рациональном питании, своевременной диагностике и лечении глистных инвазий, назначении витамина В12 при состояниях, ведущих к развитию его дефицита (например, после резекции кишечника, субтотальной резекции желудка).
В этиологии фолиеводефицитной анемии играют роль следующие факторы:
Недостаточное поступление с питанием (вскармливание козьим молоком);
Нарушение всасывания в кишечнике (энтерит);
Повышенная потребность (недоношеность; малый вес при рождении; гемолитическая анемия, гипертиреоз, инфекционно-воспалительные заболевания);
Использование медикаментов – антагонистов фолиевой кислоты (препараты для лечения эпилепсии, метотрексат);
Повышенное выведение (гемодиализ).
Клиническая картина складывается из симптомов, характерных для анемии: слабости, головокружения, одышки сердцебиения при физической нагрузке, повышенной утомляемости, нарушения успеваемости в школе. Общие признаки, являющиеся следствием гипоксии тканей: бледность, тахикардия, одышка, плохой аппетит, вялость или повышенная возбудимость. Кроме того могут наблюдаться ангулярный стоматит, глоссит. Пациенты могут жаловаться на анорексию, тошноту, рвоту, боли в животе и диарею.
Фолиеводефицитная анемия крайне редко наблюдается в чистом виде. Как правило, дефицит фолиевой кислоты сочетается с дефицитом железа, так как эти состояния развиваются вследствие действия единых этиопатогенетических факторов. При этом и клинические проявления и лабораторные характеристики анемии зависят от соотношения выраженности дефицита железа и фолата
