
NEONATOL_KTOPROCHITALTOTLOH-1
.pdf
Сепсис — генерализованная ациклическая гнойно-воспалительная инфекция, вызванная условно-патогенной бактериальной микрофлорой, в основе развития которой лежит дисфункция иммунной, преимущественно фагоцитарной, системы организма с развитием неадекватного системного воспалительного ответа.
На условно-патогенную (часто госпитальную) инфекцию, приводящую к генерализованному повреждению эндотелия сосудистого русла, стойким нарушениям микроциркуляции, расстройствам гемостаза с обязательным компенсированным или декомпенсированным ДВС-синдромом и дальнейшей полиорганной недостаточностью.
КЛАССИФИКАЦИЯ
Единой классификации сепсиса новорожденного в настоящее временя у нас в стране нет. Выделяют ранний сепсис, при котором клинические симптомы появляются в первые трое суток жизни ребенка, и поздний сепсис новорожденных — сепсис, который манифестирует клинически позднее 4-го дня жизни.
Ранний сепсис: типично внутриутробное, преимущественно антенатальное, инфицирование восходящим или гематогенным путем. Реже инфицирование при родах или в раннем постнатальном периоде. Очевидный первичный очаг инфекции у ребенка, как правило, отсутствует. Источник инфекции –микрофлора родовых путей матери.
Факторы риска развития раннего неонатального сепсиса:
*недоношенность, внутриутробная гипотрофия и задержка внутриутробного развития,
*преждевременный разрыв околоплодных оболочек, длительность безводного промежутка более 12 ч,
*повышение температуры тела и наличие очагов инфекции у матери при родах и в раннем послеродовом периоде, хорионамнионит, осложнѐнное течение перинатального периода (перинатальная гипоксия, родовая травма). Заболевание обычно протекает в виде септицемии (присутствие микробов или их токсинов в кровеносном русле). Характерно фульминантное развитие клинических симптомов, системной воспалительной реакции и полиорганной недостаточности при отсутствии метастатических гнойных очагов.
Поздний сепсис: инфицирование постнатально. Первичный очаг инфекции присутствует. Чаше септикопиемия (с образованием одного или нескольких септикопиемических, метастатических гнойно-воспалительных очагов). Типичное проявление септикопиемии и ее критерий — однотипность возбудителя, выделяемого из очагов воспаления и из крови больного. Источник инфекции: микрофлора матери, микрофлора окружающей среды.
Факторы риска позднего неонатального сепсиса:
* недоношенность, гипотрофия, нарушение естественных защитных барьеров кожи и слизистых оболочек при проведении реанимационных мероприятий, интубации трахеи, катетеризации вен, неблагоприятная эпидемиологическая обстановка.
Заболевание может характеризоваться как гиперергическим, фульминантным течением, так и медленно прогрессирующим развитием клинических симптомов, гипореактивным характером.
Сепсис также классифицируют по этиологическому принципу и входным воротам инфекции. Этиологию заболевания определяют по результатам микробиологического исследования крови, СМЖ, аспирата из трахеи, мочи, содержимого гнойновоспалительных очагов у больного ребенка. При отрицательных результатах посевов крови спектр наиболее вероятных возбудителей заболевания следует прогнозировать на основании данных анамнеза, динамики клинического состояния больного на фоне предшествующего курса антибиотиков, эпидемиологической ситуации в отделении.
При сепсисе целесообразно указывать в клиническом диагнозе этиологию и локализацию входных ворот инфекции - для разработки противоэпидемических и профилактических мероприятий. Выделяют пупочный, кожный, отогенный, урогенный,

катетеризационный, легочный, абдоминальный и другие, реже встречающиеся виды позднего сепсиса новорожденных.
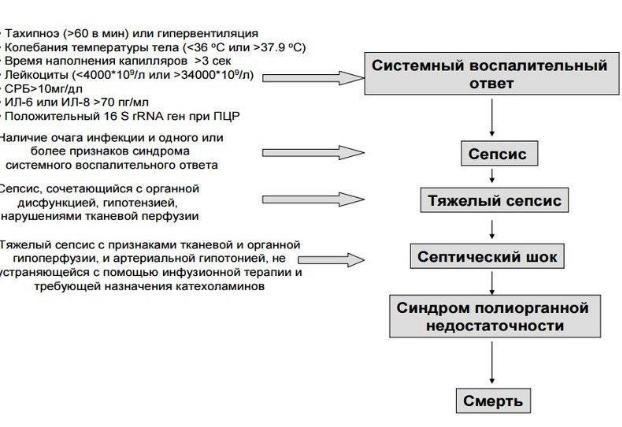
Септический шок-развитие в условиях сепсиса прогрессирующей артериальной гипотонии, не связанной с гиповолемией, не устраняемой введением симпатомиметиков.
ЭТИОЛОГИЯ. Зависит от времени инфицирования плода или ребенка (антенатальное, интранатальное или постнатальное) и локализацией входных ворот.
*Е. coli и реже другие представители кишечной Гр «-» микрофлоры –интранальный; клиническая манифестация - в первые 48-72 ч жизни ребенка.
*При позднем сепсисе новорожденных - стрептококки гр. В, но значительно большее число случаев заболевания приходится на долю Е. coli, St. aureus, Klebsiella pneumoniae, Pseudomonas spp. и Enterobacter spp.
В структуре грамотрицательных возбудителей сепсиса возросла роль таких микроорганизмов, как Pseudomonas spp., Klebsiella spp. и Enterobacter spp. Как правило, эти бактерии выступают в роли возбудителя сепсиса у пациентов ОРИТН, находящихся на ИВЛ и ПП, у хирургических больных.
По локализации первичного септического очага:
*пупочный сепсис- ведущая роль стафилококки и в меньшей степени -кишечная палочка,
*кожный сепсис — стафилококки и (β-гемолитические стрептококки группы А). *при катетеризационном сепсисе преобладающую роль играют метициллин-
резистентные стафилококки или смешанная микрофлора, обусловленная ассоциацией стафилококков или грамотрицательной микрофлоры с грибами рода Candida;
*при абдоминальном госпитальном сепсисе актуальны энтеробактер, анаэробы. Пусковой момент — первичный гнойный очаг, он в силу изначальной
несостоятельности противоинфекционной защиты и массивности микробного обсеменения приводит к проникновению микроорганизмов в системный кровоток больного и развитию бактериемии.
Бактериемия+ антигенемия +токсемия - факторы, запускающие ряд каскадных защитных реакций организма. Поглощение (фагоцитоз) бактерий и продуктов их распада активированными клетками моноцитарно-макрофагальной природы, процессы распознавания и представления Аг макрофагами лимфоцитам сопровождаются избыточным выбросом в системный кровоток провоспалительных цитокинов (ИЛ-1, ФНО- α, ИЛ-8, интерферон-γ, гранулоцитарно-макрофагальный колониестимулирующий фактор). Взаимодействуя со специфическими рецепторами к цитокинам на мембранах различных клеток организма, высокие концентрации провоспалительных цитокинов приводят к развитию симптомокомплекса СВР. +они способствуют активации центра терморегуляции и возникновению лихорадки, изменяют белковосинтезирующую функцию печени, подавляют синтез альбумина и индуцируют выработку гепатоцитами белков острой фазы воспаления (С-реактивного белка, гаптоглобина), усиление катаболической направленности обмена веществ и кахексия.
Высокие концентрации хемокинов (ИЛ-8) → усиление костномозгового кроветворения, гранулоцитопоэза, выброс юных форм нейтрофилов из костного мозга в кровь, усиление направленного движения нейтрофилов к очагу инфекции (хемотаксиса). Нейтрофилы способны быстро менять свой метаболизм в ответ на любое стимулирующее воздействие, вплоть до развития в процессе фагоцитоза «респираторного взрыва» и генерации токсических радикалов кислорода, а также секреторной дегрануляции, при которой высвобождаются ферменты, обладающие бактерицидной активностью. Передвигаясь к очагам инфекции, нейтрофилы контактируют с молекулами адгезии на поверхности клеток эндотелия сосудов, фибробластов, клеток других тканей и органов. В результате адгезии изменяется чувствительность рецепторов самих нейтрофилов к цитокинам и другим медиаторам, что позволяет гранулоцитам адекватно реагировать на изменения в тканях.
Содержимое нейтрофильных гранул индуцирует агрегацию тромбоцитов, выход гистамина, серотонина, протеаз, производных арахидоновой кислоты, факторов, активирующих свертывание крови, систему комплемента, кинин-каллекреиновую систему.
СВР- общебиологическая неспецифическая реакция организма человека в ответ на действие повреждающего эндогенного или экзогенного фактора.
При сепсисе СВР развивается при наличии первичного гнойно-воспалительного очага. Развитие СВР способствует индуцированному апоптозу и в некоторых случаях некрозу клеток, что и определяет ее повреждающее действие на организм. Доминирование деструктивных эффектов литокинов и других медиаторов воспаления приводит к нарушению проницаемости и функции эндотелия капилляров, нарушению микроциркуляции, запуску ДВС-синдрома.
*Избыточная активация гипоталамо-гипофизарно-надпочечниковой системы при септическом шоке и молниеносном течении сепсиса способствует появлению неадекватной реакции на выброс АКТГ.
*Неуправляемая активация свертывающей системы крови, которая в условиях нарастающей депрессии фибринолиза неизбежно приводит к развитию тромбоцитопении и коагулопатии потребления (ДВС-синдрома).
* Системный воспалительный ответ — основа нарушения функции всех органов и систем, приводит к формированию ПОН (проявляется выраженными расстройствами гомеостаза)
Эндотоксин МО повышает интенсивность СВО, приводит к развитию нечувствительной к терапии артериальной гипотонии.
Продолжающееся поступление в кровоток бактерий и их Аг приводит к дезорганизации СВО. Антигенная перегрузка - причина выраженного истощения защитных механизмов, иммуносупрессии, которая в условиях бактериемии и нарушения микроциркуляции способствует формированию вторичных, метастатических гнойных очагов, поддерживающих системную воспалительную реакцию, бактериемию, токсемию и антигенемию.

44.Клиническая картина неонатального сепсиса (понятие о полиорганной недостаточности и септическом шоке), особенности врожденной и нозокомиальной форм.

45.Современные методы диагностики и лечения неонатального сепсиса.


46.Причины и факторы риска наследственных и врожденных заболеваний. Понятие об эмбрио- и фетопатиях.
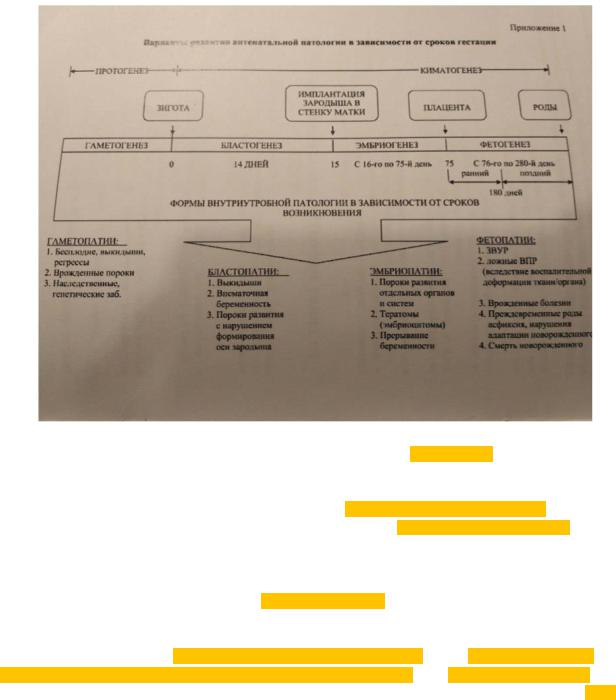
Эмбриопатии — повреждение зародыша с момента прикрепления его к стенке матки до формирования плаценты (15–75-й день, или 2–12-я неделя внутриутробного развития). К последствиям эмбриопатий относят пороки развития отдельных органов и систем, тератомы, диабетические, алкогольные, медикаментозные и многие другие пороки.
Фетопатии — болезни плода, возникающие с 12-й недели до начала родов. Важная роль в формировании фетопатий принадлежит состоянию плацентарного комплекса.
ВПР — это результат отклонения от нормального развития особи.
Патогенные факторы, приводящие к формированию пороков развития, а также способствующие их возникновению, подразделяются на эндогенные (наследственные) и экзогенные. К эндогенным факторам относятся мутации.
Экзогенные факторы способны вызывать как развитие повреждений без изменения структуры наследственного материала, так и мутации. Выделяют экзогенные повреждающие факторы физической (ионизирующее излучение) или химической природы (этанол, фармакологические, токсические вещества, гормоны), инфекционные агенты (вирусы, бактерии, простейшие, грибы), тяжелые заболевания матери (тиреотоксикоз, сахарный диабет).
Периоды наибольшей чувствительности зародыша к действию повреждающих факторов называют критическими периодами киматогенеза.
Вонтогенезе человека можно выделить два критических периода развития: первый связан с процессом имплантации бластулы в эндометрий и соответствует примерно 14-му дню гестации; второй ассоциирован с началом формирования плаценты (плацентации) и соответствует 3–6-й неделе беременности.
Вотечественной патологической анатомии принято выделять три закономерности патогенеза киматопатий (Т. Е. Ивановская).
Первая закономерность — дизонтогенез (нарушение развития организма) представляет собой сочетание альтеративных и реактивных процессов (воспаление, иммунный ответ, регенерация). На ранних этапах внутриутробного развития реактивные процессы развиты слабо, что связано с незрелостью тканей плода, поэтому доминирующими являются альтеративные (дистрофические, некротические) изменения.
Вторая закономерность — на поздних стадиях пренатального онтогенеза пороки развития каких-либо органов сочетаются с тканевыми пороками в других органах, а также с различными типовыми изменениями (альтеративные процессы, нарушения кровообращения).
Третья закономерность — характер киматопатий зависит прежде всего от того, в какой период антенатального развития происходит воздействие патогенного фактора. Так, эмбриопатия практически всегда сопровождается формированием порока развития органа, в то время как фетопатии характеризуются, прежде всего, возникновением тканевых пороков.
Например, в период бластогенеза зародыш на любое воздействие отвечает нарушением или имплантации, или развития эмбрио- и трофобласта в бластоцисте. В период эмбриогенеза почти всегда любое повреждение приводит к формированию того или иного врожденного порока или к гибели эмбриона.
Ряд тератогенных факторов (например, препараты талидомид и диэтилстильбэстрол) обладает «тропизмом» к конкретным тканевым зачаткам и вызывает определенные виды пороков. Вместе с тем один и тот же тератогенный фактор может вызывать различные пороки развития, действуя в разные сроки эмбриогенеза. Но и разные тератогенные факторы приведут к одному и тому же пороку развития в зависимости от времени их воздействия на эмбрион.
Для каждого органа существует определенный отрезок времени, в течение которого при воздействии тератогенного фактора возникает порок развития этого органа. Этот отрезок времени называется тератогенным терминационным периодом, т. е. это предельный срок, в течение которого тератогенный фактор может вызывать ВПР.
47.Врожденные заболевания, диагностируемые с помощью неонатального скрининга. Клиническая картина, диагностика, принципы лечения врожденного гипотиреоза.
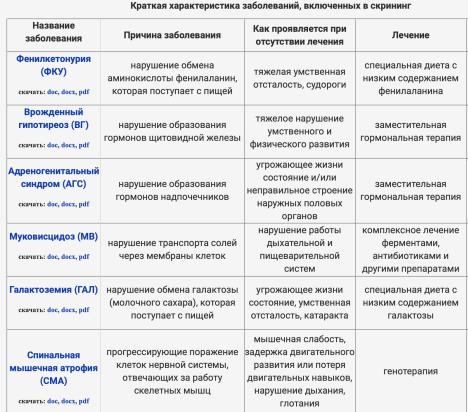
В настоящее время проводится скрининг на 36 заболеваний: ФКУ, врожденный гипотиреоз, адреногенитальный синдром, муковисцидоз, галактоземию, СМА, ПИДы и группа наследственных болезней обмена веществ.
Врожденный гипотиреоз - врожденное заболевание ЩЖ у детей, в основе него полная или частичная недостаточность тиреоидных гормонов - задержка развития всех органов и систем. Частота 1:3000—4000 новорожденных в Европе и Северной Америке. У девочек заболевание встречается в 2—2,5 раза чаще, чем у мальчиков.
ЗГТ – л-тироксин.
48.Врожденные заболевания, диагностируемые с помощью неонатального скрининга. Клиническая картина, диагностика, принципы лечения фенилкетонурии.
В настоящее время проводится скрининг на 36 заболеваний: ФКУ, врожденный гипотиреоз, адреногенитальный синдром, муковисцидоз, галактоземию, СМА, ПИДы и группа наследственных болезней обмена веществ.
Фенилкетонурия (ФКУ) – группа аутосомнорецессивных заболеваний, обусловленных нарушением обмена незаменимой аминокислоты фенилаланина (ФА), поступающей в организм человека с белковой пищей.
