
- •Билет 1
- •1. Изменение возбудимости в различные фазы процесса возбуждения. Функциональная лабильность.
- •Функциональная лабильность
- •2. Факторы, обеспечивающие движение крови по сосудам большого круга кровообращения; изменение давления в разных частях сосудистого русла.
- •3. Центральная архитектоника поведенческого акта (афферентный синтез, акцептор результата действия, обратная афферентация о результате действия), по п.К.Анохину
- •Билет 2
- •1. Физиологические особенности малого круга кровообращения.
- •3 .Сравнительная характеристика скелетных и гладких мышц. Виды мышечной работы
- •Билет 3
- •1.Методы изучения функции цнс (разрушение, раздражение, электроэнцефалография, метод вызванных потенциалов, микроэлектродные методы.)
- •2.Кровяное давление: факторы, обеспечивающие определенную величину артериального и венозного давления. Артериальный пульс.
- •Факторы, обеспечивающие величину кровяного давления.
- •3.И.П.Павлов представление о условных и безусловных рефлексах. Свойства этих рефлексов
- •Билет 4
- •2. Механизмы образования вторичной мочи; клиническое значение анализа мочи; регуляция реабсорбции в различных отделах нефрона.
- •3.Современные представления о природе автоматизма. Узлы автоматизма, доказательства (лигатуры Станниуса). Проводящая система сердца.
- •Лигатуры Станниуса
- •Билет 5
- •1. Структурно-функциональные особенности симпатического и парасимпатического отделов вегетативной нервной системы. Метасимпатическая система.
- •25. Симпатическая и парасимпатическая иннервация органов и тканей.
- •2.Транспорт кислорода кровью. Гемоглобин, его физиологическое значение. Кривая диссоциации оксигемоглобина. Кислородная емкость крови.
- •3.Методы определения расхода энергии. Прямая и непрямая калориметрия.
- •Билет 6
- •1.Нейрон (строение, функции, виды, генерация потенциала действия в нейроне)
- •2.Функции почек. Структурно-функциональная единица почек, строение, кровоснабжение
- •3.Эмоции: нейрофизиологические механизмы; виды, роль. Эмоциональный стресс; профилактика.
- •Билет 7
- •1.Структура и функции тромбоцитов их роль и участие в коагуляционном и сосудисто- тромбоцитарном гемостазе.
- •2.Кора больших полушарий (особенности строения, функции).
- •3.Классификация кровеносных сосудов по структурно-функциональному принципу.
- •Билет 8
- •1.Прямые (положительные) и обратные (отрицательные) гормональные связи: роль гипоталамуса и гипофиза. Гипоталамо-гипофизарные взаимоотношения.
- •2.Состав и функции плазмы. Белки плазмы. Осмо-онкотическое давление; роль в транскапиллярном обмене.
- •3.Аускультация сердца. Тоны сердца: происхождение. Соотношение фкг и экг в норме.
- •Билет №9
- •1.Рефлекс. Определение и классификация рефлексов. Строение дуги соматического рефлекса, понятие «кольцо рефлекса», обратная афферентация.
- •2.Обмен веществ и энергии в организме. Понятие анаболизма и катаболизма.Пластическая и энергетическая роль питательных веществ.
- •3.Память: физиологические механизмы,виды,стадии, место в фус.
- •Билет 10
- •1.Синапс. Определение, строение, классификация и свойства синапсов. Этапы и механизмы синаптической передачи.
- •2.Анализ одиночного сердечного цикла; изменение возбудимости в различные фазы.
- •3.Функциональная система, поддерживающая постоянный уровень осмотического давления крови. Механизм жажды
- •Билет 11
- •1.Виды и свойства рецепторов. Сенсорная рецепция. Этапы рецепторного ответа.
- •2.Роль печени в пищеварении. Состав и функции желчи. Регуляция желчеобразования и желчевыделения.
- •3.Эмоции. Произвольные и непроизвольные компоненты эмоций. Характеристика отрицательных эмоций. Стандартные реакции на эмоциональный стресс.
- •Билет 12
- •1.Ультраструктура биологических мембран. Мембранно-ионная теория происхождения биопотенциалов.
- •2.Механизм голода и насыщения
- •3.Основной обмен; значение; условия и методы определения. Факторы, влияющие на величину основного обмена.
2.Транспорт кислорода кровью. Гемоглобин, его физиологическое значение. Кривая диссоциации оксигемоглобина. Кислородная емкость крови.
В артериальной крови содержание составляет 18—20 об.%, а в венозной — 12 об.%. Количе- ство физически растворенного в крови равно всего лишь 0,3 об.%; следовательно, практически весь 02 переносится кровью в виде химического соединения с гемоглобином.
Гемоглобин — красный кровяной пигмент, содержащийся в эритроцитах; состоит из 4 одинаковых групп — гемов. Тем представляет собой протопорфирин, в центре которого рас- положен ион двухвалентного железа, играющий важную роль в переносе 02 . Каждый гем присоединяет к себе по 1 молеку- ле 02 , одна молекула гемоглобина связывает 4 молекулы 02 , возникает обратимая связь, при этом валентность железа не изменяется. Это называется оксигенацией гемоглобина. Вос- становленный гемоглобин (НЬ) становится окисленным — НЬ02 (оксигемоглобин).
Максимальное
количество кислорода, которое может
быть связано в 100 мл крови при полном
насыщении гемоглобина кислородом,
называется кислородной емкостью
крови. Она зависит от содержания
гемоглобина в крови. 1 г гемоглобина
способен присоединить 1,34 мл 02 ;
следовательно, при содержании в крови
в среднем 140 г/л гемоглобина (130—160 г/л у
мужчин и 120—140 г/л у женщин) кислородная
емкость крови будет 1,34-140=187,6 мл (или 19
об.% у мужчин и 18— 19 об.% у женщин). Гем
может подвергаться не только оксигенации,
но и ис- тинному окислению. При этом
железо из двухвалентного пре- вращается
в трехвалентное. Окисленный гем носит
название гематина (метгема), а вся
молекула в целом — метгемоглобина. В
крови человека в норме метгемоглобин
содержится в незна- чительном количестве,
но при некоторых заболеваниях, отрав-
лениях некоторыми ядами, при действии
лекарственных ве- ществ, например кодеина
и фенацетина, его содержание уве-
личивается. Опасность таких состояний
заключается в том, что окисленный
гемоглобин очень слабо диссоциирует
(не от- дает тканям 02 ) и не может
присоединять другие молекулы 02 , т.е.
теряет свойства переносчика 02 . Также
опасно соединение гемоглобина с угарным
газом (СО) с образованием карбок-
сигемоглобина (НЬСО), так как сродство
гемоглобина к СО в 300 раз больше, чем к
02 , и НЬСО диссоциирует в 10 000 раз медленнее,
чем НЬ02. В норме на долю карбоксигемоглобина
приходится лишь 1 % общего количества
гемоглобина крови, а у курильщиков к
в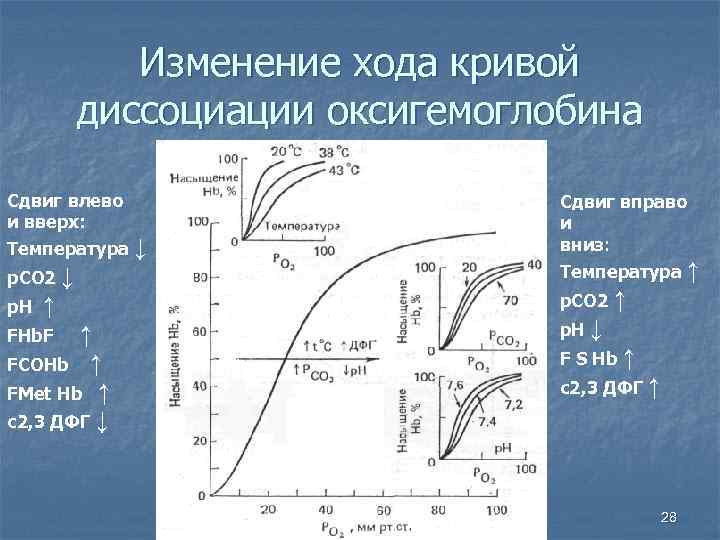 ечеру
достигает 20 %. Скорость процесса связывания
02 гемоглобином в легких и отдачи его
тканям иллюстрирует кривая образования
и дис- социации оксигемоглобина . Степень
насыщения гемоглобина кислородом, т.е.
образо- вание оксигемоглобина, зависит
от напряжения кислорода в крови. На
кривой имеется 4 характерных отрезка,
отражаю- щих эту зависимость: • 1 — при
напряжении 02 в крови от 0 до 10 мм рт. ст.
в крови находится восстановленный
гемоглобин, оксигенация крови идет
медленно; • 2 — от 10 до 40 мм рт. ст. —
насыщение гемоглобина кислородом идет
очень быстро и достигает 75 %; • 3 — от 40
до 60 мм рт. ст. — насыщение гемоглобина
кислородом замедляется, но достигает
90 %; • 4 — при возрастании Р02 свыше 60 мм
рт. ст. дальней- шее насыщение гемоглобина
идет очень медленно и постепенно
приближается к 96—98 %, никогда не достигая
100 %. Однако такое высокое насыщение
гемоглобина кислородом наблюдается
только у мо- лодых людей. У пожилых людей
эти показатели ниже. Диссоциация
оксигемоглобина происходит в тканевых
ка- пиллярах большого круга кровообращения.
Главным факто-ром, обеспечивающим
диссоциацию оксигемоглобина, явля- ется
большой градиент Р02 : в пришедшей
артериальной кро- ви Р02 составляет около
95 мм рт. ст., в межклеточной жид- кости
Р02 уменьшается примерно до 40 мм рт. ст.,
а в клетках тканей падает до 10—15 мм рт.
ст. и меньше, в рабо- тающих мышцах
приближается к 0 (когда Р02 в клетке стано-
вится равным 0,1 мм рт. ст., клетка погибает).
Резкое падение Р02 в тканях связано с
интенсивным потреблением его клет- ками
для окислительных процессов. Диссоциация
оксигемо- глобина в тканях приводит к
уменьшению содержания окси- гемоглобина
с 96 до 75 % и снижению Р02 до 40 мм рт. ст.
Каждые 100 мл артериальной крови, содержащие
18—20 мл 02 , отдают тканям в среднем около
4,5 мл 02 , т.е. 20—30 %. Эта часть 02 , поглощаемая
тканями, называется коэффициен- том
утилизации кислорода. В миокарде, сером
веществе мозга и печени коэффициент
утилизации достигает 50—60 %. Кроме
главного фактора — градиента Р02 , имеется
и ряд других факторов, влияющих на
диссоциацию оксигемоглобина в тканях.
К ним относятся РС02 в тканях, рН среды,
температура. Чем активнее работает
орган, тем интенсивнее в нем протекают
метаболические процессы, тем быстрее
потребляет- ся 02 и падает его напряжение
в тканях, быстрее накапливает- ся С02 ,
закисляется среда и повышается температура
ткани — все это ускоряет диссоциацию
оксигемоглобина. Все перечис- ленные
факторы ведут к конформационным
изменениям бел- ковой части молекулы
гемоглобина, в результате чего гемогло-
бин отдает 02 . Влияние РС02 на связь
гемоглобина с 02 от- крыл отечественный
ученый Б.Ф. Вериго в 1898 г. (эффект Ве-
риго). Влияние рН на диссоциацию
оксигемоглобина открыл датский физиолог
Ч. Бор в 1904 г. (эффект Бора). Диссоциации
оксигемоглобина также способствует
2,3-ди- фосфоглицерат — промежуточный
продукт, образующийся в эритроцитах
при расщеплении глюкозы, особенно при
ги- поксии. Диссоциацию оксигемоглобина
ускоряет АТФ. При повышении РС02 и
температуры, при снижении рН в тканях
сродство гемоглобина к 02 понижается,
процесс идет в сторону диссоциации
оксигемоглобина, при этом график
образования — диссоциации оксигемоглобина
смещается вправо (см. рис. 9.4). При снижении
РС02 , понижении температуры и сдвиге рН
в щелочную сторону сродство гемоглобина
к 02 повышается, процесс идет в сторону
образования оксигемоглобина, график
образования — диссоциации оксигемоглобина
смещается влево.
ечеру
достигает 20 %. Скорость процесса связывания
02 гемоглобином в легких и отдачи его
тканям иллюстрирует кривая образования
и дис- социации оксигемоглобина . Степень
насыщения гемоглобина кислородом, т.е.
образо- вание оксигемоглобина, зависит
от напряжения кислорода в крови. На
кривой имеется 4 характерных отрезка,
отражаю- щих эту зависимость: • 1 — при
напряжении 02 в крови от 0 до 10 мм рт. ст.
в крови находится восстановленный
гемоглобин, оксигенация крови идет
медленно; • 2 — от 10 до 40 мм рт. ст. —
насыщение гемоглобина кислородом идет
очень быстро и достигает 75 %; • 3 — от 40
до 60 мм рт. ст. — насыщение гемоглобина
кислородом замедляется, но достигает
90 %; • 4 — при возрастании Р02 свыше 60 мм
рт. ст. дальней- шее насыщение гемоглобина
идет очень медленно и постепенно
приближается к 96—98 %, никогда не достигая
100 %. Однако такое высокое насыщение
гемоглобина кислородом наблюдается
только у мо- лодых людей. У пожилых людей
эти показатели ниже. Диссоциация
оксигемоглобина происходит в тканевых
ка- пиллярах большого круга кровообращения.
Главным факто-ром, обеспечивающим
диссоциацию оксигемоглобина, явля- ется
большой градиент Р02 : в пришедшей
артериальной кро- ви Р02 составляет около
95 мм рт. ст., в межклеточной жид- кости
Р02 уменьшается примерно до 40 мм рт. ст.,
а в клетках тканей падает до 10—15 мм рт.
ст. и меньше, в рабо- тающих мышцах
приближается к 0 (когда Р02 в клетке стано-
вится равным 0,1 мм рт. ст., клетка погибает).
Резкое падение Р02 в тканях связано с
интенсивным потреблением его клет- ками
для окислительных процессов. Диссоциация
оксигемо- глобина в тканях приводит к
уменьшению содержания окси- гемоглобина
с 96 до 75 % и снижению Р02 до 40 мм рт. ст.
Каждые 100 мл артериальной крови, содержащие
18—20 мл 02 , отдают тканям в среднем около
4,5 мл 02 , т.е. 20—30 %. Эта часть 02 , поглощаемая
тканями, называется коэффициен- том
утилизации кислорода. В миокарде, сером
веществе мозга и печени коэффициент
утилизации достигает 50—60 %. Кроме
главного фактора — градиента Р02 , имеется
и ряд других факторов, влияющих на
диссоциацию оксигемоглобина в тканях.
К ним относятся РС02 в тканях, рН среды,
температура. Чем активнее работает
орган, тем интенсивнее в нем протекают
метаболические процессы, тем быстрее
потребляет- ся 02 и падает его напряжение
в тканях, быстрее накапливает- ся С02 ,
закисляется среда и повышается температура
ткани — все это ускоряет диссоциацию
оксигемоглобина. Все перечис- ленные
факторы ведут к конформационным
изменениям бел- ковой части молекулы
гемоглобина, в результате чего гемогло-
бин отдает 02 . Влияние РС02 на связь
гемоглобина с 02 от- крыл отечественный
ученый Б.Ф. Вериго в 1898 г. (эффект Ве-
риго). Влияние рН на диссоциацию
оксигемоглобина открыл датский физиолог
Ч. Бор в 1904 г. (эффект Бора). Диссоциации
оксигемоглобина также способствует
2,3-ди- фосфоглицерат — промежуточный
продукт, образующийся в эритроцитах
при расщеплении глюкозы, особенно при
ги- поксии. Диссоциацию оксигемоглобина
ускоряет АТФ. При повышении РС02 и
температуры, при снижении рН в тканях
сродство гемоглобина к 02 понижается,
процесс идет в сторону диссоциации
оксигемоглобина, при этом график
образования — диссоциации оксигемоглобина
смещается вправо (см. рис. 9.4). При снижении
РС02 , понижении температуры и сдвиге рН
в щелочную сторону сродство гемоглобина
к 02 повышается, процесс идет в сторону
образования оксигемоглобина, график
образования — диссоциации оксигемоглобина
смещается влево.
