новая папка / otvety_biokhimia
.docx1.Представление о белках как важнейшем классе органичских веществ и структурно-функциональном компоненте организма человка. Белки - высокомолекулярные азотистые органические вещества, построенные из аминокислот. Белки – основная и необходимая составная часть всех организмов. Именно Белки осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Сухое вещество большинства органов и тканей человека и животных, а также большая часть микроорганизмов состоят главным образом из белков (40-50%) Микроорганизмы обычно богаче белком. Белковые вещества лежат в основе важнейших процессов жизнедеятельности. Так, например , процессы обмена веществ ( пищеварение, дыхание, выделение, и другие) обеспечиваются деятельностью ферментов , являющихся по своей природе белками. К белкам относятся и сократительные структуры, лежащие в основе движения, например сократительный белок мышц, опорные ткани, покровы, состоящие главным образом из коллагенов, эластинов, кератинов, а также токсины, антигены и антитела, многие гормоны и другие биологически важные вещества. Энгельс определил, что жизнь есть способ существования белковых тел, заключающийся в постоянном самообновлении химических составных частей этих тел. В природе существует примерно 1010-1012 различных белков. Белками являются ферменты, антитела, многие гормоны и другие биологические активные вещества. Необходимость постоянного обновления белков лежит в основе обмена веществ. Именно поэтому белки и явились тем исключительным материалом , который послужил основой возникновения жизни на Земле. Ни одно вещество из всех веществ биологического происхождения не имеет столь большого значения и не обладает столь многогранными функциями в жизни организма как белки. Белки содержат в среднем около 1 6% азота, 50-55% углерода , 21-23% кислорода , 15-17% азота , 6-7% водорода , 0,3-2,5% серы . В составе отдельных белков обнаружены также фосфор, йод, железо, медь и некоторые другие макро- и микроэлементы, в различных, часто очень малых количествах.
|
2.Аминокислоты,входящие в состав белков,их строение и свойства. Пептидная связь. Первичная структура белков. Зависимость биологических свойств от первичной структкры.
Аминокислоты — органические кислоты, у которых атом водорода -углеродного атома замещен на аминогруппу –NH2 1.В составе белков 20 альфа-а-т,общая формула кот:
2.А-ты различаются по строению,размерам,св-м радикалов,присоединенных к альфа углеродному атому.Функц. группы а-т определяют особенности св-в разных альфа а-т: -анионные гр-пы –СОО; катионные гр-пы –NH3,=NH, -NH-C=NH2 / / NH2 -полярные незаряженные гр-пы: -ОН, -CONH2, -SH; неполярные : -СН3; алифатические цепи,ароматические циклы Пролин в отличие от других 19 мономеров белков иминокислота,радикал в пролине связан как с альфа углеродным атомом,так и с аминогруппой.
Некоторые функц. гр-пы в радикалах а-т появляются после синтеза белка.
3. А-ты различаются по их растворимости в воде. Это связано со СП-тьюрадикалов вз-ть с водой(гидрироваться). К гидрофильным относятся радикалы, содержащие анионные, катионные и полярные незаряженные функц. гр-пы. К гидрофобным относятся радикалы,содержащие метильные гр-пы , алифатические цепи или циклы. 4. Пептидные связи соединяют а-ты в пептиды. Альфа –корбоксильная группа 1й а-ты может реагировать с альфа-иминогруппой другой а-ты с обр-м пептидной связи.
Пептидные цепи белков представляют собой полипептиды,те линейные полимеры альфа а-т,соединен пептид связью.
Первичная структура белка несет информ. о его пространственной структуре. Первичная структура белка - это последовательность ковалентно связанных пептидными связями аминокислот, составляющих белок.Пептидная связь образуется за счет -карбоксильной группы одной аминокислоты и -аминной группы другой что -аминогруппа находится слева, а -карбоксильная группа — справа. Соответствующие участки полипептидной цепи называют N-концом (аминным концом) и С-концом (карбоксильным концом), а аминокислотные остатки — соответственно N-концевым и С-концевым остатками.
|
3.Конформация пептидных цепей в белках(вторичная и третичная структура)вторичная-пространственная структура, обр-ся в результате вз-вияй между функц. группами пептидного остова. альфа-спираль и бета-спираль. В Альфа-спирали водородные св-зи обр-ся между атомом кислорода карбокс. гр-пы и водородом амидного азота через 4 а-ты; боковые цепи а-х остатков нах на периферии спирали Ветта-структура обр между линейными областями одной полипептид. цепи,обр-я складки. Полипептидные цепи или их части могут обр-ть параллельные и антипараллельные бета структуры. третичная-трехмерная пространственная структура,обр-ся за счет вз-й между радикалами а-т,СПС располагаться на значительном расстоянии друг от друга в пептидной цепи. Третичная структура формируется в результате нековалентных взаимодействий (электростатические, ионные, силы Ван-дер-Ваальса и др.) боковых радикалов, обрамляющих -спирали и -складки, и непериодических фрагментов полипептидной цепи. Среди связей, удерживающих третичную структуру, следует отметить: а) дисульфидный мостик (–S–S–) между двумя остатками цистеина; б) сложноэфирный мостик (между карбоксильной группой и гидроксильной группой); в) солевой мостик (между карбоксильной группой и аминогруппой); г) водородные связи между группами -СО - и -NH-; Третичной структурой объясняется специфичность белковой молекулы, ее биологическая активность. конформационная лабильность-спс. белков к небольшим изменениям конформации за счет разрыва одних и обр-я других слабых связей.
5.Лабильность пространственной структуры белков и их денатурация.Факторы,вызывающие денатурацию. Денатурация-разрушение их нативной конформации,вызван разрывом связей ,стабилизирующих пространств. структуры,при действии денатурирующих агентов.
факторы:высокая температура-разруш слабых связей в белке; кислоты и щелочи-изменение ионизации иогенных групп,разрыв ионных и водородных связей; мочевина-разруш внутримолек. водородных связей и из-за обр-я водород связей+мочевина; спирт, фенол, хлорамин-разруш гидрофобных и водород связей ; соли тяжелых металлов-обр-е нераствор солей белков и ионов тяжелых металлов
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4. Четвертичная стуктурабелков. Особенности строения и функционирования олигомерных белков на примере гемсодержащих белков и их денатурация.
Сущность такой структуры в объединении несколько полимерных цепей были в единый комплекс. Такой комплекс также рассматривается как белок, состоящий из нескольких субъединиц. Белки, состоящие из нескольких субъединиц, широко распространены в природе (гемоглобин, вирус табачной мозаики, фосфорилаза, РНК-полимераза). Субъединицы принято обозначать греческими буквами (так у гемоглобина имеется по две и субъединицы). Наличие нескольких субъединиц важно в функциональном отношении — оно увеличивает степень насыщения кислородом. Четвертичная структура ( клубок белков) Четвертичная структура стабилизируется в основном силами слабых воздействий: а) водородная; б) гидрофобная; в) ионные; г) ковалентные (дисульфидные, пептидные).
гемоглобин-олигомерный белок,функция которого регулируется различными лигандами.
ф-ции:быстое насыщение кислородом в легких; СПС отдавать кислород в капиллярах тканей при относ высоком парциальном давлении кислорода; возможность регуляции сродства гемоглобина к О2.
Гис Е7 создает условия для связывания кислорода с гемом и ослабляет взаимодействие гемма с СО.
денатурация-потерю белками их естественных свойств (растворимости, гидрофильности и др.) вследствие нарушения пространственной структуры их молекул. Практически любое заметное изменение внешних условий, например, нагревание или обработка белка кислотой приводит к последовательному нарушению четвертичной, третичной и вторичной структур белка. Обычно денатурация вызывается повышением температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др. Денатурация часто приводит к тому, что в коллоидном растворе белковых молекул происходит процесс агрегации частиц белка в более крупные. Визуально это выглядит, например, как образование «белка» при жарке яиц.
|
6.Многообразие белков. Глобулярные и фибриллярные белки.
20 аминокислот(заменимые- Тирозин Цистеин Глицин Аланин Серин Глутаминовая кислота Глутамин Аспарагиноваякислота Аспарагин Пролин ; незаменимые- валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин и в некоторых случаях аргинин ),разные ф-ции. Возникновение новых белков часто связано с незначительными изменениями в структуре уже имеющихся белков. Кроме того, благодаря генетическим механизмам, белок с полезными свойствами или основная структурная часть этого белка могут входить в состав других белков. Такие белки, имеющие схожую последовательность аминокислот и родственные функции, объединяют в семейства родственных белков.
По форме молекулы и особенностям пространственной структуры белки делятся на две группы: глобулярные и фибриллярные. Полипептидные цепи фибриллярных белков имеют форму спирали, которая закреплена расположенными вдоль цепи внутримолекулярными водородными связями. В волокнах фибриллярных белков закрученные пептидные цепи расположены параллельно оси волокна, они как бы ориентированы относительно друг друга, располагаются рядом, образуя нитевидные структуры и имеют высокую степень асимметрии. Фибриллярные белки плохо растворимы или совсем нерастворимы в воде. При растворении в воде они образуют растворы высокой вязкости. К фибриллярным белкам относятся белки, входящие в состав тканей и покровных образований. Это миозин-белок мышечных тканей; коллаген, являющийся основой седиментационных тканей и кожных покровов; кератин, входящий в состав волос, роговых покровов, шерсти и перьев. К этому же классу белков относится белок натурального шелка — фиброин, вязкая сиропообразная жидкость, затвердевающая на воздухе в прочную нерастворимую нить. Этот белок имеет вытянутые полипептидные цепи, соединенные друг с другом межмолекулярными водородными связями, что и определяет, по-видимому, высокую механическую прочность натурального шелка. Пептидные цепи глобулярных белков сильно изогнуты, свернуты и часто имеют форму жестких шариков-глобул. Молекулы глобулярных белков обладают низкой степенью асимметрии, они хорошо растворимы в воде, причем вязкость их растворов невелика.
|
7.Классификация белков по их биологическим функциям. 1. Ферменты Ферменты - специализированные белки, ускоряющие течение химических реакций. Благодаря ферментам в клетке скорости химических реакций возрастают в миллионы раз. Имеют активный центр, они специфически связывают определённый лиганд (или группу похожих лигандов) и катализируют определённый тип химического превращения данной молекулы.(рибонуклеаза) 2. Регуляторные белки белковых гормонов, участвующих в поддержании постоянства внутренней среды организма, которые воздействуют на специфические клетки-мишени(гормон инсулин восстанавливает гомеостаз.) белки, присоединение которых к другим белкам или иным структурам клетки регулирует их функцию. Регуляторные ДНК-связывающие белки, могут регулировать скорость считывания генетической информации 3. Рецепторные белки Сигнальные молекулы (гормоны, нейромедиаторы) действуют на внутриклеточные процессы через взаимодействие со специфическими белками-рецепторами. 4. Транспортные белки 5. Структурные белки 6. Защитные белки Некоторые белки, в частности иммуноглобулины, обладают способностью узнавать и связывать чужеродные молекулы, вирусные частицы и бактерии, в результате чего происходит их нейтрализация. Кроме того, комплекс чужеродной частицы с иммуноглобулином легко узнаётся и уничтожается клетками иммунной системы. 7. Сократительные белки наделяют клетку способностью либо сокращаться, либо передвигаться. К таким белкам относят актин и миозин - фибриллярные белки, участвующие в сокращении скелетных мышц.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
8. Физико-химические свойства белков. Молекулярный вес, размеры и форма, растворимость, ионизация, гидратация. Методы выделения индивидуальных белков. 1. Различия белков по форме молекул по форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки 2. Различия белков по молекулярной массе Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров 3. Суммарный заряд белков Степень ионизации функциональных групп этих радикалов зависит от рН среды. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков:-NH3+ +ОН- → -NH2 + H2O. 4. Соотношение полярных и неполярных групп на поверхности нативных молекул белков На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков 5. Растворимость белков Растворимость зависит от всех свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Гидратация -белки растворяются и набухают получения индивидуальных белков - их очистка от других белков, находящихся в растворе, полученном из данной ткани. Так как белки обладают конформационной лабильностью, при работе с белками следует избегать денатурирующих воздействий, поэтому выделение и очистка белков происходят при низких температурах. На первых стадиях очистки белков целесообразно использовать методы, учитывающие какую-либо характерную особенность данного белка, например термостабильность или устойчивость в кислых растворах. Первыми методами очистки необходимо удалить из раствора основную массу балластных белков, которые значительно отличаются от выделяемого белка физико-химическими свойствами. Впоследствии применяют всё более тонкие методы очистки белка.( Очистка белков избирательной денатурацией, Высаливание, Гель-фильтрация, Ультрацентрифугирование, Электрофорез белков)
|
Биосинтез нуклеиновых кислот и белков.
22.Строение нуклеиновых кислот. Связи, формирующие структуру ДНК, РНК. Строение хроматина и рибосом. Нуклеиновые кислоты - высокомолекулярные соединения со строго определённой линейной последовательностью мономерами кот являются нуклеотиды. Каждый нуклеотид содержит:
Пентозу + основанием за счет N-гликозидной связи, пентоза-фосфат-пентоза
ДНК рнк Молекула ДНК представляет собой спираль, образованную 2 полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси.
Первичная структура РНК-это порядок чередования рибонуклеозидмонофосфатов в полинуклеотидной цепи. Мононуклеотиды связываются между собой 3*5*-фосфодиэфирными связями. Различают тРНК, рРНК,мРНК они имеют 1 полинуклеотидную цепь. отдельные уч-ки цепей РНК обр-т спирализованные петли-шпильки-за счет водород. связей между комплемент. азот основаниями А-У, Г=Ц
|
23+24.Типы
РНК.Биосинтез
ДНК(репликация):стехиометрия Реплика́ция ДНК — это процесс удвоения молекулы ДНК. ДНК-полимераза. 1.ДНК-топоизомеразы, находясь перед репликативной вилкой, разрезают молекулу ДНК для облегчения ее расплетания и раскручивания. 2. ДНК-хеликазы, следуя за топоизомеразами, раскручивают и расплетают молекулу ДНК. 3. ДНК-связывающие белки (ДСБ) связывают расплетенные нити ДНК и стабилизируют их, не допуская обратного "слипания" друг с другом. 4. ДНК-полимераза δ (греч.: δ – дельта), согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепидочерней ДНК в направлении 5'→3' на матрице материнской нити ДНК по направлению от ее 3'-конца к 5'-концу (скорость до 100 пар нуклеотидов в секунду). 5. Непосредственно сразу после расплетания и стабилизации другой нити материнской молекулы к ней присоединяется ДНК-полимераза α (α- альфа ) и в направлении 5'→3' синтезирует праймер (РНК-затравку) – последовательность РНК на матрице ДНК длиной от 10 до 200 нуклеотидов. После этого фермент удаляется с нити ДНК. Вместо ДНК-полимеразы α к 3'-концу праймера присоединяется ДНК-полимераза ε (ε - эпсилон). 6. ДНК-полимераза ε как бы продолжает удлинять праймер, но в качестве субстрата встраивает дезоксирибонуклеотиды (в количестве 150-200 нуклеотидов). В результате образуется цельная нить из двух частей – РНК (т.е. праймер) и ДНК. ДНК-полимераза ε работает до тех пор, пока не встретит праймер предыдущего фрагмента Оказаки (синтезированный чуть ранее). После этого данный фермент удаляется с цепи. 7. ДНК-полимераза β встает вместо ДНК-полимеразы ε, движется в том же направлении (5'→3') и удаляет рибонуклеотиды праймера, одновременно встраивая дезоксирибонуклеотиды на их место. Фермент работает до полного удаления праймера, т.е. пока на его пути не встанет дезоксирибонуклеотид (еще более ранее синтезированный ДНК-полимеразой ε). Связать результат свой работы и впереди стоящую ДНК фермент не в состоянии, поэтому он сходит с цепи. В результате на матрице материнской нити "лежит" фрагмент дочерней ДНК. Он называется фрагмент Оказаки. 8. ДНК-лигаза производит сшивку двух соседних фрагментов Оказаки, т.е. 5'-конца отрезка, синтезированного ДНК-полимеразой ε, и 3'-конца цепи, встроенного ДНК-полимеразой β |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
25 Транскрипция
Транскрипция – биосинтез иРНК на матрице ДНК. Процесс консервативный. Ферменты синтеза: а) РНК-полимераза I – синтезирует р-РНК б) РНК-полимераза II – синтезирует и-РНК в) РНК-полимераза III – т-РНК. Транскрипция наяинается после присоединения фермента РНК-полимеразы к спецефической нуклеотидной последовательности(промотору),отмечающей в ДНК то место,с которого должен начаться синтез РНК. Присоединившись, РНК-полимераза раскручивает примерно один виток спирали ДНК и движется ,связывая между собой нуклеозидтрифосфаты(ЦТФ, ГТФ, УТФ, АТФ), комплементарные нуклеотидам матричной цепи ДНК. Фермент продолжает присоединять нуклеотиды к растущей цепи РНК до тех пор,пока не встретит на своем пути еще одну спец. нуклеотидную последовательность в Цепи ДНК-стоп-сигнал. Обычно в любом уч-ке двойной спирали ДНК транскрибируется только одна из двух цепей(КОДОГЕННАЯ). На ДНК матрице обр. три вида РНК: мРНК, тРНК, рРНК. В виде мРНК генетическая информация для синтеза полипептида передается от ДНК к рибосомам; тРНК доставляет к рибосомам аминокислоты; Главный компанент рибосом является рРНК
|
26. Трансляция
Трансляцией называют осуществляемый рибосомой синтез белка из аминокислот на матрице информационной РНК .
Образование петидной связи: метионин от инициаторной тРНК переносится на альфа –амногруппу аа-тРНК, а в А-центре с обр-м дипептидил-тРНК. Катализируют пептидилтрансферазную р-ю рРНК большой субъединицей рибосомы. Транслокация:рибосома перемещается на один кодон в направлении 5*3*. Дипептидил-тРНК из А-центра в Р-центр,а в А-центре оказывается след. кодон. тРНК(мет) покидает рибосому.
|
27. Свойства биологического кода.
биологический код-способ записи инф-ии об а-той последовательности белков с помощью последовательности нуклеотидов в ДНК или РНК.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
28. Теория оперона. Функционирование оперонов, регулируемых по механизму индукции и репрессии.
оперон-функционал часть молекулы ДНК. Состоит из нес-х уч-в(промотор,оператор,структурные гены,терминатор) начало:РНК-полимераза+промотор=начинается синтез,но ему мешать будет оператор. Оператор блокирует синтез. Есть 2 мех-ма регуляции Индукция:определенный агент(белок,субстрат)+оператор=индуцирует синтез Репрессия:в присутствии агента не идет.
31. Незаменимые аминокислоты: пищевая ценность разных белков - незаменимые аминокислоты - не синтезируются в организме человека, а поступают только с пищей. К незаменимым аминокислотам относят 8 аминокислот:
|
29. Молекулярные механизмы генетической изменчивости. Молекулярные мутации: замены,делеции,вставки нуклеотидов
Изменения в последовательности пуриновых или пиримидиновых оснований в гене, не исправленные ферментами репарации, получили название -мутации Транспозоны - участки ДНК, удаляемые из одного локуса хромосомы и встраиваемые в другой .локус той же или другой хромосомы. Ретротранспозоны не покидают исходного положения в молекуле ДНК, но могут копироваться, и копии встраиваются, подобно транспозо-нам, в новый участок. Включаясь в гены или участки около генов, они могут вызывать мутации и изменять их экспрессию. Геномные изменение числа хромосом(Болезнь дауна) Хромосомные общее число хромосом неизменно(Делеция х-хромосомы) Генная затрагивают один кодон или небольшой отрезок гена и не обнаруживаются цитогенетически(серповидноклеточная анемия) Виды мутаций ЗАМЕНА, при которых одно азотистое основание в ДНК замещается на другое Без изменения смысла кодона(изменение в структеру ДНК- Замена одного нуклеот. в кодоне, изменений в белке нету) С изменением смысла кодона (миссенс-мутация)(изменения белка замена одной а-ты на другую) С образованием терминирующего кодона (нонсенс-мутация) ВСТАВКА обеспечивающие внедрение в молекулу ДНК одного или нескольких дополнительных нуклеотидов; Без сдвига «рамки считывания»(изменения ДНК- Вставка фрагмента ДНК из 3 нуклеотидов или с числом нуклеотидов, кратным 3; изменение белка - Происходит удлинение полипептидной цепи на одну или несколько аминокислот) Со сдвигом «рамки считывания»( изменение ДНК - Вставка одного или нескольких нуклеотидов, не кратных 3; изменение белка - Синтезируется пептид со «случайной» последовательностью аминокислот, так как изменяется смысл всех кодонов, следующих за местом мутации ДЕЛЕЦИЯ(или выпадения) одного или нескольких нуклеотидов, при которых происходит укорочение молекулы ДНК. Без сдвига «рамки считывания» ( изменение ДНК - Выпадение фрагмента ДНК из 3 нуклеотидов или с числом нуклеотидов, кратным 3; изменение белка Происходит укорочение белка на одну или несколько аминокислот Со сдвигом «рамки считывания» (изменение ДНК - Выпадение одного или нескольких нуклеотидов, не кратных 3; изменение белка - Синтезируется пептид со «случайной» последовательностью аминокислот, так как изменяется смысл всех кодонов, следующих за местом мутации |
30.Основные пищевые вещества-углеводы, жиры, белки,суточная потребность. Основные пищевые вещества — белки, жиры, углеводы, минеральные вещества, витамины и вода. Эти пищевые вещества называют также питательными, учитывая их главенствующее значение в жизнедеятельности организма и отграничивая от натуральных, входящих в состав пищи, веществ - вкусовых, ароматических, красящих и т. д. К незаменимым пищевым веществам, которые не образуются в организме или образуются в недостаточном количестве, относятся белки, некоторые жирные кислоты, витамины, минеральные вещества и вода. К заменимым пищевым веществам относятся жиры и углеводы. Поступление с пищей незаменимых пищевых веществ является обязательным. Нужны в питании и заменимые пищевые вещества, так как при недостатке последних на их образование в организме расходуются другие питательные вещества и нарушаются обменные процессы Пищевой рацион — это состав и количество пищевых продуктов, используемых в течение дня (суток).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
32. Витамины. Классификация витаминов. Витамины - низкомолекулярные органические соединения различной химической природы и различного строения, синтезируемые главным образом растениями, частично - микроорганизмами. 1. ВИТАМИНЫ, РАСТВОРИМЫЕ В ЖИРАХ Витамин А (Ретинол), провитамины А (каротины), (антиксерофталический). Витамин D (кальциферолы), (антирахитический). Витамин E (токоферолы), (витамин размножения). Витамин K (филлохиноны), (антигеморрагический), Витамин F (полинасыщенные жирные кислоты) 2. ВИТАМИНЫ, РАСТВОРИМЫЕ В ВОДЕ. В 1 (тиамин), (обмен углеводов). В 2 (рибофлавин), (участие в процессах роста, дыхания). РР (никотиновая кислота), (повышает использование растительных белков). В 3 (пантотеновая кислота), (регулирует функции нервной системы, надпочечников, щитовидной железы). В 6 (пиридоксин), (регулирует обмен белков, жиров, ферментов, кроветворение). В 12 (цианкобаламин), (стимулирует рост, синтез аминокислот, нуклииновых кислот, пуринов). В с (фолиевая кислота), (размножение клеток, кроветворение, синтез нуклииновых и аминокислот). Н (биотин), (участвует в жировом обмене, оказывает регулирующее влияние на нервную систему). N (липоевая кислота), (предупреждает ожирение печени). Р (биофлавоноиды), (капилляроукрепляющее действие и снижение проницаемости стенок сосудов). С (аскорбиновая кислота), (связан с окислительно-востановительным действием, белковым обменом) В приводимой классификации витаминов в скобках указаны наиболее характерные биологические свойства данного витамина — его способность предотвращать развитие того или иного заболевания. Обычно названию заболевания предшествует приставка " анти ", указывающая на то, что данный витамин предупреждает или устраняет это заболевание. 3. ВИТАМИНОПОДОБНЫЕ В ВЕЩЕСТВА В 13 (оротовая кислота), В 15 (пангамовая кислота), В 4 (холин), В 8 (инозит), В т (карнитин), Н 1 (Параминбензойная кислота), F (полинасыщенные жирные кислоты), U (S=метилметионин-сульфат-хлорид |
33.Функции витаминов. Алиментарные и вторичные авитаминозы гиповитаминозы. Гипервитаминоз. Витамины - низкомолекулярные органические соединения различной химической природы и различного строения, синтезируемые главным образом растениями, частично - микроорганизмами. Авитаминоз-полное отсутствие витаминов в пище или полное неусвоение в ЖКТ Гипоавитаминоз-недостаточное сод-е аитаминов в пище или частичное усвоение Гиперавитаминоз-избыточное сод-е витаминов в орг-ме,хар-но только для жирорастворимых витаминов Витамин АГиповитаминоз (недостаток витамина): нарушение зрения, замедление развития и роста, нарушение формирования шерстного покрова, диарея. Гипервитаминоз (избыток витамина): тошнота, рвота, диарея, выпадение шерсти, деформация костей, кровотечения. Витамины группы ВГиповитаминоз: повышенная утомляемость, раздражительность, нервозность, выпадение шерсти, нарушения со стороны кожи. Гипервитаминоз: избыточное поступление с пищей этих водорастворимых витаминов обычно выводится с мочой. В тяжелых случаях отмечаются нарушения нервной системы, крови или пищеварения. Витамин СГиповитаминоз: нарушение лактации, одышка, опухание суставов, замедленное заживление ран, повреждения дентина. Гипервитаминоз: диарея. Исследования еще продолжаются и вызывают много споров. Однако считается, что избыток витамина выводится с мочой. Витамин DГиповитаминоз: рахит, деформация костей, атрофия или гипотрофия мышц, нарушения зрения и нервной системы. Гипервитаминоз: учащенное мочеиспускание, тошнота, рвота, мышечная слабость, кальцификация мышц, включая сердце. Витамин ЕГиповитаминоз: нарушения состава крови и кровотечения, падение уровня коллагена, разрушение аминокислот, снижение функции некоторых гормонов, снижение репродукции. Гипервитаминоз: в целом этот витамин нетоксичен, хотя его избыток может вызвать повышение кровяного давления. Витамин КГиповитаминоз: кровотечения, аборты. Гипервитаминоз: практически не бывает, так как в целом сам витамин нетоксичен.
|
34. Витаминзависимые и витаминрезистентные состояния. Особую группу причин витаминной недостаточности составляют врожденные, генетически обусловленные нарушения обмена и функций витаминов. Особую группу составляют врожденные, генетически обусловленные нарушения обмена и функций витаминов. При данных нарушениях возникают клинические симптомы, сходные с проявлениями тех или иных авитаминозов, и некоторые развиваются, несмотря на нормальную обеспеченность организма соответствующими витаминами. В некоторых случаях клинические проявления удается полностью или частично корригировать путем постоянного введения соответствующего витамина в дозах, превышающих физиологические в 100-1000 раз. Подобные случаи получили название витаминзависимых, в других случаях введение даже крайне высоких доз соответствующих витаминов не устраняет клинических проявлений дефицита витамина, подобные случаи носят название витаминрезистентных. Они приводят к тяжелым нарушениям состояния больных вплоть до развития летальных исходов Целый ряд наследственных болезней обмена обусловлен недостатком в организме витаминов. В некоторых случаях отсутствие или снижение активности соответствующего фермента может быть частично восстановлено путем введения повышенных доз витамина. Подобные нарушения обмена веществ носят название врожденных витаминзависимых. Когда в результате генетической мутации образование фермента полностью нарушается или образуется фермент с нарушенной структурой, лишенный своей активности, то введение повышенных доз витамина не дает какого-либо эффекта. Такие нарушения обмана веществ носят название витаминрезистентных (устойчивых к введению витаминов) врожденных нарушений. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
35. Биохимическая характеристика патогенеза рахита Развивающаяся при рахите С-витаминная недостаточность, влияет на процессы кровотворения (М. Н. Бессонова). Резкие изменения в составе крови обнаруживались при выраженном гиповитаминозе С. Ряд этиологических моментов, влияющих на развитие рахита, может одновременно быть, причиной развивающейся анемии При рахите в первой фазе количество неорганического фосфора крови снижается, а кальция остается нормальным; коэффициент Ca/P увеличивается. Во второй фазе в разгаре рахита понижается и коли-чество кальция; коэффициент Ca/P снижается. В третьей фазе (при начинающемся выздоровлении) количество фосфора повышается, количество же кальция остается уменьшенным: коэффициент Ca/P продолжает снижаться. В четвертой фазе (соответствующей выздоровлению) наступает нормализация фосфора и кальция; коэффициент Ca/P повышается. патогенезе рахита, одной из основных причин обеднения организма фосфором являются нарушения в процессах реабсорбции фосфатов в почечных канальцах. Здоровый ребенок раннего возраста «весьма бережно относится с фосфатам»: примерно 80-85% их всасывается обратно при прохождении через почечные канальцы. У ребенка, заболевшего рахитом, уже в начальном периоде происходит резкое снижение реабсорбции фосфатов в почках, особенно же значительны потери фосфатов в цветущем периоде рахита.
|
36. Биохимическая характеристика гипервитаминозов А и Д Гипервитаминоз — острое расстройство в результате интоксикации сверхвысокой дозой одного или нескольких витаминов (содержащихся в пище или витаминсодержащих лекарствах).
Гипервитаминоз витамина А возникает в том случае, когда в рационе питания содержится большое количество печени морских животных, моллюсков и рыб или при приеме витаминов в значительных дозах. У детей при остром гипервитаминозе изменяется поведение. Ребенок становится вялым, сонливым, малоподвижным, раздражительным, ухудшается аппетит. Могут появиться рвота и высокая температура. При хроническом гиперавитаминозе, кроме неадекватного поведения, отмечаются следующие симптомы: сухость кожи, выпадение волос, воспаление слизистой оболочки десен, губ, появление на них трещин. У взрослых при остром гипервитаминозе отмечаются следующие симптомы: вялость, апатия, острая головная боль, рвота, кожные высыпания (подобные таким как при скарлатине), ухудшение зрения, резкое снижение фибриногена, возникновение брадикардии. У беременных женщин возможны самопроизвольный аборт или осложнения в развитии плода. Симптомы острой интоксикации витамином А проходят через неделю. Хроническая интоксикация ретинолом может наступить в результате длительного приема больших доз (50 мг) витамина А. Она характеризуется гиперкератозом кожи и слизистых оболочек, огрубением и вьшадением волос, слезотечением, сухостью роговицы, обострением желчнокаменной болезни, хронического панкреатита, увеличением печени и селезенки.
|
37. Понятие о метаболизме,метаболических путях. Ферменты и метаболизм. Понятие регуляции метаболизма. Метаболизм — совокупность химических реакций, протекающих в клетках организма с момента поступления пищевых веществ в организм до образования конечных продуктов обмена. Метаболический путь — последовательность химических превращений вещества. Метаболические пути многоэтапны, взаимосвязаны, регулируемы, скоординированы в про- странстве. Они бывают линейными (распад и синтез гликогена, гликолиз и др.) и цикличе- скими (цикл трикарбоновых кислот, орнитиновый цикл): S → A → B → C → D → P — пример линейного метаболического пути, где S — исходный субстрат, Р — конечный продукт, А, В, С, D — метаболиты (промежуточные продукты). 1. Катаболизм — процесс расщепления сложных молекул до более простых, идущий с выделением энергии. 2. Анаболизм — процесс синтеза сложных веществ из более простых, идущий с затратой энергии в виде АТФ. катаболизм проходит в 3 этапа: I этап Происходит в кишечнике (переваривание пищи) или в лизосомах при расщеплении уже ненужных молекул. При этом освобождается около 1% энергии, заключенной в молекуле. Она рассеивается в виде тепла. II этап Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ. III этап Все реакции этого этапа идут в митохондриях. Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ. Часть выделенной на этом этапе энергии молекулы рассеивается в виде тепла и около 46% энергии
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
38. Методы изучения обмена веществ. Методы исследования. При изучении метаболизма какого-нибудь одного из питательных веществ прослеживают все его превращения от той формы, в какой оно поступает в организм, до конечных продуктов, выводимых из организма. В таких исследованиях применяется крайне разнообразный набор биохимических методов. Использование интактных животных или органов. Животному вводят изучаемое соединение, а затем в его моче и экскрементах определяют возможные продукты превращений (метаболиты) этого вещества. Более определенную информацию можно получить, исследуя метаболизм определенного органа, например печени или мозга. В этих случаях вещество вводят в соответствующий кровеносный сосуд, а метаболиты определяют в крови, оттекающей от данного органа. Поскольку такого рода процедуры сопряжены с большими трудностями, часто для исследования используют тонкие срезы органов. Их инкубируют при комнатной температуре или при температуре тела в растворах с добавкой того вещества, метаболизм которого изучают. Клетки в таких препаратах не повреждены, и так как срезы очень тонкие, вещество легко проникает в клетки и легко выходит из них. Иногда затруднения возникают из-за слишком медленного прохождения вещества сквозь клеточные мембраны. В этих случаях ткани измельчают, чтобы разрушить мембраны, и с изучаемым веществом инкубируют клеточную кашицу. Именно в таких опытах было показано, что все живые клетки окисляют глюкозу до СО2 и воды и что только ткань печени способна синтезировать мочевину. Использование клеток. Даже клетки представляют собой очень сложно организованные системы. В них имеется ядро, а в окружающей его цитоплазме находятся более мелкие тельца, т.н. органеллы, различных размеров и консистенции. С помощью соответствующей методики ткань можно "гомогенизировать", а затем подвергнуть дифференциальному центрифугированию (разделению) и получить препараты, содержащие только митохондрии, только микросомы или прозрачную жидкость - цитоплазму. Эти препараты можно по отдельности инкубировать с тем соединением, метаболизм которого изучается, и таким путем установить, какие именно субклеточные структуры участвуют в его последовательных превращениях. Известны случаи, когда начальная реакция протекает в цитоплазме, ее продукт подвергается превращению в микросомах, а продукт этого превращения вступает в новую реакцию уже в митохондриях. Инкубация изучаемого вещества с живыми клетками или с гомогенатом ткани обычно не выявляет отдельные этапы его метаболизма, и только последовательные эксперименты, в которых для инкубации используются те или иные субклеточные структуры, позволяют понять всю цепочку событий.
|
39.Основные мембраны клетки и их функции. Общие свойства мембран:жидкостность, поперечная ассиметрия, избирательная проницаемость Плазматическая мембрана Плазматическая мембрана, окружающая каждую клетку, определяет её величину, обеспечивает транспорт малых и больших молекул из клетки и в клетку, поддерживает разницу концентраций ионов по обе стороны мембраны. Мембрана участвует в межклеточных контактах, воспринимает, усиливает и передаёт внутрь клетки сигналы внешней среды Ядерная мембрана Ядерная оболочка состоит из внешней и внутренней ядерных мембран. Ядерная оболочка имеет поры, через которые РНК проникают из ядра в цитоплазму, а регуляторные белки из цитоплазмы в ядро. Мембрана эндоплазматического ретикулума (ЭР) Мембрана ЭР имеет многочисленные складки и изгибы. Она образует непрерывную поверхность, ограничивающую внутреннее пространство, называемое полостью ЭР. Шероховатый ЭР связан с рибосомами, на которых происходит синтез белков плазматической мембраны, ЭР, аппарата Гольджи, лизосом, а также секретируе-мых белков. Области ЭР, не содержащие рибосом, называют гладким ЭР. Здесь происходит завершающий этап биосинтеза холестерина, фосфолипидов, реакции окисления собственных метаболитов и чужеродных веществ с участием мембранных Аппарат Гольджи Аппарат Гольджи - важная мембранная органелла, отвечающая за модификацию, накопление, сортировку и направление различных веществ в соответствующие внутриклеточные компартменты, а также за пределы клетки. Специфические ферменты мембраны комплекса Гольджи, гликозилтрансферазы, гликозилируя белки по остаткам серина, треонина или амидной группе аспарагина, завершают образование сложных белков - гликопротеинов. Митохондриальные мембраны Митохондрии - органеллы, окружённые двойной мембраной, специализирующиеся на синтезе АТФ путём окислительного фосфорилирования. Отличительная особенность внешней митохондриальной мембраны - содержание большого количества белка порина, образующего поры в мембране. Благодаря порину внешняя мембрана свободно проницаема для неорганических ионов, метаболитов и даже небольших молекул белков Мембрана лизосом Мембрана лизосом играет роль "щита" между активными ферментами (более 50), обеспечивающими реакции распада белков, углеводов, жиров, нуклеиновых кислот, и остальным клеточным содержимым. Мембрана содержит уникальные белки, например АТФ-зависимую протонную помпу (насос), которая поддерживает кислую среду (рН 5), необходимую для действия гидролитических ферментов (протеаз, липаз), а также транспортные белки, позволяющие продуктам расщепления макромолекул покидать лизосому св-ва-;жидкостность: Двойной липидный слой мембраны имеет жидкокристаллическую структуру; положение молекул липидов упорядочено, но они сохраняют способность к диффузии в пределах слоя параллельно поверхности мембраны (латеральная диффузия). Поперечная диффузия (обмен молекул между слоями) возможна лишь в ограниченных размерах. поперечная ассиметрия: Мембранные структуры клетки в норме замкнуты. Каждая мембрана имеет внутреннюю и внешнюю поверхность, которая обладает выраженной ассиметрией в плане расположения различных фосфолипидов. Например, фосфатидилхолин локализуется на внешней стороне мембраны эритроцита, а на внутренней расположены фосфатидилэтаноламины и фосфатидилсерины. В норме анионные фосфолипиды не присутствуют на внешней поверхности биомембран. Появление фосфатидилсерина (ФС) на внешней поверхности мембраны эритроцита является сигналом для выведения его из кровяного русла. Изменение асимметрии мембраны тромбоцита, приводящее к появлению ФС на внешней мембране, вносит свой вклад в развитие локальной реакции свертывания крови. избирательная проницаемость.
|
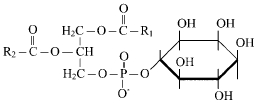
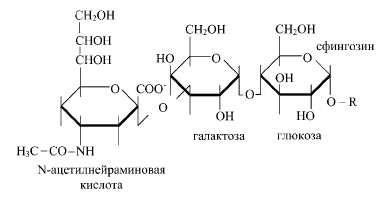
40. Липидный состав мембран- фосфолипиды, гликолипиды, холестерин. Липиды мембран амфифильны,имеют полярную и неполярную части Гидрофильной группой фосфолипида явл. фосфатный остаток с присоединенным к нему холином,этаноламином,серином. Гидрофобную часть липидов составляют углеводные цепи ацильных остатков,различающиесяпо длине и степени насыщенности. Строение ацильной группы липида влияет на св-ва мембраны. Молекулы липидов в мембране способны к латеральной диффузии.ЕЕ скорость зависит от микровязкости мембран,кот зависит от относительного содержания насыщенных и ненасыщенных жир к-т. Гликилипиды построены на основе аминоспирта сфингозина. Гидрофильная группа гликолипидов представлена углеводным остатком , присоединенным гликозидной связью к гидроксильной группе сфингозина. В зависимости от длины ув части различают цереброзиды(моносахаридный остаток) и ганглиозиды( сложный олигосахарид) Холестерин является важным составляющем мембран. Молекулы располагаются в гидрофобной зоне мембраны параллельно гидрофобным хвостам молекул фосфоро- и гликолипидов. Гидроксильная группа контактирует с гидрофильными головками фосфоро- и гликолипидов Наличие холестерина в мембранах уменьшает подвижность цепей жирных кислот, снижает возможность латеральной диффузии липидов и белков ,может влиять на ф-ции мембранных белков. белки=)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
41. Роль липидов в формировании бислоя. Основу любой молекулярной мембраны составляют молекулы липидов, образующих бислой. К липидам относится большая группа органических веществ, обладающих плохой растворимостью в воде (гидрофобность) и хорошей растворимостью в органических растворителях и жирах (липофильность). Состав липидов в разных мембранах неодинаков. Например, плазматическая мембрана, в отличие от мембран эндоплазматической сети и митохондрий обогощена холестерином. Характерными представителями липидов, встречающихся в клеточных мембранах, являются фосфолипиды (глицерофосфатиды), сфингомиелины и из стероидных липидов – холестерин. Особенностью липидов является разделение их молекул на две функционально различные части: гидрофобные неполярные, не несущие зарядов («хвосты»), состоящие из жирных кислот, и гидрофильные, заряженные полярные «головки». Это определяет способность липидов самопроизвольно образовывать двухслойные (билипидные) мембранные структуры толщиной 5-7 нм. Важнейшие свойства бислоя: - способность к самосборке - текучесть -ассиметричность |
42. Участие фосфолипаз в обмене фосфолипидов. Фосфолипазы ферменты класса гидролаз, катализирующие гидролиз фосфоглицеридов.. В зависимости от положения гидролизуемой связи в фосфолипиде различают 4 основных класса фосфолипаз: A, B, C и D.
Лизофосфолипиды расщепляются под действием фосфолипаз L (существование позиционно специфичных фосфолипаз L1 и L2 не доказано). Фосфолипазы В - устаревшее назв. препаратов, обладающих активностью по типу фосфолипаз А и L.
X - остаток холина, серина, миоинозита и др.; для фосфолипаз L1 R2=C(O)R4, R3=H; для фосфолипаз L2 R2=H, R3=C(O)R4 Каждое из семейств фосфолипаз неоднородно и включает ферменты, значительно отличающиеся по молекулярным массам, субъединичному составу и другим свойствам. Все фосфолипазы наиболее активно катализируют гидролиз на поверхности раздела фаз фосфолипид - вода; медленно гидролизуют водорастворимые субстраты. Фосфолипаза A1 - отщепляет SN-1 ацильную цепь. Фосфолипаза A2 - () отщепляет SN-2 ацильную цепь. Фосфолипаза B -( отщепляет обе SN-1 и SN-2 ацильные цепи. Фосфолипаза, обладающая активностями как фосфолипазы А1 так и А2, то есть способной гидролизовать ацильную цепь фосфолипида в sn-1 и sn-2 положениях. Фосфолипаза C - гидролизует связь между глицериновым остатком фосфолипида и полярной фосфатной группой, при этом образуются диацилглицерин и фосфат-содержащая полярная группа. Фосфолипаза D - гидролизует связь между фоасфатной группой и спиртовой группой, при этом высвобождаются фосфатидная кислота и спирт. Существует 2 изоформы этой фосфолипазы D1 и D2. Фосфолипазы играют важную роль в обмене липидов в живых организмах. Их используют для определения структуры фосфоглицеридов и места их локализации в мембранах.
|
43. Белки мембран: интегральные, поверхностные, заякоренные. глубоко проникать в липидный бислой или даже пронизывать его - интегральные белки Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы,а неполярные контактируют с мембранными липидами. Такие белки называют "вывернутыми" по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH2). прикрепляться к мембране - поверхностные белки. Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя. Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина Закрепление с помощью мембранного "якоря" "Якорем" может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов Роль мембранного "якоря" может выполнять также ковалентно связанный с белком остаток жирной кислоты). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина. Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С-концу белка фосфатидилинозитолгликана. Этот "якорь" - часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
44.Механизмы переноса веществ через мембраны: простая диффузия, первично-активный транспорт ( Na-K-АТФаза, Са-АТФаза), пассивный симпорт и антипорт. Вторично-активный транспорт, регулируемые каналы (Са-канал эндоплазматического ретикулума). Простая диффузия осуществляется за счет теплового движения молекул из зоны с большей концентрацией в зону с меньшей концентрацией. Разность концентраций по обе стороны мембраны называется градиентом концентраций. При переносе заряженных частиц важную роль играет разница потенциалов. Обычно внутри клетки накапливаются отрицательно заряженные частицы. Таким путем транспортируются: Н2О, СО2, О2. Перенос веществ простой диффузией прекращается когда концентрация вещества с одной и с другой стороны мембраны выравнивается. первично-активный транспорт-перенос в-в против градиента концентрации с затратой энергии NA-К-Атфаза-ответственна за одновременный перенос натрия наружу(3), калия внутрь(2) кальций-атфаза-ответствена за перенос кальция наружу Вторично-активный транспорт. Активный перенос вещества через мембрану может осуществляться за счет энергии градиента концентрации другого вещества. Переносчик в этом случае имеет специфические центры связывания для обоих веществ (Присоединение и отделение переносимого вещества вызывает изменения конформации переносчика, и соответственно — изменения сродства к переносимым веществам. Если концентрация вещества X снаружи больше, чем внутри, оно может перемещаться путем облегченной диффузии. Переносчик имеет центр связывания и для вещества Y, которое транспортируется попутно с веществом X (симпорт), причем вещество Y может транспортироваться против градиента своей концентрации. Сходным образом происходит и антипорт — перемещение вещества против градиента своей концентрации в направлении, противоположном перемещению другого вещества по его градиенту концентрации Симпорт и антипорт могут происходить за счет энергии градиента концентрации ионов Na+, создаваемого Na,K-AT-Фазой. Таким способом происходит, например, всасывание аминокислот из кишечника и глюкозы из первичной мочи и кишечника . Следовательно, в этих случаях первичным источником энергии служит АТФ: сначала энергия гидролиза АТФ трансформируется в энергию трансмембранного градиента концентрации Na+, а затем энергия этого градиента используется для переноса аминокислот или глюкозы. Открытие или закрытие селективных каналов регулируется либо изменением концентрации специфических регуляторов, таких как медиаторы, гормоны, циклические нуклеотиды, NO, G-белки, либо изменением трансмембранного электрохимического потенциала (рис. 5-14). Воздействие регуляторного фактора вызывает конформационные изменения каналообразующих белков, канал открывается и ионы проходят по градиенту концентрации. Транспорт веществ через каналы не приводит к конформационным изменениям белков и зависит только от разности концентраций веществ по обе стороны мембраны. Поэтому скорость транспорта веществ через такие каналы может достигать 106-108 ионов в секунду.
49.НАДНдегидрогеназа,убихинондегидрогеназа Перенос электронов от NADH к О2 включает ряд переносчиков, которые локализованы во внутренней мембране митохондрий. За исключением убихинона и цитохрома С, это сложные белковые комплексы. NADH-дегидрогеназа (NADH-Q-редуктаза, комплекс I) состоит из нескольких полипептидных цепей. Роль простетической группы играет FMN. Единственный субстрат фермента - NADH, с которого 2 электрона и протон переносятся на FMN с образованием FMNH2. Второй протон поглощается из матрикса. Реакция протекает по уравнению: NADH + Н+ + Е (FMN) → NAD+ + Е (FMNH2) С FMNH2 электроны переносятся затем на ряд железо-серных белков (FeS), играющих роль второй простетической группы в молекуле NADH-дегидрогеназы. Атомы железа в этих белках (негемовое железо) собраны в несколько групп, так называемых железо-серных центров. FeS-центры входят в состав многих белков (флавопротеинов, цитохромов), участвующих в окислительно-восстановительных реакциях. Известны 3 типа FeS-центров (FeS, Fe2S2, Fe4S4), в которых атом железа связан с атомом серы остатков цистеина или неорганической серы. Строение железо-серных центров показано на рис. 6-7. NADH-дегидрогеназа содержит несколько центров типа Fe2S2 и Fe4S4 Атомы железа в таких центрах могут принимать и отдавать электроны поочерёдно, переходя в ферро- (Fe2+) и ферри- (Fe3+) состояния. От железо-серных центров электроны переносятся на кофермент Q (убихинон) Молекулы убихинона в зависимости от источника, из которого они выделены, различаются длиной углеводородной цепи, которая у млекопитающих содержит 10 изопреноидных звеньев и обозначается как Q10. В процессе переноса электронов с NADH-дегидрогеназы через FeS на убихинон он обратимо превращается в гидрохинон. Убихинон выполняет коллекторную функцию, присоединяя электроны от NADH-дегидрогеназы и других флавинзависимых дегидрогеназ, в частности, от сукцинат-дегидрогеназы. Убихинон участвует в реакциях типа: Е (FMNH2) + Q → Е (FMN) + QH2.
Рис. 6-6. Структурные формулы рабочей части коферментов FAD и FMN. В ходе реакции FAD и FMN присоединяют 2 электрона и, в отличие от NAD+, оба теряемых субстратом протона.
Рис. 6-8. Структура убихинона (кофермента Q). n - число изопреноидных звеньев. Убихинон может принимать один электрон и превращаться в семихинон или 2 электрона и полностью восстанавливаться в гидрохинон (убихинол).
|
46. Эндэргонические и экзэргоническиг реакции в живой клетке. Макроэргические соединения. С позиций термодинамики, метаболизм представляет собой совокупность процессов, в которой реакции, потребляющие энергию из внешней среды (эндэргонические), сопрягаются с энергодающими (экзэргоническими) реакциями, что позволяет живым существам оказывать постоянное сопротивление нарастанию энтропии. Экзергонические реакции – химические реакции с высокой константой равновесия и отрицательной величиной G, эндергонические – с низкой константой равновесия и положительной величиной G (они обычно не протекают спонтанно). Для начала и завершения этих реакция необходим приток энергии извне. В живых системах экзергонические процессы обычно сопряжены с эндергоническими реакциями, обеспечивая последние необходимым количеством энергии. - экзэргонические реакции , которые сопровождаются выделением энергии; энергия аккумулируется в виде макроэргических соединений; - эндэргонические реакции , для протекания которых необходимы затраты энергии (реакции синтеза и восстановления) Макроэргические соединения – это вещества, содержащие богатые энергией связиПонятие макроэргическая связь довольно условно и применяется для обозначения тех связей, которые гидролизуются в водной среде с выделением значительной энергии. Так, гидролиз концевой фосфоангидрид- ной связи АТФ (АТФ + Н2О → АДФ + Фн), ведет к освобождению 34,5 кДж/моль энергии). Однако, если реакция протекает в неводной среде (например, в липидном слое мембран), то образование и разрушение АТФ протекает без больших затрат энергии. Вещества гидролиз которых, приводит к высвобождению более 21 кДж/моль энергии от- носят к высокоэнергетическим (макроэргам), а вещества освобождающие меньшие количе- ства энергии - к низкоэнергетическим. К макроэргам относят: АТФ, другие трифосфаты нук- леозидов (ГТФ, ЦТФ, УТФ, ТТФ), аргининфосфат, креатинфосфат, ацетилфосфат, 1,3- дифосфоглицерат, фосфоенолпируват и др. К низкоэнергетическим - глюкозо-6-фосфат, глюкозо-1-фосфат, глицерофосфат и другие. Уникальная роль АТФ состоит в том, что она имеет промежуточное значение энергии гидролиза и выполняет роль связующего звена (раз- менной монеты) между высоко- и низкоэнергетическими соединениями. Для протекания эндэргонических реакций необходим внешний источник энергии. Реакции, характеризующиеся высокой константой равновесия К и отрицательной величиной стандартного изменения свободной энергии ΔG, называются экзергоническими. Реакция с очень низкой константой равновесия и, следовательно, с положительной величиной стандартного изменения свободной энергии не протекает спонтанно и не завершается при стандартных условиях без притока энергии извне. Такие процессы называются эндергоническими. В биологических системах эндергонические процессы должны быть сопряжены с экзергоническими таким образом, чтобы эндергонические процессы получали необходимую для своего течения энергию от экзергонических процессов. В подобного рода сопряженных системах эндергонический процесс может осуществляться только при условии, что уменьшение свободной энергии сопряженного с ним экзергонического процесса превышает прирост свободной энергии данного эндергонического процесса.
50. Окислительное фосфорилирование, коэффициент P/О. ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. У животных, растений и грибов окислительное фосфорилирование протекает в митохондриях, у бактерий ферментные системы, осуществляющие этот процесс, находятся в клеточной мембране. Митохондрии окружены белково-фосфолипидной мембраной. Внутри митохондрий идет ряд метаболич. процессов распада пищ. в-в, поставляющих субстраты окисления АН2 для окислительного фосфорилирования. Субстратами окислительного фосфорилирования служат продукты расщепления органических соединений — белки, жиры и углеводы. Однако чаще всего в качестве субстрата используются углеводы. Образовавшиеся в результате гликолиза триозы, и в первую очередь пировиноградная кислота , вовлекаются в дальнейшее окисление, происходящеее в митохондриях.
При этом используется энергия расщепления всех химических связей, что приводит к выделению CO2 , потреблению кислорода и синтезу большого количества АТФ. Эти процессы связаны с окислительным циклом трикарбоновых кислот и дыхательной цепью переноса электронов, где происходят фосфорилирование АДФ и синтез клеточного "топлива" - молекул АТФ. В цикле трикарбоновых кислот электроны, освободившиеся при окислении, переносятся на акцепторные молекулы коферментов ( НАД - никотинамид адениндинуклеотид), которые вовлекают их далее в цепь переноса электронов ( ЭТЦ - электронтранспортную цепь ). Эти события внутри митохондрий происходят в их матриксе . Остальные реакции, связанные с дальнейшим переносом электронов и синтезом АТФ, связаны с внутренней митохондриальной мембраной , с кристами митохондрий. Освободившиеся в процессе окисления в цикле трикарбоновых кислот электроны, акцептированные на коферментах, переносятся затем в дыхательную цепь (цепь переноса электронов), где они соединяются с молекулярным кислородом, образуя молекулы воды. Дыхательная цепь представляет собой ряд белковых комплексов, встроенных во внутреннюю митохондриальную мембрану, и является главной системой превращения энергии в митохондриях. Здесь происходят последовательное окисление и восстановление элементов дыхательной цепи, в результате чего высвобождается небольшими порциями энергия. За счет этой энергии в трех точках цепи из АДФ и фосфата образуется АТФ. Поэтому говорят, что окисление (перенос электронов) сопряжено с фосфорилированием (АДФ + Фн = АТФ), то есть происходит процесс окислительного фосфорилирования. Эффективность окислительного фосфорилирования в митохондриях определяется как отношение величины образовавшегося АТФ к поглащённому кислороду: АТФ/О или P/O (коэф фосфорилирования). Экспериментально определяемые значения P/O, как правило, оказываются меньше 3. Это свидетельствует о том, что процесс дыхания не полностью сопряжен с фосфорилированием. На основании строения и функций компонентов дыхательной цепи предложен механизм окислительного фосфорилирования: 1. Ферменты дыхательной цепи расположены в строго определенной последовательности: каждый последующий белок обладает большим сродством к электронам, чем предыдущий (он более электроположителен, т.е. обладает более положительным окислительно-восстановительным потенциалом). Это обеспечивает однонаправленное движение электронов. 2. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2. 3. Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную ферментативную цепь, по которой электроны движутся (50-200 шт/сек) к своему конечному акцептору – кислороду. В результате образуется вода. 4. Поступающие в дыхательную цепь электроны богаты свободной энергией. По мере их продвижения по цепи они теряют энергию. Часть энергии электронов используется I, III, IV комплексами дыхательных ферментов для перемещения ионов водорода через мембрану в межмембранное пространство. Другая часть рассеивается в виде тепла. Упрощенно сказанное представить в виде равенства:
5. Перенос ионов водорода через мембрану (выкачивание) происходит не случайно, а в строго определенных участках мембраны. Эти участки называются участки сопряжения (или, не совсем точно, пункты фосфорилирования). Они представлены I, III, IV комплексами дыхательных ферментов. В результате работы этих комплексов формируется градиент ионов водорода между внутренней и наружной поверхностями внутренней митохондриальной мембраны. Такой градиент обладает потенциальной энергией. Градиент (Δμ, "дельта мю") получил название электрохимический градиент или протонный градиент. Он имеет две составляющие – электрическую (ΔΨ, "дельта пси") и концентрационную (ΔрН):Δμ = ΔΨ + ΔрН Название "участки сопряжения" возникло из-за того, что появление протонного градиента в результате окислительных процессов обеспечивает в дальнейшем фосфорилирование АДФ до АТФ (см п.п.6). Именно благодаря этим трем ферментным комплексам энергия реакций окисления может передаваться на фосфорилирование, т.е. существует сопряжение (связывание) двух процессов. 6. Как завершение всех предыдущих событий и необходимый их результат происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу (Н+-транспортирующая АТФ-аза, КФ 3.6.3.14.). Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла:
|
48.НАД-зависимые и флавиновые дегидрогеназы Никотинамидзависимые дегидрогеназы содержат в качестве коферментов NAD+ или NADP+ (см. раздел 2). NAD+ и NADP+ - производные витамина PP. Эти коферменты входят в состав активных центров дегидрогеназ, но могут обратимо диссоциировать из комплекса с апоферментами и включаются в состав фермента в ходе реакции. Субстраты NAD- и NADP-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле. Рабочей частью никотинамидных коферментов служит никотинамид (рис. 6-5). Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа: R-CHOH-R1 + NAD+↔ R-CO-R1 + NADH + Н+. Таким образом, NAD+, присоединяя протоны и электроны от различных субстратов, служит главным коллектором энергии окисляемых веществ и главным источником электронов, обладающих высоким энергетическим потенциалом, для ЦПЭ. Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN. Эти коферменты образуются в организме человека из витамина В2 (см. раздел 2). Флавиновые коферменты прочно связаны с апоферментами. Рабочей частью FAD и FMN служит изоаллоксазиновая сопряжённая циклическая система (рис. 6-6). FAD служит акцептором электронов от многих субстратов в реакциях типа: R-CH2-CH2-R1 + Е (FAD) ↔ R-CH=CH-R1 + Е (FADH2), где Е - белковая часть фермента. Большинство FAD-зависимых дегидрогеназ - растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукцинат-дегидрогеназа, находящаяся во внутренней мембране митохондрий. К FMN-содержащим ферментам принадлежит NADH-дегидрогеназа, которая также локализована во внутренней мембране митохондрий; она окисляет NADH, образующийся в митохондриальном матриксе.
51. Строение митохондрий и структурная организация дыхательной цепи. Митохондрии— это постоянные мембранные органеллы. Играют роль энергетических станций клеток. В них протекают процессы окислительного фосфорилирования, также они хранят наследственный материал в виде митохондриальной ДНК. Митохондрия имеет две мембраны: наружную (гладкую) и внутреннюю (образующую выросты — листовидные (кристы) и трубчатые (тубулы)). Мембраны различаются по химическому составу, набору ферментов и функциям. У митохондрий внутренним содержимым является матрике — коллоидное вещество. В матриксе размещается аппарат биосинтеза белка органеллы: 2-6 копий кольцевой ДНК, лишенной гистоновых белков (как у прокариот), рибосомы, набор т-РНК, ферменты редупликации, транскрипции, трансляции, наследственной информации. В осуществлении энергетической функции митохондрий активно участвуют как матрикс, так и поверхность внутренней мембраны, на которой расположена цепь переноса электронов (цитохромы) и АТФ-синтаза, катализирующая сопряженное с окислением фосфорилирование АДФ, что превращает его в АТФ. В клетках эукариот дыхательная цепь расположена во внутренней мембране митохондрий, у дышащих бактерий в цитоплазматической мембране. Компоненты дыхательной цепи – НАДН + Н+, ФАДН2, убихинол (KoQ-H2), цитохромы и вода. Молярные соотношения данных компонентов в дыхательной цепи постоянны и встроены в митохондриальную мембрану в виде 4 белково-липидных комплексов ( НАДН-KoQH2- редуктаза, сукцинат-KoQ-редуктаза, KoQH2-цитохром с-редуктаза и цитохром a-цитохромоксидаза). KoQ (убихинон) – необходимый компонент дыхательной цепи, является производным бензохинона с боковой цепью. KoQ может находится и в окисленном и в востановленном состояии. Это свойство определяет его роль в дыхательной цепи – служить коллектором восстановительных эквивалентов, поставляемых в дыхательную цепь через флавиновые дегидрогеназы. Дополнительный компонент дыхательной цепи- FeS (негемовое железо) – железосерный белок. Он участвует в ОВР протекающей по одноэлектронному типу. Цитохромы дыхательной цепи – гемопротеины. Особую роль играют цитохромы b, c1, c, a, a3.Цитохром a3 – терминальный участок дыхательной цепи – цитохромоксидаза, которая осуществляет окисление цитохрома c с образованием воды.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
52. Разобщение тканевого дыхания и окислительного фосфорилирования. Терморегуляторные функции тканевого дыхания. Функция дыхательной цепи - утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов. Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. Соответственно своим ОВ потенциалам эти соединения в восстановленной форме подключаются к дыхательной цепи, в которой происходит дискриминация Протов и электронов. В результате чего происходит, что тканевое дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» её. Разобщители – соединения, обеспечивающие протонную проводимость. Несопряжённое дыхание (свободное окисление) обеспечивает поддержание температуры тела на более высоком уровне, чем температура окружающей среды. В процессе эволюции у человека сформировались специальные ткани(бурый жир) которые поддерживают постоянной высокую температуру тела за счёт регулируемого разобщения окисления и фосфорилирования в митохондриальной цепи. Процесс разобщения регулируется гормонами. Разобщение процессов дыхания и окислительного фосфорилирования происходит если протоны начинают проникать через внутреннюю мембрану митохондрий. В этом случае выравнивается градиент рН и исчезает движущая сила фосфорилирования. Химические вещества - разобщители называются протонофорами, они способны переносить протоны через мембрану. К таковым относятся 2,4 -динитрофенол, гормоны щитовидной железы и др. (рис. 4.8.3.).
Образовавшаяся АТФ из матрикса в цитоплазму переносится ферментами транслоказами, при этом в обратном направлении в матрикс переносится одна молекула АДФ и одна молекула фосфорной кислоты. Понятно, что нарушение транспорта АДФ и фосфата тормозит синтез АТФ.
Скорость окислительного фосфорилирования зависит в первую очередь от содержания АТФ, чем быстрее она расходуется, тем больше накапливается АДФ, тем больше потребность в энергии и следовательно активнее идет процесс окислительного фосфорилирования. Регуляцию скорости окислительного фосфорилирования концентрацией в клетке АДФ называют дыхательным контролем.
|
53. Нарушения энергетического обмена: гипоэнергетические состояния как результат гипоксии, гипоавитаминоза и др. причин. Причиной гипоэнергетических состояний может быть следующее:
Энергетические процессы в клетках зависят от концентрации и активности большого числа разнообразных гуморальных факторов (витамины, гормоны, продукты обмена, нервные медиаторы, ионы и т. д.). Обмен энергии регулируется деятельностью нервной и эндокринной систем. Кора головного мозга. Эмоциональное возбуждение сопровождается изменением корковой регуляции теплопродукции и повышает ее. Высвобождение энергии усиливается в эректильной фазе травматического шока. Гипоталамус. Одной из важнейших функций гипоталамуса является терморегуляция. При возбуждении латеральных гипоталамических полей увеличивается теплопродукция. Повреждение этих областей, а также медиальной части заднего гипоталамуса ведет к возникновению гипотермии и затрудняет защиту от воздействия холода. Опухоли преоптического поля и туберальной части сопровождаются гипертермией. Гипофиз. Удаление гипофиза приводит к снижению энергетических процессов в результате прекращения регулирующего влияния тропных гормонов (ТТГ, АКТГ) на периферические эндокринные железы. Отсутствует секреция соматотропного гормона, который увеличивает теплообразование за счет стимуляции свободного окисления. При опухолях гипофиза повышается энергетический обмен. Эозинофильная аденома сопровождается гиперпродукцией соматотропного гормона, увеличивающего теплообразование. Базофильная аденома приводит к гиперпродукции тиреотропного (ТТГ) и адренокортикотропного (АКТГ) гормонов, возникает гиперплазия щитовидной железы и коркового слоя надпочечных желез, теплопродукция увеличивается. Щитовидная железа. Тироксин и другие гормоны щитовидной железы являются основными регуляторами проницаемости митохондрий и, следовательно, энергетического обмена. При гиперфункции щитовидной железы усиливается как свободное, так и фосфорилирующее окисление, теплопродукция увеличивается. При уменьшении продукции тироксина (гипофункция щитовидной железы) теплопродукция уменьшается. Надпочечные железы. Адреналэктомия ведет к снижению энергетического обмена. При опухолях надпочечников энергетический обмен повышается. Поджелудочная железа. Инсулин — гормон поджелудочной железы — угнетает теплопродукцию и вызывает гипотермию. Удаление поджелудочной железы повышает освобождение энергии. Половые гормоны. Гормоны половых желез — тестостерон и прогестерон — активизируют свободное окисление, стимулируют высвобождение энергии. Витамины. Свободное окисление активизируется аскорбиновой кислотой. Фосфорилирующее окисление усиливают витамины Е, К, В1, В2, B12, биотин. При В-авитаминозах наблюдается гиперпродукция энергии, поскольку многие из них входят в состав коферментов цикла трикарбоновых кислот и переноса электронов в дыхательной цепи.
|
54. Окислительное декарбоксилирование ПВК: последовательность реакций, строение пируватдегидрогенаного комплекса.Окислительное декарбоксилирование пирувата происходит в матриксе митохондрий. Превращение пирувата в ацетил-КоА описывают следующим суммарным уравнением: СН3-СО-СООН + NAD+ + HSKoA → CH3-CO ∼SKoA + NADH + H+ + CO2 В пируватдегидрогеназный комплекс (ПДК) входят 3 фермента: пируватдекарбоксилаза (Е1), дигидролипоилтрансацетилаза (Е2) и дигидролипоилдегидрогеназа (Е3), а также 5 коферментов: тиаминдифосфат (ТДФ), липоевая кислота,. FAD, NAD+ и КоА. Стадия I. На этой стадии пируват соединяется с ТДФ в составе Е1 и подвергается декарбоксилированию. Стадия П. Дигидролипоилтрансацетилаза (Е2) катализирует перенос атома водорода и ацетильной группы от ТДФ на окисленную форму липоиллизиновых групп с образованием ацетилтиоэфира липоевой кислоты (рис. 6-21). Стадия III. На стадии III КоА взаимодействует с ацетильным производным Е2, в результате чего образуются ацетил-КоА и полностью восстановленный липоильный остаток, простетическая группа Е2 (рис. 6-23). Стадия IV. На стадии IV дигидролипоилде-гидрогеназа (Е3) катализирует перенос атомов водорода от восстановленных липоильных групп на FAD - простетическую группу фермента Е3. Стадия V . На стадии V восстановленный FADH2 передаёт водород на NAD+ с образованием NADH.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
55. Цикл лимонной кислоты.
Цифры 1-8 обозначают реакции цитратного цикла. Цикл начинается с того, что ацетильный остаток конденсируется с оксалоацетатом, в результате чего образуется шестиуглеродное соединение - цитрат. На образование цитрата в каждом обороте цикла расходуется одна молекула оксалоацетата; в результате завершения цикла происходит регенерация оксалоацетата. Таким образом, одна молекула оксалоацетата может многократно использоваться для окисления ацетильных остатков.
|
56.Механизмы регуляции цитратного цикла Образованием оксалоацетата завершается один оборот цитратного цикла. В одном обороте цикла лимонной кислоты в 2 реакциях декарбоксилирования (превращение изоцитрата в а-кетоглутарат и ос-кетоглутарата в сукцинил-КоА) происходит образование 2 молекул СО2. В 4 реакциях цитратного цикла происходит дегидрирование с образованием восстановленных коферментов: 3 молекул NADH+H+ и 1 молекулы FADH2. B составе сукцинатдегидрогеназы. Наконец, на один оборот цикла затрачивается 2 молекулы воды: одна - на стадии образования цитрата, вторая - на стадии гидратации фумарата. На каждую молекулу NADH при образовании молекулы воды в процессе тканевого дыхания синтезируются 3 молекулы АТФ, а на каждую молекулу FADH2 - 2 молекулы АТФ (рис. 6-25). Таким образом, каждый оборот цикла лимонной кислоты сопровождается синтезом 11 молекул АТФ путём окислительного фосфорилирования. Одна молекула АТФ образуется путём субстратного фосфорилирования. 1 - ПДК активируется пируватом, NAD+, КоА; ингибируется NADH и ацетил-КоА; 2 - цитратсинтаза (реакция ускоряется при повышении концентрации оксалоацетата и замедляется при повышении концентрации цитрата, NADH, АТФ и сукцинил-КоА); 3 - изоцитратдегидрогеназа аллостерически активируется АДФ, ионами кальция, ингибируется NADH; 4 - α-кетоглутаратдегидрогеназный комплекс ингибируется NADH, АТФ и сукцинил-КоА, а активируется ионами кальция.
|
Обмен и функции углеводов.
57 Основные углеводы животных,их содержание в тканях, биологическая роль. Основные углеводы пищи. Преваривание углеводов. . Углеводы участвуют во многих метаболических процессах, но прежде всего они являются основными поставщиками энергии. На долю углеводов приходится примерно 75% массы пищевого суточного рациона и более 50% от суточного количества необходимых калорий. Следует отметить и структурную роль углеводов. Так, в виде гликозаминогликанов углеводы входят в состав межклеточного матрикса. Большое число белков (ферменты, белки-транспортёры, белки-рецепторы, гормоны) - гликопротеины, углеводная составляющая которых повышает их специфичность. Например, различия в строении олигосахаридных фрагментов клеточной оболочки эритроцитов обеспечивают групповую принадлежность крови. Из углеводов в процессе метаболизма образуется большое число органических соединений, которые служат исходными субстратами для синтеза липидов, аминокислот, нуклеотидов. Производные углеводов - глюкурониды - участвуют в детоксикации ксенобиотиков и инактивации веществ эндогенного происхождения. Углеводы могут быть синтезированы в организме с использованием других метаболитов: некоторых аминокислот, глицерина, молочной кислоты.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
58.Глюкоза как важн. метаболит углеводного обмена:общая схема источников и путей расходования глюкозы в организма.
59. Катаболизм глюкозы. Аэробный распад
Пути катаболизма глюкозы. 1 - аэробный гликолиз; 2, 3 - общий путь катаболизма; 4 - аэробный распад глюкозы; 5 - анаэробный распад глюкозы (в рамке); 2 (в кружке) - стехиометрический коэффициент. 60Распространение и физиологическое значение аэробного распада глюкозы. . Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя её аэробным путём. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания). Кроме энергетической функции, процесс катаболизма глюкозы может выполнять и анаболические функции. Метаболиты гликолиза используются для синтеза новых соединений. Так,фруктозо-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата - структурного компонента нуклеотидов; 3-фосфоглицерат может включаться в синтез аминокислот, таких как серии, глицин, цистеин (см. раздел 9). В печени и жировой ткани ацетил-КоА, образующийся из пирувата, используется как субстрат при биосинтезе жирных кислот, холестерина, а дигидроксиацетонфосфат как субстрат для синтеза глицерол-3-фосфата (см. раздел 8).
|
62Аэробный распад глюкозы.Гликолитическая оксидоредукция . Суммарное уравнение процесса:С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
Процесс циклического восстановления и окисления НАД в реакциях анаэробного окисления глюкозы получил название гликолитическая оксидоредукция. Субстратное фосфорилирование - синтез богатых энергией фосфорных соединений за счёт энергии окислительно-восстановительных реакций гликолиза и при окислении a-кетоглутаровой кислоты в цикле трикарбоновых кислот.
|
63. Распространение и физ значение анаэробного распада глюкозы Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение как аэробного, так и анаэробного гликолиза. Но преимущественный анаэробный гликолиз и увеличение синтеза лактата служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов.
64.Биосинтез глюкозы.
Цикл Кори
65. Цикл Кори
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
66. Представление о пентозофосфатном пути превращения глюкозы
|
67+69.Свойства и распрастранение гликогенакак резервного полисахарида Обмен глюкозы в печени Гликоген - разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы.
|
70.Роль инсулина ,глюкагона,адреналина в обмене УВ Инсулин — единственный гормон, снижающий содержание глюкозы в крови, это реализуется через:
Глюкагон: стимулирует гликогенолиз, стимулирует глюконеогенез, Адреналин: усиливает глюконеогенез и гликогенолиз, тормозит синтез гликогена в печени и скелетных мышцах, усиливает захват и утилизацию глюкозы тканями, повышая активность гликолитических ферментов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
72. Наследственные нарушения обмена моносахаридов и дичахаридов:галактоземия, непереносимость фруктозы,непереносимость дисахаридов. Гала́ктоземи́я — наследственное заболевание, в основе которого лежит нарушение обмена веществ на пути преобразования галактозы в глюкозу (мутация структурного гена, ответственного за синтез фермента галактозо-1-фосфатуридилтрансферазы).. Таблица 7-5. Нарушения метаболизма фруктозы
Непереносимость дисахаридов - нарушение переваривания дисахаридов (лактозы, сахарозы, мальтозы и др.) вследствие дефицита в кишечной слизистой ферментов дисахаридаз (лактазы и др.). Подобная интестинальная энзимопатия имеет генетическую природу, нередко встречается у нескольких членов одной и той же семьи. Приобретенная (вторичная) дисахаридазная недостаточность может развиваться при различных заболеваниях органов пищеварения (энтеритах, после резекции кишечника, язвенной болезни двенадцатиперстной кишки и др.). Чаще всего встречается непереносимость лактозы.
|
73.Важнейшие липиды тканей человека. Резервные липиды и липиды мембран. Липиды – отн.нер-римы в воде, р-римы в неполярных растворителях (эфир, хлороформ). Значение: Выс.энергетическая ценность (питание и запасание энергии); Теплоизоляция; Электроизоляция вдоль нерв.волокон; Липопротеины – в составе мембран, митохондрий, транспортируют липиды в крови; Гормоны (стероиды); Витамин Е (α-токоферол – антиоксидант, уч.в метаболизме селена). Жирные к-ты (есть ω-номенклатура – нумерация с посл.[ω]-атома С): 1.Насыщенные (например, миристиновая – 14 атомов С, пальмитиновая 16, стеариновая 18); 2.Ненасыщенные: мононенасыщ. (пальмитолеиновая С16, связь 9=10; олеиновая С18, 9=10); полиненасыщ. (линолевая 18С, 9=10, 12=13; арахидоновая 20С, 5=6, 8=9, 11=12, 14=15); эйкозаноиды (производные эйкоза-20С-полиеновых ЖК): -Простаноиды (простагландины, тромбоксаны и простациклины) и –лейкотриены. Почти все природные ненасыщ.ЖК – в цис-конфигурации. Спирты: глицерол, холестерол, высшие спирты (цетиловый – C16H33OH, долихол) Классификация липидов: I.ПРОСТЫЕ ЛИПИДЫ: 1.Жиры (триацилглицеролы; сложн.эфиры ЖК с глицеролом) и 2.Воска (сложн.эфиры ЖК с одноатомными спиртами) II.СЛОЖНЫЕ ЛИПИДЫ(сложн.эфиры ЖК с др.соединениями): 1.Фосфолипиды: глицерофосфолипиды (спирт=глицерол) и сфинголипиды (спирт=сфингозин). Примеры: фосфатидная кислота (почти не присут.в своб.виде, важн.компонент кардиолипинах, наход-ся в мембране митохондрий), фосфатидилхолин (лецитин; в составе сурфактанта), фосфатидилэтаноламин (кефалин), плазмалогены, сфингомиелины (нерв.ткань; сфингозин – аминоспирт; церамид – соед-ин сфингозина с жирн.к-той). 2.Гликолипиды (ЖК, сфингозин +угл.компонент) – преим.на нар.стороне плазм.мембраны в составе углеводов клет.пов-ти). Примеры: галактозоцерамид (мозг, сод-ся в миелине) и глюкозилцерамид, ганглиозиды – соединения с сиаловой к-той (i.e.GM3 – церамид +глюкоза +галактоза +нейраминовая к-та) III.Предшественники и ПРОИЗВОДНЫЕ липидов (i.e.ЖК, глицерол, стероиды, кетон.тела, жирор-римые витамины). Стероиды: [Л3]. Почти у всех природных стероидов – конформация «кресла». Ориентация колец: А и В – и цис-, и транс-, В и С – транс-, С и D – транс (кроме серд.гликозидов). Примеры: холестерол, эргостерол (предшест.витамина D – обр-ся после раскрытия В-кольца). Резервные липиды – запасаются в организме, и их количество меняется в зависимости от возраста, пола, условий питания, видов деятельности.
|
74.Жирные кислоты липидов тканей человека. Кислота называется жирной, если число углеродных атомов в ее молекуле больше четырех. Преобладают длинноцепочечные жирные кислоты (число атомов углерода 16 и выше). Количество углеродных атомов и двойных связей обозначается двойным индексом. Например: С18 : 1 (9-10). В данном случае 18 - число атомов углерода и 1 - количество двойных связей. В скобках указывается местоположение двойных связей (по номерам углеродных атомов).Количество углеродных атомов и двойных связей в молекулах следующих жирных кислот.
Жирные кислоты, имеющие двойную связь в положении (3, обладают очень выраженным антиатеросклеротическим действием (линоленовая). Особенно много (3-содержащих жирных кислот находится в рыбьем жире и других морепродуктах. В организме человека такие жирные кислоты не синтезируются. Жирные кислоты, входящие в состав организма человека, имеют общие черты строения.
По количеству двойных связей жирные кислоты можно разделить на насыщенные (нет двойных связей), мононенасыщенные (есть одна двойная связь) и полиненасыщенные (две или более двойных связей).Свободные жирные кислоты встречаются в очень небольшом количестве. В основном они находятся в составе других липидов. При этом они связаны с другими компонентами липидов сложноэфирной связью (этерифицированы).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
75.Эссенциальные жирные кислоты:омега6,3-кислоты как предшественники синтеза эйкозаноидов.
Главный
субстрат для синтеза эйкозаноидов у
человека - арахидоновая кислота (20:4,
ω-6), так как её содержание в организме
человека значительно больше остальных
полиеновых кислот-предшественников
эйкозаноидовВ меньшем количестве для
синтеза эйкозаноидов используются
эйкозапентаеновая (20:5, ω-3) и эйкозатриеновая
(20:3, ω-6) жирные кислоты.Полиеновые
кислоты с 20 атомами углерода поступают
в организм человека с пищей или
образуются из незаменимых (эссенциальных)
жирных кислот с 18 атомами углерода,
также поступающими с пищей (рис.
8-44).Полиеновые
жирные кислоты, которые могут служить
субстратами для синтеза эйкозаноидов,
входят в состав глицерофосфолипидов Рис. 8-44. Синтез полиеновых жирных кислот с 20 углеродными атомами в организме человека. мембран. Под действием ассоциированной с мембраной фосфолипазы А2 жирная кислота отщепляется от глицерофосфолипида и используется для синтеза эйкозаноидов.
|
76. Биосинтез жирных кислот. Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя илипосле еды. Условно можно выделить 4 этапа биосинтеза: 1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот. 2. Перенос ацетил-SКоА из митохондрий в цитозоль:
Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА. Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом ("яблочный" фермент).
Образование ацетил-SКоА из лимонной кислоты 3. Образование малонил-SКоА из ацетил-SКоА. Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов.
Образование малонил-SКоА из ацетил-SКоА 4. Синтез пальмитиновой кислоты. Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ). Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФН.
Активные группы синтазы жирных кислот В первых двух реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоАк цистеину 3-кетоацилсинтазы. 3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы. Далее кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином. Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину присоединяется малонил-SКоА и цикл повторяется 7 раз до образования остатка пальмитиновой кислоты. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой.
Удлинение цепи жирных кислот Синтезированная пальмитиновая кислота при необходимости поступает в эндоплазматический ретикулум или в митохондрии. Здесь с участием малонил-S-КоА и НАДФН цепь удлиняется до С18 или С20. Удлиняться могут и ненасыщенные жирные кислоты (олеиновая, линолевая, линоленовая) с образованием производных эйкозановой кислоты (С20). Но двойная связь животными клетками вводится не далее 9 атома углерода, поэтому ?3- и ?6-полиненасыщенные жирные кислоты синтезируются только из соответствующих предшественников. Например, арахидоновая кислота может образоваться в клетке только при наличии линоленовой или линолевой кислот. При этом линолевая кислота (18:2) дегидрируется до γ-линоленовой (18:3) и удлиняется до эйкозотриеновой кислоты (20:3), последняя далее вновь дегидрируется до арахидоновой кислоты (20:4). Так формируются жирные кислоты ω6 ряда Для образования жирных кислот ω3-ряда, например, тимнодоновой (20:5), необходимо наличие α-линоленовой кислоты (18:3), которая дегидрируется (18:4), удлиняется (20:4) и опять дегидрируется (20:5).
Реакции синтеза жирных кислот
|
77.β-Окисление жирных кислот β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА.
β-Окисление начинается с дегидрирования ацил-КоА FAD-зависимой ацил-КоА дегидрогеназой с образованием двойной связи между α- и β-атомами углерода в продукте реакции - еноил-КоА. Восстановленный в этой реакции кофермент FADH2 передаёт атомы водорода в ЦПЭ на кофермент Q. В результате синтезируются 2 молекулы АТФ В следующей реакции р-окисления по месту двойной связи присоединяется молекула воды таким образом, что ОН-группа находится у β-углеродного атома ацила, образуя β-гидроксиацил-КоА. Затем β-гидроксиацил-КоА окисляется NАD+-зависимой дегидрогеназой. Восстановленный NADH, окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ. Образовавшийся β-кетоацил-КоА подвергается тиолитическому расщеплению ферментом тиолазой, так как по месту разрыва связи С-С через атом серы присоединяется молекула кофермента А. В результате этой последовательности из 4 реакций от ацил-КоА отделяется двухуглеродный остаток - ацетил-КоА. Жирная кислота, укороченная на 2 атома углерода, опять проходит реакции дегидрирования, гидратации, дегидрирования, отщепления ацетил-КоА. Эту последовательность реакций обычно называют "циклом β-окисления", имея в виду, что одни и те же реакции повторяются с радикалом жирной кислоты до тех пор, пока вся кислота не превратится в ацетильные остатки. Продуктами каждого цикла β-окисления являются FADH2, NADH и ацетил-КоА. Хотя реакции в каждом "цикле" одни и те же, остаток кислоты, который входит в каждый последующий цикл, короче на 2 углеродных атома. В последнем цикле окисляется жирная кислота из 4 атомов углерода, поэтому образуются 2 молекулы ацетил-КоА, а не 1, как в предыдущих. Суммарное уравнение β-окисления, например пальмитоил-КоА может быть представлено таким образом: С15Н31СО-КоА + 7 FAD + 7 NAD+ + 7 HSKoA → 8 СН3-СО-КоА + 7 FADH2 + 7 (NADH + H+). Если рассчитывать выход АТФ при окислении пальмитиновой кислоты), то из общей суммы молекул АТФ необходимо вычесть 2 молекулы, так как на активацию жирной кислоты тратится энергия 2 макроэргических связей
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
78.Биосинтез и использование кетоновых тел в качестве источника энергии Ацетоацетат и 3-гидроксибутират в норме играют роль топлива и являются важным источником энергии. Кетоновые тела поступают в кровь и могут использоваться как источники энергии в других тканях.
Образовавшийся ацетил-КоА далее вступает в цитратный цикл. При этом в связи отсутствием в печени 3-кетоацил-КоА-трансферазы сама печень не способна использовать ацетоацетат в качестве источника энергии, снабжая им те или другие органы. Т.О. ацетоацетат можно рассматривать как водорастворимую транспортную форму ацетильных компонентов. В норме кетоновые тела в крови человека отсутствуют или их концентрация невелика (~ 3 мг/дл). Содержание кетоновых тел увеличивается в таких состояниях, когда источником энергии для организма служат жирные кислоты – при длительной мышечной работе, при голодании, при некоторых болезнях. Через двое суток голодания концентрация кетоновых тел в крови достигает 5-6 мг/дл, через неделю – 40-50 мг/дл. При сахарном диабете концентрация кетоновых тел может повышаться до 300-400 мг/дл, что приводит к метаболическому ацидозу.
|
79.Пищевые жиры и их переваривание. Всасывание продуктов переваривания. Нарушения переваривания и всасывания.
Нарушения переваривания и всасывания жиров. Стеаторея Нарушение переваривания жиров может быть следствием нескольких причин. Одна из них - нарушение секреции жёлчи из жёлчного пузыря при механическом препятствии оттоку жёлчи. Это состояние может быть результатом сужения просвета жёлчного протока камнями, образующимися в жёлчном пузыре, или сдавлением жёлчного протока опухолью, развивающейся в окружающих тканях. Уменьшение секреции жёлчи приводит к нарушению эмульгирования пищевых жиров и, следовательно, к снижению способности панкреатической липазы гидролизовать жиры.
|
80.Ресинтез трацилглицеридов в стенке кишечника. Образование хиломикронов. Транспорт жиров.
Образование хиломикронов Жиры, образовавшиеся в результате ресинтеза в клетках слизистой оболочки кишечника, упаковываются в ХМ. Основной апопротеин в составе ХМ - белок апоВ-48. Этот белок закодирован в том же гене, что и белок ЛПОНП - В-100 который синтезируется в печени. В кишечнике в результате посттранскрипционных превращений "считывается" последовательность мРНК, которая кодирует только 48% от длины белка В-100, поэтому этот белок называется апоВ-48. Белок апоВ-48 синтезируется в шероховатом ЭР и там же гликозилируется. Затем в аппарате Гольджи происходит формирование ХМ, называемых "незрелыми". По механизму экзоцитоза они выделяются в хилус, образующийся в лимфатической системе кишечных ворсинок, и через главный грудной лимфатический проток попадают в кровь. В лимфе и крови с ЛПВП на ХМ переносятся апопротеины Е (апоЕ) и С-П (апоС-П); ХМ превращаются в "зрелые". ХМ имеют довольно большой размер, поэтому после приёма жирной пищи они придают плазме крови опалесцирующий, похожий на молоко, вид. ХМ транспортируют жир к различным тканям, где он утилизируется, поэтому концентрация ХМ в крови постепенно снижается, и плазма опять становится прозрачной. ХМ исчезают из крови в течение нескольких часов.
Рис. 8-20. Путь экзогенных жиров и хиломикронов. *ЛПЛ - липопротеинлипаза, ЖК - жирные кислоты.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
82.Состав и строение транспортных липопротеидов крови
|
83.Депонирование и мобилизация жиров: регуляция синтеза и мобилизация жиров. Роль инсулина ,глюкагона и адреналина. синтез жиров (липогенез) или их распад (липолиз), зависит от поступления пищи и физической активности. В абсорбтивном состоянии под действием инсулина происходит липогенез, в постабсорбтивном состоянии - липолиз, активируемый глюкагоном. Адреналин, секреция которого увеличивается при физической активности, также стимулирует липолиз. Регуляция синтеза жиров. В абсорбтивный период при увеличении соотношения инсулин/ глюкагон в печени активируется синтез жиров. В жировой ткани индуцируется синтез ЛП-липазы в адипоцитах и осуществляется её экспонирование на поверхность эндотелия; следовательно, в этот период увеличивается поступление жирных кислот в адипоциты. Одновременно инсулин активирует белки-переносчики глюкозы - ГЛЮТ-4. Поступление глюкозы в адипоциты и гликолиз также активируются. В результате образуются все необходимые компоненты для синтеза жиров: глицерол-3-фосфат и активные формы жирных кислот. В печени инсулин, действуя через различные механизмы, активирует ферменты путём дефосфорилирования и индуцирует их синтез. В результате увеличиваются активность и синтез ферментов, участвующих в превращении части глюкозы, поступающей с пищей, в жиры. Это - регуляторные ферменты гликолиза, пируватдегидрогеназный комплекс и ферменты, участвующие в синтезе жирных кислот из ацетил-КоА. Результат действия инсулина на обмен углеводов и жиров в печени - увеличение синтеза жиров и секреция их в кровь в составе ЛПОНП. ЛПОНП доставляют жиры в капилляры жировой ткани, где действие ЛП-липазы обеспечивает быстрое поступление жирных кислот в адипоциты, где они депонируются в составе триацилглицеринов. Запасание жиров в жировой ткани - основная форма депонирования источников энергии в организме человека (табл. 8-6). Запасы жиров в организме человека массой 70 кг составляют 10 кг, но у многих людей количество жиров может быть значительно больше. Жиры образуют в адипоцитах жировые вакуоли. Жировые вакуоли иногда заполняют значительную часть цитоплазмы. Скорость синтеза и мобилизации подкожного жира происходит неравномерно в разных частях организма, что связано с неодинаковым распределением рецепторов гормонов на адипоцитах. Регуляция мобилизации жиров. Мобилизация депонированных жиров стимулируется глюкагоном и адреналином и, в меньшей степени, некоторыми другими гормонами (соматотроп-ным, кортизолом). В постабсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему, активирует протеинкиназу А, которая фосфо-рилирует и, таким образом, активирует гормончувствительную липазу, что инициирует липо-лиз и выделение жирных кислот и глицерина в кровь. При физической активности увеличивается секреция адреналина, который действует через β-адренергические рецепторы адипоцитов, активирующие аденилатциклазную систему (рис. 8-24). В настоящее время обнаружено 3 типа β-рецепторов: β1, β2, β3, активация которых приводит к липолитическому действию. К наибольшему липолитическому действию приводит активация β3-рецепторов. Адреналин одновременно действует и на α2-рецепторы адипоцитов, связанные с ингибирующим G-белком, что инактивирует аденилатциклазную систему. Вероятно, действие адреналина двояко: при низких концентрациях в крови преобладает его антилиполитическое действие через α2-рецепторы, а при высокой - преобладает липолитическое действие через β-рецепторы. ля мышц, сердца, почек, печени при голодании или физической работе жирные кислоты становятся важным источником энергии. Печень перерабатывает часть жирных кислот в кетоновые тела, используемые мозгом, нервной тканью и некоторыми другими тканями как источники энергии. В результате мобилизации жиров концентрация жирных кислот в крови увеличивается приблизительно в 2 раза (рис. 8-25), однако абсолютная концентрация жирных кислот в крови невелика даже в этот период. Т1/2 жирных кислот в крови тоже очень мал (менее 5 мин), что означает существование быстрого потока жирных кислот из жировой ткани к другим органам. Когда постабсорбтивный период сменяется аборбтивным, инсулин активирует специфическую фосфатазу, которая дефосфорилирует гормончувствительную липазу, и распад жиров остана Вливается
|
84.Основные фосфолипиды и гликолипиды тканей человека. Глицерофосфолипиды. Фосфолипиды — сложные эфиры многоатомных спиртов глицерина или сфингозина и высших жирных кислот и фосфорной кислоты. В их состав входят также азотсодержащие вещества — холин,этаноламин и серин. Фосфолипиды подразделяются на глицерофосфолипиды и сфингофосфолипиды (в зависимости от много- атомного спирта, входящего в их состав). Наиболее широко распространены в животных тканях глицерофосфолипиды. Глицерофосфолипиды являются производными фосфатидной кислоты, состоят из глицерина, жирных кислот, фосфорной кислоты и обычно азотсодержащих соединений.
R1 и R2 — радикалы жирных кислот, а R3 — радикал азотистого соединения. Глицерофосфолипиды обладают выраженными полярными свойствами за счет того, что часть их молекул (радикалы жир- ных кислот) гидрофобна, а другая (фосфорная кислота и радикал азотистого соединения) — гидрофильна. При помещении в воду глицерофосфолипиды образуют мицеллы. Глицерофосфолипиды подразделяются в зависимости от характера азотистого основания на фосфатидилфолины (лецитины), фос- фатидилэтаноламины (кефалины) и фосфатидилсерины. Вместо азотистого основания глицерофосфолипиды могут содержать шестиуглеродный циклический спирт — инозит, такие липиды на- зывают фосфатидилинозитолами. 1. Фосфатидилхолины (лецитины) — глицерофосфолипиды,состоящие из глицерина, остатков жирных кислот и фосфорной кислоты, азотистого основания — холина.
2. Фосфатидилэтаноламины содержат азотистое основание — этаноламин. Фосфатидилхолины и фосфатидилэтаноламины встречаются в организме человека и животных в наибольшем количестве, они метаболически связаны друг с другом и являются главными липидными компонентами мембран клеток.
3.
Фосфатидилсерины содержат остаток
аминокислоты се
4. Фосфатидилинозитолы в качестве радикала R3 содержат шестиуглеродный циклический спирт инозитол. Их гидролиз приводит к отщеплению жирной кислоты в положении 2 с образованием лизофосфолипидов, оказывающих сильное гемолитическое действие.
Гликолипиды — сложные липиды, содержащие углеводный фрагмент. В животных тканях гликолипиды представлены в основном гликосфинголипидами, состоящими из церамида, построенного из спирта сфингозина и остатка жирной кислоты, остатков сахаров.К гликолипидам относятся галактозилцерамиды глюкозилцерамиды. Галактозилцерамиды встречаются в основном в нервной ткани,содержат гексозу и жирные кислоты с 24 углеродными атомами(лигноцериновую, нервоновую или цереброновую).
Сульфогалактозилцерамиды имеют в своем составе остаток серной кислоты, присоединенный к третьему углеродному атому гексозы. Сульфогалактозилцерамиды содержатся в белом веществе мозга. Глюкозилцерамиды содержат вместо остатка галактозы остаток глюкозы. Они находятся в тканях, отличных от нервной. Из глюкозилцерамидов образуются ганглиозиды, содержащие дополнительно одну или несколько молекул сиаловой кислоты. Вместо остатка глюкозы они чаще содержат сложный олигосахарид. Ганглиозиды содержатся в больших количествах в нервной ткани, выполняют рецепторные функции
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
85.Обмен стероидов. Холестерин как предшественник ряда других стероидов. представление о биосинтезе холестерина Стероиды - производные восстановленных конденсированных циклических систем - циклопентанпергидрофенантренов. Холестерол - стероид, характерный только для животных организмов. Холестерин усваивается из пищи---его эфиры гидролизуются холестеролэстеразой панкреатического или кишечного сока---продукты гидролиза всасываются в киш-ке в виде смешанных мицелл---экзогенный холестерин превращ в эфиры. В2 стадии:активация жир к-ты под действием ацетил-Коа-синтетазы; перенос ацильного остатка ацил-Коа на ОН-группу холестерина,катализирующий ацилхолестеролацилтрынсфераза---свободный холестерин упаковывается в хиломикроны,кот поступают в лимфу,потом в кровь---хиломикроны+ЛВП и получают белки(апоЕ-II)---в обратном направлении из хиломикрона в ЛВП поступают апоА-I и апоА-II.------хиломикроны превращ в в зрелые частицы---ТАГ расщепляются под действием липопротеинлипазы,прикрепляются к стенкам капилляров---обр остаточные хиломикроны------они удаляются из кров русла с помощью ЛНП-рецепторов,и расщепляются лизосомальными ферментами.----Холестерин,освобожд.-ся из остаточных хиломикронов и липопротеинов,включаются в общий фонд этого стероида В пр-се синтеза холестерина можно выделить 3 этапа: 1.Образование мевалоната из 3 остатков а-Коа. а-Коа идет в цитоплазмув виде цитрата. В цитозоле кажд молекула ГМГ-Коа восстанавливается ГМГ-Коа-редуктазой в мевалонат с исп-м 2 NADPH+H 2. Образование сквалена 6 молекулами мевалоната. мевалонат---изопентенилпирофосфаты---(образуется 30углеродное соединение сквалена) 3.Сквален превращается в холестерин. Сквален циклизируется с обр полициклического ядра ланостерина---холестерин.
|
86. Выведение желчных кислот и холестерина из организма
Из организма человека ежедневно выводится около 1 г холестерола. Приблизительно половина этого количества экскретируется с фекалиями после превращения в желчные кислоты . Оставшаяся часть выводится в виде нейтральных стероид ов. Большая часть холестерола, поступившего в желчь, реабсорбируется; считается, что по крайней мере часть холестерола, являющегося предшественником фекальных стеролов , поступает из слизистой оболочки кишечника . Основным фекальным стеролом является копростанол , который образуется из холестерола в нижнем отделе кишечник а под действием присутствующей в нем микрофлоры . Значительная доля солей желчных кислот , поступающих с желчью, всасывается в кишечнике и через воротную вену возвращается в печень , где снова поступает в желчь. Этот путь транспорта солей желчных кислот получил название кишечно-печеночной циркуляции . Оставшаяся часть солей желчных кислот, а также их производные выводятся с фекалиями. Под действием кишечных бактерий первичные желчные кислоты превращаются во вторичные
|
104.Роль гормонов в системе регуляции метаболизма. Клетки-мишени и клеточные рецепторы гормонов. Гормональные сигналы интегрируют и координируют метаболическую активность различных тканей, разносят информацию о размещении и распределении энергоемких веществ и веществ-предшественников синтеза биологических макромолекул к каждому органу. Мишенью для гормона могут служить клетки одной или нескольких тканей. Воздействуя на клетку-мишень, гормон вызывает специфическую ответную реакцию. Характерный признак клетки-мишени - способность воспринимать информацию, закодированную в химической структуре гормона. Клетки-мишени отличают соответствующий гормон от множества других молекул и гормонов благодаря наличию на клетке-мишени соответствующего рецептора со специфическим центром связывания с гормоном. Рецепторы пептидных гормонов и адреналина располагаются на поверхности клеточной мембраны. Рецепторы стероидных и тиреоидных гормонов находятся внутри клетки. Причём внутриклеточные рецепторы для одних гормонов, например глюкокортикоидов, локализованы в цитозоле, для других, таких как андрогены, эстрогены, тиреоидные гормоны, расположены в ядре клетки. Рецепторы по своей химической природе являются белками и, как правило, состоят из нескольких доменов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
105. Механизмы передачи гормональных сигналов в клетке. По механизму действия гормоны можно разделить на 2 группы. К первой группе относят гормоны, взаимодействующие с мембранными рецепторами (пептидные гормоны, адреналин, а также гормоны местного действия - цитокины, эйкозаноиды). Вторая группа включает гормоны, взаимодействующие с внутриклеточными рецепторами. Связывание гормона с рецептором приводит к сопряжению одних молекул с другими (трансдукция сигнала). Таким образом, генерируется сигнал, который регулирует клеточный ответ путём изменения активности или количества ферментов и других белков. 1. Передача гормональных сигналов через мембранные рецепторы Гормоны (первичные посредники), связываясь с рецепторами на поверхности клеточной мембраны, образуют комплекс гормон-рецептор, который трансформирует сигнал первичного посредника в изменение концентрации особых молекул внутри клетки - вторичных посредников. Вторичными посредниками могут быть следующие молекулы: цАМФ, цГМФ, ИФ3, ДАТ, Са2+, NO. Гормоны, взаимодействие которых с рецептором клетки-мишени приводит к образованию цАМФ, действуют через трёхкомпонентную систему, которая включает белок-рецептор, G-белок и фермент аденилатциклазу. Образующийся под действием аденилатциклазы цАМФ активирует протеинкиназу А, фосфорилируюшую ферменты и другие белки, что ведет к изменению скорости метаболизма. 2. Передача сигналов через внутриклеточные рецепторы Стероидные и тиреоидные гормоны связываются с рецепторами внутри клетки и регулируют скорость транскрипции специфических генов
|
107.Изменение гормонального статуса и метаболизма при сахарном диабете.
Сахарный диабет - заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина. диабет I типа - инсулинзависимый (ИЗСД) Инсулинзависимый сахарный диабет - заболевание, вызываемое разрушением р-клеток островков Лангерханса поджелудочной железы. диабет II типа - инсулиннезависимый (ИНСД). Инсулинонезависимый сахарный диабет - общее название нескольких заболеваний, развивающихся в результате относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени (например, дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала и др.) При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния. Для всех форм диабета характерно повышение концентрации глюкозы в крови - гипергликемия.После приёма пищи концентрация глюкозы может достигать 300-500 мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде, т.е. снижается толерантность к глюкозе. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия). К характерным признакам сахарного диабета относят также повышение концентрации в крови кетоновых тел - кетонемия. При низком соотношении инсулин/глюкагон жиры не депонируются, а ускоряется их катаболизм. Печень захватывает жирные кислоты, окисляет их до ацетил-КоА, который, в свою очередь, превращается в β-гидроксимасляную и ацетоуксусную кислоты. В тканях ацетоацетат частично декарбоксилируется до ацетона, запах которого исходит от больных сахарным диабетом и ощущается даже на расстоянии. Увеличение концентрации кетоновых тел в крови (выше 20 мг/дл, иногда до 100 мг/дл) приводит к кетонурии. Накопление кетоновых тел снижает буферную ёмкость крови и вызывает ацидоз. При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Образующийся при этом аммиак вступает в орнитиновый цикл, что приводит к увеличению концентрации мочевины в крови и, соответственно, в моче - азотемия и азотурия. Выделение мочи у больных возрастает в несколько раз и в некоторых случаях достигает 8-9 л в сутки, но чаще не превышает 3-4 л - полиурия. Потеря воды вызывает постоянную жажду - полидипсия.
|
108. Патогенез основных симптомов сахарного диабета
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
109. Регуляция водно-солевого обмена. Строение и функции альдостерона и вазопрессина. Важнейшие параметры вводно-солевого гомеостаза - осмотическое давление, рН и объём внутриклеточной и внеклеточной жидкости. Основные гормоны, участвующие в тонкой регуляции водно-солевого баланса и действующие на дистальные извитые канальцы и собирательные трубочки почек: антидиуретический гормон (АДГ), альдостерон и предсердный натриуретический фактор (ПНФ). Антидиуретический гормон (АДГ), или вазопрессин - пептид с молекулярной массой около 1100 Д, содержащий 9 аминокислот, соединённых одним дисульфидным мостиком. АДГ синтезируется в нейронах гипоталамуса в виде предшественника препрогормона, который поступает в аппарат Гольджи и превращается в прогормон. В составе нейросекреторных гранул прогормон переносится в нервные окончания задней доли гипофиза (нейрогипофиз). Для АДГ существуют 2 типа рецепторов: V1 и V2. Рецепторы V2, опосредующие главный физиологический эффект гормона, обнаружены на базолатеральной мембране клеток собирательных трубочек и дистальных канальцев - наиболее важных клеток-мишеней для АДГ В отсутствие АДГ моча не концентрируется и может выделяться в количествах, превышающих 20 л в сутки (норма 1,0-1,5 л в сутки). Связывание АДГ с V2 стимулирует аденилатциклазную систему и активацию протеинкиназы А. В свою очередь, протеинкиназа А фосфорилирует белки, стимулирующие экспрессию гена мембранного белка - аквапорина-2. Аквапорин-2 перемещается к апикальной мембране собирательных канальцев и встраивается в неё, образуя водные каналы. Это обеспечивает избирательную проницаемость мембраны клеток для воды, которые свободно диффундируют в клетки почечных канальцев и затем поступают в интерстициальное пространство. Рецепторы типа V1 локализованы в мембранах ГМК сосудов. Взаимодействие АДГ с рецептором V1 приводит к активации фосфолипазы С, которая гидролизует фосфатидилинозитол-4,5-бисфосфат с образованием инозитолтрифосфата и диацилглицерола. Инозитолтрифосфат вызывает высвобождение Са2+ из ЭР. Результатом действия гормона через рецепторы V1 является сокращение гладкомышечного слоя сосудов. Альдостерон - наиболее активный минера-локортикостероид, синтезирующийся в коре надпочечников из холестерола. Синтез и секреция альдостерона клетками клубочковой зоны непосредственно стимулируются низкой концентрацией Na+ и высокой концентрацией К+ в плазме крови. На секрецию альдостерона влияют также простагландины, АКТГ. Однако наиболее важное влияние на секрецию альдостерона оказывает ренинангиотензиновая система. В клетках-мишенях гормон взаимодействует с рецепторами, которые могут быть локализованы как в ядре, так и в цитозоле клетки. Образовавшийся комплекс гормон-рецептор взаимодействует с определённым участком ДНК и изменяет скорость транскрипции специфических генов. Результат действия альдостерона - индукция синтеза: а) белков-транспортёров Na+ из просвета канальца в эпителиальную клетку почечного канальца; б) Nа+,К+,-АТФ-азы, обеспечивающей удаление ионов натрия из клетки почечного канальца в межклеточное пространство и переносящей ионы калия из межклеточного пространства в клетку почечного канальца; в) белков-транспортёров ионов калия из клеток почечного канальца в первичную мочу; г) митохондриальных ферментов ЦТК, в частности цитратсинтазы, стимулирующих образование молекул АТФ, необходимых для активного транспорта ионов. Суммарным биологическим эффектом индуцируемых альдостероном белков является увеличение реабсорбции ионов натрия в канальцах нефронов, что вызывает задержку NaCl в организме, и возрастание экскреции калия.
|
110.Система ренин-ангиотензин-альдостерон. Биохимические механизмы возникновения почечной гипертонии. Ренин - протеолитический фермент, продуцируемый юкстагломерулярными клетками, расположенными вдоль конечной части афферентных (приносящих) артериол, входящих в почечные клубочки. Уменьшение АД (кровотечение, потеря жидкости, снижение концентрации NaCl) сопровождается падением перфузионного давления в приносящих артериолах клубочка и соответствующей стимуляцией высвобождения ренина. Субстратом для ренина служит ангиотензиноген. Ангиотензиноген - α2-глобулин, содержащий более чем 400 аминокислотных остатков. Образование ангиотензиногена происходит в печени и стимулируется глюкокортикоидами и эстрогенами. Ренин гидролизует пептидную связь в молекуле ангиотензиногена и отщепляет N-концевой декапептид (ангиотензин I), не имеющий биологической активности. При участии аминопептидаз ангиотензин II превращается в ангиотензин III - гептапептид, проявляющий активность ангиотензина II. Однако концентрация гептапептида в плазме крови в 4 раза меньше концентрации октапептида, и поэтому большинство эффектов являются результатом действия ангиотензина П. Дальнейшее расщепление ангиотензина II и ангиотензина III протекает при участии специфических протеаз (ангиотензиназ). Ангиотензин II оказывает стимулирующее действие на продукцию и секрецию альдостерона клетками клубочковой зоны коры надпочечников, который, в свою очередь, вызывает задержку ионов натрия и воды, в результате чего объём жидкости в организме восстанавливается. Кроме этого, ангиотензин II, присутствуя в крови в высоких концентрациях, оказывает мощное сосудосуживающее действие и тем самым повышает АД.
|
111.Роль гормонов в регуляции обменов кальция и фосфатов.
Основными регуляторами обмена Са2+ в крови являются паратгормон, калыщтриол и каль-цитонин. Паратгормон (ПТГ) - одноцепочечный полипептид, состоящий из 84 аминокислотных остатков (около 9,5 кД), действие которого направлено на повышение концентрации ионов кальция и снижение концентрации фосфатов в плазме крови. ПТГ синтезируется в паращитовидных железах. Органы-мишени для ПТГ - кости и почки. В клетках почек и костной ткани локализованы специфические рецепторы, которые взаимодействуют с паратгормоном, в результате чего инициируется каскад событий, приводящий к активации аденилатциклазы. Внутри клетки возрастает концентрация молекул цАМФ, действие которых стимулирует мобилизацию ионов кальция из внутриклеточных запасов. Ионы кальция активируют киназы, которые фосфорилируют особые белки, индуцирующие транскрипцию специфических генов. В костной ткани При связывании паратгормона с рецепторами клеток-мишеней остеобласты начинают усиленно секретировать инсулиноподобный фактор роста 1 и цитокины. Эти вещества стимулируют метаболическую активность остеокластов. В частности, ускоряется образование ферментов, таких как щелочная фосфатаза и коллагеназа, которые воздействуют на компоненты костного матрикса, вызывают его распад, в результате чего происходит мобилизация Са2+ и фосфатов из кости во внеклеточную жидкость. В почках ПТГ стимулирует реабсорбцию кальция в дистальных извитых канальцах и тем самым снижает экскрецию кальция с мочой, уменьшает реабсорбцию фосфатов. Как и другие стероидные гормоны, кальцитриол синтезируется из холестерола. Действие гормона направлено на повышение концентрации кальция в плазме крови. В коже 7-дегидрохолестерол (провитамин D3) превращается в непосредственного предшественника кальцитриола - холекальциферол (витамин D3). В ходе этой неферментативной реакции под влиянием УФ-излучения связь между девятым и десятым атомами углерода в молекуле холестерола разрывается, раскрывается кольцо В, и образуется холекальциферол. Кальцитриол оказывает воздействие на тонкий кишечник, почки и кости. Подобно другим стероидным гормонам, кальцитриол связывается с внутриклеточным рецептором клетки-мишени. Образуется комплекс гормон-рецептор, который взаимодействует с хроматином и индуцирует транскрипцию структурных генов, в результате чего синтезируются белки, опосредующие действие кальцитриола. Так, например, в клетках кишечника кальцитриол индуцирует синтез Са2+-переносящих белков, которые обеспечивают всасывание ионов кальция и фосфатов из полости кишечника в эпителиальную клетку кишечника и далее транспорт из клетки в кровь, благодаря чему концентрация ионов кальция во внеклеточной жидкости поддерживается на уровне, необходимом для минерализации органического матрикса костной ткани. В почках кальцитриол стимулирует реабсорбцию ионов кальция и фосфатов. Кальцитонин - полипептид, состоящий из 32 аминокислотных остатков с одной дисульфидной связью. Гормон секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидных желёз в виде высокомолекулярного белка-предшественника. Кальцитонин - антагонист паратгормона. Он ингибирует высвобождение Са2+ из кости, снижая активность остеокластов. Кроме того, кальцитонин подавляет канальцевую реабсорбцию ионов кальция в почках, тем самым стимулируя их экскрецию почками с мочой.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
112. Причины и проявления рахита, гипо и гиперпаратироидизма.
Рахит - заболевание детского возраста, связанное с недостаточной минерализацией костной ткани. Нарушение минерализации кости - следствие дефицита кальция. Рахит может быть обусловлен следующими причинами: недостатком витамина D3 в пищевом рационе, нарушением всасывания витамина D3 в тонком кишечнике, снижением синтеза предшественников кальцитриГола из-за недостаточного времени пребывания на солнце, дефектом 1α-гидроксилазы, дефектом рецепторов кальцитриола в клетках-мишенях. Всё это вызывает снижение всасывания кальция в кишечнике и снижение его концентрации в крови, стимуляцию секреции паратгормона и вследствие этого мобилизацию ионов кальция из кости. При рахите поражаются кости черепа; грудная клетка вместе с грудиной выступает вперёд; деформируются трубчатые кости и суставы рук и ног; увеличивается и выпячивается живот; задерживается моторное развитие. Основные способы предупреждения рахита - правильное питание и достаточная инсоляция. При первичном гиперпаратиреозе нарушается механизм подавления секреции паратгормона в ответ на гиперкальциемию. Это заболевание встречается с частотой 1:1000. Причинами могут быть опухоль околощитовидной железы (80%) или диффузная гиперплазия желёз, в некоторых случаях рак паращитовидной железы (менее 2%). Избыточная секреция паратгормона приводит к повышению мобилизации кальция и фосфатов из костной ткани, усилению реабсорбции кальция и выведению фосфатов в почках. Вследствие этого возникает гиперкальциемия, которая может приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У больных появляются общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц, увеличивается риск переломов позвоночника, бедренных костей и костей предплечья. Увеличение концентрации фосфата и ионов кальция в почечных канальцах может служить причиной образования в почках камней и приводит к гиперфосфатурии и гипофосфатемии. Вторичный гиперпаратиреоз встречается при хронической почечной недостаточности и дефиците витамина D3 и сопровождается гипокальциемией, связанной в основном с нарушением всасывания кальция в кишечнике из-за угнетения образования кальцитриола поражёнными почками. У больных развивается повреждение скелета (остеопороз) вследствие повышения мобилизации кальция из костной ткани. В некоторых случаях (при развитии аденомы или гиперплазии околощитовидных желёз) автономная гиперсекреция паратгормона компенсирует гипокальциемию и приводит к гипер-кальциемии (третичный гиперпаратиреоз). Основной симптом гипопаратиреоза, обусловленный недостаточностью паращитовидных желёз, - гипокальциемия. Понижение концентрации ионов кальция в крови может вызвать неврологические, офтальмологические нарушения и нарушения ССС, а также поражения соединительной ткани. У больного гипопарати-реозом отмечают повышение нервно-мышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
|
113. Изменение метаболизма при гипо и гипертиреозе. Гипотиреоз у новорождённых приводит к развитию кретинизма, который проявляется множественными врождёнными нарушениями и тяжёлой необратимой задержкой умственного развития. Гипотиреоз развивается вследствие недостаточности йодтиронинов. Обычно гипотиреоз связан с недостаточностью функции щитовидной железы, но может возникать и при заболеваниях гипофиза и гипоталамуса. Наиболее тяжёлые формы гипотиреоза, сопровождающиеся слизистым отёком кожи и подкожной клетчатки, обозначают термином "микседема" Характерные проявления заболевания: снижение частоты сердечных сокращений, вялость, сонливость, непереносимость холода, сухость кожи. Эти симптомы развиваются вследствие снижения основного обмена, скорости гликолиза, мобилизации гликогена и жиров, потребления глюкозы мышцами, уменьшения мышечной массы и снижения теплопродукции. В настоящее время у взрослых людей частой причиной гипотиреоза является хронический аутоиммунный тиреоидит, приводящий к нарушению синтеза йодтиронинов (зоб Хашимото). Гипотиреоз может быть также результатом недостаточного поступления йода в организм -эндемический зоб. Эндемический зоб (нетоксический зоб) часто встречается у людей, живущих в районах, где содержание йода в воде и почве недостаточно. Если поступление йода в организм снижается (ниже 100 мкг/сут), то уменьшается продукция йодтиронинов, что приводит к усилению секреции ТТГ (из-за ослабления действия йодтиронинов на гипофиз по механизму отрицательной обратной связи), под влиянием которого происходит компенсаторное увеличение размеров щитовидной железы (гиперплазия), но продукция йодтиронинов при этом не увеличивается. Гипертиреоз возникает вследствие повышенной продукции йодтиронинов. Диффузный токсический зоб (базедова болезнь, болезнь Грейвса) - наиболее распространённое заболевание щитовидной железы. При этом заболевании отмечают увеличение размеров щитовидной железы (зоб), повышение концентрации йодтиронинов в 2-5 раз и развитие тиреотоксикоза. Характерные признаки тиреотоксикоза: увеличение основного обмена, учащение сердцебиений, мышечная слабость, снижение массы тела (несмотря на повышенный аппетит) , потливость, повышение температуры тела, тремор и экзофтальм (пучеглазие). Эти симптомы отражают одновременную стимуляцию йодтиронинами как анаболических (рост и дифференцировка тканей), так и катаболических (катаболизм углеводов, ли-пидов и белков) процессов. Гипертиреоз может возникать в результате различных причин: развитие опухоли, тиреоидит, избыточное поступление йода и йодсодер-жащих препаратов, аутоиммунные реакции.
|
114. Половые гормоны: строение,влияние на обмен веществ.
Мужские половые гормоны вырабатываются в основном в мужских половых железах - в интерстициальных клетках Лейдига семенников (95%). Небольшое количество андрогенов образуется в коре надпочечников. Путь биосинтеза андрогенов в яичках и коре надпочечников одинаков. Предшественником андрогенов, как и других стероидных гормонов, служит холестерол который либо поступает из плазмы в составе ЛПНП, либо синтезируется в самих железах из ацетил-КоА. Тестостерон. Превращение прегненолона в тестостерон катализируется пятью микросо-мальными ферментами и может протекать двумя путями: через образование дегидроэпиандростерона или через образование прогестерона (что, по-видимому, преобладает в семенниках человека). Суточная секреция тестостерона у мужчин составляет в норме примерно 5 мг и сохраняется на протяжении всей жизни организма. К мишеням тестостерона относят эмбриональные вольфовы структуры, сперматогонии, мышцы, кости, почки, мозг. Подобно другим стероидным гормонам, андрогены образуют внутри клетки комплекс с рецептором, который связывается с определённым участком хроматина, активируя специфические гены, белковые продукты которых опосредуют биологические эффекты андрогенов. Физиологическое действие андрогенов различно в разные периоды жизни организма. У эмбриона под действием андрогенов из вольфова протока образуются придаток яичка (эпидидимис), семявыносящий проток и семенной пузырёк. У плода мужского пола происходит маскулинизация мозга. Поскольку андрогены в организме обладают мощным анаболическим действием и стимулируют клеточное деление, повышенный уровень андрогенов в препубертатный период приводит к скачкообразному увеличению линейных размеров тела, увеличению скелетных мышц, росту костей, но одновременно способствуют и остановке роста, так как стимулируют сращение эпифизов длинных костей с их стволами. Андрогены вызывают изменение структуры кожи и волос, снижение тембра голоса вследствие утолщения голосовых связок и увеличения объёма гортани, стимулируют секрецию сальных желёз. В яичниках синтезируются женские половые гормоны - эстрогены и прогестины, среди которых наиболее активны 17β-эстрадиол и прогестерон Согласно современным представлениям, образование эстрогенов яичников предполагает выработку андрогенов (андростендиона) в клетках теки фолликулов с последующей ароматизацией андрогенов в клетках гранулёзы. В детском возрасте незрелые яичники вырабатывают небольшое количество гормонов, поэтому концентрация эстрогенов в крови низкая. В пубертатный период чувствительность гипоталамо-гипофизарной системы к действию ЛГ и ФСГ снижается. Импульсная секреция гонадотропин-рилизинг-гормона устанавливает суточный ритм секреции ЛГ и ФСГ. В начале каждого менструального цикла секреция ФСГ и ЛГ вызывает развитие первичных фолликулов. Созревающий фолликул в результате совместного действия ЛГ, стимулирующего продукцию андрогенов клетками теки, и ФСГ, стимулирующего ароматизацию андрогенов, секретирует эстрогены, которые по механизму отрицательной обратной связи угнетают секрецию ФСГ. Концентрация ФСГ в крови остаётся низкой ещё и в результате торможения секреции этого гормона белком ингибином, выделяемым яичниками. По мере созревания фолликула (фолликулярная фаза) концентрация эстрадиола повышается, чувствительность гипофизарных клеток к гонадолиберину возрастает, и эстрадиол по механизму положительной обратной связи повышает секрецию ЛГ и ФСГ. Повышение секреции ЛГ приводит к овуляции - освобождению яйцеклетки из лопнувшего фолликула. После овуляции клетки гранулёзы превращаются в жёлтое тело, которое, помимо эстрадиола, начинает вырабатывать всё большее количество основного гормона лютеиновой фазы - прогестерона (прогестина). Если возникает беременность, жёлтое тело продолжает функционировать и секретировать прогестерон, однако на более поздних этапах беременности прогестерон в основном продуцируется плацентой. Если оплодотворение не происходит, высокая концентрация прогестерона в плазме крови по механизму отрицательной обратной связи угнетает активность гипоталамо-гипофизарной системы, тормозится секреция ЛГ и ФСГ, жёлтое тело разрушается, и снижается продукция стероидов яичниками. Эстрогены связываются с внутриклеточными рецепторами и, подобно другим стероидным гормонам, регулируют транскрипцию структурных генов. Предполагается, что эстрогены индуцируют синтез свыше 50 различных белков, участвующих в проявлении физиологических эффектов эстрогенов. Эстрогены оказывают влияние на обмен липидов. Так, увеличение скорости синтеза ЛПВП и торможение образования ЛПНП, вызываемое эстрогенами, приводит к снижению содержания холестерола в крови. Действие прогестерона в основном направлено на репродуктивную функцию организма. Образование прогестерона отвечает за увеличение базальной температуры тела на 0,2-0,5 °С, которое происходит сразу после овуляции и сохраняется на протяжении лютеиновой фазы менструального цикла. При высоких концентрациях прогестерон взаимодействует с рецепторами, локализованными в клетках почечных канальцев, конкурируя таким образом с альдостероном. Прогестерон может также оказывать действие и на ЦНС, в частности вызывать некоторые особенности поведения в предменструальный период.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
115.Распад ГЕМА Первая реакция катаболизма гема происходит при участии NADPH-зависимого ферментативного комплекса гемоксигеназы. Ферментная сисгема локализована в мембране ЭР, в области электронтранспортных цепей микросомального окисления. Фермент катализирует расщепление связи между двумя пиррольными кольцами, содержащих винильные остатки, - таким образом, раскрывается структура кольца. В ходе реакции образуются линейный тетрапир-рол - биливердин(пигмент жёлтого цвета) и монооксид углерода (СО), который получается из углерода метениловой группы. Биливердин восстанавливается до билирубина NADPH-зависимым ферментом биливердинредуктазой. Дальнейший метаболизм билирубина происходит в печени. Билирубин, образованный в клетках РЭС (селезёнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином. Эту форму билирубина называют неконъюгированным билирубином. Комплекс "альбумин-билирубин", доставляемый с током крови в печеНb, на поверхности плазматической мембраны гепатоцита диссоциирует. Высвобожденный билирубин образует временный комплекс с липидами плазматической мембраны. Облегчённая диффузия билирубина в гепатоциты осуществляется двумя типами белков-переносчиков: лигандина (он транспортирует основное количество билирубина) и протеина Z. Активность поглощения билирубина гепатоцитом зависит от скорости его метаболизма в клетке. В гладком ЭР гепатоцитов к билирубину присоединяются (реакция конъюгации) полярные группы, главным образом от глюкуроновой кислоты.Билирубин имеет 2 карбоксильные группы, поэтому может соединяться с 2 молекулами глюкуроновой кислоты, образуя хорошо растворимый в воде конъюгат - диглюкуронид билирубина (конъюгированный, или прямой, билирубин). Секреция конъюгированного билирубина в жёлчь идёт по механизму активного транспорта, т.е. против градиента концентрации. В норме диглюкуронид билирубина - главная форма экскреции билирубина в жёлчь, однако не исключается присутствие небольшого количества моноглюкуронида. В кишечнике поступившие билирубинглюкурониды гидролизуются специфическими бактериальными ерментами β-глюкуронидазами, которые гидролизуют связь между билирубином и остатком глюкуроновой кислоты. Освободившийся в ходе этой реакции билирубин под действием кишечной микрофлоры восстанавливается с образованием группы бесцветных тет-рапиррольных соединений – уробилиногенов. В норме большая часть бесцветных уробилиногенов, образующихся в толстой кишке, под действием кишечной микрофлоры окисляется в прямой кишке до пигмента коричневого цвета уробилина и удаляется с фекалиями.
|
116.Нарушение обмена билирубина Причинами гипербилирубинемии могут быть увеличение образования билирубина, превышающее способность печени экскретировать его, или повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах. Гипербилирубинемию отмечают также при закупорке желчевыводящих протоков печени. Пожелтение тканей из-за отложения в них билирубина называют желтухой. Гемолитическая (надпечёночная) желтуха - результат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающим способность печени к его выведению. Основная причина надпечёночной желтухи - наследственные или приобретённые гемолитические анемии. При гемолитических анемиях, вызванных сепсисом, лучевой болезнью, дефицитом глюкозо-6-фосфатдегидрогеназы эритроцитов, та-лассемией, переливанием несовместимых групп крови, отравлением сульфаниламидами, количество освобождающегося из эритроцитов гемоглобина за сутки может доходить до 45 г (при норме 6,25 г), что значительно увеличивает образование билирубина. Один из главных признаков гемолитической желтухи - повышение содержания в крови не-конъюгированиого (непрямого) билирубина. Печёночно-клеточная (печёночная) желтуха обусловлена повреждением гепатоцитов и жёлчных капилляров, например, при острых вирусных инфекциях, хроническом и токсических гепатитах. Причина повышения концентрации билирубина в крови - поражение и некроз части печёночных клеток. Происходит задержка билирубина в печени, чему способствует резкое ослабление метаболических процессов в поражённых гепатоцитах, которые теряют способность нормально выполнять различные биохимические и физиологические процессы, в частности переводить конъюгированный (прямой) билирубин из клеток в жёлчь против градиента концентрации. При печёночно-клеточной желтухе повышается концентрация в крови как общего билирубина, так и обеих его фракций - неконъюгированного (непрямого) и конъюгированного (прямого). Механическая, или обтурационная (подпечёночная), желтуха развивается при нарушении желчеотделения в двенадцатиперстную кишку. Это может быть вызвано закупоркой жёлчных протоков, например при желчнокаменной болезни, опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки, хроническим воспалением поджелудочной железы или послеоперационным сужением общего жёлчного протока .
|
117.Диагностическое значение определения билирубина В настоящее время для определения содержания билирубина в сыворотке (плазме) крови используют предложенный в 1916 г. Ван дер Бергом метод определения билирубина в сыворотке крови, основанный на диазореакции. В нормальном состоянии концентрация общего билирубина в плазме составляет 0,3-1 мг/дл (1,7-17 мкмоль/л), 75% от общего количества билирубина находится в неконъюгированной форме (непрямой билирубин). В клинике конъ-югированный билирубин называют прямым, потому что он водорастворим и может быстро взаимодействовать с диазореагентом, образуя соединение розового цвета, - это и есть прямая реакция Ван дер Берга. Неконъюгированный билирубин гидрофобен, поэтому в плазме крови содержится в комплексе с альбумином и не реагирует с диазореактивом до тех пор, пока не добавлен органический растворитель, например этанол, который осаждает альбумин. Неконъюгированный илирубин, взаимодействующий с азокрасителем только после осаждения белка, называют непрямым билирубином. Когда содержание билирубина превышает норму, говорят о гипербилирубинемии. В зависимости от того, концентрация какого типа билирубина повышена в плазме - неконъюгированного или конъюгированного, - гипербилирубинемию классифицируют как неконъюгированную и конъюгированную.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
118.Токсичность кислорода:образование активных форм молекулы кислорода могут принимать по одному электрону из различных реакций и превращаться в активные формы О2+е---О2минус+е----Н2О2+е и Н---Н2О+ОНминус к ативным формам относятся гидроксил гр-па,супероксиданион,перекись водорода неферментативные формы-витамины Е, С, каротиноиды-могут останавливать развитие цепи свободнорадикальных реакций. Е-наиб активен действует в мембран липидах,кот н защищает от окисления ферментативные-ряд ферментов,кот инактивируют активные формы кислорода,-супероксиддисмутаза,каталаза, глутатионпероксидаза
|
119. Повреждение мембран в результате перекисного окисления липидов. ПОЛ - цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.Стадии перекисного окисления липидов 1) Инициация: образование свободного радикала (L•)
Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала. 2) Развитие цепи: L • + О2 → LOO • LOO• + LH → LOOM + LR• Развитие цепи происходит при присоединении О2, в результате чего образуется липопе-роксирадикал LOO• или пероксид липида LOOH.ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других. 3) Разрушение структуры липидов
Конечные продукты перекисного окисления полиеновых кислот - малоновый диальдегид и гидропероксид кислоты. 4) Обрыв цепи - взаимодействие радикалов между собой: LOO• + L• → LOOH + LH L• + vit E → LH + vit E• vit E• + L• → LH + vit Еокисл. В. Повреждение клеток в результате перекрестное окислени лепидовАктивные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении.Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления.Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ко-валентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции.ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов - всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липи-ды, обычно добавляют антиоксиданты - вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи. Биохимия крови. 120.Полиморфные формы гемоглобина Дефицит гемоглобина может быть вызван, во-первых, уменьшением количества молекул самого гемоглобина (см.анемия), во-вторых, из-за уменьшенной способности каждой молекулы связать кислород при том же самом парциальном давлении кислорода. Гипоксемия — это уменьшение парциального давления кислорода в крови, её следует отличать от дефицита гемоглобина. Хотя и гипоксемия, и дефицит гемоглобина являются причинами гипоксии. Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов. Гемоглоби́н A, или ΗbA — нормальный гемоглобин взрослого человека. Этот белок представляет собой тетрамер, состоящий из двух пар полипептидных цепей — мономеров: двух мономеров α-цепей и двух мономеров β-цепей (так называемый гемоглобин A, или гемоглобин α2β2), или двух мономеров α и двух мономеров δ (гемоглобин Α2, или гемоглобин α2δ2).
Гемоглоби́н С (Hemoglobin C), или ΗbC — один из мутантных гемоглобинов. Гемоглоби́н E (HbE, эмбриональный гемоглобин) — эмбриональный тип гемоглобина человека. Гемоглобин E — белок-тетрамер. Выявлены подтипы эмбрионального гемоглобина Gower 1, Gower 2 и Portland 2. Все эти типы отличаются по строению полипептидных цепей как от более позднего фетального гемоглобина HbF, так и от взрослого типа гемоглобина HbA. В составе эмбрионального гемоглобина обнаружены цепи типов ζ и ε, не встречающиеся в составе других гемоглобинов. Gower 1 имеет состав ζ2ε2, Gower 2 — α2ε2, Portland 2 — ζ2β2[1]. Гемоглоби́н S (Hemoglobin S, HbS) — это особая мутантная форма гемоглобина, образующаяся у больных с серповидно-клеточной анемией и склонная к кристаллизации вместо образования нормальной четвертичной структуры и растворения в цитоплазме эритроцита. Гемоглобин F — это белок-гетеротетрамер из двух α-цепей и двух γ-цепей глобина, или гемоглобин α2γ2. Этот вариант гемоглобина есть и в крови взрослого человека, но в норме он составляет менее 1 % от общего количества гемоглобина крови взрослого и определяется в 1-7 % от общего числа эритроцитов крови. Однако у плода эта форма гемоглобина является доминирующей, основной.
|
.Распад Гемма.Обезвреживание билирубина За сутки у человека распадается около 9 г гемопротеинов, в основном это гемоглобин эритроцитов. Эритроциты живут 90-120 дней, после чего лизируются в кровеносном русле или в селезенке.При разрушении эритроцитов в кровяном русле высвобождаемый гемоглобин образует комплекс с белком-переносчикомгаптоглобином (фракция α2-глобулинов крови) и переносится в клетки ретикуло-эндотелиальной системы (РЭС) селезенки (главным образом), печени и костного мозга. Синтез билирубина В клетках РЭС гем в составе гемоглобина окисляется молекулярным кислородом. В реакциях последовательно происходит разрыв метинового мостика между 1-м и 2-м пиррольными кольцами гема с их восстановлением, отщеплением железа и белковой части и образованием оранжевого пигмента билирубина.
Реакции синтеза билирубина Билирубин – токсичное, жирорастворимое вещество, способное нарушать окислительное фосфорилирование в клетках. Особенно чувствительны к нему клетки нервной ткани.
Строение билирубина Выведение билирубина Из клеток ретикуло-эндотелиальной системы билирубин попадает в кровь. Здесь он находится в комплексе с альбумином плазмы, в гораздо меньшем количестве – в комплексах с металлами, аминокислотами, пептидами и другими малыми молекулами. Образование таких комплексов не позволяет выделяться билирубину с мочой. Билирубин в комплексе с альбумином называется свободный(неконъюгированный) или непрямой билирубин.
Этапы метаболизма билирубина в организме Из сосудистого русла в гепатоциты билирубин попадает с помощью белка-переносчика (лигандина). В клетке протекает реакция связывания билирубина с УДФ-глюкуроновой кислотой, при этом образуются моно- и диглюкурониды. Кроме глюкуроновой кислоты, в реакцию могут вступать сульфаты, фосфаты, глюкозиды. Билирубин-глюкуронид получил название связанный (конъюгированный) илипрямой билирубин.
После образования билирубин-глюкурониды АТФ-зависимым переносчиком секретируются в желчные протоки и далее в кишечник, где при участии бактериальной β-глюкуронидазы превращаются в свободный билирубин. Одновременно некоторое количество билирубин-глюкуронидов может попадать (особенно у взрослых) из желчи в кровь по межклеточным щелям. Таким образом, в крови в норме одновременно существуют две формы билирубина: свободный, попадающий сюда из клеток РЭС (около 80% всего количества), и связанный, попадающий из желчных протоков (до 20%). Превращение в кишечнике В кишечнике билирубин подвергается восстановлению под действием микрофлоры до мезобилирубина и мезобилиногена (уробилиногена). Часть последних всасывается и с током крови вновь попадает в печень, где окисляется до ди- и трипирролов. При этом в здоровом организме в общий круг кровообращения и в мочу мезобилирубин и уробилиноген не попадают, а полностью задерживаются гепатоцитами. Оставшаяся в кишечнике часть пигментов ферментами бактериальной флоры толстого кишечника восстанавливается достеркобилиногена и выделяется из организма, окрашивая кал. Незначительное количество стеркобилиногена через геморроидальные вены попадает в большой круг кровообращения, отсюда в почки и выделяется с мочой. На воздухе стеркобилиноген и уробилиноген превращаются, соответственно, в стеркобилин и уробилин.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
123.Нарушение обмена билирубина:желтухи Обтурационная(закупорка желчевывод протоков, паразитарные,поствоспалительные,постоперацион периоды): КРОВЬ:Общий билирубин-повышен; Непрямой –повышен; Прямой-повышен МОЧА:прямой +; уробилин +; КАЛ: стеркобилин – Паренхимотозная(гепатит,цирроз,отравления,наследственно): КРОВЬ:повышен;повышен/норма;резко увеличен; МОЧА:+, -; КАЛ:+ Гемолитическая(повышенный гемолиз,трансфузия,ожоги,инфекция,интоксикация): КРОВЬ:повыш; повыш; норма или повыш; МОЧА:-, +; КАЛ:норма или повыш ФИЗИОЛОГИЧЕская(у новорожден)(неразвитость ферментативной систмы): КРОВЬ:пов; пов; норма или пов; МОЧА-,-; КАЛ-
|
124.Основные свойства белковых фракций крови и значение их определения для диагностики заболеваний. Энзимодиагностика. Белковые фракции представляют собой отдельные виды белков крови: альбумин, альфа1-, альфа2-, бета- и гамма-глобулины. Их исследование используется в качестве дополнительного теста в диагностике многих заболеваний. Повышение альфа-1- и альфа-2-глобулинов может наблюдаться при острых и обострениях хронических воспалительных процессов, при диффузных заболеваниях соединительной ткани (системная красная волчанка, ревматизм, ревматоидный артрит и др.), злокачественных опухолях, некоторых болезнях почек, протекающих с нефротическим синдромом (гломерулонефрит, амилоидоз и др.). Снижение уровня альфа-2-глобулинов может наблюдаться при хроническом панкреатите, сахарном диабете, реже при токсических гепатитах. Повышение содержания бета-глобулинов чаще всего встречается у людей с нарушением липидного (жирового) обмена, в том числе у пациентов с атеросклерозом, ишемической болезнью сердца, гипертонией. Снижение бета-глобулинов встречается реже и обычно обусловлено общим дефицитом белков плазмы. Повышение количества гамма-глобулинов, являющихся основными «поставщиками» антител, нередко наблюдается при хронических заболеваниях печени (хронический гепатит, цирроз), хронических инфекциях, некоторых аутоиммунных заболеваниях (ревматоидный артрит, хронический аутоиммунный гепатит и др.), миеломной болезни. Снижение гамма-глобулинов в крови встречается в норме у детей в возрасте 3-4 месяцев (физиологическое снижение), а у взрослых всегда имеет патологический характер и обычно указывает на врожденные или приобретенные иммунодефицитные состояния, нередко наблюдается при системной красной волчанке. Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
|
125. Коллаген: особенности аминокислотного состава, первичной и пространственной структуры. Коллаген - основной структурный белок межклеточного матрикса. Он составляет от 25 до 33% общего количества белка в организме, т.е. -6% массы тела. Название "коллаген" объединяет семейство близкородственных фибриллярных белков, которые являются основным белковым элементом кожи, костей, сухожилий, хряща, кровеносных сосудов, зубов. Коллаген - ярко выраженный полиморфный белок. В настоящее время известно 19 типов коллагена, которые отличаются друг от друга по первичной структуре пептидных цепей, функциям и локализации в организме. 95% всего коллагена в организме человека составляют коллагены I, II и III типов, которые образуют очень прочные фибриллы. Молекулы коллагена состоят из трёх полипептидных цепей, называемых α-цепями. Идентифицировано более 20 α-цепей, большинство которых имеет в своём составе 1000 аминокислотных остатков, но цепи несколько отличаются аминокислотной последовательностью. В состав коллагенов могут входить три одинаковые или разные цепи. каждая третья аминокислота в полипептидной цепи представлена глицином, около 1/4 аминокислотных остатков составляют пролин или 4-гидроксипролин, около 11% - аланин. В коллагене отсутствуют такие аминокислоты, как цистеин и триптофан, α гистидин, метионин и тирозин находятся лишь в очень небольшом количестве. В составе первичной структуры α-цепи коллагена содержится также необычная аминокислота - гидроксилизин. Полипептидную цепь коллагена можно представить как последовательность триплетов Гли-X-Y, где X и Y могут быть любыми аминокислотами, но чаще в положении X стоит пролин, а в положении Y - гидроксипролин или гидроксилизин. Пролин благодаря своей структуре вызывает изгибы в полипептидной цепи, стабилизируя ле-возакрученную спиральную конформацию. На один виток спирали приходится 3 аминокислотных остатка, а не 3,6, как это характерно для вторичной структуры глобулярных белков. пираль пептидной цепи коллагена стабилизированасилами стерического отталкивания пирролидиновых колец в остатках пролина. Важную роль в формировании коллагеновых фибрилл играют модифицированные аминокислоты: гидроксипролин и гидроксилизин. Гидроксильные группы гидроксипролина соседних цепей тропоколлагена образуют водородные связи, укрепляющие структуру коллагеновых фибрилл.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
126.Особенности строения и функции эластина. эластин (также белок межклеточного матрикса) обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях лёгких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной, но после снятия нагрузки они возвращаются к свёрнутой конформации. Эластин содержит в составе около 800 аминокислотных остатков, среди которых преобладают аминокислоты с неполярными радикалами, такие как глицин, валин, аланин. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина; полностью отсутствует гидроксилизин. Наличие большого количества гидрофобных радикалов препятствует созданию стабильной глобулы, в результате полипептидные цепи эластина не формируют регулярные вторичную и третичную структуры, а принимают в межклеточном матриксе разные конформации с примерно равной свободной энергией
|
127.Гликозаминогликаны и протеогликаны. Строение и функции. Гликозаминогликаны - линейные отрицательно заряженные гетерополисахариды. Протеогликаны - высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани. Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы. Полисахаридные компоненты у разных протеогликанов разные. Гликозаминогликаны и протеогликаны, являясь обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей. Благодаря особенностям своей структуры и физико-химическим свойствам, протеогликаны и гликозаминогликаны могут выполнять в организме человека следующие функции:
|
128. Особенности энергетического обмена в мышцах. Креатинфосфат. Важнейшей функцией мышечного волокна является сократительная. Процесс сокращения и расслабления связан с потреблением АТФ(АТР), гидролиз которого катализирует миозин-АТФ-аза Однако небольшой запас АТФ, имеющийся в мышцах, расходуется менее чем за 1 с после стимуляции. Потребности работающей мышцы в АТФ удовлетворяются за счет следующих ферментативных реакций: 1. Резерв в виде креатинфосфата. Быстрая регенерация АТФ может быть достигнута за счет переноса фосфатной группыкреатинфосфата на АДФ (ADP) в реакции, катализируемой креатинкиназой . В спокойном состоянии креатинфосфат вновь синтезируется из креатина. При этом фосфатная группа присоединяется по гуанидиновой группе креатина (N-гуанидино-N-метилглицина). Креатин, в основном накапливается в мышцах. Здесь креатин медленно циклизуется за счет неферментативной реакции с образованием креатинина, который поступает в почки и удаляется из организма 2 Анаэробный гликолиз. В мышечной ткани наиболее важным долгосрочным энергетическим резервом является гликоген В покоящейся ткани содержание гликогена составляет до 2% от мышечной массы. При деградации под действием фосфорилазыгликоген легко расщепляется с образованием глюкозо-6-фосфата, который при последующем гликолизе превращается в пируват. При большой потребности в АТФ и недостаточном поступлении кислорода пируват за счет анаэробного гликолиза восстанавливается вмолочную кислоту (лактат), которая диффундирует в кровь 3. Окислительное фосфорилирование. В аэробных условиях образующийся пируват поступает в митохондрии, где 4. Образование инозинмонофосфата Другим источником быстрого восстановления уровня АТФ является конверсия АДФв АТФ и АМФ (AMP), катализируемая аденилаткиназой (миокиназой) . Образовавшийся АМФ за счет дезаминирования частично превращается в ИМФ (инозинмонофосфат) , что сдвигает реакцию в нужном направлении. Из всех способов синтеза АТФ наиболее продуктивным является окислительное фосфорилирование. За счет этого процесса обеспечиваются потребности в АТФ постоянно работающей сердечной мышцы (миокарда). Вот почему для успешной работы сердечной мышцы обязательным условием является достаточное снабжение кислородом (инфаркт миокарда — это следствие перебоев в поступлении кислорода). В высокоактивных (красных) скелетных мышцах источником энергии для рефосфорилирования АДФ служит окислительное фосфорилирование в митохондриях. В обеспечении этих мышц кислородом принимает участие миоглобин (Mb) - близкий гемоглобинубелок, обладающий свойством запасать кислород. В малоактивных скелетных мышцах, лишенных красного миоглобина и поэтому белых, главным источником энергии для восстановления уровня АТФ является анаэробный гликолиз. Такие мышцы сохраняют способность к быстрым сокращениям, однако они могут работать лишь короткое время, поскольку при гликолизе образование АТФ идет с низким выходом. Спустя некоторое время мышцы истощаются в результате изменения рН в мышечных клетках. Расщепление гликогена контролируется гормонами Процесс гликогенолиза стимулируется адреналином (через b-рецепторы) за счет образования цАМФ и активации киназы фосфорилазы. Активация фосфорилазы наступает также при увеличенииконцентрации ионов Са2+ во время мышечного сокращения.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
130.Медиаторы:катехоламины,серотонин,гамма-аминомасляная кислота,глутаминовая кислота,глицин,гистамин. Нейромедиа́торы (нейротрансмиттеры, посредники) — биологически активные химические вещества, посредством которых осуществляется передача электрического импульса с нервной клетки через синаптическое пространство между нейронами γ-Аминомасляная кислота (ГАМК, GABA) — аминокислота, важнейший тормозной нейромедиатор центральной нервной системы человека и млекопитающих. Аминомасляная кислота является биогенным веществом. Содержится в ЦНС и принимает участие в нейромедиаторных и метаболических процессах в мозге. Глици́н (аминоуксусная кислота, аминоэтановая кислота) — простейшая алифатическая аминокислота, единственная аминокислота, не имеющая оптических изомеров.Глицин входит в состав многих белков и биологически активных соединений. Из глицина в живых клетках синтезируются порфирины ипуриновые основания. Химическая формула: NH2-CH2-COOH Глицин также является нейромедиаторной аминокислотой. Рецепторы к глицину имеются во многих участках головного мозга и спинного мозга и оказывают «тормозное» воздействие на нейроны, уменьшают выделение из нейронов «возбуждающих» аминокислот, таких, какглутаминовая кислота, и повышают выделение ГАМК. Глутаминовая кислота (2-аминопентандиовая кислота) — алифатическая аминокислота. В живых организмах глутаминовая кислота в виде аниона глутамата присутствуют в составе белков, ряда низкомолекулярных веществ и в свободном виде. Глутаминовая кислота играет важную роль в азотистом обмене.Глутаминовая кислота также является нейромедиаторной аминокислотой, одним из важных представителей класса «возбуждающих аминокислот». Связывание глутамата со специфическими рецепторами нейронов приводит к возбуждению последних. Адреналин (эпинефрин) (L-1(3,4-Диоксифенил)-2-метиламиноэтанол) — основной гормон мозгового вещества надпочечников, а также нейромедиатор. По химическому строению является катехоламином. Адреналин содержится в разных органах итканях, в значительных количествах образуется в хромаффинной ткани, особенно в мозговом веществе надпочечников. Норадреналин, норэпинефрин[1], L-1-(3,4-Диоксифенил)-2-аминоэтанол — гормон мозгового вещества надпочечников и нейромедиатор. Относится к биогенным аминам, к группе катехоламинов. Норадреналин является предшественником адреналина. По химическому строению норадреналин отличается от него отсутствием метильной группы у атома азота аминогруппы боковой цепи, его действие как гормона во многом синергично с действием адреналина. Считается одним из важнейших «медиаторов бодрствования». Норадренергические проекции участвуют в восходящей ретикулярной активирующей системе. Дофами́н (допами́н[1], DA) — нейромедиатор, а также гормон, вырабатываемый мозговым веществом надпочечников и другими тканями (например, почками).По химической структуре дофамин относится к биогенным аминам, конкретно к катехоламинам. Дофамин является предшественникомнорадреналина (и, соответственно, адреналина) в его биосинтезе.Дофамин является одним из химических факторов внутреннего подкрепления (ФВП). Как и у большинства таких факторов, у дофамина существуют синтетические аналоги,например, амфетамин, метамфетамин, меткатинон. Кокаин является ингибитором обратного захвата дофамина. Резерпин блокирует накачку дофамина в пресинаптические везикулы. Серотони́н, 5-гидрокситриптамин, 5-НТ — один из основных нейромедиаторов. По химическому строению серотонин относится кбиогенным аминам, классу триптаминов. Серотонин играет роль нейромедиатора в ЦНС. Серотонинергические нейроны группируются в стволе мозга: в варолиевом мосту и ядрах шва. От моста идут нисходящие проекции в спинной мозг, нейроны ядер шва дают восходящие проекции к мозжечку, лимбической системе, базальным ганглиям, коре. При этом нейроны дорсального и медиального ядер шва дают аксоны, различающиеся морфологически, электрофизиологически, мишенями иннервации и чувствительностью к некоторым нейротоксическим агентам, например, экстази. Гистамин — 2-(4-имидазолил)этиламин, бесцветные кристаллы, хорошо растворимые в воде и этаноле, нерастворим в эфире. биогенный амин, медиатор аллергических реакций немедленного типа, также является регулятором многих физиологических процессов. Гистамин является одним из эндогенных факторов (медиаторов), участвующих в регуляции жизненно важных функций организма и играющих важную роль в патогенезе ряда болезненных состояний.
|
131 классификация и номенклатура ферментов. ферменты делятся: а) на классы - по типу катализируемой реакции, б)каждый класс подразделяется на подклассы - по природе атакуемой химической группы, в) подклассы делятся на подподклассы - по характеру атакуемой связи или по природе акцептора.Выделяют 6 классов ферментов: I класс - Оксидоредуктазы(Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота). II класс - Трансферазы (Трансферазы катализируют реакции переноса различных групп от одного субстрата (донор) к другому (акцептор), участвуют в реакциях взаимопревращения различных веществ, обезвреживания природных и чужеродных соединений. Коферментами являются пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от строения переносимых групп. Примером подклассов являются ферменты, переносящие одноуглеродные фрагменты, альдегидные или кетоостатки, ацильные остатки, азотсодержащие группы, фосфорсодержащие группы.Часто встречается рабочее название трансфераз - киназы. Это трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды, белки и др), т.е. фосфотрансферазы. Систематическое название образуется: Донор группы : акцептор группы - переносимая группа трансфераза). III класс - Гидролазы(осуществляют разрыв внутримолекулярных связей в субстрате (за исключением С-С связей) путем присоединения элементов Н2О, подразделяются на 13 подклассов. Сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют. Широко представлены ферментами желудочно-кишечного тракта и лизосомальными ферментами. Осуществляют распад макромолекул, образуя легко адсорбируемые мономеры. Примером подклассов служат группы ферментов, действующие на сложные эфиры, на простые эфиры, на пептиды, на углерод-углеродные связи. Систематическое название образуется: Гидролизуемый субстрат : отделяемая группа гидролаза. Исторически названия гидролаз складывались из названия субстрата с окончанием " аза" - коллагеназа, амилаза, липаза, ДНК-аза. Наиболее часто встречаются следующие рабочие названия гидролаз: 1. Эстеразы - гидролиз сложноэфирных связей. 2. Липазы - гидролиз нейтральных жиров (триацилглицеролов). 3. Фосфатазы - гидролиз моноэфиров фосфорной кислоты. 4. Гликозидазы - гидролизуют О- и S-гликозидные связи. 5. Протеазы, пептидазы - гидролиз белков и пептидов. 6. Нуклеазы - гидролиз нуклеиновых кислот.). IV класс - Лиазы(ферменты, катализирующие разрыв С-О, С-С, C-N и других связей, а также обратимые реакции отщепления различных групп негидролитическим путем. Выделяют 7 подклассов. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту двойной связи. Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт. Примером подклассов являются ферменты, действующие на углерод-углеродные связи, углерод-кислородные связи, углерод-азотные связи. Систематическое название образуется: Расщепляемый субстрат : отделяемая группа - лиаза). V класс - Изомеразы(ферменты, катализирующие изомерные превращения в пределах одной молекулы. Изомеразы - сложные ферменты. К их коферментам относятся пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др. Выделяют 6 подклассов изомераз в зависимости от типа реакции. Например, в первый подкласс выделяют рацемазы (обратимое превращение L- и D-стереоизомеров) и эпимеразы (превращения изомеров, имеющих более одного центра асимметрии, отражающее суть реакции, например, "номер изменяемого атома углерода", изменение "цис-транс", изменение "кето-енол", изменение "альдозо-кетозо"). VI класс - Лигазы(синтетазы - ферменты, катализирующие присоединение друг к другу двух молекул с использованием энергии высокоэнергетических связей АТФ (или других макроэргов). Лигазы - сложные ферменты. Они содержат нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые коферменты. Выделяют 6 подклассов. Примером подклассов служат группы ферментов по виду образуемой связи: углерод-кислород, углерод-сера, углерод-азот, углерод-углерод. Систематическое название образуется: Субстрат 1 : субстрат 2 - лигаза) Каждому ферменту присвоен четырехзначный классификационный номер, включающий класс, подкласс, подподкласс и порядковый номер в подподклассе. Чтобы дать ферменту название существует два способа: 1. Систематическое название- согласно современной классификации. Часто такое название длинно и сложно для использования, поэтому как производное систематического названия у многих ферментов имеется одно или несколько рабочих названий.2. Тривиальное название- название, сложившееся исторически. Например, пепсин, трипсин. Для некоторых ферментов (чаще для гидролаз) к названию субстрата добавляется окончание "-аза" - уреаза, амилаза, липаза. Тем не менее и у таких ферментов имеется систематическое название. В случае, если фермент не может выполнять свою функцию, говорят об энзимопатологии (энзимопатии) - состояния, связанные с патологическим изменением активности ферментов. Наиболее часто встречается снижение активности и нарушение каких-либо метаболических процессов. В результате энзимопатологии клиническое значение может иметь: -накоплениесубстрата реакции, например: фенилаланина при фенилкетонурии, свободного билирубина при желтухах новорожденных, некоторых жиров при болезнях лизосомального накопления (липидозы), -недостаток продукта, например: меланина при альбинизме, катехоламинов при паркинсонизме, -обе особенностиодновременно, как при гликогенозах, сопровождающихся гипогликемией при избытке гликогена в печени. По характеру нарушения выделяют первичные и вторичные энзимопатии. Первичные (наследственные) энзимопатии связаны с генетическим дефектом и наследственным снижением активности. Например, фенилкетонуриясвязана с дефектом фенилаланин-4-монооксигеназы, которая превращает фенилаланин в тирозин. В результате накапливаются аномальные метаболиты фенилаланина, оказывающие сильный токсический эффект. Заболевание подагра связано с дефектом ферментов метаболизма пуриновых оснований и накоплением мочевой кислоты.Алкаптонурия - нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Кроме этого, распространенными первичными энзимопатиями являются галактоземия, недостаточность лактазы и сахаразы, различные липидозы. Вторичные (приобретенные) энзимопатиивозникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак. Другим примером может служить недостаточность ферментов желудочно-кишечного тракта при заболеваниях желудка, поджелудочной железы или желчного пузыря. Недостаток витаминов и их коферментных форм также является причиной приобретенных ферментопатий. |
132. Понятие о ферментах. Специфичность действия ферментов. Кофакторы ферментов. Зависимость скорости ферментативных реакций от концентрации субстрата, фермента, температуры и рН. Принципы количественного определения ферментов. Единицы активности.Понятие об активном центре фермента. Механизм действия ферментов. Ингибиторы ферментов: обратимые и необратимые, конкурентные. Применение ингибиторов в качестве лекарств.Регуляция действия ферментов: аллостерические механизмы,химическая (ковалентная) модификация. Белок-белковые взаимодействия. Примеры метаболических путей, регулируемых этими механизмами. Физиологическое значение регуляции действия ферментов. Ферменты - это катализаторы биологической природы (белки), которые обеспечивают протекание биохимических процессов в живых клетках. Ф. не входят в состав конечных продуктов реакции. Ф. не тратятся в процессе катализа. Ф. только ускоряют реакции, протекающие без них. Ф. не могут возбудить реакции, протекающие по законам термодинамики. Простые ферменты состоят только из АК, а сложные из 2х частей: белковой (апофермент) и небелковой (кофактор). Если кофактор прочно связан с апоферментом, он называется простетической группой, если непрочно - коферментом.Кофактор- это ионы металла или сложные органические соединения, которые выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента (Пр.: в активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции происходит перенос концевого гамма-фосфорного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата). Особенности: 1. Используются неоднократно; 2. Работают в узком диапазоне t и pH; 3. Катализируют только те реакции, которые биохимически возможны; 4. Обладают каталитической эффективностью; 5. Характерна конформационная лабильность; 6. Способность к регуляции 7.Обладают специфичностью: а)субстратная Наличие субстратной специфичности объясняют две гипотезы: 1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") - активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую. 2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") - подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата. б) каталитическая- Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. 1. Зависимость скорости реакции от концентрации субстрата При увеличении концентрации субстрата скорость реакции сначала возрастает соответственно подключению к реакции новых молекул фермента, затем наблюдается эффект насыщения, когда все молекулы фермента взаимодействуют с молекулами субстрата. При дальнейшем увеличении концентрации субстрата между его молекулами возникает конкуренция за активный центр фермента и скорость реакции снижается. 2. Зависимость от концентрации фермента При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта 3. Зависимость скорости реакции от температуры Зависимость активности ферментов (скорости реакции) от tописывается колоколообразной кривой с максимумом скорости при значениях оптимальнойtдля данного фермента. Закон о повышении скорости реакции в 2-4 раза при повышении tна 10°С справедлив и для ферментативных реакций, но только в пределах до 55-60°С, т.е. доtденатурации белков. Наряду с этим, как исключение, имеются ферменты некоторых м/о, существующих в воде горячих источников и гейзеров. При пониженииtактивность ферментов понижается, но не исчезает совсем. Иллюстрацией может служить зимняя спячка некоторых животных (суслики, ежи),tтела которых понижается до 3-5°С. 4. Зависимость скорости реакции от рН Зависимость также описывается колоколообразной кривой с максимумом скорости при оптимальном для данного фермента значении рН. Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности. Например, оптимальные значения рН для пепсина 1,5-2,5, трипсина 8,0-8,5, амилазы слюны 7,2, аргиназы 9,7, кислой фосфатазы 4,5-5,0, сукцинатдегидрогеназы 9,0. 6. Используются неоднократно; 7. Работают в узком диапазоне tиpH; 8. Катализируют только те реакции, которые биохимически возможны; 9. Обладают каталитической эффективностью; 10. Характерна конформационная лабильность; 11. Способность к регуляции при определении активности ферментов нужно одновременно учитывать три меняющихся фактора: 1) масса полученного продукта или исчезнувшего субстрата, 2) время, потраченное на реакцию, 3)количество биологического материала, содержащего фермент. Основы количественного определения активности ферментов 1.Активность фермента выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент. Активность фермента может выражаться, например, в ммоль/с?л, г/час?л, МЕ/л, кат/мл и т.д. 2.Создание стандартных условий, чтобы можно было сравнивать результаты, полученные в разных лабораториях - оптимальная рН и фиксированная температура, например, 25°С или 37°С, соблюдение времени инкубации субстрата с ферментом. 3.Необходимо наличие избытка субстрата, чтобы работали все имеющиеся в растворе молекулы фермента. За единицу активности любого ферментапринимают такое его кол-во которое катализирует превращ-е 1мкм вещ-ва в 1 минуту. Активность ферментов опр-ют: пог скорости убыв субстрата; по скороти обр-я продукта. Удельная активность=мкм/мин.мг белка. 5. Понятие об активном центре фермента. Механизм действия ферментов. Ингибиторы ферментов: обратимые и необратимые, конкурентные. Применение ингибиторов в качестве лекарств. Активный центр- комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Активный центр: -каталитический центр, -субстрат-связывающий участок, -кофермент-связывающий участок, - низкомолекулярное соединение, которое способствует взаимодействию субстрата и фермента. Наиболее часто в состав активного центра входят такие АК как серин, гистидин, трионин, цистеин. Микросреда активного центра отличается от остального окружения фермента более низкой диэлектрической проницаемостью, приближающейся к таковой для некоторых органических растворителей. Также хар-ся повышенной микровязкостью, что ограничивает свободу вращательного движения группировок активного центра. Активный центр ограничивает влияние воды, что необходимо для эффективного катализа. При связывании субстрата и активного центра, субстрат претерпевает конформационные изменения (комплементарность увеличивается). - это явление индуцированного соответствия. В свою очередь в активном центре выделяют два участка: якорный(контактный, связывающий) - отвечает за связывание и ориентацию субстрата в активном центре, 2)каталитический - непосредственно отвечает за осуществление реакции. . Энергия активации - это произведение энергии активации элементарного акта и постоянной Авогадро (Дж,/моль). -Это энергетический барьер, который должны преодолеть молекулярные вещества по пути превращения в продукты реакции. Основная задача фермента - снизить Е активации. Если фермент просто связывается с субстратом - этого не достаточно для катализа. Ф. не только распознает и связывает субстрат, но и индуцирует переходное состояние субстрата. Вферментативной реакции можно выделить следующие этапы: 1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S). 2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий. 3. Превращение переходного комплекса в комплекс фермент-продукт (E-P). 4. Отделение конечных продуктов от фермента Вферментативной реакции можно выделить следующие этапы: 1. Присоединение субстрата (S) к ферменту (E) с образованием фермент-субстратного комплекса (E-S). 2. Преобразование фермент-субстратного комплекса в один или несколько переходных комплексов (E-X) за одну или несколько стадий. 3. Превращение переходного комплекса в комплекс фермент-продукт (E-P). 4. Отделение конечных продуктов от фермента. Механизмы катализа:1. Кислотно-основной катализ- в активном центре фермента находятся группы специфичных аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие группы представляют собой мощные катализаторы многих органических реакций (Доноры -СООН -NH3+-SH, Акцепторы -СОО- -NH2 -S-) 2. Ковалентный катализ- ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции. Типы ферментативных реакций:1. Тип "пинг-понг"- фермент сначала взаимодействует с субстратом А, отбирая у него какие либо химические группы и превращая в соответствующий продукт. Затем к ферменту присоединяется субстрат В, получающий эти химические группы. Примером являются реакции переноса аминогрупп от аминокислот на кетокислоты - трансаминирование.2. Тип последовательных реакций- к ферменту последовательно присоединяются субстраты А и В, образуя "тройной комплекс", после чего осуществляется катализ. Продукты реакции также последовательно отщепляются от фермента.3. Тип случайных взаимодействий- субстраты А и В присоединяются к ферменту в любом порядке, неупорядоченно, и после катализа так же отщепляются. Ингибитор- вещество, вызывающее специфичное снижение активности фермента. Т.о., неорганические к-ты и тяжелые Ме ингибиторами не являются, а являются инактиваторами, так как снижают активность любых ферментов, т.е. действуют неспецифично. Можно выделить два основных направления ингибирования: 1. по прочности связывания Ф. с ингибитором ингибирование бывает обратимым и необратимым. 2. по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное. При необратимом ингибировании происходит связывание или разрушение функциональных групп Ф., необходимых для проявления его каталитической активности (модификации подвергается активный центр). Бывают: а)Специфические (блокируют определенные группы активного центра: диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию); б) Неспецифические (реагирует с любыми свободнымиSН-группами белков. Не имеют физиологического значения и являются ферментными ядами: Присоединение ацетильной группы аспирина (ацетилсалициловой к-ты) к аминогруппе в активном центре фермента циклооксигеназы вызывает инактивацию последнего и прекращение синтеза простагландинов).
Конкурентный ингибиторпо своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр, что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования - возможность усилить или ослабить ингибирование через изменение концентрации субстрата. Лекарства: ингибиторы холинэстеразы используют при лечении мышечных дистрофий. Увеличивают активность ацетилхолинэстеразы, конц-я ацетилхолина повышается, усиливается проведение нервного импульса (прозерин, эндрофомит). Антибактериальные средства сульфаниламиды, схожие по структуре с п-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке конкурентно нарушается использование п-аминобензойной кислоты для синтеза фолиевой кислоты, что и вызывает лечебный эффект. Неконкурентное ингибированиесвязано с присоединением ингибитора не в активном центре, а в другом месте молекулы с образованием неактивного комплекса, что приводит к инактивации активного центра и снижению скорости реакции. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо токсинов. Обратимо, но не может быть ослаблено или устранено повышением конц-ии субстрата. Пр.: синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание. Использование ингибиторов ферментов Весьма широко применяются в настоящее время ингибиторы протеаз (контрикал, гордокс) при панкреатитах - состояниях, когда происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы. Ингибиторы холинэстеразы (физостигмин, прозерин) приводят к накоплению нейромедиатора ацетилхолина в синапсах и показаны при миастении, двигательных и чувствительных нарушениях при невритах, радикулитах, психогенной импотенции. Препараты, содержащие ингибиторы моноаминоксидазы (наком, мадопар), повышают выработку нейромедиаторов катехоламинов в ЦНС при лечении паркинсонизма. Подавление активности моноаминооксидазы (разрушающей катехоламины) сохраняет нормальную передачу сигналов в нервной системе. Ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и т.п.) используются как антигипертензивное средство и вызывают расширение периферических сосудов, уменьшение нагрузки на миокард, снижение артериального давления. Аллопуринол - ингибитор ксантиноксидазы, фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры. Ингибиторы гидроксиметилглутарил-SКоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях. Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни. 6. Регуляция действия ферментов: аллостерические механизмы, химическая (ковалентная) модификация. Белок-белковые взаимодействия. Примеры метаболических путей, регулируемых этими механизмами. Физиологическое значение регуляции действия ферментов. В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие.Чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления). Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях: 1. изменением количества молекул фермента; 2.доступностью молекул субстрата и кофермента; 3.изменением каталитической активности молекулы фермента. Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма. Основные способы регуляции активности ферментов: 1. Доступность субстрата или кофермента.Здесь работаетзакон действия масс- фундаментальный закон химической кинетики: при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ. Или упрощенно - скорость, с которой вещества реагируют друг с другом, зависит от их концентрации. Таким образом, изменение количества хотя бы одного из субстратов прекращает или начинает реакцию. Например, для цикла трикарбоновых кислот (ЦТК) таким субстратом является оксалоацетат (щавелевоуксусная кислота). Наличие оксалоацетата "подталкивает" реакции цикла, что позволяет вовлекать в окисление молекулы ацетил-SКоА. Именно из-за недостатка оксалоацетата (относительного или абсолютного) развивается кетоацидоз (механизм развития) при голодании и инсулинзависимом сахарном диабете. 2. Компартментализация- это сосредоточение ферментов и их субстратов в одном компартменте (одной органелле) - в эндоплазматическом ретикулуме, митохондриях, лизосомах. Например, ферменты цикла трикарбоновых кислот (ЦТК) и ?-окисления жирных кислот расположены в митохондриях, ферменты синтеза белка - в рибосомах. 3.Изменение количества ферментаможет происходить в результате увеличения или снижения его синтеза. Изменение скорости синтеза фермента обычно зависит от количества определенных гормонов или субстратов реакции, например: -исчезновение пищеварительных ферментов при длительном голодании и их появление в восстановительный период (в результате изменения секреции кишечных гормонов); -при беременности и после родов в молочной железе активно идет синтез фермента лактозосинтазы под воздействием лактотропного гормона; -гормоны глюкокортикоиды стимулируют синтез ферментов глюконеогенеза, что обеспечивает стабильность концентрации глюкозы в крови и устойчивость ЦНС к стрессу; 4. Ограниченный (частичный) протеолиз проферментовподразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений. Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывания крови, лизосомальных ферментов (катепсины). 5. Аллостерическая регуляция.Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными.Аллостерический центр(allos - чужой) - центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором, а также эффектором, модулятором, регулятором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы. Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называютсяключевыми ферментами. В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким-то образом связанных с данной реакцией. Например, фермент энергетического распада глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ - активаторами фермента. Аллостерическая регуляция имеет большое значение в следующих ситуациях: -при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений; -при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ; -для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты; -для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути. 6. Белок-белковое взаимодействиеобозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона). 7. Ковалентная (химическая) модификациязаключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление - протеинфосфатазы. Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, ферменты гликогенфосфорилаза и гликогенсинтаза при потребности организма в глюкозе фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена, а гликогенсинтаза неактивна. При необходимости синтеза гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза - неактивной. Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов - отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях - получить шанс выжить.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
133. Образование и пути использования аммиака. Биосинтез мочевины: последовательность реакций, регуляция. Гипераммониемия. . Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов - нервная ткань, печень, кишечник, мышцы. Основные источники аммиака: 1.неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) - в печени, 2.окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках, 3.дезаминирование амидов глутаминовой и аспарагиновой кислот - в печени и почках, 4.катаболизм биогенных аминов - во всех тканях, в наибольшей степени в нервной ткани, 5.жизнедеятельность бактерий толстого кишечника, 6.распад пуриновых и пиримидиновых оснований - во всех тканях. Так как аммиак является чрезвычайно токсичным соединением, то в тканях существуют несколько реакций связывания (обезвреживания) аммиака - синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата: синтез глутаминовой кислоты (восстановительное аминирование) - взаимодействие ?-кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону ?-кетоглутарата, -синтез глутамина - взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях. Образование большого количества глутамина обеспечивает высокие концентрации его в крови (0,5-0,7 ммоль/л). Так как глутамин проникает через клеточные мембраны путем облегченной диффузии, то он легко попадает не только в гепатоциты, но и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового и пиримидинового колец, гуанозинмонофосфата (ГМФ), аспарагина, глюкозамино-6-фосфата (предшественник всех остальных аминосахаров). Синтез аспарагина - взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи, синтез карбамоилфосфата в митохондриях печени - реакция является первой в процессе синтеза мочевины, средства для удаления аммиака из организма.Транспорт аммиака.Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в меньшей степени аспарагин и глутамат, некоторое количество аммиака находится в крови в свободном виде. Глутамин и аланин являются наиболее представленными, их доля среди всех аминокислот крови составляет до 50%. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аммиак от мышц и стенки кишечника. В мышцах основным акцептором лишнего аминного азота является пируват. При катаболизме белков в мышцах происходят реакции трансаминирования аминокислот, образуется глутамат, который далее передает аминоазот на пируват и образуется аланин. Из мышц с кровью аланин переносится в печень, где в обратной реакции передает свою аминогруппу на глутамат. Образующийся пируват используется как субстрат в реакциях синтеза глюкозы (глюконеогенез), а глутаминовая кислота дезаминируется и аммиак используется в синтезе мочевины. Целевыми органами для транспорта аммиака являются печень, почки и кишечник. В печени: а)аспарагин и глутамин дезаминируются соответственно аспарагиназой и глутаминазой, образующийся аммиак используется для синтеза мочевины, б)аланин вступает в реакции трансаминирования с ?-кетоглутаратом, в)глутаминовая кислота подвергается окислительному дезаминированию. В кишечнике часть глутамина дезаминируется глутаминазой. После этого образованный аммиак выделяется в просвет кишечника (не более 5%) или через кровь воротной вены уходит в печень, а глутамат вступает в трансаминирование с пируватом, в результате чего аминоазот переходит на аланин и с ним также поступает в печень, В почках идет образование аммонийных солей с использованием глутамата, глутамина и аспарагина. Аммиак является токсичным соединением, находящимся в крови в относительно небольших концентрациях (11,0-32,0 мкмоль/л). Симптомы аммиачного отравления проявляются при превышении этих пределов всего в 2-3 раза. Предельно допустимый уровень аммиака в крови 60 мкмоль/л. При повышении концентрации аммиака (гипераммониемия) до предельных величин может наступить кома и смерть. При хронической гипераммониемии развивается умственная отсталость. Гипотезы токсичности аммиака. Токсичность аммиака обусловлена следующими обстоятельствами: 1. Связывание аммиака при синтезе глутамата вызывает отток ?-кетоглутарата из цикла трикарбоновых кислот, при этом понижается образование энергии АТФ и ухудшается деятельность клеток. 2. Ионы аммония NH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток. 3. Накопление свободного иона NH4+ в цитозоле влияет на мембранный потенциал и работу внутриклеточных ферментов - он конкурирует с ионными насосами для Na+ и K+. 4. Продукт связывания аммиака с глутаминовой кислотой - глутамин - является осмотически активным веществом. Это приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть. 5. Использование ?-кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза ?-аминомасляной кислоты (ГАМК), тормозного медиатора нервной системы. Наследственные и приобретенные формы гипераммониемий.Приобретенная (вторичные)гипераммониемия развивается вследствие заболеваний печени и вирусных инфекций. В крайне тяжелых случаях она проявляется как тошнота, рвота, судороги, нечленораздельная речь, затуманивание зрения, тремор, нарушение координации движений. Наследственные формыгипераммониемии вызваны генетическим дефектом любого из пяти ферментов синтеза мочевины. Соответственно ферменту заболевание делится на пять типов. Первичными признаками гипераммониемий являются сонливость, отказ от пищи, рвота, беспокойство, судороги, нарушение координации движений, тахипноэ, дыхательный алкалоз. Могут развиться печеночная недостаточность, легочные и внутричерепные кровоизлияния. Наиболее частой является гипераммониемия типа II, связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание рецессивно, сцеплено с Х-хромосомой. У матери также наблюдается гипераммониемия и отвращение к белковым продуктам. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения). Лабораторным критерием заболевания является накопление глутамина (в 20 и более раз) и аммиака в крови, ликворе и моче. Основа лечения гипераммониемий сводится к ограничению белка в диете, уже это позволяет предотвратить многие нарушения мозговой деятельности. Практически весь аммиак удаляется из организма через почки в виде мочевины, которая синтезируется в печени, и в виде образующися в эпителии канальцев почек солей иона аммония. В клетки печени и почек аммиак попадает в составе глутамина и аспарагина, глутаминовой кислоты, аланина и в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах. В клетке глутамин и аспарагин дезаминируются соответственно глутаминазой и аспарагиназой с образованием аммиака (точнее, иона аммония). Аланин вступает в реакцию трансаминирования. Образованный в результате реакции пируват идет в глюконеогенез или энергетический обмен. Параллельно образуется глутаминовая кислота. В целом глутаминовая кислота в гепатоците может появляться тремя путями: 1) из крови, 2) при дезаминировании глутамина, 3) при трансаминировании ?-кетоглутарата с аспартатом или аланином. Происхождение и дальнейшая ее судьба зависит от конкретных концентраций всех задействованных веществ. Обычно далее глутамат дезаминируется глутаматдегидрогеназой с образованием аммиака.Синтез мочевины.В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма. Реакции синтеза мочевины являются циклическим процессом и получили название орнитиновый цикл. Синтез мочевины начинается в митохондриях (первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином. В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.Синтез аммонийных солей. Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей. Часть глутамина крови, не задержавшаяся в печени, достигает почек. В эпителиальных клетках почечных канальцев, в основном в дистальных канальцах, имеется фермент глутаминаза, гидролизующая амидную группу с образованием глутамата. Глутамат, в свою очередь, дезаминируется глутаматдегидрогеназой. Параллельно в эпителии происходят процессы клеточного дыхания, сопросождающиеся образованием угольной кислоты, которая диссоциирует на ион Н+ и карбонат-ион НСО3?. Ионы водорода секретируются в первичную мочу, карбонат-ионы - в кровь. Выделяемый аммиак диффундирует в просвет канальца, где соединяется с ионом Н+, образуя ионы аммония NH4+. Они связываются с неорганическими (фосфаты, хлориды, сульфаты) или с органическими анионами (уксусной, щавелевой, молочной кислот). тканях.
|
134. Функции пептидов и белков. Суточная потребность в белках. Переваривание белков. Регуляция переваривания белков. Патология переваривания и всасывания белков.Белки играют фундаментальную роль в формировании и поддержании структуры и функций живых организмов. В количественном отношении белки занимают первое место среди всех содержащихся в живой клетке макромолекул. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций:1.Структурная.Белки формируют вещество соединительной ткани - коллаген, эластин, кератин, протеогликаны.Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) - спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности),К данной функции можно отнести участие в создании органелл - рибосомы.2.Ферментативная. Все ферменты являются белками. Но вместе с тем, имеются экспериментальные данные о существовании рибозимов, т.е. рибонуклеиновой кислоты, обладающей каталитической активностью.3.Гормональная. Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Часть из них являются белками, например, инсулин и глюкагон.4.Рецепторная.Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.5.Транспортная.Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа) или через мембраны - Na+,К+-АТФаза (противоположный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки).6.Резервная.В качестве примера депо белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.7.Сократительная.Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).8.Защитная.Защитной функцией при инфекциях обладают иммуноглобулины крови, при повреждении тканей - белки свертывающей системы крови. Механическую защиту и поддержку клеток осуществляют протеогликаны.Для поддержания азотистого равновесия достаточно употреблять 30-50 г белков в сутки. Однако такое количество не обеспечивает сохранения работоспособности и здоровья человека. Принятые нормы белкового питания для взрослых и детей учитывают климатические условия, профессию, условия труда и другие факторы. Взрослый человек при средней физической нагрузке должен получать 100-120 г белков в сутки. При тяжёлой физической работе эта норма увеличивается до 130-150 г. Детям до 12 лет достаточно 50-70 г белков в сутки. При этом подразумевается, что в пишу входят разнообразные белки животного и растительного происхождения. а) соотношение заменимых и незаменимых аминокислот - в белке должно быть не менее 32% незаменимых АК,б)близость аминокислотного состава белка к аминокислотному составу усредненного белка тела человека,в)легкость переваривания в ЖКТ.Расщепление белковдо АК начинается в желудке, продолжается в 12-перстной кишке и заканчивается в тонком кишечнике. В некоторых случаях распад белков и превращения АК могут происходить также в толстом кишечнике под влиянием микрофлоры. Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи. В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.Регуляция желудочного пищеварения. Регуляция осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами. К гуморальным регуляторам желудочной секреции относятсягастрин и гистамин. Гастрин стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также он обеспечивает секрецию гистамина. Гастрин выделяется специфичными G-клетками:- в ответ на раздражение механорецепторов,- в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков), - под влиянием n.vagus.Гистамин, образующийся в энтерохромаффиноподобных клетках (ECL-клетки, принадлежат фундальным железам) слизистой оболочки желудка, взаимодействует с Н2-рецепторами на обкладочных клетках желудка, увеличивает в них синтез и выделение соляной кислоты.Закисление желудочного содержимого подавляет активность G-клеток и по механизму обратной отрицательной связи снижает секрецию гастрина и желудочного сока.Соляная кислота. Одним из компонентов желудочного сока является HCL. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+. Источником ионов Н+ является угольная кислота, образуемая ферментом карбоангидразой. При ее диссоциациии , кроме ионов водорода, образуются карбонат-ионы НСО3-. Они по градиенту концентрации движутся в кровь в обмен на ионы Сl-. В полость желудка ионы Н+ попадают энергозависимым антипортом с ионами К+ (Н+,К+-АТФаза), хлорид-ионы перекачиваются в просвет желудка также с затратой энергии. При нарушении нормальной секреции HCl возникают гипоацидный или гиперацидный гастрит, отличающиеся друг от друга по клиническим проявлениям, последствиям и требуемой схеме лечения. Функции соляной кислоты:1.денатурация белков пищи,2.бактерицидное действие,3.высвобождение железа из комплекса с белками и перевод в двухвалентную форму, что необходимо для его всасывания,4.превращение неактивного пепсиногена в активный пепсин,5.снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина,после перехода в 12-перстную кишку - стимуляция секреции панкреатического сока.Пепсин.Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр "прикрыт" N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что "раскрывается" активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена. Оптимум рН для пепсина 1,5-2,0. Пепсин, не обладая высокой специфичностью, гидролизует пептидные связи, образованные аминогруппами ароматических АК (тирозина, фенилаланина, триптофана), аминогруппами и карбоксигруппами лейцина, глутаминовой к-ты и т.д.Гастриксин. Его оптимум рН соответствует 3,2-3,5. Наибольшее значение этот фермент имеет при питании молочно-растительной пищей, слабо стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых АКПокинув желудок, пища подвергается действию панкреатического сока, кишечного сока и желчи.Сок поджелудочной железы содержит проферменты - трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются до трипсина, химотрипсина, карбоксипептидаз и эластазы, соответственно, способом ограниченного протеолиза. Указанные ферменты осуществляют основную работу по перевариванию белков.В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков.Трипсин, химотрипсин, эластаза являются эндопептидазами. Карбоксипептидазы и аминопептидазы - экзопептидазы.Регуляция кишечного пищеварения.В кишечнике под влиянием соляной кислоты, поступающей из желудка в составе пищевого комка, начинается секреция гормона секретина, который с током крови достигает поджелудочной железы и стимулирует выделение жидкой части панкреатического сока, богатого карбонат-ионами (HCO3-). В результате рН химуса повышается до 7,0-7,5. Благодаря работе желудочных ферментов в химусе имеется некоторое количество аминокислот, вызывающих освобождение холецистокинина-панкреозимина. Он стимулирует секрецию другой, богатой проферментами, части поджелудочного сока, и секрецию желчи. Нейтрализация кислого химуса в двенадцатиперстной кишке происходит также при участии желчи. Формирование желчи (холерез) идет непрерывно, не прекращаясь даже при голодании.Трипсин. Синтезируемый в поджелудочной железе трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина. Трипсин специфичен к пептидным связям, образованным с участием карбоксильных групп лизина и аргинина. Трипсин может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока - химотрипсиноген, проэластазу, прокарбоксипептидазу. Параллельно трипсин участвует в переваривании пищевых липидов (посмотреть), активируя фермент переваривания фосфолипидов - фосфолипазу А2, и колипазу фермента липазы, отвечающей за гидролиз триацилглицеролов.Химотрипсин.Образуется из химотрипсиногена при участии трипсина и промежуточных, уже активных, форм химотрипсина, которые выстригают два дипептида из цепи профермента. Три образованныхфрагмента удерживаются друг с другом посредством дисульфидных связей. Фермент специфичен к пептидным связям, образованным с участием карбоксильных групп фенилаланина, тирозина и триптофана, т.е. так же, как пепсин.Эластаза.Активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.Карбоксипептидазы.Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз - карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В - остатки лизина и аргинина.Аминопептидазы. Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.Дипептидазы. Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов.Лизосомы энтероцитов. Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами. При заболеваниях ЖКТ и нарушении переваривания, при диете с избытком белков часть пептидов, не успевая расщепиться, достигает толстого кишечника и потребляется живущими там микроорганизмами - развивается гниение белков в кишечнике.При различныз заболеваниях ЖКТ в желудке нарушается выделение НС1 и пепсиеногена,переваривание белков снижается.Встречаются изменения кислотности желуд сока.Повыш кислотность лелуд сока сопровождается диареей,изжогой и может быть симптомом язвы желудка и12перстной кишки.Понижен кислотность при некоторых видах гастрита.Переваривание в кишечнике6 низкое значение рн химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь,он стимулирует выделение из поджел железы в тонкий кишечник панкреатич сока.Поступление пептидов в тонкий кишечник вызывает секрецию др белкового гормона-холецистокенина,который стимулирует выделение панкреатич ферментов. Под действие ферментов поджел железы и кл кишечника завершается переваривание белковНарушения:Небольшую долю продуктов переваривания белка составляют негидролизованные короткие пептиды. У некоторых людей возникает иммунная реакция на приём белка, что связано со способностью к всасыванию таких пептидов. Продукты полностью переваренного белка (АК) лишены антигенных свойств и иммунных реакций не вызывают. У новорождённых проницаемость слизистой оболочки кишечника выше, чем у взрослых, поэтому в кровь могут поступать АТ молозива (секрет молочных желёз, выделяющийся в первые дни после родов, обогащённый АТ и антитоксинами). Это усугубляется наличием в молозиве белка - ингибитора трипсина. Протеолитические ферменты в пищеварительных секретах новорождённых обладают низкой активностью. Всё это способствует всасыванию в кишечнике небольшого кол-ва нативных белков, достаточного для обеспечения иммунной реакции. Подобное усиление всасывающей способности кишечника является причиной наблюдаемой иногда непереносимости белков пищи (например, молока и яиц) у взрослых людей. Всё больше подтверждений получает гипотеза, согласно которой при заболевании целиакии (нетропической спру)происходит нарушение клеток слизистой оболочки кишечника, где всасываются небольшие негидролизованные пептиды. Целиакия характеризуется повышенной чувствительностью к глютену - белку клейковины зёрен злаков, употребляемых с пищей человеком. Этот белок оказывает токсическое действие на слизистую оболочку тонкой кишки, что приводит к её патологическим изменениям и нарушению всасывания. Патогенез заболевания недостаточно ясен. Такие заболевания, как цистинурия,болезнь Хартнапаи некоторые другие, возникают вследствие дефекта переносчиков нейтральных аминокислот в кишечнике и почках. Описана врождённая патология, связанная с дефектом фермента 5-оксопролиназы. При этом с мочой выделяется оксопролин. У этих больных нарушены транспорт АК в ткани и их метаболизм в клетках.
|
135. Трансаминирование аминокислот. Специфичность аминотрансфераз. Значение реакций трансаминирования. Непрямое дезаминирование аминокислот: последовательность реакций, ферменты, биологическое значение. У человека основным способом дезаминирования является окислительное дезаминирование. Выделяют два варианта окислительного дезаминирования: прямое и непрямое. Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное). 1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. В орг-ме человека эти ферменты присутствуют, но практически неактивны. 2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой к-ты, катализируется только глутаматдегидрогеназой, превращающей глутамат в ?-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех кл орг-ма (кроме мышечных). Этот тип дезамин-ия тесным образом связан с трансаминированием аминокислот и формирует с ним процесс трансдезаминирования. Непрямое окислительное дезаминирование (трансдезаминирование).Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма. Первый этапзаключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты - этот перенос называется трансаминирование и его механизм довольно сложен. В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется ?-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2"). В результате трансаминирования свободные аминокислоты теряют ?-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе. Второй этапсостоит в отщеплении аминогруппы от аминокислоты 2 - дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх). В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и ?-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Так как НАДН используется в дыхательной цепи и ?-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования: Реакции трансаминирования: -активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот - с целью оптимизации их соотношения, -обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога), -начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) - с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии, -необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза - для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах - для его прямого вовлечения в реакции цикла трикарбоновых кислот. -при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов для -глюконеогенеза и способствуют патологической гипергликемии. Продукт трансаминирования глутаминовая кислота: -является одной из транспортных форм аминного азота в гепатоциты, -способна реагировать со свободным аммиаком, обезвреживая его. Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей. Механизм реакции трансаминированиянепрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6). В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию. Весь перенос аминогруппы совершается в две стадии: 1.к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. 2. на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует. Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений - шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт - кетокислота. После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота. Чаще всего аминокислоты взаимодействуют со следующими кетокислотами: пировиноградной с образованием аланина, щавелевоуксусной с образованием аспартата, ?-кетоглутаровой с образованием глутамата. Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на ?-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор - ?-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты. Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование. В медицине нашло практическое применение определение активности двух ферментов трансаминирования - аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминтрансферазы (АСТ). Оба фермента обратимо взаимодействуют с ?-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот. Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах - для АЛТ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
136. Декарбоксилирование аминокислот. Его сущность. Декарбоксилирование гистидина, серина, цистеина, орнитина, лизина и глутамата. Роль биогенных аминов в регуляции метаболизма и функций. Процесс отщепления карбоксильной группы аминокислот в виде СО2 получил название декарбоксилирования. Несмотря на ограниченный круг аминокислот и их производных, подвергающихся декарбоксилиро-ванию в животных тканях, образующиеся продукты реакции - биогенные амины - оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами - декарбоксилазами аминокислот. Декарбоксилазы аминокислот состоят из белковой части, обеспечивающей специфичность действия, и простетической группы, представленной пиридоксальфосфатом (ПФ). Синтез нейромедиаторов из аминокислот в первую очередь связан с вовлечением в метаболизм ?-карбоксильной группы аминокислот или, проще говоря, ее удалением. Гистидин. Реакция образования гистамина наиболее активно идет в тучных клетках легких, кожи, печени, базофилах и эозинофилах. В них гистамин синтезируется и накапливается в секреторных гранулах.В кровь гистамин выделяется при повреждении ткани, при ударе, при электрическом раздражении. В клинической практике секреция гистамина обычно связана с аллергиями - при повторном попадании антигена в ранее сенсибилизированный организм развивается аллергическая реакция. Физиологические эффекты: расширение артериол и капилляров и, как следствие, покраснение кожи, снижение артериального давления; повышение проницаемости стенки капилляров и, как следствие, выход жидкости в межклеточное пространство (отечность), снижение артериального давления; если предыдущие пункты имеют место в головном мозге - повышение внутричерепного давления; увеличивает тонус гладких мышц бронхов, как следствие - спазм и удушье; слабо повышает тонус мышц желудочно-кишечного тракта; стимулирует секрецию слюны и желудочного сока. Глутамат.Синтез ?-аминомасляной кислоты (ГАМК) происходит исключительно в центральной нервной системе - в подкорковых образованиях головного мозга.Физиологические эффекты:В центральной нервной системе ГАМК (наряду с глутаминовой кислотой) является тормозным медиатором. Наиболее высока ее роль в височной и лобной коре, гиппокампе, миндалевидных и гипоталамических ядрах, черной субстанции, ядрах мозжечка. При декарбоксилировании орнитина образуется путресцин, лизина - кадаверин. образуются при бактериальном брожении из белков, известны из-за неприятного запаха.Из них образуются полиамины. Из путресцина образуются спермин и спермидин, которые стабилизируют структуру мембран. Спермидин прочно связан с ДНК и может способствовать стабилизации ееструктуры.Продукты декарбоксилирования-путресцин,кадаверин,БЫВ-спермидин,Физиолог роль-изменяют степень агрегации полисом.Регулируют синтез РНК и белка. При декарбоксилировании серинаобразуется этаноламин, который путем метилирования превращается в холин. Холин и этаноламин входят в состав сложных липидов. Из холина путем ацетилирования образуется ацетилхолин. Серин: продукт декарбоксилирования-этаноламин,БАВ-ацетилхолин,Физиолог роль-возбуждающий медиатор вегетативной нервной системы. При декарбоксилировании цистеинаобразуется меркаптоэтиламин, который входит в состав КоА. Меркаптоэтиламин является радиопротектором. Таким образом, биогенные амины являются сильными фармакологически активными веществами, оказывающими разностороннее влияние на физиологические функции организма. Некоторые биогенные амины нашли широкое применение в качестве лекарственных препаратов. Биогенные амины- это вещества, характеризующиеся присутствием в их молекулярной структуре аминогруппы (NH2). Их можно обнаружить как в растениях, так и в животных. Их делят на несколько семейств, в частности - на этаноламины (холин и ацетилхолин), полиэтилендиамины (путресцин и кадаверин), полиамины (спермин), имидазолилалкиламины (гистамин), фенилалкиламины (мескалин и тирамин), катехоламины (адреналин, норадреналин и дофамин), индолилалкиламины (триптамин и серотонин), а также бетаины (карнитин). Биогенные амины могут быть предшественниками алкалоидов и гормонов. Кроме того, некоторые из них являются нейромедиаторами или компонентами фосфолипидов и витаминов. Их также можно обнаружить в рибосомах и некоторых бактериях. Обычно они синтезируются посредством декарбоксилирования или карбоксилирования аминокислот (например, гистидин превращается в гистамин). Некоторые биогенные амины являются галлюциногенами (мескалин), другие могут быть даже токсичными (путресцин и кадаверин). Мед и маточное молочко содержат холинергический фактор - ацетилхолин. Этот биогенный амин действует как нейромедиатор на уровне синапсов центральной нервной системы и вызывает сокращение гладких мышц на уровне бронхов и желудочно-кишечного тракта, стимулируя таким образом перистальтику (это может объяснять слабый послабляющий эффект меда). Он также расширяет капиллярные сосуды и снижает артериальное давление. Для получения дополнительной информации по этому вопросу см. свойства меда и маточного молочка при заболеваниях сердечно-сосудистой системы. Гистамин образуется посредством окислительного декарбоксилирования гистидина - аминокислоты, широко представленной в пыльце. Он стимулирует образование желудочного сока железами, расположенными в дне желудка, и таким образом способствует пищеварению. Он также расширяет кровеносные капилляры, повышает проницаемость мембран и вызывает сокращение гладких мышц пищеварительного тракта, матки и бронхов.
|
137 .колагенПолипептидная ? - цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], где Гли - глицин, Х и Y могут быть любыми аминокислотами, но чаще всего: Х -пролин или аланин Y - гидроксипролин или гидроксилизин. Коллаген содержит 33% глицина. Синтез коллагена Коллаген синтезируется внутри различных клеток соединительной ткани в виде препроколлагена, содержащего на N - конце сигнальную последовательность из 100 аминокислотных остатков. Эта последовательность облегчает перемещение ? - цепей в просвет ЭПР. Созревание коллагена (процессинг) После синтеза цепи коллагена следует сложный многоступенчатый процесс - созревания коллагена. Включает 2 этапа: I - внутриклеточный II - внеклеточный На I этапе происходит пострансляционная модификация полипептидных цепей препроколлагена. На II этапе образуются зрелые коллагеновые волокна. Внутриклеточный этап включает ряд последовательных изменений цепи препроколлагена: 1) Отщепление сигнальной последовательности от N-конца препроколлагена и образование проколлагена. 2) Гидроксилирование пролина и лизина проколлагена гидроксилазами в полости ЭПР Синтезированный гидроксипролин участвует в образовании водородных связей в тройной спирали коллагена. Гидроксилизин подвергается гликозилированию и образуется гидроксиаллизин, который участвует в образовании сшивок между молекулами коллагена при сборке фибрилл. Это пострансляционная модификация цепи проколлагена Гидроксилазы содержат в активном центре атом Fe 2+, в качестве кофермента выступает витамин С 3) Гликозилирование гидроксилизина под действием гликозилтрансфераз Углеводные компоненты связываются с ОН - группами гидроксилизина О - гликозидными связями. Чаще всего углеводными компонентами являются глюкоза или дисахарид галактозилглюкоза. 4) Формирование тройной спирали проколлагена, который затем секретируется из клетки. Каждая ? - цепь проколлагена соединяется водородными связями с двумя другими ? - цепями проколлагена. Образуются дисульфидные связи внутри- и между полипептидных цепей. Дисульфидные связи внутри цепей возникают между остатками цистеина на С- и N- концах проколлагена (С- и N - пептиды). Дисульфидные связи на С- и N-концах проколлагена также важны для предотвращения образования крупных фибрилл. II. Внеклеточный этап созревания включает также ряд последовательных изменений 1)Образование молекулы тропоколлагена. Отщепление от проколлагена N - и С - концевых пептидов и образование тропоколлагена. Тропоколлаген - структурная единица фибрилл. Формирование фибрилл коллагена Из молекул тропоколлагена происходит сборка коллагеновых фибрилл, в которых одна нить тропоколлагена сдвинута по отношению к другой примерно на ? своей длины. На стыках молекулы тропоколлагена не примыкают друг другу вплотную, между ними остается просвет длиной в 35-40 нм. В твердых тканях эти просветы выполняют роль центров минерализации. Такое расположение повышает прочность фибрилл на растяжение. 3) Стабилизация и укрепление фибрилл коллагена и образованием коллагеновых волокон Модифицированные аминокислоты - гидроксипролин и гидроксилизин играют важную роль в образовании фибрилл. ОН - группы гидроксипролина соседних цепей тропоколлагена образуют водородные связи, укрепляющую структуру фибрилл. Радикалы лизина и гидроксилизина обеспечивают поперечные сшивки между молекулами тропоколлагена Для создания укрепляющих связей фермент лизилоксидаза катализирует реакцию образование аллизина и гидроксиаллизина (содержит реактивную альдегидную группу). Остаток лизина Остаток аллизина Возникшие альдегидные группы участвуют в образовании ковалентных связей или сшивок между собой или другими АМК, которые также стабилизируют фибриллы тропоколлагена: Альдольная сшивка - аллизин + аллизин Альдиминная сшивка - лизин + аллизин Образуется лизиннорлейцин.
|
138 . Слюна является секретом слюнных желез и важной биологической средой полости рта, а потому ее свойства и химический состав существенно влияют на состояние зубов и слизевой оболочки полости рта. Слюну выделяют три больших парных железы: околоушные, подъязычные, подчелюстные и мелкие слюнные железы полости рта. Секрет каждой железы имеет свой особенный состав и свойства: " Околоушные железы - выделяют секрет серозного типа. " Подчелюстные железы - выделяют секрет серозно-слизистого типа. " Подъязычные железы - выделяют секрет слизистого типа. В полости рта слюна смешивается и превращается в ротовую жидкость, в которой кроме собственно слюны как секрета слюнных желез содержится также эпителиальные клетки, лейкоциты, бактерии, остатки еды, и тому подобное. За сутки в среднем выделяется 1,5-2,0 л. слюны при общей массе всех желез - 5-6 граммов. Наибольшее количество - 71% выделяют подчелюстные железы, 25% - околоушные мелкие слюнные железы, 3-4% - подъязычные. Скорость секреции нестимулируемой слюны составляет 0,02-0,10мл/мин.(по другим данным 0,3-0,5мл/мин.). Стимулируемая слюна, которая образуется при действии раздражителя, выделяется со скоростью - 1,5-2,3мл/мин. Функции слюны. 1. Пищеварительная функция. Слюна является первым пищеварительным соком на пути переваривания пищевых продуктов. Слюна увлажняет, размягчает еду и формирует первичную пищевую грудку. Процесс переваривания еды сопровождается механическим рпзмельчением и насыщением муцином и гидролитическими ферментами: ?-амілазою, мальтазой, трипсиноподобными ферментами, пепсиногеном, нуклеазой, каликреиноподобнымилипазами. Поэтому еда начинает перевариваться уже в ротовой полости, а растворенные в слюне соединения влияют на вкусовые рецепторы и стимулируют функцию желудочно-кишечного тракта. 2. Минерализирующая функция - участие в образовании и поддержании состава твердого апатита тканей зуба и прежде всего эмали. Снабжение эмали питательными соединениями осуществляется преимущественно за счет компонентов слюны. В слюне содержатся все необходимые факторы минерализации - неорганические и органические соединения, а также гормоны и витамины, которые регулируют этот процесс. Изменения биохимического состава слюны являются основной причиной заболеваний зубов. В частности при гипосаливации и особенно -ксеростомии (отсутствие слюны) быстро развивается заболевание слизевой оболочки рта, а через 3-5 месяцев наступает множественное поражение зубов кариесом. 3. Защитная функция. Слюна является первым барьером на пути проникновения в организм вредных факторов, а потому содержит мощную ферментативную и иммунную систему защиты, которая включает: защитный фермент - лизоцим, ингибиторы протеиназ, факторы свертывания крови, муцин, систему секреторного иммуноглобулина А, лейкоциты. 4. Буферная функция - обусловленная наличием фосфатного буфера и белков. Слюна поддерживает слабощелочную реакцию в ротовой жидкости, которая является исключительно важным для оптимального протекания процессов минерализации и реминерализации эмали. Слабощелочная буферная система слюны позволяет успешно противодействовать деминерализирующему влиянию органических кислот (конечно в определенных пределах). 5. Функция выделения - со слюной выделяются конечные продукты азотистого обмена, метаболіти гормонов, минеральные соли, продукты превращения лекарств, токсинов. В частности, важной функцией слюны является выведение из организма роданидов - продуктов обеззараживания (детоксикации) цианидов в тканях (содержание 0,02-0,03г/л). Особенно высоким содержание роданидов является в слюне курильщиков (0,06-0,12г/л). 6. Регуляторная функция - это способность слюны поддерживать гомеостаз полости рта. В составе слюны выделяются гормоны и регуляторные пептиды, которые имеют высокую биологическую активность, в частности гормоны: кортизол, эстрогены, прогестерон, тетростерон, паротин ипепдиды: фактор роста эпителия, фактор роста нервов, белки с высоким родством к Са2+. Физико-химические свойства слюны. Смешана слюна - это вязкая жидкость с удельным весом 0,001-0,017. Вязкость слюны зависит от содержания муцина, который является основой слизевых образований и предотвращает повреждение слизевой оболочки рта и пищевода, формирует защитное покрытие зубной пеликулы. рН слюны колеблется от 6,4 до 7,8 в зависимости от гигиены ротовой полости, характера питания, индивидуальных особенностей метаболизма. Сдвиг рН слюны в кислую сторону (<6,2) приводит к деминерализации эмали и развитию кариеса. Такие условия влекут в частности избыточным развитием ацидофильных бактерий, которые образуют большое количество органических кислот, и рядом заболеваний, которые сопровождаются развитием тканевой гипоксии, - сахарный диабет, разного рода гемофилии, ацидурии. Оптимальным для процессов минерализации и реминерализации тканей зуба является слабощелочное значение рН слюны - 7,2-7,8. Биохимический состав слюны. Слюна является сложным секретом, в котором содержится 99% воды и 1% растворенных органических и неорганических соединений. Таблица. Содержание органических веществ в смешанной слюне человека. № Компоненты Содержание № Компоненты Содержание 1 Общий белок 2,0-5,0 граммов/л 10 Остаточный азот 7,7-14,7 ммоль/л 2 Муцин 2,0-3,0 граммов/л 11 3,5- цАМФ 5-50 нмоль/л 3 Амилаза 0,2-0,5 граммов/л 12 Глюкоза 0,05-0,10 ммоль/л 4 Гликопротеины 2,0-2,5 граммов/л 13 Нейраминована кислота 0,01 граммов/л 5 Серомукоид 0,29-0,35 граммов/л 14 Пируват 22,0-45,0 мкмоль/л 6 Лизоцим 0,15-0,25 граммов/л 15 Лактат 0,21-0,44 ммоль/л 7 Иммуноглобулин А 0,3 граммов/л 16 Цитрат 10-104 мкмоль/л 8 Свободные аминокислоты 1,5-2,2 ммоль/л 17 Холестерол 0,025-0,09 граммов/л 9 Мочевина 1,5-2,0 ммоль/л 18 Липидный фосфор 0,015-0,030 граммов/л Органические компоненты слюны. Среди органических компонентов важнейшими являются белки, содержание которых составляет 2,0 - 5,0граммов/л. В частности: муцин, гликопротеины, протеогликаны, альбумины, ?-глобулины, -глобулины, а также ферменты: лизоцим, амилаза, кислая и щелочная фосфатаза, пероксидаза, аминотрансферазы, лактатдегидрогеназа, и тому подобное. Кроме того, в слюне содержатся углеводы (моно-, дисахариды, гликозаминогликаны), липиды (свободные жирные кислоты, фосфоацилглицеролы, холестерол и его эфиры), небелковые азотистые соединения, витамины, гормоны. Большую часть белков - 2-3 грамма/л составляет гликопротеин-муцин, который синтезируется в подчелюстных железах и благодаря наличию в его составе до 60% углеводов предоставляет слюне густого слизистого характера. Компонентами является глюкуроновая кислота, N-ацетилглюкозамин, фруктоза, галактоза. Агрегаты муцину образуют сверхмолекулярные комплексы больших размеров, они связывают и удерживают воду, благодаря чему имеют высокую вязкость. Негативный, полианионний заряд углеводных компонентов в муцине обусловливает их способность адсорбироваться на поверхностигидроксиапатитов зубной эмали и защищать эмаль от влияния негативных факторов - в частности органических кислот. В слюне содержится большое количество (до 10% общего содержания белка) фермента ?-амілази (0,2- 0,5 граммов/л). 70% ?-амілази продуцируется околоушными слюнными железами, остальные 30% - подчелюстными железами. ?-Амілаза катализирует гидролиз полисахаридов - гликогена и крахмала к дисахариду (мальтозе) и остаточным олигосахаридам и декстринів. ?-Амилаза слюны за свойствами подобная к ?-амилазеподжелудочной железы. Активность ?-амилазы смешанной слюны в норме составляет 623±20 международных единиц. Лизоцим (мурамидаза) слюны - фермент, содержание которого составляет 0,15-0,25 граммов/л, то есть около 5% всех белков слюны. Основным источником является секрет подчелюстных желез, в околоушных железах его содержание меньше. Лизоцим имеет высокие актибактериальныесвойства, поскольку разрушает клеточную стенку бактерий. Клетки бактерий покрытых жесткой пористой оболочкой пептидогликановой природы - муреином. Муреин построен из длинных (нитей) цепей полисахаридов, которые состоят из N-ацетилглюкозамину и N-ацетилмурамовой кислоты. Полисахаридные цепи сшиты между собой белковыми (пента- и тетра-пептидними) фрагментами. Клеточная стенка - (муреин) это гигантскаямешковидная молекула пептидогликана, что охватывает всю клетку. Лизоцим расщепляет гликозидные связи между N-ацетилглюкозамином и N-ацетилмурамовой кислотой в полисахаридах и клетка погибает. Среди защитных ферментов слюны следует отметить пероксидазу и каталазу. Различают лактопероксидазу и миелопероксидазу, которые продуцируются соответственно железами или лейкоцитами. Лактопероксидаза слюны за своими свойствами подобная пероксидазе молока. Миелоперосидаза продуцируется лейкоцитами. Оба фермента ингибируют процессы перекисного окисления липидов, перерывая свободнорадикальные реакции, поскольку удаляют гидроперекиси из цепного процесса. Ферменты: щелочная фосфотаза, которая усиливает процессы реминерализации и кислая фосфотаза, которая имеет деминерализирующее действие, образуются слюнными железами, микроорганизмами и лейкоцитами. Они проникают в эмаль зуба и существенно влияют на процессы минерализации - деминерализации. Активность протеолитических ферментов в слюне является низкой в результате высокого содержания ингибиторов протеаз в слюне. В частности: " железы продуцируют кислотостабильные ингибиторы трипсиноподобных протеиназ (КСИ); " из плазмы поступают: ?-антитрипсин и ?2-макроглобулин; " лейкоциты и микроорганизмы также продуцируют ряд ингибиторов. В смешанной слюне определяют активность больше 100 ферментов. Кроме них, в слюне присутствуют: гиалуронидаза, нуклеаза, уреаза, ферменты гликолиза, переаминирования, декарбоксилирования, цикла трикарбонових кислот, тканевого дыхания, супероксиддисмутаза, нейраминидаза,холинэстереза и другие. Поэтому исследования нарушений ферментативной активности слюны находят все более широкое приложение вензимодіагностиці патологических процессов при ряде заболеваний. Особенную группу белков слюны представляют иммуноглобулины. Полость рта имеет иммунитет в известной мере независимый от общей иммунной системы организма. Известно 5 классов иммуноглобулинов крови: IgG, IgМ, IgA, IgD, IgE. В сыворотке основным классом иммуноглобулинов являетсяIGG, в слюне преобладает секреторный IGA, который отличается от IGA плазмы крови. Основную массу его содержания (до 90%) продуцируют околоушные железы. Две 4-цепных молекулы IGA соединяются в димер с помощью полипептида, так называемого секреторного компонента (S), и образуют функционально активную форму - sIgA. Полный комплекс sIgA имеет ряд свойств, которые определяют его способность защищать слизевые оболочки от инородных агентов, которые имеют антигенную природу, а именно: " высокую стойкость к действию проеиназ; " неспособность связывать компоненты комплемента, который обусловливает отсутствие повреждающей действию на слизевые оболочки; " способность передшкоджати адгезии мікрооганізмів и их токсинов, а также аллергенов, на эпителии и слизевых оболочках, что блокирует их проникновение во внутрішне среду организма. Антиадгезивные свойства sIgA обусловливают его антибактериальные, антивирусные и антиаллергические свойства. Важной является также его способность активировать систему клеточного комплемента. Низкомолекулярные органические компоненты слюны включают: мочевину - 1,5-2,0 ммоль/л остаточный азот - 7,7-14,7 ммоль/л аминокислоты - 1,5-2,2 ммоль/л и на порядок меньшие количества глюкозы, лактата, пирувата, тиоцианата, и тому подобное. В слюне найдены витамины В, С, РР, А, Д. Слюнные железы секретируют специфический гормон - паротин. Он снижает уровень Са2+ крови и усиливает его поступление в ткани, тем самым способствует минерализации зубов и костной ткани. Особенную группу соединений слюны составляют стероидные гормоны. Со слюной в ротовую полость выделяются: глюкокортикоиды, половые, тиреоидные гормоны, и тому подобное. Слюна содержит приблизительно 10-15% гормонов от их концентрации в крови. Поэтому определение содержания гормонов в слюне является информативным показателем состояния надпочечников, половых желез и гонадотропной функции гипофиза. Слюна содержит ряд белковых факторов свертывания крови и фибринолиза. В слюне обнаружены соединения, которые имеют тромбопластичну иантигепаринову активность, а также естественные антикоагулянты - плазминоген и его активаторы. В смешанной слюне активность факторов свертывания крови и фибринолиза больше в сравнении со слюной проливов, которая свидетельствует о взаимном активирующем влияние всех компонентов смешанной слюны. При нормальных физиологичных условиях активность прокоагулянта более высока, чем антикоагулянтов. При повреждениях тканей ротовой полости существенно повышается активность фибринолитических ферментов. Это способствует очистке слизевых оболочек от фібринозного налета и продуктов распада (автолиза) белков. Минеральный состав слюны. Особенностью слюны является преобладание содержания К+ (в 4-5 раз) и низшее содержание Na+ (в 5-10 раз) по сравнению с их содержанием в плазме крови. Содержание Са2+ в смешанной слюне такой же как в крови - 0,1г/л. Слюна отличается высоким содержанием фосфата, который в 2 разы превышает его содержание в крови и составляет 0,1г/л. Таблица. Содержание минеральных элементов в смешанной слюне человека. № Компоненты Содержание № Компоненты Содержание 1 Калий 0,5-0,74 граммов/л 6 Хлор 0,3-0,8 граммов/л 2 Натрий 0,26-0,31 граммов/л 7 Фтор 0,06-1,8 мг/л 3 Кальций 0,048-0,103 граммов/л 8 Медь 16,471,03 мкг% 4 Магний 0,047 граммов/л 9 Цинк 58,583,12 мкг% 5 Фосфор 0,098 граммов/л 10 Никель 16,471,03 мкг% Чрезвычайно важной является роль слюны в поддержании растворимых форм кальций-фосфатних солей в точках кристаллизации. Специальные пролинзобогащеные белки слюны обеспечивают существование кальциевых фосфатов в коллоидном состоянии в растворах перенасыщенных гидроксиапатитом. Они удерживают ионы Са2+ и препятствуют неконтролированному осаждению кальция из перенасыщенных растворов. Именно благодаря таким белкам слюны, какие богатые на пролин, тирозин и гистидин и имеют высокое родство к гидроксиапатитам, процесс формирования кристаллов носит упорядоченный характер.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
139.ткани зуба К таким тканям относятся эмаль, дентин, цемент зуба. Эти ткани отличаются друг от друга различным происхождением в онтогенезе. Поэтому отличаются по химическому строению и составу. А также по характеру метаболизма. В них эмаль - эптодермального происхождения, а кость, цемент, дентин - мезентимального происхождения, но , несмотря на это, все эти ткани имеют много общего, состоят из межклеточного вещества или матрицы, имеющего углеводно-белковую природу и большое количество минеральных веществ, в основном, представленных кристаллами апатитов. Степень минерализации: Эмаль -> дентин -> цемент -> кость. В этих тканях следующее процентное содержание: Минеральные вещества: Эмаль-95%; Дентин-70%; Цемент-50%; Кость-45% Органические вещества: Эмаль-1 - 1,5%; Дентин-20%; Цемент-27%; Кость-30% Вода: Эмаль-30%; Дентин-4%; Цемент-13%; Кость-25%. Эти кристаллы имеют гексогенальную форму. Минеральные компоненты эмали Они представлены в виде соединений, имеющих кристаллическую решетку A (BO ) K A = Ca, Ba, кадмий, стронций В = РО , Si, As, CO . K = OH, Br, J, Cl. 1) гидроксиапатит - Са (РО ) (ОН) в эмали зуба 75% ГАП - самый распространенный в минерализованных тканях 2) карбонатный апатит - КАП - 19% Са (РО ) СО - мягкий, легко растворимый в слабых кислотах, целочах, легко разрушается 3) хлорапатит Са (РО ) Сl 4,4% мягкий 4) стронцевый апатит (САП) Са Sr (PO ) - 0,9% не распространен в минеральных тканях и распространен в неживой природе. Мин. в-ва 1 - 2% в неапатитной форме, в виде фосфорнокислого Са, дикальциферата, ортокальцифосфата. Соотношение Са / Р - 1,67 соответствует идеальному соотношению, но ионы Са могут замещаться на близкие по свойству химические элементы Ва, Сr, Mg. При этом снижается соотношение Са к Р, оно уменьшается до 1,33%, изменяются свойства этого апатита, уменьшается резистентность эмали к неблагоприятным условиям. В результате замещения гидроксильных групп на фтор, образуется фторапатит, который превосходит и по прочности и по кислотоустойчивости ГАП. Са (РО ) (ОН) + F = Ca (PO ) FOH гидроксифторапатит Са (РО ) (ОН) + 2F = Ca (PO ) F фторапатит Са (РО ) (ОН) + 20F = 10CaF + 6PO + 2OH фторид Са. СаF - он прочный, твердый, легко выщелачивается. Если рн сдвигается в щелочную сторону, происходит разрушение эмали зуба, крапчатость эмали, флюороз. Стронцевый апатит - в костях и зубах животных и людей, живущих в регионах с повышенным содержанием радиоактивного стронция, они обладают повышенной хрупкостью. Кости и зубы становятся ломкими, развивается стронцевый рахит, беспричинный, множественный перелом костей. В отличие от обычного рахита, стронцевый не лечится витамином Д. Особенности строения кристалла Наиболее типичной является гексогенальная форма ГАП, но может быть кристаллы с палочковидной, игольчатой, ромбовидной. Все они упорядочены, определенной формы, имеют упорядоченные эмаль призмы - является структурной единицей эмали. 4 структуры: кристалл состоит из элементарных единиц или ячеек, таких ячеек может быть до 2 тысяч. Мол.масса = 1000. Ячейка - это структура 1 порядка, сам кристалл имеет Mr = 2 000 000, он имеет 2 000 ячеек. Кристалл - структура 2 порядка. Эмалевые призмы являются структурой 3 порядка. В свою очередь, эмалевые призмы собраны в пучки, это структура 4 порядка, вокруг каждого кристалла находится гидратная оболочка, любое приникновение веществ на поверхность или внутрь кристалла связано в этой гидратной оболочкой. Она представляет собой слой воды, связанной с кристаллом, в котором происходит ионный обмен, он обеспечивает постоянство состава эмали, называется эмалевой лимфой. Вода внутрикристаллическая, от нее зависят физиологические свойства эмали и некоторые химические свойства, растворимость, проницаемость. Вид: вода, связанная с белками эмали. В структуре ГАП соотношение Са / Р - 1,67. Но встречаются ГАП, в которых это соотношение колеблется от 1,33 до 2. Ионы Са в ГАПе могут быть замещены на близкие по свойствам в Са другие хим.эл-ты. Это Ba, Mg, Sr, реже Na,K, Mg, Zn, ион H O. Такие замещения называются изоморфными, в результате соотношение Са / Р падает. Таким образом, образуется из ГАП - ГФА. Фосфаты могут заместиться на ион РО НРО цитрат. Гидрокситы замещаются на Cl, Br, F , J . Такие изоморфные замещения приводят к тому, что изменяется и свойство апатитов - резистентность эмали к кислотам и к кариесу падает. Существуют другие причины изменения состава ГАП, наличие вакантных мест в кристаллической решетке, которые должны быть замещены с одним из ионов, возникают вакантные места чаще всего при действии кислот, уже в сформированном кристалле ГАП, образование вакантных мест приводит к изменению св-в эмали, проницаемости, растворимости, адсорб.св-ва. Нарушается равновесие между процессом де- и реминерализации. Возникают оптимальные условия для хим. реакций на поверхности эмали. Физико-химические свойства кристалла апатита Одним из важнейших свойств кристалла является заряд. Если в кристалле ГАП 10 ост.Са, тогда считают 2 х 10 = 3 х 6 + 1 х 2 = 20 + 20 = 0. ГАП электонейтрален, если в структуре ГАП содержится 8 ионов Са - Са (РО ) , то 2 х 8 20 = 16 < 20, кристалл приобретает отриц.заряд. Он может и положительно заряжаться. Такие кристаллы становятся неустойчивыми. Они обладают реакционной способностью, возникает поверхностная электрохимическая неуравновешенность. ионы находятся в гидратной оболочке. Могут нейтрализовать заряд на поверхности апатита и такой кристалл снова приобретает устойчивость. Стадии проникновения веществ в кристалл ГАП 3 стадии 1) ионный обмен между раствором, который омывает кристалл - это слюна и зубдесневая жидкость с его гидратной оболочкой. В нее поступают ионы, нейтрализующие заряд кристалла Са, Sr, Co, PО, цитрат. Одни ионы могут накапливаться и также легко покидать, не проникая внутрь кристалла - это ионы К и Cl, другие ионы проникают в поверхностный слой кристалла - это ионы Na и F. Стадия происходит быстро в течение нескольких минут. 2) это ионный обмен между гидратной оболочкой и поверхностью кристалла, происходит отрыв иона от поверхности кристалла и замена их на другие ионы из гидратной оболочки. В результате уменьшается или нейтралезуется поверхностный заряд кристалла и он приобретает устойчивость. Более длительная, чем 1 стадия. В течение нескольких часов. Проникают Ca, F, Co ,Sr, Na, P. 3) Проникновение ионов с поверхности внутрь кристалла - называется внутрикристаллический обмен, происходит очень медленно и по мере проникновения иона скорость этой стадии замедляется. Такой способностью обладают ионы Ра, F, Са, Sr. Наличие вакантных мест в кристаллической решетке является важным фактором в активации изоморфных замещений внутри кристалла. Проникновение ионов в кристалл зависит от R иона и уровня Е, которой он обладает, поэтому легче проникают ионы Н , и близкие по строению к иону Н . Стадия протекает дни, недели, месяцы. Состав кристалла ГАП и свойства их постоянно изменяются и зависят от ионного состава жидкости, которая омывает кристалл и состава гидратной оболочки. Эти св-ва кристаллов позволяют целенаправленно изменять состав твердых тканей зуба, под действием реминерализующих растворов с целью профилактики или лечения кариеса. Органические вещества эмали Доля орг.в-в 1 - 1,5%. В незрелой эмали до 20%. Орг.в-ва эмали влияют на биохимические и физические процессы, происходящие в эмали зуба. Орг.в-ва нах-ся между кристаллами апатита в виде пучков, пластинок или спирали. Осн.представители - белки, углеводы, липиды, азотсодержащие в-ва (мочевина, пептиды, цикл.АМФ, цикл.аминокислоты). Белки и углеводы входят в состав органич.матрицы. Все процессы реминерализации происходят на основе белковой матрицы. Большая часть представлена коллагеновыми белками. Они обладают способностью инициировать реминерализацию. 1. а) белки эмали - нерастворимы в кислотах, 0,9% ЭДТА. Они относятся к коллаген- и керамидо- подобным белкам с большим количеством сер, оксипролина, гли, лиз. Эти белки играют защитную ф-цию в процессе деминерализации. Не случайно в очаге деминерализации на ст.белого или пигментированного пятна кол-во этих белков > в 4 раза. Поэтому кариозное пятно в течение нескольних лет не превращается в кариозную полость, а иногда вообще не развивается кариес. У пожилых людей к кариесу > резистентность. б) кальцийсвязывающие белки эмали. КСБЭ. Содержат ионы Са в нейтральной и слабощелочной среде и способствуют проникновению Са из слюны в зуб и обратно. На долю белков А и Б приходится 0,9% от общей массы эмали. 2. Б.растворимые в воде не связанные с минеральными в-вами. Они не обладают сродством к минер.компонентам эмали, не могут образовывать комплексы. Таких белков 0,3%. 3. Своб.пептиды и отд.аминокислоты, такие как промин, гли, вал, оксипролин, сер. До 0,1% 1) ф-я защитная. Белки окружают кристалл. Предупреждают процесс деминерализации 2) белки инициируют минерализацию. Активно участвуют в этом процессе 3) обеспечивают минер.обмен в эмали и др.твердых тканях зуба. Углеводы представлены полисахаридами: глюкоза, галактоза, фруктоза, гликоген. Дисахариды нах-ся в свободной форме, а образуются белковые комплексы - фосфо-гликопротеиды. Липидов очень мало. Представлены в виде гликофосфолипидов. При образовании матрицы они выполняют роль связующих мостиков между белками и минералами. Дентин уступает по твердости. Наиболее важными элементами дентина являются ионы Са, РО , Со , Мg , F. Mg сод-ся в 3 раза больше, чем в эмали. Концентрация Na и Cl возрастает во внутренних слоях дентина. Основное в-во дентина состоит из ГАП. Но в отличие от эмали, дентин пронизан большим количеством дентинных канальцев. Болевые ощущения передаются по нервным рецепторам. В дентинных канальцах нах-ся отростки клеток одонтобластов, пульпа и дентинная жидкость. Дентин составляет основную массу зуба, но явл.менее минерализов.в-вом, чем эмаль, по строению напоминает грубоволокнистую кость, но более твердый. Органические вещества Белки, липиды, углеводы, ... Белковый матрикс дентина - 20% от общей массы дентина. Состоит из коллагена, на его долю приходится 35% всех органических в-в дентина. Это свойство характерно для тканей лизин нормального происхождения, содержит глюкозаминогликогены, галактозу, гексазамиты и гелиуроновые кислоты. Дентин богат активными регуляторными белками, которые регулируют процесс реминерализации. К таким спец.белкам отн-ся амелогенины, энамелины, фосфопротеиды. Для дентина, как и для эмали, характерен замедленный обмен мин.компонентов, что имеет большое значение для сохранения стабильности тканей в условиях повышенного риска деминерализации, стресса. Цемент зуба Покрывает тонким слоем весь зуб. Первичный цемент образован минеральным в-вом, в котором в разных направлениях проходят коллагеновые волокна, клеточные элементы - цементобласты. Цемент зрелого зуба мало обновляется. Состав: минер.компоненты в основном представлены карбонатами и фосфатами Са. Цемент не имеет как эмаль и дентин, собственных кровеносных сосудов. В верхушке зуба - клеточный цемент, основная часть - бесклеточный цемент. Клеточный напоминает кость, а бесклеточный состоит из колл.волокон и аморфного в-ва, склеивающего эти волокна. Пульпа зуба. Это рыхлая соединит.ткань зуба, заполняющая коронковую полость и корневой канал зуба с большим количеством нервов и кровеносных сосудов, в пульпе есть коллагеновые, но нет эластических волокон, есть клеточные элементы, представленные одонтобластами, макрофагами и фибробластами. Пульпа является биологическим барьером защищающим зуб.полость и периодонт от инфекции, выполняет пластическую и трофическую функцию. Характеризуется повыш-ой активностью окислительно-восстановит.процессов, а поэтому высоким потреблением О . Регуляция энергетического баланса пульпы осуществяется путем сопряжения окисления с фосфорилированием. О высоком уровне биологич.процессов в пульпе говорят наличие таких процессов, как ПФП, синтез РНК, белков, поэтому пульпа богата ферментами, осуществляющими эти процессы, но особенно свойственен для пульпы углеводный обмен. Есть ферменты гликолиза, ЦТК, водно-минерального обмена (щелочн.и кислая фосфотозы), трансаминазы, аминопептидазы.
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






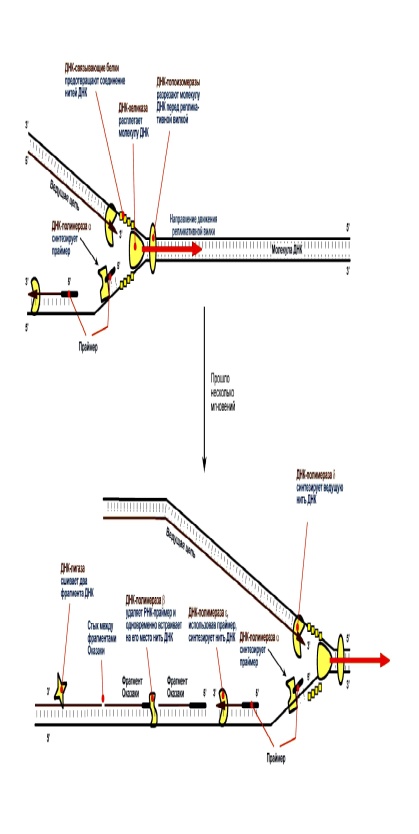


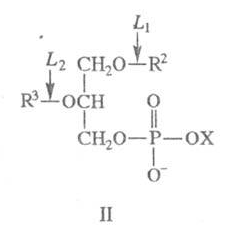

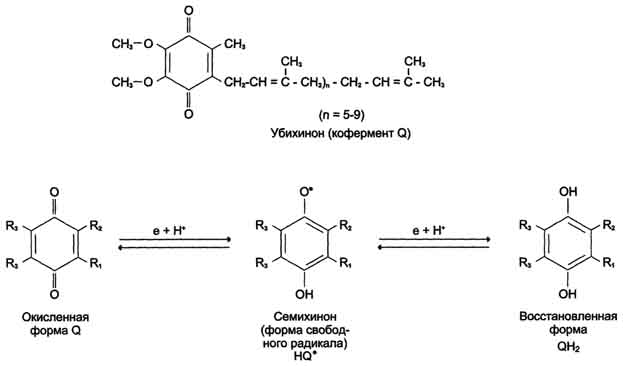



 Анаэробный
гликолиз по сравнению с аэробным менее
эффективен. В этом процессе катаболизм
1 моль глюкозы без участия митохондриальной
дыхательной цепи сопровождается
синтезом 2 моль АТФ и 2 моль лактата.
АТФ образуется за счёт 2 реакций
субстратногофосфорилирования.
Поскольку глюкоза распадается на 2
фосфотриозы, то с учётом стехиометри-ческого
коэффициента, равного 2, количество
моль синтезированного АТФ равно 4.
Учитывая 2 моль АТФ, использованных
на первом этапе гликолиза, получаем
конечный энергетический эффект
процесса, равный 2 моль АТФ. Таким
образом, 10 цитозольньгх ферментов,
катализирующих превращение глюкозы
в пируват, вместе с лактатдегидрогеназой
обеспечивают в анаэробном гликолизе
синтез 2 моль АТФ (на 1 моль глюкозы)
без участия кислорода.
Анаэробный
гликолиз по сравнению с аэробным менее
эффективен. В этом процессе катаболизм
1 моль глюкозы без участия митохондриальной
дыхательной цепи сопровождается
синтезом 2 моль АТФ и 2 моль лактата.
АТФ образуется за счёт 2 реакций
субстратногофосфорилирования.
Поскольку глюкоза распадается на 2
фосфотриозы, то с учётом стехиометри-ческого
коэффициента, равного 2, количество
моль синтезированного АТФ равно 4.
Учитывая 2 моль АТФ, использованных
на первом этапе гликолиза, получаем
конечный энергетический эффект
процесса, равный 2 моль АТФ. Таким
образом, 10 цитозольньгх ферментов,
катализирующих превращение глюкозы
в пируват, вместе с лактатдегидрогеназой
обеспечивают в анаэробном гликолизе
синтез 2 моль АТФ (на 1 моль глюкозы)
без участия кислорода.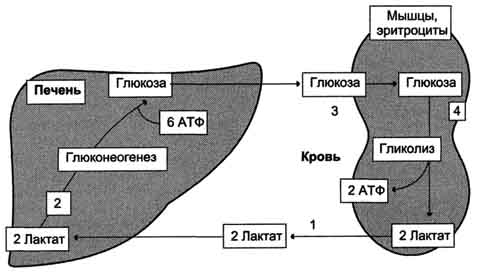

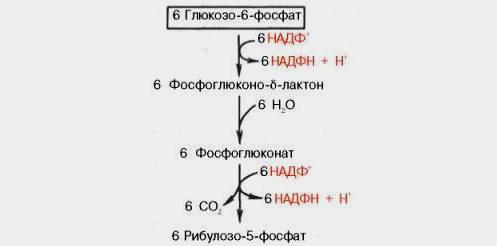
 Синтез гликогена
Синтез гликогена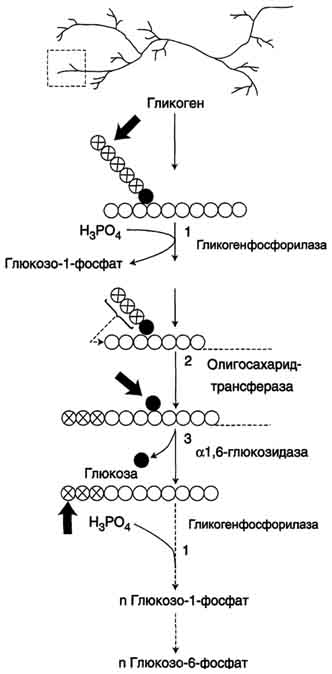 Распад
гликогена
Распад
гликогена





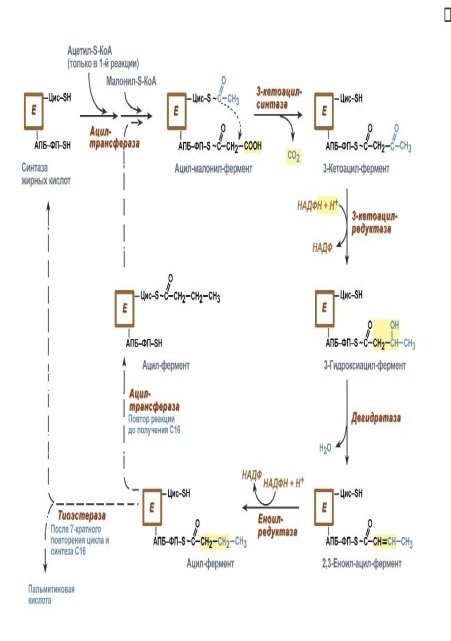
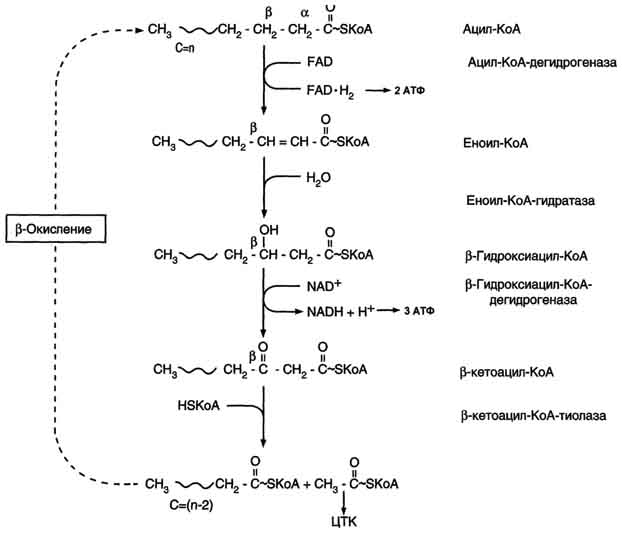






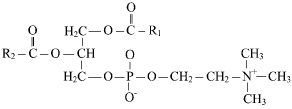

 рина.
Они участвуют в синтезе
фосфатидилэтаноламинов.
рина.
Они участвуют в синтезе
фосфатидилэтаноламинов.