
Кузина ОХТ полимеров
.pdf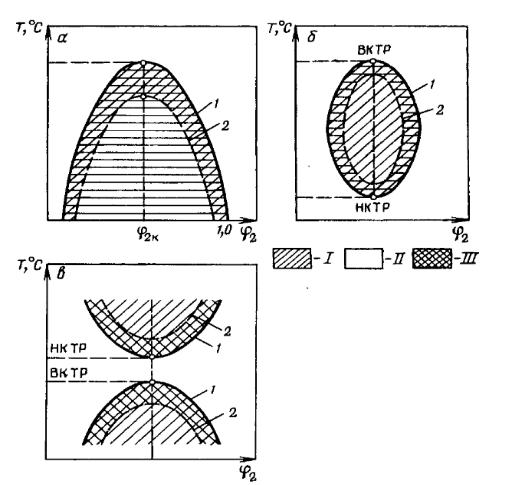
Gсм Нсм Т Sсм , |
(1) |
где Gсм , Нсм , Sсм – изменение свободной энергии, энтальпии и энтропии растворения соответственно (индекс «см» - означает смешение).
Рисунок 1– Фазовые диаграммы состояния растворов полимеров состав-температура: I – двухфазная область, II – однофазная область (гомогенная) область; III – метастабильная область.
Типы фазовых диаграмм определяются термодинамическими параметрами.
При ∆Hсм>0 и ∆Sсм>0 диаграмма состояния имеет вид, показанный на рисунке 1 (а), и характеризуется ВКТР (например, система полистиролциклогексан, триацетат целлюлозы – хлороформ). При ∆Hсм<0 и ∆Sсм<0 на диаграмме состояния (рисунок 1, в) появляется точка НКТР (например, система поливиниловый спирт – вода, полиакрилонитрил – диметилформамид). В некоторых случаях фазовая диаграмма имеет вид, подобный приведенному на рисунке 1 (б).
11
Сольватационное взаимодействие макромолекул полимера и молекул растворителя существенно изменяет способность полимерных цепей к конформационным переходам, т.е. влияет на их равновесную гибкость. По величине термодинамического сродства к полимеру все растворители делятся на «хорошие» и «плохие». Для термодинамически «хороших» растворителей характерно образование достаточно мощных сольватных оболочек вокруг макромолекул, что существенно уменьшает возможность их конформационных переходов, т.е. обуславливает снижение равновесной гибкости. В «хороших» растворителях размеры молекулярных клубков увеличиваются, что приводит к изменению их гидродинамических свойств, а количество кинетически независимых частиц, в роли которых выступают сегменты макромолекул, снижается. Это влечет за собой изменение количественных характеристик растворов полимеров.
В термодинамически «плохом» растворителе внутреннее взаимодействие преобладает над сольватационным, и макромолекула стремится свернуться в сравнительно плотный клубок. Растворитель, в котором взаимное расположение элементарных звеньев полимерной цепи в статистическом клубке может быть описано вероятностной кривой Гаусса, называется тэтарастворителем (θ-растворитель). Вместе с тем температура, при которой взаимодействие между полимером и растворителем отсутствует, называется тэта-температурой (θ – температура). Небольшое снижение температуры ниже θ – температуры, а также небольшая добавка осадителя к раствору полимера в θ – растворителе вызывает начало разделения раствора на фазы, т.е. осаждение полимера. ВКТР соответствует θ – температуре раствора полимера, обладающего бесконечно большой молекулярной массой.
1.2 Оценка параметров растворимости полимеров
Выбор растворителей для полимеров проводится с учетом растворяющей способности и скорости испарения органических жидкостей, технологических свойств материала, экономических факторов, а также требований техники безопасности (взрыво- и пожароопасность, токсичность) и экологии.
Основы подбора растворителей для полимеров по их растворяющей способности до сих пор имеют полуколичественный характер. Хорошо известно эмпирическое правило, что химическое и структурное сходство
12

полимера и органической жидкости облегчают растворение («подобное растворяется в подобном»). Были сделаны попытки количественной оценки растворяющей способности органических жидкостей по отношению к тому или иному полимеру с помощью понятия «плотность энергии когезии» - DK (теория регулярных растворов Гильденбранда – Скетчарда).
Энергия когезии Ек – это энергия, необходимая для разрушения всех межмолекулярных контактов и отнесенная к одному молю вещества
– кДж/моль. Для растворителей Ек равна энергии испарения. Отнеся ее к единице мольного объема VM (м3/моль), получают величину плотности энергии когезии DK = EK/VM (кДж/м3).
Для практической оценки взаимной растворимости веществ, в том числе полимеров и органических жидкостей, используют не плотность энергии когезии, а производную от этой величины, названную параметром растворимости δ, который равен δ= (DK)1/2.
Параметр растворимости органических жидкостей определяют обычно по теплоте испарения:
|
Н RT |
, |
(2) |
|
V |
|
|
где Н – энтальпия испарения, кДж/моль.
Поскольку полимер нельзя испарить, параметр его растворимости определяют косвенными методами, например, по набуханию или растворению полимера в жидкостях с известными параметрами растворимости, или рассчитывают по суммарной энергии когезии атомных групп полимера.
Для этого можно использовать уравнение, предложенное Смоллом:
|
|
i |
, |
(3) |
|
|
M |
|
|||
|
|
|
|
|
|
где |
– плотность полимера, кг/м3; |
|
|||
i – |
мольные константы |
взаимодействия |
различных атомных |
||
группировок, входящих в элементарное звено (МДж/м3) 1/2/моль; M – масса повторяющегося звена полимера, кг/моль.
13
Таблица 1 – Мольные константы взаимодействия различных атомных группировок
Атомная группировка |
γ *, (кал/см3)0,5 |
–СН3 |
214 |
–СН2– |
133 |
>СН– |
28 |
|
|
|
93 |
|
|
=СН2 |
190 |
–СН= |
111 |
|
|
=СН= |
19 |
|
|
–СН=СН– |
222 |
|
|
–СН=С< |
285 |
|
|
–С6Н5 |
735 |
>С6Н4 (о-, м-,п-) |
658 |
–С10Н7 |
1146 |
|
|
–С5Н9 (пятичленное кольцо) |
105-115 |
–С6Н11 (шестичленное кольцо) |
95-105 |
–Н (подвижный) |
80-100 |
|
|
–О– (в простых эфирах) |
70 |
|
|
>С=О (в кетонах) |
275 |
|
|
–СО–О– (в сложных эфирах) |
310 |
|
|
–СN |
410 |
|
|
–Cl |
270 |
|
|
–Cl в >CCl2 |
260 |
– Cl в >CCl3 |
250 |
–Br |
340 |
|
|
–I |
425 |
|
|
>CF2 |
150 |
–CF3 |
274 |
–S– |
225 |
|
|
–SH |
315 |
|
|
–O–NO2 |
440 |
–NO2 |
440 |
≡PO4 |
500 |
* 1 (кал/см3)1/2 = 2,04•10-3 (Дж/м3)1/2 |
|
14
Растворение полимеров будет происходить при любом соотношении компонентов при условии, что молярная энтальпия смешения Н близка к нулю. Ее можно подсчитать по уравнению:
Н ( |
1 |
|
2 |
)2 V |
2 |
, |
(4) |
|
|
1 |
|
|
где 1 , 2 – параметры растворимости;1 и 2 – объемные доли компонентов.
Величину β=(δ1-δ2)2 называют параметром совместимости. Чем она меньше (чем ближе значение параметров растворимости), тем лучше совместимость компонентов. Растворения может не произойти, если δр - δп
> + 2 ((кал/см3)0,5).
Органические жидкости, имеющие величины δ, близкие к соответствующим величинам отдельных полимеров (при сходстве химического строения), действительно являются их хорошими растворителями. Так, поливинилхлорид (δ=19,1) растворяется в дихлорэтане (δ=19,6) и о-дихлорбензоле (δ=20,6). Полиолефины (полиэтилен, полипропилен – соответственно δ=15,9 и 16,2) растворяются в алифатических углеводородах (гексане и октане, имеющих соответствующие величины δ=14,6 и 15,1), полистирол (δ =18,2) - в бензоле и толуоле (δ=18,2). Хорошими растворителями эпоксидных олигомеров (δ =19,8) являются ацетон (δ =20,0) и диоксан (δ = 20,0). В то же время при полном несходстве химического строения органической жидкости и полимера даже при хорошем совпадении их величин δ полимер не растворяется. Так, полистирол (δ=18,2) не растворяется в кетонах (для метилэтилкетона δ=18,6, ацетона – δ = 20,0). Такие отклонения в растворимости полимеров связаны с наличием в системе сильных специфических взаимодействий полимер – растворитель, которые не учтены при выборе критерия растворимости полимера по сходству параметров растворимости. К специфическим взаимодействиям относят водородные и координационные связи, образующиеся при участии функциональных групп в полимере и растворителе, в частности гидроксильной, карбоксильной, сложноэфирной, эпоксидной, уретановой, аминной, амидной и др. Для таких систем плотность энергии когезии не всегда может служить критерием растворимости.
Попытки количественного учета межмолекулярных взаимодействий различного характера привели к появлению так называемого трехмерного
15
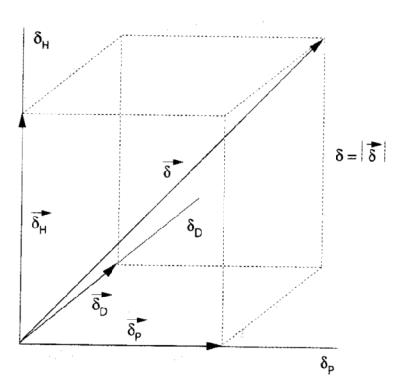
параметра растворимости (параметр Хансена), который можно представить в виде векторной суммы величин трех частных параметров:
|
2 d2 p2 h2 , |
(5) |
где d |
– параметр, учитывающий дисперсионные взаимодействия; |
|
p |
– параметр, учитывающий дипольные и |
индукционные |
взаимодействия, характерные для полярных молекул; |
|
|
h |
– параметр, учитывающий взаимодействия, |
обусловленные |
водородными связями.
Согласно приведенной формуле δ представляет собой векторную сумму этих трех векторов
Рисунок 2 – Параметры растворимости в виде векторов в трехмерной системе по Хансену
Расчет соответствующих величин δ в этом случае возможен только с использованием эмпирических уравнений.
Трехмерный параметр может быть использован для определения области растворимости полимеров и смешиваемости растворителей. Как правило, растворители хорошо смешиваются, если разность их параметров растворимости не превышает 4 - 6 единиц. Верхняя граница хорошей
16
растворимости полимера в растворителе представляет собой разность параметров растворимости в 6 единиц. Разницу в параметрах растворимости двух веществ, например растворителя (L) и полимера (P), находят по правилам векторной алгебры согласно следующему уравнению:
d (L) d (P) 2 p (L) p (P) 2 h (L) h (P) 2 0,5 |
(6) |
Таблица 2 – Параметры растворимости некоторых органических растворителей
Органический |
Параметры растворимости, (Дж/см3)1/2 |
||||
растворитель |
|
|
|
|
|
δ |
δd |
δр |
δh |
||
|
|
|
|
|
|
Хлороформ |
18,79 |
17,80 |
2,50 |
6,10 |
|
|
|
|
|
|
|
Этиловый спирт |
26,36 |
15,78 |
8,80 |
19,40 |
|
|
|
|
|
|
|
Бутиловый спирт |
23,05 |
15,93 |
5,70 |
15,70 |
|
|
|
|
|
|
|
Пропиловый |
24,42 |
15,81 |
6,70 |
17,30 |
|
спирт |
|||||
|
|
|
|
||
|
|
|
|
|
|
Этилцеллозольв |
24,07 |
16,01 |
9,20 |
14,30 |
|
|
|
|
|
|
|
Ацетон |
19,93 |
15,46 |
10,40 |
6,90 |
|
|
|
|
|
|
|
Толуол |
18,18 |
17,99 |
1,43 |
2,04 |
|
|
|
|
|
|
|
Этиленгликоль |
33,25 |
16,83 |
11,00 |
25,90 |
|
|
|
|
|
|
|
Метилэтилкетон |
18,91 |
15,85 |
9,00 |
5,10 |
|
|
|
|
|
|
|
Диацетоновый |
20,77 |
15,61 |
8,20 |
10,80 |
|
спирт |
|||||
|
|
|
|
||
|
|
|
|
|
|
Бутилацетат |
17,30 |
15,65 |
3,70 |
6,30 |
|
|
|
|
|
|
|
Этилацетат |
18,65 |
15,18 |
5,30 |
9,20 |
|
|
|
|
|
|
|
Диметилформамид |
24,77 |
17,38 |
13,70 |
11,20 |
|
|
|
|
|
|
|
Таблица 3 – Параметры растворимости некоторых полимеров (олигомеров)
Полимер |
Параметры растворимости, (Дж/см3)1/2 |
||||
δ |
δd |
δр |
δh |
||
|
|||||
Алкид тощий |
21,4 |
18,8 |
9,2 |
5,3 |
|
|
|
|
|
|
|
Алкид жирный |
19,2 |
17,3 |
5,1 |
6,1 |
|
|
|
|
|
|
|
Ацетат целлюлозы |
25,9 |
19,0 |
12,2 |
12,2 |
|
|
|
|
|
|
|
17
Продолжение таблицы 3
Полимер |
|
Параметры растворимости, (Дж/см3)1/2 |
|||
|
δ |
δd |
δр |
δh |
|
|
|
||||
Мочевиноформальдегидная |
24,7 |
19,4 |
8,2 |
13,1 |
|
смола |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Нитрат целлюлозы |
22,0 |
14,3 |
14,3 |
8,8 |
|
|
|
|
|
|
|
Полибутадиен |
|
18,8 |
18,0 |
5,1 |
2,4 |
|
|
|
|
|
|
Поливинилацетат |
|
23,0 |
19,3 |
10,2 |
8,2 |
|
|
|
|
|
|
Поливинилбутираль |
22,4 |
17,3 |
8,8 |
11,2 |
|
|
|
|
|
|
|
Поливинилхлорид |
|
22,4 |
18,1 |
10,0 |
3,1 |
|
|
|
|
|
|
Полиизобутилен |
|
17,5 |
15,9 |
2,0 |
7,1 |
|
|
|
|
|
|
Полиизопрен |
|
18,0 |
17,3 |
3,1 |
3,1 |
|
|
|
|
|
|
Полиметилметакрилат |
23,1 |
18,8 |
10,2 |
8,6 |
|
|
|
|
|
|
|
Полистирол |
|
20,0 |
17,5 |
6,1 |
4,1 |
|
|
|
|
|
|
Полиэтилметакрилат |
22,0 |
18,8 |
10,8 |
4,3 |
|
|
|
|
|
|
|
Стирол-бутадиеновый |
18,4 |
17,7 |
3,7 |
3,7 |
|
эластомер |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Сополимер винилхлорида с |
|
|
|
|
|
винилацетатом |
частично |
19,4 |
16,8 |
8,0 |
5,0 |
омыленный |
|
|
|
|
|
|
|
|
|
|
|
Фенолформальдегидная |
23,1 |
18,4 |
8,2 |
11,2 |
|
смола (новолак) |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Фенолформальдегидная |
26,7 |
19,2 |
10,8 |
15,1 |
|
смола (резол) |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Хлорированный |
|
20,8 |
20,0 |
7,5 |
4,3 |
полиэтилен |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Эпоксидная смола |
|
23,5 |
17,3 |
11,2 |
11,2 |
|
|
|
|
|
|
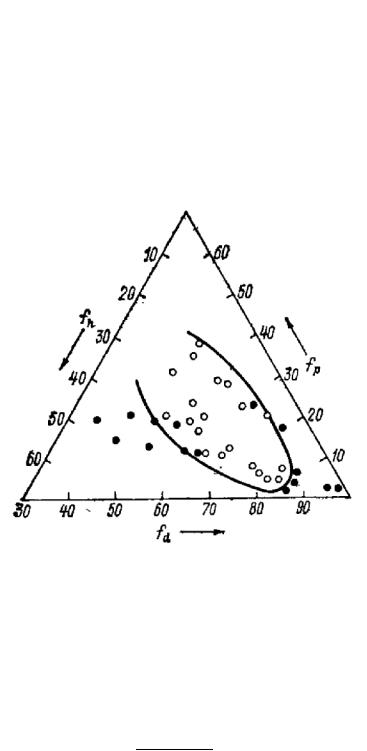
Несмотря на то, что параметр растворимости можно рассчитать, область растворимости обычно определяют экспериментально – по растворимости данного полимера в различных растворителях. Нагляднее всего это можно проиллюстрировать, используя тройную диаграмму на плоскости (треугольник Гиббса). Перевод тройных параметров в координаты на этой диаграмме осуществляют, находя доли частных параметров от их суммы:
18
fd 100 |
d |
; fp 100 |
p |
; fh 100 |
h |
(7) |
|
|
|
Выраженные таким образом параметры дисперсионного, полярного и водородного взаимодействия в сумме дают 100. Каждый растворитель может быть изображен на площади треугольника точкой с координатами, соответствующими его величинам: fd, fP и fh. Пример изображения области растворимости полимера представлен на рисунке
Рисунок 2 – Область растворимости смолы
С помощью тройной диаграммы может быть выбрана и оптимальная смесь растворителей для каждого олигомера. Параметр растворимости для смесей – величина аддитивная и может быть рассчитан по уравнению:
|
|
|
xi Vi i |
, |
(8) |
|
см |
xi Vi |
|||||
|
|
|
|
где Vi – мольный объем i-гo компонента; xi – мольная доля i-гo компонента;
xi=(Ci/Mi)/Σ(Ci/Mi); здесь Ci– концентрация i-го компонента, % (масс).
19

Для расчета состава бинарной смеси растворителей, выбранных с учетом технологических, экономических и других факторов, на диаграмму наносят точки, соответствующие их параметрам растворимости. Соединяя эти точки прямой линией, находят на ней точку, расположенную в наибольшей близости к точке олигомера, а затем по координатам этой точки определяют оптимальный состав смеси.
В состав растворителей могут входить и органические жидкости, не растворяющие олигомеры, координаты которых расположены вне области их растворимости. Их обычно называют разбавителями.
Пара «растворитель – разбавитель» должна выбираться с таким расчетом, чтобы прямая, соединяющая точки с координатами растворителя и разбавителя, проходила вблизи точки олигомера. Такая смесь является растворяющей только на отрезке, попадающем в область растворимости. Наибольшей растворяющей способностью обладают смеси растворителей, координаты которых расположены с противоположных сторон точки, соответствующей олигомеру.
Растворяющую способность органической жидкости можно количественно оценить и на основе термодинамических соображений.
Вещество В растворяется в жидкости (растворителе), если оно имеет сродство к растворителю (и раствору) большее, чем к своей собственной фазе (к самому себе). Сродство В к данной фазе определяется величиной его химического потенциала (парциальной мольной энергией Гиббса, Дж/моль) в этой фазе. Сродство тем выше, чем ниже химический потенциал. Поэтому, если μВ – химический потенциал вещества в собственной фазе, a μBS – его потенциал в растворе, то вещество В будет обладать более высоким сродством к раствору в том случае, когда разность (μВ - μBS) имеет положительное значение. Растворяющая сила (способность) dB растворителя вещества В равна (безразмерная величина):
dB |
B BS , |
(9) |
|
RT |
|
где R – газовая постоянная, |
равная 8,315 Дж-К-1моль-1; Т – абсолют- |
|
ная температура, К. |
|
|
Химический потенциал раствора μBS зависит от |
объемной доли |
|
растворенного вещества. Если значение dB положительно, то сродство В к растворителю больше, чем к своей фазе, и растворение происходит бес- 20
