
идз / ИДЗ2 Андреева
.docxМИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра микро- и наноэлектроники |
||||||
ОТЧЁТ по индивидуальному домашнему заданию № 2 по дисциплине «Методы анализа структур электроники и микросистемной техники» Тема: «Оже-спектроскопия»
|
||||||
|
||||||
Санкт-Петербург 2025 |
МОДЕЛИРОВАНИЕ СПЕКТРА
Исследуемый
образец – Mn2O4Ti.
В таблице 1 приведём значения энергии
связи
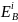 электронов на i-ом
слое для атомов, содержащихся в исследуемом
образце.
электронов на i-ом
слое для атомов, содержащихся в исследуемом
образце.
Таблица 1 – Энергии связи электронов в атомах образца, эВ
Z |
М, г/моль |
Элемент |
K |
LI |
LII |
LIII |
MI |
MII |
MIII |
MIV |
MV |
25 |
54,938 |
Mn |
6539 |
769 |
652 |
641 |
84 |
49 |
4 |
||
8 |
16 |
O |
532 |
24 |
7 |
– |
– |
– |
– |
– |
|
22 |
47,9 |
Ti |
4965 |
564 |
461 |
455 |
59 |
34 |
3 |
||
Представим все возможные Оже-переходы в таблице 2.
Таблица 2 – Возможные Оже-переходы для элементов исследуемого соединения
Вид перехода |
A |
B |
C |
KLL-переходы |
K |
LI |
LI |
LII |
|||
LIII |
|||
LII |
LII |
||
LIII |
|||
LIII |
LIII |
||
LMM-переходы |
LI |
MI |
MI |
MII |
|||
MIII |
|||
MIV |
|||
MV |
|||
MII |
MII |
||
MIII |
|||
MIV |
|||
MV |
|||
MIII |
MIII |
||
MIV |
|||
MV |
|||
MIV |
MIV |
||
MV |
|||
MV |
MV |
||
LII |
MI |
MI |
|
MII |
|||
MIII |
|||
MIV |
|||
MV |
|||
MII |
MII |
||
MIII |
|||
MIV |
|||
MV |
|||
MIII |
MIII |
||
MIV |
|||
MV |
|||
MIV |
MIV |
||
MV |
|||
MV |
MV |
||
LIII |
MI |
MI |
|
MII |
|||
MIII |
|||
MIV |
|||
MV |
|||
MII |
MII |
||
MIII |
|||
MIV |
|||
MV |
|||
MIII |
MIII |
||
MIV |
|||
MV |
|||
MIV |
MIV |
||
MV |
|||
MV |
MV |
Определим наиболее вероятные Оже-переходы для каждого из элементов исследуемого соединения по рисунку 1.
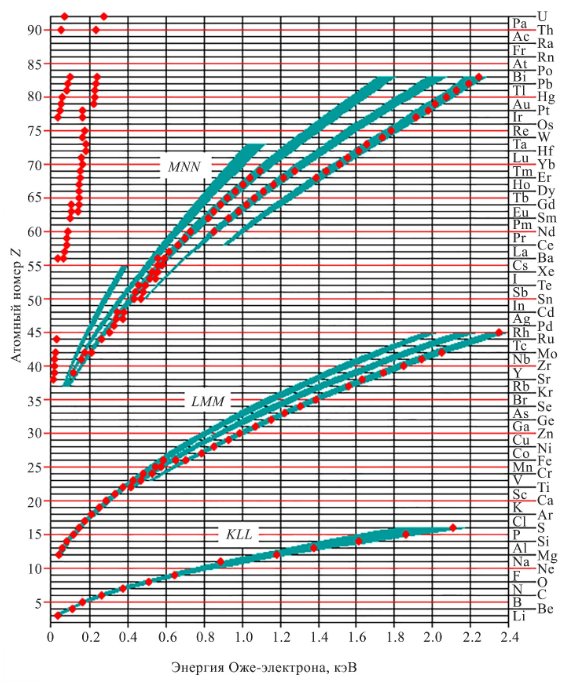
Рисунок 1 – Зависимость энергии Оже-электронов от атомного номера элемента
Таким образом, для кислорода наиболее вероятным является переход типа KLL, а для марганца и титана – LMM. Найдём значения энергии Оже-переходов, соответствующие самым большим значениям выхода в данном виде анализа по спектрам в приложении А.
Приблизительные значения энергии Оже-перехода: Mn ~ 589 эВ, O ~ 503 эВ, Ti ~ 418 эВ.
Определим энергию Оже-переходов с учётом возникновения дырок, используя соотношение (1).
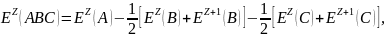 (1)
(1)
где
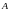 ,
,
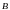 ,
,
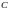 – энергетические уровни Оже-перехода,
– энергетические уровни Оже-перехода,
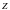 – порядковый номер элемента, для которого
производится расчет. В таблице 3 представим
результаты расчёта энергии Оже-электронов
для элементов исследуемого соединения.
– порядковый номер элемента, для которого
производится расчет. В таблице 3 представим
результаты расчёта энергии Оже-электронов
для элементов исследуемого соединения.
Для расчёта энергии Оже-переходов представим значения энергий для атомов, порядковый номер которых больше на единицу относительно находящихся в исследуемом образце, в таблице 2.
Таблица 2 – Энергии связи электронов в атомах образца, эВ
Z |
Элемент |
K |
LI |
LII |
LIII |
MI |
MII |
MIII |
MIV |
MV |
26 |
Fe |
7114 |
846 |
723 |
710 |
95 |
56 |
6 |
||
9 |
F |
686 |
31 |
9 |
– |
– |
– |
– |
– |
|
23 |
V |
5465 |
628 |
520 |
513 |
66 |
38 |
2 |
||
Пример расчёта для KLILII,III -перехода в атоме O и для LIIMIMI-перехода в атоме Ti:
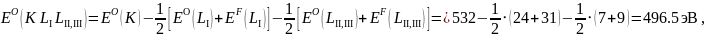
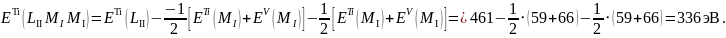
Таблица 3 – Значения энергии Оже-электронов (эВ)
Вид перехода |
A |
B |
C |
Mn |
O |
Ti |
KLL-переходы |
K |
LI |
LI |
4924 |
477 |
3773 |
LII |
5044 |
496.5 |
3878.5 |
|||
LIII |
5056 |
496.5 |
3885 |
|||
LII |
LII |
5164 |
516 |
3984 |
||
LIII |
5176 |
516 |
3990.5 |
|||
LIII |
LIII |
5188 |
516 |
3997 |
||
LMM-переходы |
LI |
MI |
MI |
595 |
– |
439 |
MII |
627 |
465.5 |
||||
MIII |
627 |
465.5 |
||||
MIV |
674.5 |
499 |
||||
MV |
674.5 |
499 |
||||
MII |
MII |
664 |
492 |
|||
MIII |
664 |
492 |
||||
MIV |
711.5 |
525.5 |
||||
MV |
711.5 |
525.5 |
||||
MIII |
MIII |
664 |
492 |
|||
MIV |
711.5 |
525.5 |
||||
MV |
711.5 |
525.5 |
||||
MIV |
MIV |
759 |
559 |
|||
MV |
759 |
559 |
||||
MV |
MV |
759 |
559 |
|||
LII |
MI |
MI |
473 |
– |
336 |
|
MII |
510 |
362.5 |
||||
MIII |
510 |
362.5 |
||||
MIV |
557.5 |
396 |
||||
MV |
557.5 |
396 |
||||
MII |
MII |
547 |
389 |
|||
MIII |
547 |
389 |
||||
MIV |
594.5 |
422.5 |
||||
MV |
594.5 |
422.5 |
||||
MIII |
MIII |
547 |
389 |
|||
MIV |
594.5 |
422.5 |
||||
MV |
594.5 |
422.5 |
||||
MIV |
MIV |
642 |
456 |
|||
MV |
642 |
456 |
||||
MV |
MV |
642 |
456 |
|||
LIII |
MI |
MI |
462 |
– |
330 |
|
MII |
499 |
356.5 |
||||
MIII |
499 |
356.5 |
||||
MIV |
546.5 |
390 |
||||
MV |
546.5 |
390 |
||||
MII |
MII |
536 |
383 |
|||
MIII |
536 |
383 |
||||
MIV |
583.5 |
416.5 |
||||
MV |
583.5 |
416.5 |
||||
MIII |
MIII |
536 |
383 |
|||
MIV |
583.5 |
416.5 |
||||
MV |
583.5 |
416.5 |
||||
MIV |
MIV |
631 |
450 |
|||
MV |
631 |
450 |
||||
MV |
MV |
631 |
450 |
Наиболее подходящими из рассчитанных являются: для Mn – LIIIMII,IIIMIV,V -переход, для O – KLILII,III-переход, для Ti – LIIIMII,IIIMIV,V.
Для расчёта выхода характеристического рентгеновского излучения используем соотношение (2).
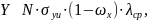 (2)
(2)
где
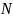 – атомный процент содержания элемента,
– атомный процент содержания элемента,
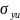 – сечение
ударной ионизации, определяемое
соотношением (3),
– сечение
ударной ионизации, определяемое
соотношением (3),
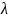 – глубина
выхода Оже-электронов, определяемая
средней длиной свободного пробега,
– глубина
выхода Оже-электронов, определяемая
средней длиной свободного пробега,
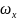 – выход
флюоресценции, справочное значение.
– выход
флюоресценции, справочное значение.
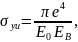 (3)
(3)
где
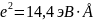 .
.
Плотность соединения определяется соотношением (4).
|
(4) |
где n – количество формульных единиц в единице объёма,
М – молярная масса одной формульной единицы,
NA = 6,02∙1023 моль-1 – число Авогадро.
Для того, чтобы найти количество формульных единиц в единице объёма, необходимо найти объём ячейки. В нашем случае решётка имеет тетрагональную сингонию, как видно на рисунке 2, соответственно объём можем найти по формуле (5).
|
(5) |
где 𝑎 = 6,17 Å,
c = 8,564 Å.
Число формульных единиц на одну ячейку равно 4. Тогда концентрация формульных единиц в единице объёма будет определяться выражением (6).
|
(6) |
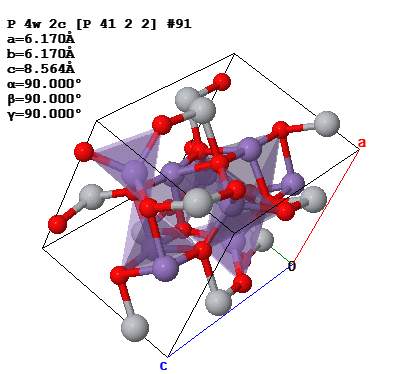
Рисунок 2 – Элементарная ячейка Mn2O4Ti
Молярная масса одной формульной единицы рассчитывается по формуле (7):
|
(7) |
где M𝑖 – молярная масса i-го элемента.
Посчитаем количество валентных электронов на одну формульную единицу. Общая степень окисления соединения должна быть равна нулю. Так как принимает электроны в нашем случае только кислород, его степень окисления 4∙(–2) = – 8 равна сумме степеней марганца и титана. Тогда общая степень окисления будет равна 2∙8 = 16. И соответственно количество валентных электронов на одну формульную единицу равно 16.
Произведём расчёт:
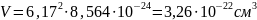
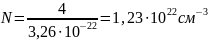
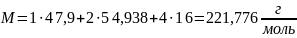
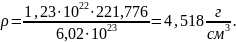
Количество атомов элемента в единице объёма можно найти как произведение количества формульных единиц в единице объёма на количество атомов элемента в одной формульной единице. Произведём расчёт для каждого элемента.
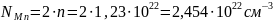
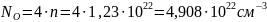
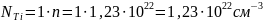
Рассчитаем ионизационные потери. Если энергия Оже-электрона больше, чем энергия связи на определённой оболочке, то он может выбить электрон с неё. Рассчитаем по формуле (8) ионизационные потери.
В таблице 4 представим распределение электронов по уровням. Расчётные данные приведём в таблицах 5,6 и 7
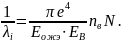 (8)
(8)
где nв – количество электронов на соответствующем энергетическом уровне.
Таблица 4 – Количество электронов на разных энергетических уровнях
Элемент |
K |
LI |
LII |
LIII |
MI |
MII |
MIII |
MIV |
MV |
NI |
Mn |
2 |
2 |
2 |
4 |
2 |
2 |
4 |
5 |
2 |
|
O |
2 |
2 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Ti |
2 |
2 |
2 |
4 |
2 |
2 |
4 |
2 |
2 |
|
Таблица 5 – Расчет ионизационных потерь для перехода MnLIIIMII,IIIMIV,V , 1/см
Оболочка |
Mn |
O |
Ti |
K |
– |
5145,928158 |
– |
L1 |
– |
114068,0742 |
4853,9606 |
L2 |
– |
391090,54 |
5938,46807 |
L3 |
– |
12033,5551 |
|
M1 |
32590,87833 |
– |
46400,5725 |
M2,3 |
167610,2314 |
– |
241555,922 |
M4,5 |
1711021,113 |
– |
912544,593 |
Таблица 6 – Расчет ионизационных потерь для перехода OKLILII,III, 1/см
Оболочка |
Mn |
O |
Ti |
K |
– |
– |
– |
L1 |
– |
134055,8334 |
– |
L2 |
– |
459620,0002 |
7071,07693 |
L3 |
– |
109062,373 |
|
M1 |
38301,66668 |
– |
94627,6471 |
M2,3 |
196980,0001 |
– |
283882,941 |
M4,5 |
2010837,501 |
– |
1072446,67 |
Таблица 7 – Расчет ионизационных потерь для перехода TiLIIIMII,IIIMIV,V, 1/см
Оболочка |
Mn |
O |
Ti |
K |
– |
– |
– |
L1 |
– |
159804,853 |
– |
L2 |
– |
547902,3532 |
– |
L3 |
– |
– |
|
M1 |
45658,52943 |
– |
65005,3639 |
M2,3 |
234815,2942 |
– |
338410,277 |
M4,5 |
2397072,795 |
– |
1278438,82 |

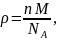
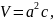
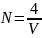
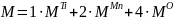 ,
,