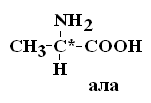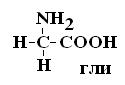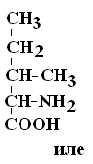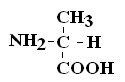- •Цвиттер-ион
- •2 Вопрос
- •Определение первичной структуры белка (псб).
- •Вторичная структура белка (всб).
- •Беспорядочный клубок
- •4 Вопрос
- •5 Вопрос
- •Состав нуклеиновых кислот
- •Углеводная часть
- •Наиболее распространенные нуклеотиды клетки.
- •7 Вопрос Вторичная структура днк. Правила Чаргаффа.
- •8 Вопрос
- •9 Вопрос
- •10 Вопрос
- •12 Вопрос
1 вопрос
α-АК являются строительными блоками, из которых образуются белковые полипептидные цепи (ППЦ) и, собственно, сами белки. Аминокислоты – это производные карбоновых кислот, в которых один из водородов углеродной цепи замещен на R.
Общая формула аминокислот:
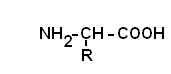
Аминокислоты – это бесцветные кристаллические вещества, плавящиеся при высоких температурах (250С). Легко растворимы в воде и нерастворимы в органических растворителях. Имея в своем составе NH2–группу основного характера и COOH– с кислыми свойствами, АК обладают амфотерностью. В водных растворах α-АК в основном существуют в виде биполярных ионов или цвиттер-ионов с диссоциированной COO––группой и протонированной NH3+–группой.
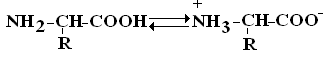
Цвиттер-ион
В зависимости от рН–среды АК могут быть в виде анионов, катионов, нейтральных биполярных ионов или в виде смеси их форм.
В сильнокислой среде АК присутствуют в виде катионов (q +)
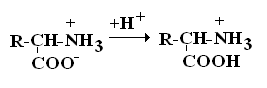
в сильнощелочной среде – в виде анионов (–q)
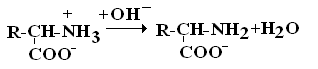
Стереохимия аминокислот.
Важным свойством АК является их оптическая активность в водных растворах. Это свойство АК обусловлено наличием в их структуре хирального атома С. Хиральным атомом или хиральным центром называется атом, у которого все связи замещены различными радикалами (R):
|
|
Оптически неактивной является только АК глицин, которая не имеет хирального центра.
Существуют два вида изомеров – структурные и стереоизомеры.
Структурные изомеры – это вещества с одинаковой Mr, но различной последовательностью связывания атомов в молекуле.
Стереоизомеры – это изомеры с одинаковой последовательностью соединения атомов, но с различным их расположением в пространстве.
Если 2 стереоизомера относятся друг к другу как предмет и его зеркальное отражение, их называют энантиомерами.
Энантиомеры всегда проявляют одинаковые химические и физические свойства за исключением одного – направления вращения плоскости поляризованного луча. Энантиомер, вращающий плоскость поляризации по часовой стрелке, называется правовращающим («+»), а против часовой стрелки – левовращающим («–»). Природные аминокислоты являются как «+», так и «–».
Смесь равного количества молекул правого и левого энантиомеров называется рацемической смесью.
Рацематы не обладают оптической активностью. По пространственному расположению атомов и радикалов вокруг хирального центра различают аминокислоты Д– и L–ряда. Для определения принадлежности АК к Д– или L–ряду сравнивают конфигурацию ее хирального центра с энантиомером глицеральдегида (ГА).
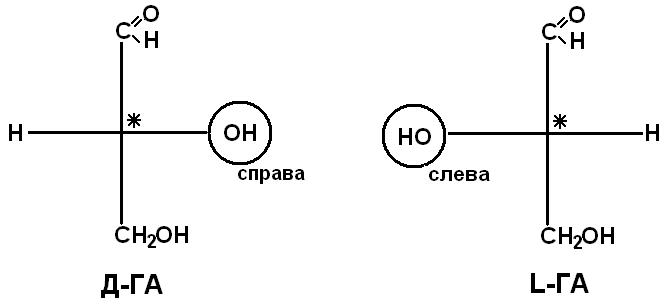
По аналогии, в аминокислотах если NH2–группа расположена справа от оси СООН-R, то это Д–АК, а если слева – L–АК.
|
|
Все аминокислоты природных белков являются α–АК.
Современная рациональная классификация аминокислот
в соответствии с ней все аминокислоты делятся на 4 группы.
I – Неполярные гидрофобные аминокислоты – их 8.
|
Аланин
Валин
Лейцин
Изолейцин
Триптофан |
|
Пролин
Фенилаланин
Метионин
|
II –Полярные гидрофильные незаряженные аминокислоты – их 7.
|
Глицин
Серин
Треонин
Цистеин |
|
Тирозин
Аспарагин
Глутамин |
III – Отрицательно заряженные кислые аминокислоты
|
Аспарагиновая кислота |
|
Глутаминовая кислота |
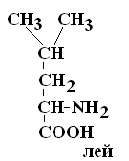
IV Положительно заряженные основные аминокислоты
|
Лизин
Аргинин
|
|
Гистидин
|
Образование пептидных связей.
–СООН группа одной аминокислоты может реагировать с –NH2 группой другой аминокислоты с образованием пептидных связей.
|
Пептидные цепи белков – это линейные полимеры –АК, соединенных пептидной связью.
Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками, цепь повторяющихся групп –NH–CH–CO– называется пептидным остовом. Аминокислотный остаток, имеющий свободную NH2–группу называется N–концевым, а имеющий свободным α–карбоксигруппу – С–концевым.
Пептиды пишутся и читаются с N–конца.
Пептидная связь, образуемая аминогруппой пролина, отличается от других пептидных связей: у атома азота пептидной группы отсутствует водород, вместо него имеется связь с R.
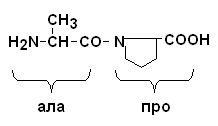
Пептидные связи очень прочные, для их неферментного гидролиза in vitro требуются жесткие условия: высокие t и , кислая среда, длительное время. In vivo, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов (), называемых протеазами или пептидгидролазами.
Полипептидная теория строения белков была предложена в 1902 г. Э.Фишером, в ходе дальнейшего развития биохимии эта теория была экспериментально доказана