
- •Сестринское дело
- •Содержание
- •Введение
- •Требования к студентам
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •СТАТИСТИЧЕСКОЕ ИСТОЛКОВАНИЕ
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Принцип действия тепловых двигателей. Коэффициент полезного
- •Принципы действия тепловых двигателей
- •Принципы действия тепловых двигателей
- •Роль холодильника
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Необратимость процессов в природе.
- •Коэффициент полезного действия (КПД) теплового двигателя
- •Необратимость тепловых процессов
- •Необратимость тепловых процессов. Примеры:
- •Необратимость тепловых процессов. Примеры:
- •Необратимость тепловых процессов. Примеры:
- •Необратимость тепловых процессов
- •Второй закон термодинамики
- •Второй закон термодинамики
- •Второй закон термодинамики
- •Контрольные задания
- •Задание. Текст задания
- •Конец выполнения контрольных заданий
- •Литература
- •Конец работы.

Необратимость процессов в природе.
Примеры необратимых процессов
Вероятность макроскопического состояния равна отношению числа микросоcтояний, реализующих макросостояние, к полному числу возможных микросостояний.
Далее |
Назад |
Содержание |
Выход |

Необратимость процессов в природе.
Примеры необратимых процессов
Переход системы к наиболее вероятному состоянию.
Чем больше , тем больше вероятность данного макросостояния и тем большее время система будет находиться в этом состоянии. Таким образом, эволюция системы происходит в направлении перехода от маловероятных состоянии к состояниям более вероятным. Именно с этим связана необратимость течения макроскопических процессов, несмотря на обратимость законов, управляющих движением отдельных частиц. Обратный процесс не является невозможным, он просто маловероятен. Так как все микросостояния равновероятны, то в принципе может возникнуть макросостояние, реализуемое малым числом микросостояний, но это чрезвычайно редкое событие. Мы не должны удивляться, если никогда не увидим их. Наиболее вероятно состояние теплового равновесия. Ему отвечает наибольшее число микросостояний.
Далее |
Назад |
Содержание |
Выход |

Необратимость процессов в природе.
Примеры необратимых процессов
Легко понять, почему механическая энергия самопроизвольно переходит во внутреннюю. Механическое движение системы (или тела) это упорядоченное движение, когда все части системы перемещаются определенным образом. Упорядоченному движению отвечает небольшое число микросостояний по сравнению с беспорядочным тепловым движением. Поэтому маловероятное состояние упорядоченного механического движения само собой превращается в беспорядочное тепловое движение, реализуемое гораздо большим числом микросостояний.
Далее |
Назад |
Содержание |
Выход |

Необратимость процессов в природе.
Примеры необратимых процессов
Менее нагляден процесс перехода теплоты от горячего тела к холодному. Но и здесь сущность необратимости та же. В начале теплообмена есть две группы молекул: молекулы с более высокой средней кинетической энергией у горячего тела и молекулы с низкой средней кинетической энергией у холодного. При установлении теплового равновесия в конце процесса все молекулы окажутся принадлежащими к одной группе молекул с одной и той же средней кинетической энергией. Более упорядоченное состояние с разделением молекул на две группы перестает существовать.
Далее |
Назад |
Содержание |
Выход |

Необратимость процессов в природе.
Примеры необратимых процессов
Итак, необратимость процессов связана с тем, что неравновесные макроскопические состояния маловероятны. Эти состояния либо возникают естественным путем в результате эволюции Вселенной, либо создаются искусственно человеком. Например, мы получаем сильно неравновесные состояния, нагревая рабочее тело теплового двигателя до температур, на сотни градусов превышающих температуру окружающей среды.
Далее |
Назад |
Содержание |
Выход |

Необратимость процессов в природе.
Примеры необратимых процессов
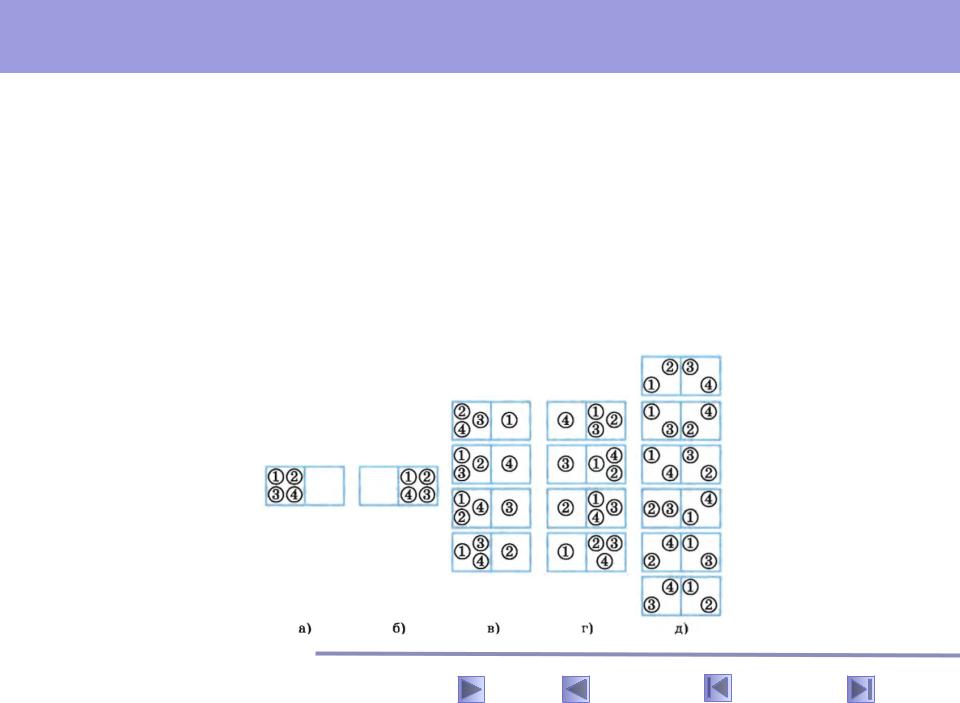
Расширение газа из четырех молекул. Рассмотрим простой пример, позволяющий вычислить вероятности различных состояний и наглядно показывающий, как увеличение числа частиц в системе приводит к тому, что процессы становятся необратимыми, несмотря на обратимость уравнений движений микрочастиц.
Пусть в сосуде имеется газ, состоящий всего лишь из четырех молекул. Вначале все молекулы находится в левой половине сосуда, отделенной перегородкой от правой половины (рис. 2, а). Уберем перегородку, и газ начнет расширяться, занимая весь сосуд. Посмотрим, какова вероятность того, что гад опять сожмётся, то есть молекулы снова соберутся в одной половине сосуда.
Далее |
Назад |
Содержание |
Выход |
Необратимость процессов в природе.
Примеры необратимых процессов
В нашем примере макросостояние будет характеризоваться указанием числа молекул в одной половине сосуда безотносительно к тому, какие именно молекулы здесь находятся. Микросостояния задаются распределением молекул по половинам сосуда с указанием того, какие именно молекулы занимают данную половину сосуда. Пронумеруем молекулы цифрами 1, 2, 3, 4. Возможны 16 различных микросостояний, все они изображены на рисунке 2, а-д
Рис.2
Далее |
Назад |
Содержание |
Выход |

Необратимость процессов в природе.
Примеры необратимых процессов
Вероятность того, что все молекулы соберутся в левой (или правой) половине сосуда, равна:
так как данному макросостоянию соответствует одно микросостояние из полного их числа 16 различных микросостояний (см. рис. 2, а, б).
Вероятность же того, что молекулы распределятся поровну, будет в 6 раз больше:
так как данному макросостоянию соответствует 6 микросостояний из полного их числа 16 (см. рис. 2, д).
Далее |
Назад |
Содержание |
Выход |

Необратимость процессов в природе.
Примеры необратимых процессов
Вероятность того, что в одной половине сосуда, например левой, будет три молекулы, а в другой соответственно одни молекула равна (см. рис. 2,
в, г):
Далее |
Назад |
Содержание |
Выход |

Необратимость процессов в природе.
Примеры необратимых процессов
Большую часть времени молекулы будут распределены в половинках сосуда поровну: это наиболее вероятное состояние. Но примерно интервала времени наблюдения молекулы будут занимать одну из половинок сосуда. Таким образом, процесс расширения газа в данном примере обратим и газ снова сжимается через сравнительно небольшой промежуток времени.
Далее |
Назад |
Содержание |
Выход |
