
Лабы Гульнову / Абсорбция
.docxАбсорбционная спектроскопия макромолекул: белки
АННОТАЦИЯ
Были сняты и проанализированы спектры поглощения растворов БСА, триптофана и тирозина, растворённых в фосфатном буфере и растворе гидроксида натрия. Установлено, что абсорбционные свойства БСА схожи с триптофаном. При денатурации белка мочевиной наблюдается уменьшение коэффициента экстинкции.
ВВЕДЕНИЕ
Молекулы поглощают свет. Длины волн, при которых происходит поглощение, и степень поглощения зависят от структуры и окружения молекулы, поэтому абсорбционная спектроскопия является полезным инструментом для характеристики макромолекул различного размера.
Первичная структура белка – последовательность аминокислот в полипептидной цепи.
Вторичная структура белка – локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. α-спирали – плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. β-листы (складчатые слои) – несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка.
Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие: ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; водородные связи; гидрофильно-гидрофобные взаимодействия при взаимодействии с окружающими молекулами воды белковая молекула
«стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура – взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Оптическая плотность в спектроскопии – это мера ослабления света прозрачными объектами.
𝐷 = lg 𝐼0
𝐼
(1)
Закон Бугера — Ламберта — Бера — физический закон, определяющий ослабление параллельного монохроматического пучка света при распространении его в поглощающей среде:
𝐷 = 𝐶𝑙𝜀 (2)
где D - оптическая плотность раствора, l - длина пути, которую прошёл пучок света в растворе, ɛ - коэффициент молярной экстинкции. Коэффициент молярной экстинкции показывает насколько сильно химическое вещество поглощает свет при определенной длине волны. Зависимость вероятности поглощения от длины волны называют спектром поглощения.
МАТЕРИАЛЫ И МЕТОДЫ
Приготовление растворов для исследования:
Получите порошок белка (БСА). Рассчитайте, навеску какой массы вы должны сделать, чтобы получить 2 мл раствора концентрации 1*10-5 М (учитывая, что молекулярная масса БСА около 67000 Да). Проверьте свои расчеты у преподавателя. Приготовьте навеску белка и растворите её в 2 мл фосфатного буфера (рН 7). Дайте раствору постоять не менее 20 мин в темном прохладном месте. Растворы тирозина и триптофана в двух средах получите у преподавателя.
Приготовьте (или получите у преподавателя) растворы аминокислот тирозина и триптофана. Молекулярная масса триптофана 204, тирозина – 181, требуемая концентрация – не менее 5*10-4 М.
Измерение спектров поглощения белка и аминокислот:
А) Измерьте спектры поглощения раствора белка (концентрация 1*10-5 М) в буфере, а триптофана (5*10-5 М) и тирозина (5*10-4 М) в двух средах – растворе NaOH и фосфатном буфере.
Условия измерения: диапазон 260 – 400 нм, шаг 2 нм (medium), объем жидкости в кювете – не менее 2 мл.
Б) Измерьте спектр поглощения денатурированного белка. Для этого доливайте маленькими дозами в измерительную кювету с белком и в кювету сравнения денатурирующий агент, указанный преподавателем, или проведите термоденатурацию. После каждой добавки агента регистрируйте спектр поглощения до тех пор, пока спектр не перестанет изменяться.
РЕЗУЛЬТАТЫ
-
№
Образец
Максимум поглощения
, нм
D
, M-1 см-1
1.
Trp + NaOH
279
0,055
1100
2.
Trp + buf
279
0,043
860
3.
Tyr + NaOH
292
0,215
430
4.
Tyr + buf
275
0,051
102
5.
Альбумин + вода
279
0,215
21500
6.
Альбумин + вода + 0,1 мл мочевины
278
0,204
21429
7.
Альбумин + вода + 0,2 мл мочевины
278
0,203
22332
8.
Альбумин + вода + 0,3 мл мочевины
279
0,177
20344
9.
Альбумин + вода + 0,4 мл мочевины
278
0,203
24340
10.
Альбумин + вода + 0,5 мл мочевины
278
0,165
20471
11.
Альбумин + вода + 0,6 мл мочевины
278
0,165
21456
12.
Альбумин + вода+ 0,7 мл мочевины
279
0,158
21322
13.
Альбумин + вода + 0,8 мл мочевины
278
0,154
21568
14.
Альбумин + вода+ 0,9 мл мочевины
278
0,147
21304
15.
Альбумин + вода+ 1,0 мл мочевины
278
0,142
21289
16.
Альбумин + вода+ 1,1 мл мочевины
279
0,129
20000
17.
Альбумин + вода+ 1,2 мл мочевины
279
0,12
19200
18.
Альбумин + вода+ 1,3 мл мочевины
278
0,139
22937
19.
Альбумин + вода+ 1,4 мл мочевины
279
0,125
20593
20.
Альбумин + вода+ 1,5 мл мочевины
278
0,119
20135
21.
Альбумин + вода+ 1,6 мл мочевины
278
0,116
20173
22.
Альбумин + вода+ 1,7 мл мочевины
278
0.114
20357
23.
Альбумин + вода+ 1,8 мл мочевины
278
0,109
16873
24.
Альбумин + вода+ 1,9 мл мочевины
279
0,109
20488
25.
Альбумин + вода+ 2,0 мл мочевины
278
0.108
20789
26.
Альбумин + вода+ 2,1 мл мочевины
278
0,104
20512
27.
Альбумин + вода+ 2,2 мл мочевины
278
0,097
19635
28.
Альбумин + вода+ 2,3 мл мочевины
278
0.09
18595
29
Альбумин + вода+ 2,4 мл мочевины
278
0,091
19238

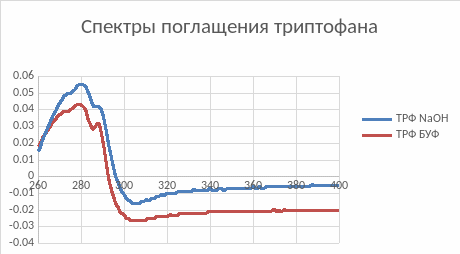
Рис.1. Спектры поглощения триптофана в Буфере и в NaOH
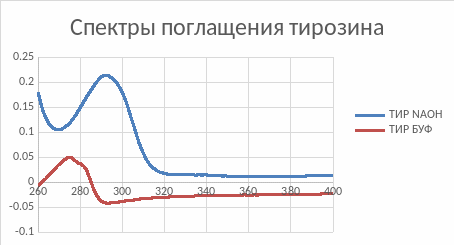
 Рис.
2. Спектры
поглощения
тирозина
в Буфере
и в NaOH
Рис.
2. Спектры
поглощения
тирозина
в Буфере
и в NaOH
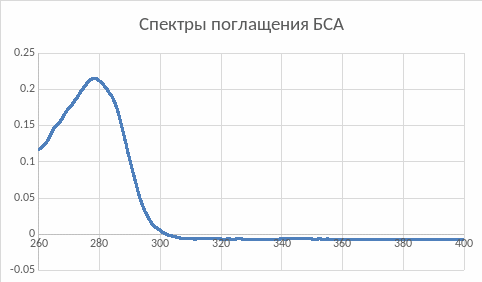
Рис.3. Спектры поглощения БСА в воде
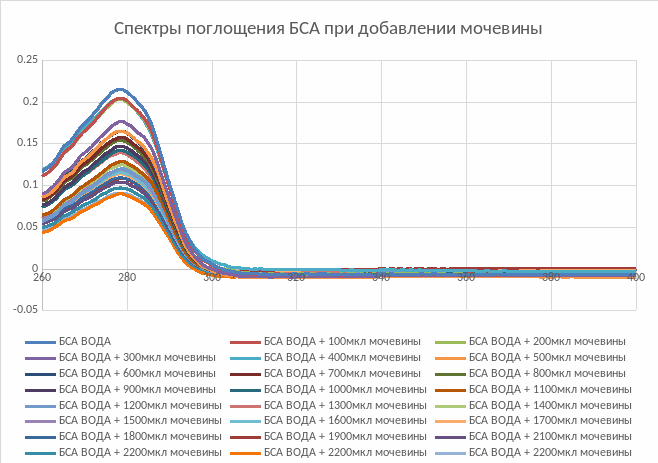
Рис.4. Спектры поглощения БСА при добавлении мочевин
ВЫВОДЫ
Абсорбционные свойства белка схожи со свойствами триптофана. Максимальная длина волны и у БСА, и у триптофана равна 279нм.
Повышение рН сдвигает спектр в длинноволновую область спектра
С повышением концентрации мочевины увеличивается коэффициент экстинкции, что свидетельствует о том, что при денатурации белка количество поглощающего света им уменьшается
При денатурации БСА мочевиной спектр белка не изменял форму спектра. Наблюдается увеличение коэффициента молярной экстинкции, что связано с изменением структуры белка в результате денатурации, а оптическая плотность варьируется от 278 до 279 нм, так как допущена ошибка в разведении аминокислот.
Из-за неправильного разведения аминокислот (тирозина и триптофана) невозможно корректно оценить коэффициент молярной экстинкции.
Спектры поглощение уходят в отрицательные значения по причине неправильного вычета фона, что можно исправить при повторном измерении поглощения фона отдельно.
В нашей работе не наблюдается светорассеяние.
