
Классификация и номенклатура органических веществ
.docxЛабораторное занятие №1. Классификация и номенклатура органических веществ.
Органические соединения классифицирует по двум признакам:
строение углеродного скелета (последовательность химически связанных между собой углеродов);
наличие и строение функциональных групп.
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: C и H.
Гомологический ряд – это ряд органических соединений, в котором каждый следующий член ряда отличается от предыдущего на группу CH2.
Строение углеродного скелета
1. Ациклические соединения — соединения с открытой углеродной цепью.
Среди них различают предельные и непредельные.



Классификация веществ по функциональным группам

НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Вследствие наличия огромного числа органических соединений огромное значение приобретает система их обозначения (наименования) таким образом, чтобы по названию можно было легко установить его структуру (химическое строение), а соответственно, и все химические и физические свойства. Таким образом, наименование должно максимально точно отражать химическое строение органического соединения, включая возможность идентификации структурных и геометрических изомеров. К настоящему моменту времени сложилось три типа номенклатуры органических соединений:
1) тривиальная;
2) рациональная;
3) систематическая (или заместительная, или номенклатура IUPAC).
Наличие тривиальных названий связано с историей. Ранее исследователи часто давали наименования соединениям по источнику их выделения или по каким-либо органолептическим, физико-химическим свойствам. Тривиальные наименования находятся в обращении иногда на таких же правах (если не чаще), чем систематические названия. Так, например, до сих пор бытует название уксусная кислота, муравьиная кислота, лактоза, мочевина и многие другие названия.
Рациональная номенклатура
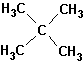
Этот тип номенклатуры получил распространение в результате того, что часть соединений может быть названа как некое родоначальное соединение, от которого они отличаются заместителями. Примером может являться неопентан («новый пентан»), углеводород класса алканов состава С5Н12. Название «неопентан» считается тривиальным, и ровным счетом ничего не говорит о его строении. Согласно номенклатуре второго типа, этот углеводород можно назвать тетраметилметаном. Название тетраметилметан уже значительно более информативно в смысле сведений о строении молекулы. Можно представить себе молекулу метана, у которой все четыре атома водорода заменены метильными группами.
Систематическим же названием неопентана является наименование 2,2-диметилпропан, составленное по правилам, разработанным Международным союзом чистой и прикладной химии (IUPAC – International Union of Pure and Applied Chemistry). Структурная формула неопентана приведена ниже:
Правило названия органических веществ по номенклатуре ИЮПАК:
1. Находим самую длинную углеродную цепь
2. Называем все заместители (включая двойную связь), так чтобы эти элементы приобрели наименьшее число.
3. Называем остаток УВ по количеству углеродов в молекуле.
Пример
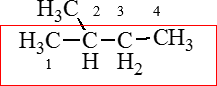
1. Нашли самую длинную углеродную цепь, пронумеровали.
2. Ко второму атому углерода есть метильный радикал называем его: 2-метил…
3. нормальная цепь включает 4 атома углерода – бутан.
2-метилбутан
Рациональная(радикально-функциональная) номенклатура используется для названий простых моно- и бифункциональных соединений и некоторых классов природных соединений. Основу названия составляет название данного класса соединений или одного из членов гомологического ряда с указанием заместителей. В качестве локантов, как правило, используются греческие буквы.
2.Гомология и гибридизация
Гомология
Гомологи́ческий ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность. Гомо́логи — вещества, входящие в один и тот же гомологический ряд.
Простейший пример гомологического ряда — алканы (общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8 и т. д.; гомологической разностью этого ряда является метиленовое звено —СН2—.
То есть каждый класс имеет гомологический ряд и все вещества в этом ряду будут является гомологами друг другу.
Гибридизация
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
sp3 — Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и трех p—электронов

Четыре sp3—гибридные орбитали симметрично ориентированны в пространстве под углом 109°28' (рис. 2).

Пространственная конфигурация молекулы, центральный атом которой образован sp3 —гибридными орбиталями —тетраэдр.
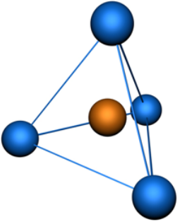
Тетраэдрическая пространственная конфигурация молекулы, центральный атом которой образован sp3—гибридными орбиталями
Однако не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов в молекуле. Рассмотрим подобный случай на примере молекул воды и аммиака. NH3. Валентность атома азота — III, его пять электронов внешнего уровня занимают четыре орбитали, значит, тип гибридизации — sp3, но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′. Аналогичные рассуждения о строении молекулы воды (H2O) приводят нас к тому, что кислород находится в sp3 гибридном состоянии, а форма молекулы — угловая, угол связи составляет 104°27′.
представлена модель молекулы метана (CH4), в которой атом углерода подвергается sp3—гибридизации.

sp2—Гибридизация — гибридизация, в которой участвуют атомные орбитали одного s— и двух p—электронов

В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом 120° друг к другу

Пространственная конфигурация молекулы, центральный атом которой включает в себя sp2—гибридные орбитали, представлена на рисунке:
Этот тип гибридизации наблюдается, например в молекуле BCl3.
Модель этой молекулы изображена на рисунке:

Модель молекулы BCl3
Примеры соединений, в которых наблюдается sp2—гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3-. Кроме того, sp2—гибридизация характерна для всех этиленовых углеводородов (алкенов) (общая формула CnH2n), карбоновых кислот и ароматических углеводородов (аренов) и других органических соединений: C2H4 (этилен), C4H8, C6H12, C6H6 (бензол), C8H10, C9H12, CH3COOH, C6H5OH (фенол), СH2O (формальдегид), C5H9NO4 (глутаминовая кислота) и др. Атомы углерода, находящиеся во втором валентном состоянии (sp2—гибридизация) связаны друг с другом двойными химическими связями. При sp2—гибридизации атом углерода образует три σ—связи и одну π—связь с соседними атомами углерода представлена на рисунке:

sp — Гибридизация (линейная)
Одна s— и одна р—орбиталь смешиваются, образуя две равноценные sp—орбитали, расположенные под углом 180°, т.е. на одной оси.

Гибридные sp—орбитали участвуют в образовании двух s—связей. Две р—орбитали не гибридизованы и расположены во взаимно перпендикулярных плоскостях.
p—Орбитали образуют в соединениях две p—связи.
Для простоты изображения пространственного строения sp—атома обычно рисуют р—орбитали в форме электронных облаков, а гибридные орбитали изображают прямыми линиями.
Углерод в sp—гибридном состоянии присутствует:
в соединениях с тройной связью HC≡CH,RC≡CR,RC≡N
в соединениях типа R2C=C=CR2
