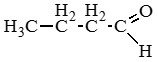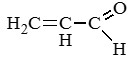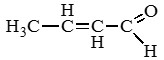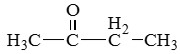41.349. Альдегиды, карбоновые кислоты, сложные эфиры
Альдегиды и кетоны.
Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.

Гомологический ряд альдегидов и кетонов:
Название |
Формула |
Альдегиды |
|
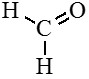
Метаналь (муравьиный альдегид, формальдегид) |
|
Этаналь (уксусный альдегид, ацетальдегид) |
|
Пропаналь (пропионовый альдегид) |
|
Бутаналь (масляный альдегид) |
|
Пропеналь (акролеин) |
|
Бутен-2-аль (кротоновый альдегид) |
|
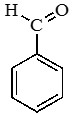
Бензальдегид |
|
Кетоны |
|
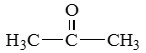
Пропанон (ацетон) |
|
Бутанон (метилэтилкетон) |
|
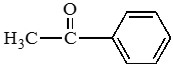
Ацетофенон (метилфенилкетон) |
|
Номенклатура и изомерия:
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания –аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
Названием альдегида = название алкана + окончание –аль
Алгоритм названия альдегидов:
1. Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, включающая атом углерода альдегидной группы.
2. Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода альдегидной группы.
3. Назовите соединение по алгоритму для углеводородов.
4. В конце названия допишите суффикс -аль.
Изомерия:
1. Углеродного скелета
2. Межклассовая – кетоны
3. ТОЛЬКО У КЕТОНОВ: положение функциональной группы
Физические свойства:
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8-12 атома «С» - душистые вещества. Альдегиды с 1-3 атомами «С» хорошо растворяются в воду, с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаза и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства альдегидов и кетонов:
Альдегиды – один из наиболее реакционноспособных классов органических соединений, что связанно с наличием в их молекулах высокополяризованной карбонильной группы.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
Горение:
2CH3CHO + 5O2 = 4CO2 + 4H2O
Присоединение (по двойной связи карбонильной группы).
В ряду
HCHO⟶RCHO⟶RCOR′ склонность к реакциям присоединения уменьшается. Это связано с наличием и числом углеводородных радикалов, связанных с атомом углерода карбонильной группы.
а) Гидрирование (восстановление водородом):
HCHO+H2⟶Ni,tCH3OH CH3−CO−CH3+H2⟶Ni,tCH3−CH(OH)−CH3
Из альдегидов при этом получаются первичные спирты, а из кетонов - вторичные.
Окисление:
CH3CHO+Ag2O=2Ag↓+CH3COOH (реакция "серебряного зеркала" - качественная реакция)
HCHO+2Cu(OH)2=2H2O+Cu2O↓+HCOOH (образуется красный осадок - качественная реакция)
Кетоны слабыми окислителями не окисляются.
Замещение атомов водорода в углеводородном радикале (замещение происходит в альфа-положение, т. е. замещается атом водорода у 2-го атома углерода):
CH3CHO + Cl2 = CH2Cl-CHO + HCl
Применение важнейших представителей:
Муравьиный альдегид:
1. Полимеры
2. Антисептик
3. Для хранения анатомических препаратов
Уксусный альдегид:
1. Получение этанола
2. Производство зеркал
3. Лекарства
4. Ацетатное волокно
5. Получение уксусной кислоты
6. Получение уксусного ангидрида
7. Получение сложного эфира – этилацетат.