
Лекция №5 Буферные системы
.docxЛекция №5. Буферные системы.
План:
Классификация и свойства буферных систем.
Механизм действия.
Буферная ёмкость.
Окислительно-восстановительные буферные растворы.
Биологическое значение буферных систем.
1.Буферная система (БС) – это равновесная система, поддерживающая постоянство рН при добавлении небольшого количества кислоты или основания, разбавлении водой.
1 тип:это протолитические системы, состоящие из раствора слабой кислоты и избытка сопряженного с ней основания.
СН3СООН + НОН ↔ СН3СОО-+ Н3О+
кислота основание сопряж. основание сопряж. кислота
СН3СООNa↔ СН3СОО-+Na+
соль избыток сопряж основания
Примеры буферных систем: СН3СООNa/ СН3СООН – ацетатная;
NaHCO3/H2CO3– бикарбонатная;
Na2CO3/H2CO3– карбонатная;
Na2HPO4/NaH2PO4– фосфатная;
Белковая НРt/NaPt; гемоглобиновая HHb/NaHb.
2.Механизм действия.
Если в ацетатную буферную систему ввести некоторое количество кислоты, то она сразу же будет взаимодействовать с ацетатом натрия, образуя кислоту буферной системы и соль, которые не изменят рН среды.
СН3СООNa/ СН3СООН +HCl→ СН3СООН +NaCl
При добавлении щелочи гидроксид- ионы будут взаимодействовать с кислотой, образуя соль буферной системы и воду, которые не изменят рН среды.
СН3СООNa/ СН3СООН +NaОH→ СН3СООNa+ Н2О
Действие буферной системы будет определяться соотношением ее компонентов.
СН3СООН ↔ СН3СОО-+ Н+
Кд= [СН3СОО-]·[Н+] / [СН3СООН]
[Н+] = Кд· [СН3СООН] / [СН3СОО-]
-lg[Н+] = -lgКд· -lg([СН3СООН]/[СН3СОО-])
рН = рКа-lg([СН3СООН]/[СН3СОО-])
рН = рКа-lg(Скислоты/Ссоли) = рКа+lg(Ссоли/ Скислоты) – уравнение для расчета рН БС.
Буферная система может состоять из двух солей, но одна из них будет выполнять роль кислоты, например фосфатная БС - Na2HPO4/NaH2PO4 – соль/кислота.
2 тип: это протолитические системы, состоящие из раствора слабого основания и избытка сопряженной с ним кислоты или соли сильной кислоты.
NH3 + HOH ↔ NH4+ + OH-
основание кислота сопряж. кислота сопряж. основание
NH4Cl ↔ NH4+ + Cl-
соль избыток сопр.кислоты
NH4ОН /NH4Cl– аммиачная БС, состоит из слабого основания и соли сильной кислоты.
Механизм действия. Если в аммиачную буферную систему ввести некоторое количество кислоты, то она сразу же будет взаимодействовать с основанием, образуя соль и воду, которые не изменят рН среды.
NH4ОН /NH4Cl+HCl→NH4Cl+ Н2О
При добавлении щелочи гидроксид- ионы будут взаимодействовать с солью, образуя основание и соль, которые не изменят рН среды.
NH4ОН /NH4Cl+NaОH→NH4ОН +NaCl
Действие буферной системы будет определяться соотношением ее компонентов.
NH4ОН →NH4++OH-
рН = 14 – рКв+lg(Соснования/Ссоли)
3.Буферная емкость.
Способность буферной системы сохранять постоянство рН ограниченно, то есть прибавлять кислоты и щелочи не изменяя рН можно лишь в пределах буферной ёмкости. Зона буферного действия – интервал значений рН, где сохраняется действие БС.
рН = рКа± 1
Количественно буферное действие характеризуется буферной ёмкостью - В, которая равна количеству вещества эквивалента сильной кислоты или сильного основания, которое нужно добавить к 1 л буферного раствора, чтобы изменить значение рН на единицу.
Ва=n(fэ)кислоты/ (Vбуферного раствора∙∆рН) = (С(fэ)кислоты∙Vкислоты) / (Vбуферного раствора∙(рН2– рН1))
Вв=n(fэ)основания/ (Vбуферного раствора∙∆рН) = (С(fэ)основания∙Vоснования) / (Vбуферного раствора∙(рН2– рН1))
4.Окислительно-восстановительный буферный раствор
Окислительно-восстановительный
буферный раствор содержит
смесь соединений элементов
переменной валентности в
двух степенях
окисления (т. е. смесь
обеих форм окислительно-восстановительной пары),
например Fe(III) и Fe(II). Значение
окислительно-восстановительного
потенциала такого буферного раствора определяется
по формуле:
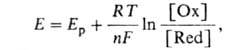
где Ер- реальный потенциал пары в данной среде, [Ох] и [Red]-концентрации соотв. ее окисленной и восстановленной форм, n - число электронов, участвующих в окислительно-восстановительной реакции, R - универсальная газовая постоянная, F- число Фарадея, T - абсолютная. температура.
В методах фотометрии пламени (в т.ч. в атомно-абсорбционном анализе) буферными называют растворы, поддерживающие практически постоянное значение характеристики не самого раствора, а пламени, в которое они вдуваются. Например, такие легкоионизирующиеся вещества, как соли К, обеспечивают концентрацию электронов в пламени, необходимую для подавления ионизации определяемых атомов. В электрохимических методах анализа буферным иногда называют раствор, препятствующий смешению растворов вблизи анода и катода.
Многие биологические жидкости (кровь и др.) являются буферными растворами; компоненты таких растворов - карбонаты, фосфаты и белки.
Список литературы:
Белик, Валентина Васильевна. Физическая и коллоидная химия [Текст] : учебник / Белик, Валентина Васильевна, Киенская, Карина Игоревна. - 5-е изд. ; стер. - М. : Академия, 2010. - 288 с.
.Кудряшева, Надежда Степановна. Физическая химия [Текст] : учебник для бакалавров / Кудряшева, Надежда Степановна, Бондарева, Лидия Георгиевна. - М.: Юрайт, 2012. - 340 с.
Афанасьев, Борис Николаевич. Физическая химия [Текст] : учебное пособие / Афанасьев, Борис Николаевич, Акулова, Юлия Петровна. - СПб. : Лань , 2012. - 464 с. : ил.
Физическая и коллоидная химия. Практикум [Текст] : учебное пособие / Кругляков, Петр Максимович [и др.]. - СПб. : Лань , 2013. - 208 с..
Полищук, Светлана Дмитриевна. Практикум по физической и коллоидной химии с курсом биохимии [Текст] : Учеб. пособие / Полищук, Светлана Дмитриевна, В. И. Вахания. - Рязань : РГСХА, 2004. - 175 с.
