
Лекция № 7. Комплексные соединения. Качественный химический анализ. Гравиметрический анализ. План:
Комплексные соединения.
Качественный химический анализ.
Гравиметрический анализ.
Комплексные соединения.
Впервые понятие о комплексе, как о сложной частице, состоящей их внутренней и внешней сферы, было введено А. Вернером в 1892 году. Согласно этому определению, координационные (комплексные) соединения – это соединения, существующие как в кристаллическом состоянии, так и в растворах, особенностями которых являются наличие центрального иона или атома-акцептора электронов, окруженного лигандами-донорами электронов. Лиганды способны отщепляться от центрального атома по гетеролитическому типу (так подчеркивается акцепторный характер центрального атома и донорный характер лигандов, хотя не исключен и т. наз. -донорный характер центрального атома и -акцепторный характер лигандов).
Лигандами могут быть ионы или нейтральные молекулы, определенным образом расположенные вокруг центрального атома. Лиганды характеризуются наличием: 1) донорных центров - нуклеофильных атомов, способных участвовать в координации (к таким центрам относятся и ненасыщенные группировки атомов); 2) дентатностью – количеством донорных центров лиганда, которые участвуют в координации (в этой связи различают моно- и полидентатные лиганды).
В качестве донорных центров чаще всего выступают элементы главных подгрупп: VA: N, P, As; VIA: O, S, Se; VIIA: F , Cl , Br , I , а также непредельные, ароматические и гетероциклические углеводороды.
К монодентатным лигандам относятся галогенид-ионы, друхатомные молекулы O2, N2, а также ряд сложных ароматических гетеросоединений. Типичным примером полидентатного лиганда может служить ЭДТА (этилендиаминтетрацетат). Необходимо иметь в виду, что количество донорных центров и дентатность не всегда совпадают.
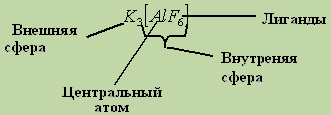
Классификация комплексных соединений.
По заряду комплексного иона:
а)
катионные:
![]() -
гексаамминокобальта (III) хлорид.
-
гексаамминокобальта (III) хлорид.
![]() -
гексааквахрома (III) хлорид.
-
гексааквахрома (III) хлорид.
б)
анионные:
![]() -
калия гексацианоферрат (III).
-
калия гексацианоферрат (III).
![]() -
кобальта
тетрахлоркобальтат (II).
-
кобальта
тетрахлоркобальтат (II).
в) нейтральные комплексы:
![]() -
дибромдиамминплатина (II).
-
дибромдиамминплатина (II).
По природе лиганда:
а)
с нейтральными лигандами:
![]() -
гексааквакобальта (III) хлорид.
-
гексааквакобальта (III) хлорид.
![]() -
тетраамминоплатины (III) хлорид.
-
тетраамминоплатины (III) хлорид.
б)
ацидокомплексы:
![]() -
тетра- и, соответственно, гекса-.
-
тетра- и, соответственно, гекса-.
в)
гетеролигандные:
![]() -
дихлордиамминпалладий (II).
-
дихлордиамминпалладий (II).
Номенклатура (IUPAC).
Дается название катиона (простого или комплексного).
Если соединение неэлектролитного типа (не подразделяется на внешнюю и внутреннюю сферы), то его название пишется в одно слово.
Степень окисления центрального атома указывается римскими цифрами в ( ).
Нейтральные лиганды имеют то же название, что и молекула.
К лигандам анионам на конце добавляется –о.(NH3 – два –мм- в корне, остальные производные – одно –м-).
Для указания количества координированных лигандов используют греческие приставки (ди-, три-, тетра- и.т. д.).
Название координационного соединения пишется в одно слово.
В комплексном ионе сначала указываются названия ионов, а потом нейтральных молекул.
Если комплексный ион имеет отрицательный заряд, то его название заканчивается на -ат.
Примеры: - дибромдиамминплатина (II).
![]() -
калий
гексафтороалюминат.
-
калий
гексафтороалюминат.
- гексаамминокобальта (III) хлорид.
![]() -
калия
трихлорамминоплатинат
(II).
-
калия
трихлорамминоплатинат
(II).
Координационное число. Координационным числом (к. ч.)– обычно называют то количество лигандов, которое центральный атом координирует в денном комплексном соединении.
Так, например в вышеприведенных примерах к. ч. соответственно равны: платина (II) – 4, алюминий – 6, кобальт – 6, платина (II) – 4.
Константа устойчивости (образования) комплексов. Если представить схематично образование комплексного соединения реакцией
![]() ,
то
,
то
константа образования (устойчивости) комплексного соединения запишется следующим образом:
 ,
где
,
где
[Mm+] и [Ln-] концентации металла и лиганда соответственно, а [ML(m-n)+]- концентрация образующегося комплексного соединения. Константа образования – величина всегда положительная.
Если комплексообразование протекает ступенчато, как, например, в случае:
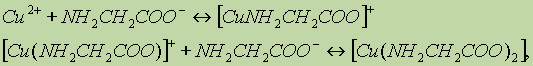
то для каждой стадии комплексообразования записывается своя ступенчатая константа устойчивости:
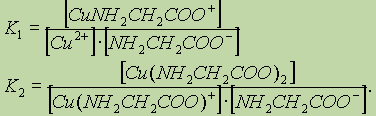
Общая константа устойчивости:
Куст. = К1∙К2.
Ввиду того, что константы образования – величины, как правило, малые, удобно пользоваться логарифмами констант:
Log = log К1 + log К2. соединения:
По
тем же причинам чаще пользуются константой
нестойкости
комплексного соединения:
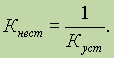 Константа нестойкости – величина
отрицательная, следовательно, чем
меньше
Константа нестойкости – величина
отрицательная, следовательно, чем
меньше
![]() ,
тем утойчивее
комплекс
,
тем утойчивее
комплекс
