ОНИД-текущий контроль 1-2024н
.docxТитульный лист материалов по дисциплине
-
ДИСЦИПЛИНА
Организация научно-исследовательской
деятельности (ОНИД)
(полное наименование дисциплины без сокращений)
ИНСТИТУТ
ИТХТ имени М.В. Ломоносова
КАФЕДРА
Физической химии им. Я.К. Сыркина
полное наименование кафедры
ВИД УЧЕБНОГО
4. Текущий контроль
(Расчетное задание, ИЗ-1)
МАТЕРИАЛА
(в соответствии с пп.1-11)
ПРЕПОДА-
ВАТЕЛЬ
Пестов Сергей Михайлович
(фамилия, имя, отчество)
СЕМЕСТР
1, 2024/2025 учебный год
(указать семестр обучения, учебный год)
-

МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«МИРЭА – Российский технологический университет»
РТУ МИРЭА
-
Институт тонких химических технологий имени М.В. Ломоносова
Организация научно-исследовательской деятельности Домашнее задание ИЗ–1
Вариант №35
Выполнил(а): студент(ка) группы Х_МО-00-24
Иванов И.И. Проверил: проф., д.х.н.
Пестов С.М.
Москва 2024
Задание 1. Рассчитайте энтальпию плавления (растворения) для растворенного вещества и оцените погрешность ее определения
![]() В
рамках модели
идеальных
растворов для
расчета
растворимости
используют уравнение Шредера:
В
рамках модели
идеальных
растворов для
расчета
растворимости
используют уравнение Шредера:
или
пл. пл.
x – мольная доля растворенного вещества в насыщенном растворе при температуре Т; R = 8.314 Дж / (моль К) – универсальная газовая постоянная;
пл. пл.
Это уравнение представляет собой линейную зависимость натурального логарифма мольной доли компонента (х) от обратной температуры (в К-1)
ln x = А – В / Т
Y = a + b X, a и b - константы
пл.
Значение коэффициента b позволяет рассчитать энтальпию плавления Нопл.
Формулы для расчета коэффициентов а и b:
![]()
![]()
m – количество экспериментальных точек.
Расчет удобно проводить с использованием программы Excel.
Оценить линейную зависимость Y (X) можно по коэффициенту корреляции rxy . Перейдем к расчету погрешности определения энтальпии плавления.
Вычисление дисперсии адекватности модели:
![]()
yi и yi´ – экспериментальные и расчетные значения Вычисление дисперсий Sa2 и Sb2 для коэффициентов а и b:
![]()
![]()
Расчет погрешности для коэффициентов Δa и Δb: Δa = ±t(α=0,95; m-1) * Sa
Δb = ±t(α=0,95; m-1) * Sb
t,f – критерий Стьюдента, f = m-1 - число степеней свободы
Расчет погрешности для энтальпии ΔΔH = Δb * R
Ответ: ΔH ± ΔΔH
Выводы: сравнить с лит. данными справочники
-
T, K
Мол. доля x1
177,7
0,012
177,2
0,022
188,2
0,025
200,7
0,029
214,2
0,037
217,7
0,044
227,1
0,052
246,6
0,075
261,9
0,113
273
0,155
281,2
0,194
289,1
0,237
296,2
0,280
303,2
0,325
307,5
0,372
313,4
0,413
317,7
0,469
321,4
0,517
331,2
0,627
338,2
0,744
346,4
0,879
Задание 1а. Рассчитайте энтальпию испарения по данным по давлению насыщенных паров и оцените погрешность ее определения
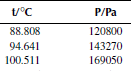
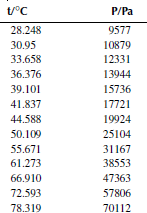
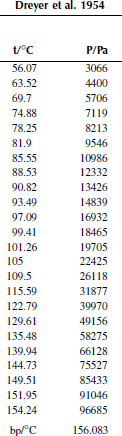
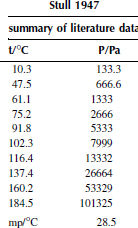
Зависимость приведенного давления насыщенного пара в узком интервале температур можно представить в виде линейной зависимости:
ln(p/ро) = a – b/T; ∆исп.Hº = –(b/R),
где po – стандартное давление, R – универсальная газовая постоянная.
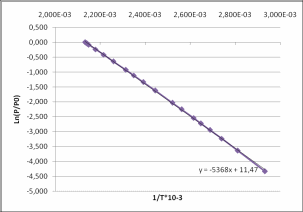
Рисунок 1 Зависимость приведенного давления насыщенного пара декалина от обратной температуры
Зависимость давления насыщенных паров от температуры
P0 = 101325 Па
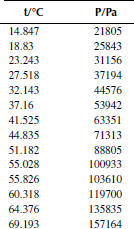
Вариант 1. Трихлорметан
Вариант 2. Трихлорметан
![]()

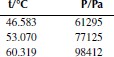
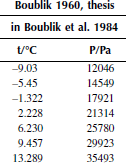
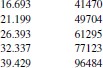
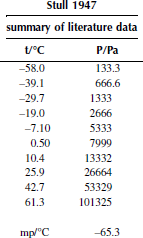
Вариант 4. Тетрахлорметан
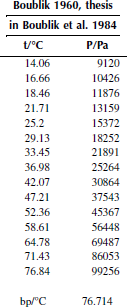
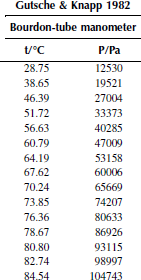
Вариант 6. 1,1,1-трихлорэтан
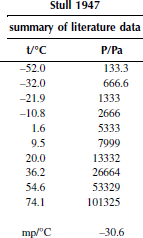
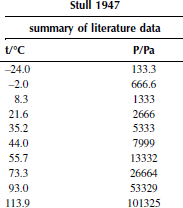
Вариант 8. 1,1,2,2-тетрахлорэтан

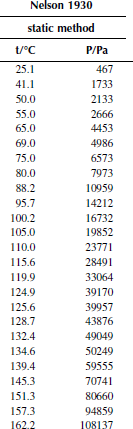
Вариант 10. 1,2-дихлорпропан
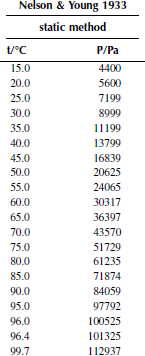
Вариант 11. 1-хлорбутан
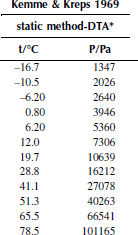
Вариант 12. 1-хлоргексан
![]()
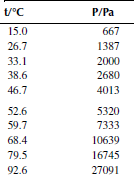

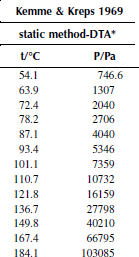
Вариант 14. 1-хлордекан
![]()
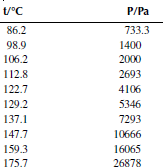


Вариант 16. 1,2-дихлорбензол
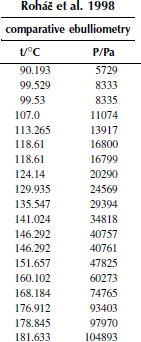
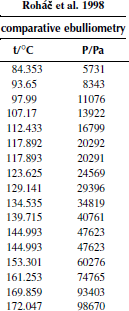
Вариант 18. 1,4-дихлорбензол
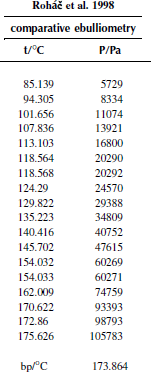
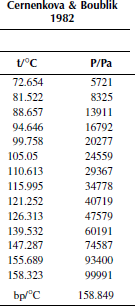
Вариант 20. 3-хлортолуол
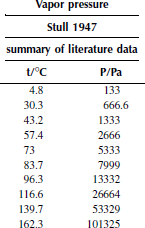
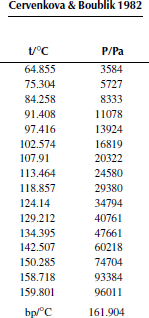
Вариант 22. фторбензол

![]()
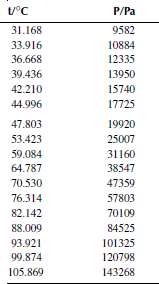
Вариант 24. 1,3-дифторбензол
![]()
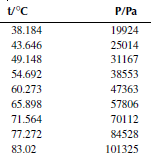
![]()

Вариант 26. 1,4-дибромбензол

Вариант 28. 4-бромтолуол
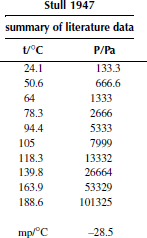
Вариант 30. бифенил
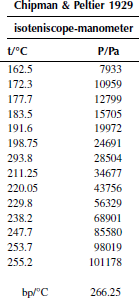
![]()
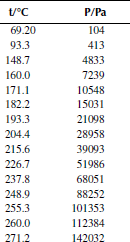
Вариант 32. 4-хлорбифенил
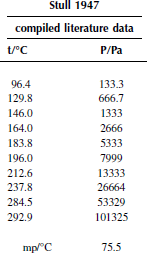
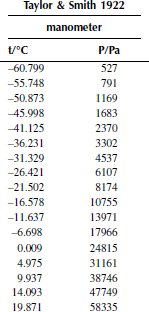
Вариант 34. Метил-трет-бутиловый эфир
![]()