- •1. Мембранные технологии, их использование в биотехнологии.
- •1. Пластинчатый диализатор
- •2. Диализатор типа «фильтр-пресс»
- •2. Роль мембранных технологий в очистке генно-инженерных белков.
- •1. Ультрафильтрация
- •2. Диализ
- •3. Электродиализ
- •3. Предложить вариант мембранной технологии для концентрирования большого количества раствора генно-инженерного белка
- •1. Ультрафильтрация: Первичный этап концентрирования
- •2. Диализ: Удаление остаточных солей и буферных компонентов
- •3. Электродиализ: Регулировка ионного состава
- •4. Центрифугирование, основные методы.
- •1. Этапы применения центрифугирования
- •1.1. Удаление клеточного мусора (клеточный лизат)
- •1.2. Концентрация белка
- •Тип ротора:
- •Условия центрифугирования:
- •Особенности
- •Виды колориметрии
- •Пример работы фотоколориметра
- •Строение и принцип работы спектрофотометра на диодной матрице:
- •Преимущества и особенности:
- •1. Поглощение белков в уф-области
- •2. Поглощение нуклеиновых кислот (нк) в уф-области
- •3. Изобестическая точка
- •Применение в бт:
- •1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
- •1. Источник инфракрасного излучения
- •2. Монохроматор
- •3. Оптическая система
- •4. Образец
- •5. Приемники излучения
- •Принцип работы
- •Особенности и преимущества Фурье-ик-спектрометра
- •1. Инфракрасная (ик) спектроскопия Описание метода:
- •Применяемые техники:
- •Применение:
- •2. Раман-спектроскопия (спектроскопия комбинационного рассеяния) Описание метода:
- •Применяемые техники:
- •3. Спектроскопия комбинационного рассеяния ближнего ик-диапазона (nir-спектроскопия)
- •Применение флуоресценции в биотехнологии
- •Тушение флуоресценции
- •Иммунофлуоресценция
- •Основные элементы устройства
- •Импульсные спектрометры с преобразованием Фурье (ft-nmr)
- •Основные этапы maldi масс-спектрометрии:
- •1. Время удерживания:
- •2. Время удерживания несорбируемого компонента или мертвое время:
- •3. Мертвый объём
- •4. Фактор удерживания к (коэффициент ёмкости)
- •5. Селективность (α):
- •6. Эффективность - число теоретических тарелок
- •7. Высота теоретической тарелки (h):
- •8. Пиковая емкость колонки
- •9. Разрешение Rs:
- •10. Фактор асимметрии для Асимметричные пики («с хвостом»)
- •1. Экстракция водорастворимых биологически активных соединений
- •2. Экстракция жирорастворимых биологически активных соединений
- •1. Лиофильные сушилки (фриз-драйеры)
- •Принцип действия:
- •2. Ротационные испарители
- •3. Сушильные шкафы
- •2. Спрей-сушилки (распылительные сушилки)
- •3. Вакуумные сушилки Принцип действия:
- •Применение:
- •1) Источники питания
- •38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
- •2. Типы анализируемых веществ:
- •5. Оборудование и сложность:
- •40. Капиллярный электрофорез, особенности и достоинства метода в сравнении с планарным электрофорезом.
2. Поглощение нуклеиновых кислот (нк) в уф-области
Нуклеиновые кислоты, такие как ДНК и РНК, также поглощают ультрафиолетовое излучение, особенно при длине волны 260 нм. Это свойство используется для анализа концентрации и чистоты нуклеиновых кислот.
Оценка концентрации НК: Поглощение на 260 нм позволяет определить концентрацию нуклеиновых кислот в растворе. Стандартная методика включает измерение поглощения при 260 нм и использование коэффициента поглощения для расчета концентрации.
Оценка чистоты НК: Используя соотношение поглощения при 260 и 280 нм (A260/A280), можно оценить чистоту образца. Это соотношение используется для обнаружения загрязнений белками, поскольку белки поглощают свет при 280 нм. Идеальное соотношение для чистой ДНК или РНК обычно составляет около 1,8-2,0.
3. Изобестическая точка
Изобестическая точка — это точка, при которой поглощение вещества не зависит от его химической формы или конформации, что имеет важное значение для анализа биомолекул. Изобестическая точка - точка пересечения трех или более спектров. Ей соответствует длина волны, при которой два соединения, способные превращаться друг в друга, имеют одинаковую поглощательную способность. Изобестические точки наблюдаются только для систем, в которых существует равновесие или переход между двумя спектрально различными молекулами. Суммарное количество молекул постоянно
Появляется в двух типах экспериментов. 1. Смещение равновесия, например при добавлении реагента и/или параметров среды (pH, t etc.) 2. Относительно медленная реакция типа A -> B. В этом случае прибор записывает несколько спектров с заданным временным промежутком.
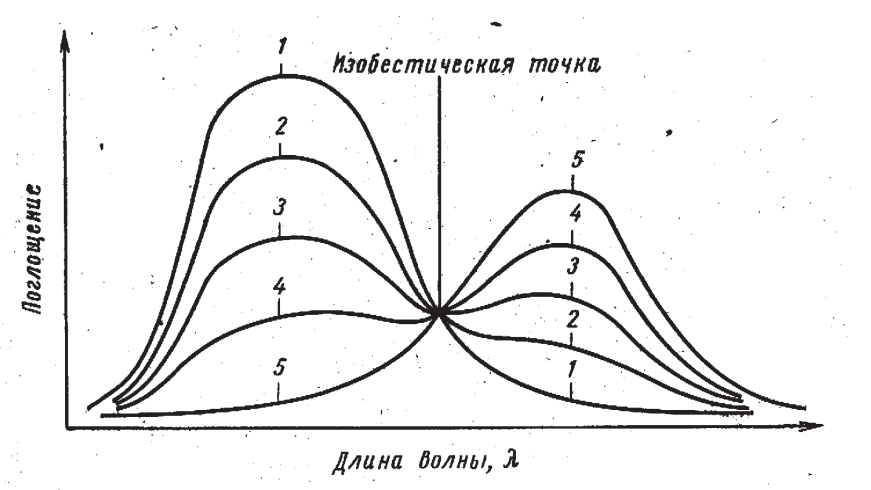
Изобестическая точка для белков: В случае белков изобестическая точка может быть использована для отслеживания изменений в структуре белка, таких как переход от нормальной конформации к денатурированному состоянию. Это особенно полезно при изучении термодинамических процессов в белках и их взаимодействиях.
Изобестическая точка для нуклеиновых кислот: Для нуклеиновых кислот изобестическая точка может быть использована для определения конформационных изменений, например, при переходе ДНК из одноцепочечной формы в двухцепочечную или при денатурации ДНК.
Применение в бт:
Контроль качества: УФ-спектроскопия позволяет оценивать чистоту и концентрацию биомолекул, таких как белки и нуклеиновые кислоты, на разных стадиях производства биопродуктов.
Мониторинг процессов: В биотехнологических процессах, таких как ферментация или клеточный рост, УФ-спектроскопия помогает отслеживать концентрацию биомолекул, например, белков, метаболитов или полимеров.
Исследования взаимодействий: Оптическая спектроскопия в УФ-области помогает изучать взаимодействие белков с другими молекулами, например, с ДНК, РНК, маломолекулярными веществами или лигандами.
8. Предложить способ спектроскопического контроля состава сложной смеси биотехнологических продуктов, включающих белки и нуклеиновые кислоты.
1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
Ультрафиолетовая и видимая спектроскопия — это один из наиболее часто используемых методов для анализа биомолекул, таких как белки и нуклеиновые кислоты.
Для белков: Белки содержат ароматические аминокислоты (триптофан, тирозин и фенилаланин), которые поглощают ультрафиолетовый свет, особенно в диапазоне 190–300 нм. Поглощение при 280 нм, связанное с триптофаном и тирозином, является хорошим индикатором концентрации белков.
Для нуклеиновых кислот: Нуклеиновые кислоты (ДНК и РНК) имеют характерные поглощения в ультрафиолетовой области (особенно при 260 нм), что позволяет оценить их концентрацию.
Применение в смеси: В смеси белков и нуклеиновых кислот можно использовать UV-Vis спектроскопию для оценки концентраций обоих компонентов. Например, поглощение при 260 нм можно использовать для измерения концентрации нуклеиновых кислот, а поглощение при 280 нм — для белков. Для точной оценки состава смеси используется соотношение этих двух значений (например, соотношение A260/A280), которое позволяет отличать белки от нуклеиновых кислот.
Преимущества:
Простота и доступность метода.
Быстрое определение концентрации белков и нуклеиновых кислот.
Минимальная подготовка образца.
Да и бля, просто предыдущий вопрос, вот нафга он добавил эти предложите варианты, делать что-ли больше нечего… или просто повторять все то что было раньше или надо сразу учитывать ик и кр
9. Колебательная спектроскопия. Приборы для ИК- и КР спектроскопии.
Вклад колебательной спектроскопии в анализ молекулярных систем
Колебательная спектроскопия является :
• методом недеструктивного анализа
• молекулярно-специфичной, что позволяет получать информацию о функциональных группах в молекуле — их типе, взаимодействиях и ориентациях
• селективной по отношению к изомерам, благодаря области «отпечатков пальцев»
• методом получения информации о твердых, жидких и газообразных веществах, о поверхностях и поверхностях раздела фаз между твердым телом и жидкостью или газом, о локальных областях, объемных образцах и слоистых структурах
Ближний ИК-диапазон, в котором расположены обертоны нормальных колебаний. В дальнем ИК-диапазоне расположены частоты, соответствующие колебаниям решётки и нормальным колебаниям слабых связей и связей с тяжёлыми атомами
Методы ИК- и КР-спектроскопии отличаются по способу генерации сигнала. В то время как ИК-спектры (это относится и к спектрам в УФ/вид. области) получают в режиме поглощения, КР-спектроскопия основана на рассеянии излучения
Типы рассеяния света:
1. Эластичное (упругое) релеевское — без изменения длины волны света
2. Неэластичное (неупругое) рамановское — с изменением длины волны света
Колебательные переходы непосредственно возбуждаются ИК-излучением, при этом время жизни возбуждённых состояний равно примерно 10^(-6) с. КР-спектры возникают в результате рассеяния света молекулами. для возбуждения требуются монохроматичные лазерные источники в видимой или ближней ик-областях, с длиной волны излучения 488 нм или 1,06 мкм
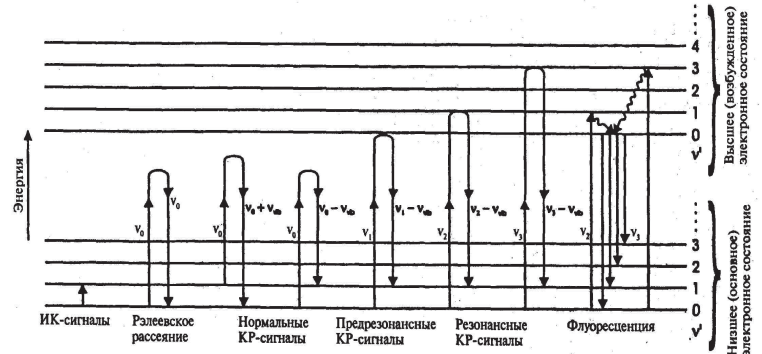
Интенсивность линий в спектре КР зависит от частоты возбуждающего света. Когда энергия кванта света, падающего на образец, близка к разности энергий электронных уровней Е1 - Е0, интенсивность линий КР сильно возрастает. в этом случае спектр называется предрезонансным. Если энергия кванта равна разности энергий электронных уровней, спектр КР называется резонансным, а его интенсивность превышает интенсивность обычного спектра примерно в 100 раз.
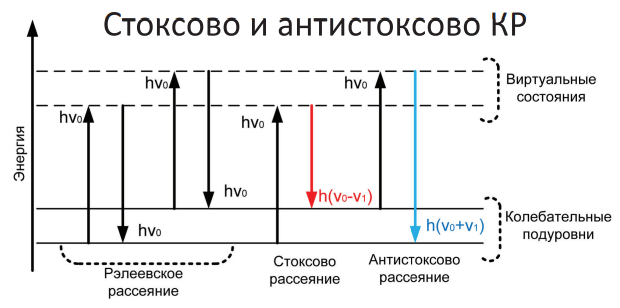
Молекула в результате взаимодействия с фотоном монохроматического излучения возбуждается до неустойчивого (виртуального) состояния. Затем она может отдать фотон, не обмениваясь с ним энергией = релеевское рассеяние света. Молекула принимает часть энергии фотона, и излучает фотон с меньшей энергией = стоксово КР. Если молекула уже находилась в возбуждённом состоянии, то при взаимодействии с фотоном она может отдавать часть своей энергии, излучая фотон с большей энергией и переходя на более низкий энергетический уровень = антистоксово КР. Соотношение интенсивности стоксовых и антистоксовых линий зависит от температуры образца.
Принципиальное различие между ИК и КР
В основе ИК- и КР-спектроскопии лежат разные явления ИК – переход молекулы на более высокий колебательный уровень в результате поглощения кванта света с соответствующей энергией. КР – рассеяние фотонов, отличающихся по энергии от падающих на образец фотонов на величину, равную разности между основным и возбуждённым колебательными уровнями.
Оба метода несут информацию о колебаниях атомов в молекулах и вместе называются колебательной спектроскопией. Чтобы молекула поглощала энергию инфракрасного излучения, при колебаниях молекулы должен меняться дипольный момент. Чтобы колебание было активным в спектроскопии КР, при молекулярных колебаниях должна меняться поляризуемость. Интенсивность полос в ИК-спектрах тем больше, чем больше полярность соответствующих связей. Интенсивность в КР-спектрах тем больше, чем менее полярна соответствующая связь и чем выше ее поляризуемость. (Дальше тяжелая фигня, но мб пригодиться, в лекции это было)
Полярность связи обуславливает полярность молекулы, то есть несимметричное распределение электронной плотности, при котором «центры тяжести положительных и отрицательных зарядов» в молекуле не будут совпадать в одной точке. Между ними возникает какое-то расстояние – дипольное расстояние или длина диполя. Количественно полярность молекул оценивается величиной электрического дипольного момента. Электрическим дипольным моментом (μп) называется произведение абсолютного заряда электрона q на расстояние между зарядами (длина диполя l) и выражается в дебаях (1Д= 10-30 Кл·м) : μп=q∙l. Электрический дипольный момент – величина векторная, то есть характеризуются направленностью (условно от положительного к отрицательному заряду). Электрический дипольный момент молекулы определяется как векторная сумма электрических дипольных моментов связей и, следовательно, зависит от полярности связей и геометрии молекулы.
Поляризуемостью ковалентной связи и (или) молекулы называют ее способность под действием внешнего электрического поля становиться полярной или более полярной. Поляризуемость π-связи выше, чем поляризуемость σ-связи. Поляризуемость молекулы возрастает с увеличением ее объема и числа π-связей.
Существует обратная зависимость между полярностью и поляризуемостью ковалентной связи: чем больше электроны в статической (нереагирующей) молекуле сдвинуты под действием электроотрицательного атома (статическая поляризация), тем меньше остаётся возможности для их дальнейшего смещения под внешним воздействием (динамическая поляризация)
ИК-спектроскопия
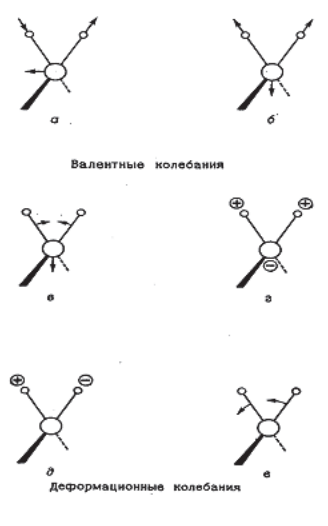
Аналитическая ИК-спектроскопия в ближнем, среднем и (в значительной степени) в дальнем интервале волновых чисел имеет дело только с колебаниями отдельных атомов или групп. Колебания атомов в молекуле делятся на два вида: валентные и деформационные. Для сложных молекул ИК-спектр является совокупностью полос, соответствующих валентным и деформационным колебаниям. Валентные колебания: а - асимметричное. б - симметричное. Деформационные колебания: в - плоскостное деформационное или ножничное г - внеплоскостное деформационное или веерное. д - внеплоскостное деформационное или крутильное. е - плоскостное деформационное или маятниковое.
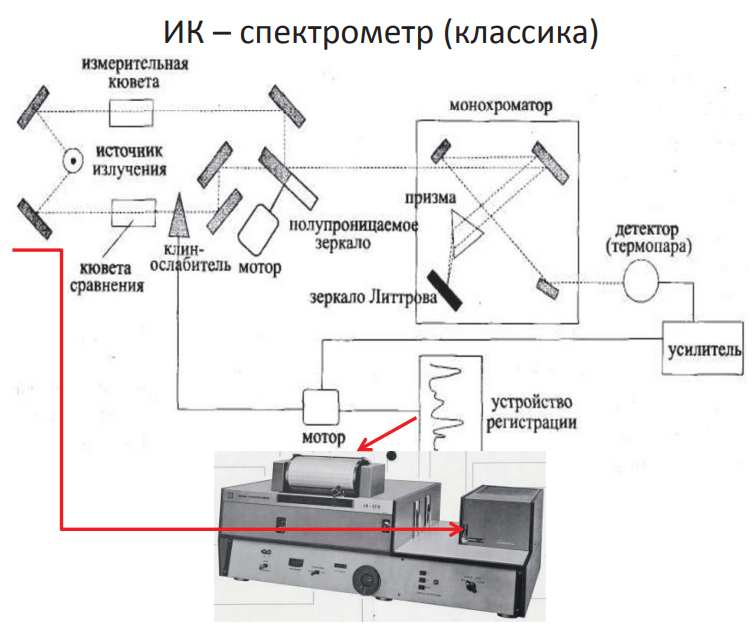
ИК-спектрометр (классика)