
- •1. Мембранные технологии, их использование в биотехнологии.
- •1. Пластинчатый диализатор
- •2. Диализатор типа «фильтр-пресс»
- •2. Роль мембранных технологий в очистке генно-инженерных белков.
- •1. Ультрафильтрация
- •2. Диализ
- •3. Электродиализ
- •3. Предложить вариант мембранной технологии для концентрирования большого количества раствора генно-инженерного белка
- •1. Ультрафильтрация: Первичный этап концентрирования
- •2. Диализ: Удаление остаточных солей и буферных компонентов
- •3. Электродиализ: Регулировка ионного состава
- •4. Центрифугирование, основные методы.
- •1. Этапы применения центрифугирования
- •1.1. Удаление клеточного мусора (клеточный лизат)
- •1.2. Концентрация белка
- •Тип ротора:
- •Условия центрифугирования:
- •Особенности
- •Виды колориметрии
- •Пример работы фотоколориметра
- •Строение и принцип работы спектрофотометра на диодной матрице:
- •Преимущества и особенности:
- •1. Поглощение белков в уф-области
- •2. Поглощение нуклеиновых кислот (нк) в уф-области
- •3. Изобестическая точка
- •Применение в бт:
- •1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
- •1. Источник инфракрасного излучения
- •2. Монохроматор
- •3. Оптическая система
- •4. Образец
- •5. Приемники излучения
- •Принцип работы
- •Особенности и преимущества Фурье-ик-спектрометра
- •1. Инфракрасная (ик) спектроскопия Описание метода:
- •Применяемые техники:
- •Применение:
- •2. Раман-спектроскопия (спектроскопия комбинационного рассеяния) Описание метода:
- •Применяемые техники:
- •3. Спектроскопия комбинационного рассеяния ближнего ик-диапазона (nir-спектроскопия)
- •Применение флуоресценции в биотехнологии
- •Тушение флуоресценции
- •Иммунофлуоресценция
- •Основные элементы устройства
- •Импульсные спектрометры с преобразованием Фурье (ft-nmr)
- •Основные этапы maldi масс-спектрометрии:
- •1. Время удерживания:
- •2. Время удерживания несорбируемого компонента или мертвое время:
- •3. Мертвый объём
- •4. Фактор удерживания к (коэффициент ёмкости)
- •5. Селективность (α):
- •6. Эффективность - число теоретических тарелок
- •7. Высота теоретической тарелки (h):
- •8. Пиковая емкость колонки
- •9. Разрешение Rs:
- •10. Фактор асимметрии для Асимметричные пики («с хвостом»)
- •1. Экстракция водорастворимых биологически активных соединений
- •2. Экстракция жирорастворимых биологически активных соединений
- •1. Лиофильные сушилки (фриз-драйеры)
- •Принцип действия:
- •2. Ротационные испарители
- •3. Сушильные шкафы
- •2. Спрей-сушилки (распылительные сушилки)
- •3. Вакуумные сушилки Принцип действия:
- •Применение:
- •1) Источники питания
- •38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
- •2. Типы анализируемых веществ:
- •5. Оборудование и сложность:
- •40. Капиллярный электрофорез, особенности и достоинства метода в сравнении с планарным электрофорезом.
Тип центрифуги: Используйте ультрацентрифугу или высокопроизводительную центрифугу с охлаждением. Такие центрифуги обеспечивают высокую скорость вращения и, соответственно, высокую центробежную силу, что позволяет эффективно осаждать белки.
Тип ротора:
Угловой ротор (fixed-angle rotor): Подходит для концентрирования, так как образующийся осадок собирается на дне пробирки, упрощая отделение супернатанта.
Горизонтальный ротор (swinging-bucket rotor): Удобен для осаждения, когда требуется сохранить равномерное распределение осадка.
Центрифужные фильтры (ultrafiltration): Для концентрирования белка без осаждения можно использовать фильтры с мембранами, которые задерживают белок, но пропускают растворитель и мелкие молекулы. Это особенно удобно для чувствительных белков, чтобы избежать денатурации.
Условия центрифугирования:
Скорость вращения: Настройте в соответствии с молекулярной массой белка. Для большинства белков подойдут 10,000–20,000 g. Для ультрафильтрации оптимальную скорость указывает производитель мембраны.
Температура: Рекомендуется поддерживать +4 °C для предотвращения денатурации белка.
Время: Зависит от объема раствора и требуемой концентрации. Обычно это 30–60 минут, при необходимости повторите.
Буфер: Используйте подходящий буфер для стабилизации белка (например, с добавлением протеазных ингибиторов и поддержанием физиологического pH).
Этапы:
Подготовьте раствор белка, удалив крупные агрегаты (предварительная фильтрация через 0,45 мкм).
Разделите раствор на равные объемы в центрифужных пробирках, чтобы обеспечить равномерную балансировку.
Проведите центрифугирование при выбранных условиях.
Удалите супернатант (если использовали осаждение).
При необходимости повторите для достижения требуемой концентрации.
Конечная стадия: После концентрирования рекомендуется проверить концентрацию белка (например, с помощью методик спектрофотометрии или БКГ-теста) и при необходимости провести диализ для удаления нежелательных примесей.
Для больших объемов раствора следует использовать системы с большим объемом роторов или промышленные ультрафильтрационные установки.
7. Оптическая спектроскопия. Спектрофотометры. Применение оптической спектроскопии в БТ.
Обычно под спектром подразумевается электромагнитный спектр — распределение интенсивности электромагнитного излучения по частотам или по длинам волн
Спектром называется зависимость интенсивности поглощения (пропускания или оптической плотности) от длины волны или волнового числа падающего на образец света, выраженную в числовом или в графическом виде.
Кювета — это прозрачный сосуд с плоскопараллельными стенками. В зависимости от диапазона длин волн, кюветы изготавливаются из разных материалов: пластика, стекла, кварца. Кюветы пластиковые или полистирольные используются для обследования жидких образцов в видимой области спектра. Длина оптического пути данной кюветы составляет 10 мм. Пластиковая кювета предназначена для работы в области 320 – 2500 нм, как правило - это кювета одноразового использования.
ПРАВИЛА ПРОВЕДЕНИЯ ИЗМЕРЕНИЙ
РАСТВОРИТЕЛЬ ДОЛЖЕН БЫТЬ ПРОЗРАЧЕН В ОБЛАСТИ ИЗМЕРЕНИЙ.
КЮВЕТЫ ДОЛЖНЫ БЫТЬ ТЩАТЕЛЬНО ОЧИЩЕНЫ ВНУТРИ И СНАРУЖИ.
ЗНАЧЕНИЯ ОПТИЧЕСКОЙ ПЛОТНОСТИ ДОЛЖНЫ БЫТЬ В ОПРЕДЕЛЕННОМ ИНТЕРВАЛЕ (А = 0,2 – 0,7. A > 3 часто выходит за границы прибора)
ОБЫЧНО ПОГЛОЩЕНИЕ ИЗМЕРЯЮТ В КЮВЕТЕ ТОЛЩИНОЙ 1 см ПРИ ТЕМПЕРАТУРЕ ОТ 19 ДО 21С.
ИЗМЕРЕНИЕ ПРОВОДЯТ ОТНОСИТЕЛЬНО РАСТВОРИТЕЛЯ КОТОРЫЙ ИСПОЛЬЗОВАЛСЯ ДЛЯ ПРИГОТОВЛЕНИЯ ИСПЫТУЕМОГО РАСТВОРА.
ОПТИЧЕСКАЯ ПЛОТНОСТЬ КЮВЕТЫ СРАВНЕНИЯ И ЕЕ СОДЕРЖИМОГО ДОЛЖНА БЫТЬ МЕНЬШЕ 0,4 - ПРЕДПОЧТИТЕЛЬНЕЕ, МЕНЬШЕ 0,2 ПРИ ИЗМЕРЕНИИ ОТНОСИТЕЛЬНО ВОЗДУХА

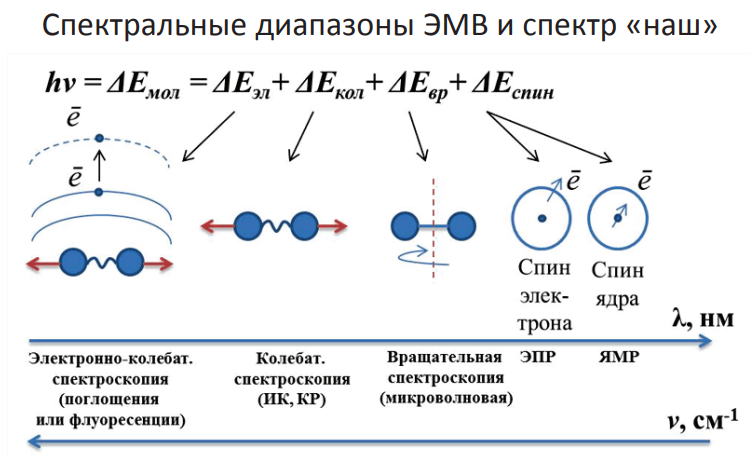
Рабочий интервал охватывает ближний УФ- и видимый диапазоны т.е. область от 200 до 800 нм (50000—12500см-1). Поглощение света веществом в этом диапазоне зависит от электронной структуры молекул и обусловлено переходом молекулы в электронновозбуждённое состояние при поглощении кванта с соответствующей энергией.
Закон Бугераа-Ламберта-Бера
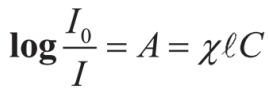
Здесь
А - оптическая плотность,
l- толщина образца,
С- концентрация,
χ- коэффициент пропорциональности
Отношение интенсивности прошедшего через образец света (I) к интенсивности падающего на него света (I0) называется пропусканием, обозначается Т, и обычно выражается в %.
T = (I/I0)×100 %
Если концентрация раствора выражена в моль/л, то выражение для оптической плотности имеет вид
A = εlC и коэффициент пропорциональности называется молярным коэффициентом экстинкции и имеет размерность л/моль2см.
Структура => спектр
Хромофор. Ковалентно ненасыщенная группа, обусловливающая поглощение в видимой или ультрафиолетовой областях спектра (например С=С‚ С=О, фенил etc.).
Ауксохром. Насыщенная группа, присоединение которой к хромофору, изменяет как длину волны, так и интенсивность максимума поглощения (например, OH, NH2, Cl).
Батохромный (красный) сдвиг. Сдвиг поглощения в сторону более длинных волн вследствие замещения в молекуле или влияния растворителя.
Гипсохромный (синий) сдвиг. Сдвиг поглощения в сторону более коротких волн вследствие замещения в молекуле или влияния растворителя.
Гиперхромный эффект. Увеличение интенсивности поглощения. Гипохромный эффект. Уменьшение интенсивности поглощения.
Увеличение длины цепи сопряжения полиена сопровождается батохромным сдвигом (→) и гиперхромным (↑) эффектом. И наоборот, уменьшение числа сопряжённых двойных связей приводит к гипсохромному (←) сдвигу и гипохромному (↓) эффекту/
Фотометрия - колориметрия .
Колориметрия – это метод количественного анализа, основанный на измерении интенсивности цвета раствора, которая зависит от концентрации окрашенного вещества. Этот метод использует связь между интенсивностью окраски вещества и концентрацией, а также законы взаимодействия света с веществом.
Принцип работы фотоколориметра заключается в сравнении между собой двух световых потоков – так называемого фонового, который был пропущен через раствор сравнения, и основного, который проходил сквозь исследуемый раствор. Отношение основного светового потока к фоновому называют пропусканием Т (или же коэффициентом пропускания). Оптическая плотность А (или же поглощение) выражается десятичным логарифмом величины, обратной коэффициенту пропускания.
Закон аддитивности цвета: Если раствор содержит несколько окрашенных компонентов, его общий цвет можно рассматривать как сумму вкладов каждого вещества.
