
- •1. Мембранные технологии, их использование в биотехнологии.
- •1. Пластинчатый диализатор
- •2. Диализатор типа «фильтр-пресс»
- •2. Роль мембранных технологий в очистке генно-инженерных белков.
- •1. Ультрафильтрация
- •2. Диализ
- •3. Электродиализ
- •3. Предложить вариант мембранной технологии для концентрирования большого количества раствора генно-инженерного белка
- •1. Ультрафильтрация: Первичный этап концентрирования
- •2. Диализ: Удаление остаточных солей и буферных компонентов
- •3. Электродиализ: Регулировка ионного состава
- •4. Центрифугирование, основные методы.
- •1. Этапы применения центрифугирования
- •1.1. Удаление клеточного мусора (клеточный лизат)
- •1.2. Концентрация белка
- •Тип ротора:
- •Условия центрифугирования:
- •Особенности
- •Виды колориметрии
- •Пример работы фотоколориметра
- •Строение и принцип работы спектрофотометра на диодной матрице:
- •Преимущества и особенности:
- •1. Поглощение белков в уф-области
- •2. Поглощение нуклеиновых кислот (нк) в уф-области
- •3. Изобестическая точка
- •Применение в бт:
- •1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
- •1. Источник инфракрасного излучения
- •2. Монохроматор
- •3. Оптическая система
- •4. Образец
- •5. Приемники излучения
- •Принцип работы
- •Особенности и преимущества Фурье-ик-спектрометра
- •1. Инфракрасная (ик) спектроскопия Описание метода:
- •Применяемые техники:
- •Применение:
- •2. Раман-спектроскопия (спектроскопия комбинационного рассеяния) Описание метода:
- •Применяемые техники:
- •3. Спектроскопия комбинационного рассеяния ближнего ик-диапазона (nir-спектроскопия)
- •Применение флуоресценции в биотехнологии
- •Тушение флуоресценции
- •Иммунофлуоресценция
- •Основные элементы устройства
- •Импульсные спектрометры с преобразованием Фурье (ft-nmr)
- •Основные этапы maldi масс-спектрометрии:
- •1. Время удерживания:
- •2. Время удерживания несорбируемого компонента или мертвое время:
- •3. Мертвый объём
- •4. Фактор удерживания к (коэффициент ёмкости)
- •5. Селективность (α):
- •6. Эффективность - число теоретических тарелок
- •7. Высота теоретической тарелки (h):
- •8. Пиковая емкость колонки
- •9. Разрешение Rs:
- •10. Фактор асимметрии для Асимметричные пики («с хвостом»)
- •1. Экстракция водорастворимых биологически активных соединений
- •2. Экстракция жирорастворимых биологически активных соединений
- •1. Лиофильные сушилки (фриз-драйеры)
- •Принцип действия:
- •2. Ротационные испарители
- •3. Сушильные шкафы
- •2. Спрей-сушилки (распылительные сушилки)
- •3. Вакуумные сушилки Принцип действия:
- •Применение:
- •1) Источники питания
- •38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
- •2. Типы анализируемых веществ:
- •5. Оборудование и сложность:
- •40. Капиллярный электрофорез, особенности и достоинства метода в сравнении с планарным электрофорезом.
1. Ультрафильтрация: Первичный этап концентрирования
Цель: Уменьшение объема раствора за счет удаления воды и низкомолекулярных примесей (солей, буферных компонентов).
Конфигурация системы:
Ультрафильтрационная установка с полупроницаемыми мембранами (MWCO, соответствующее размеру белка).
Используется режим тангенциального потока (TFF) для предотвращения засорения мембран.
Параметры:
Трансмембранное давление: 1–5 бар.
Температура: 4–25 °C.
Буфер: стабилизирующий белок, минимизирующий агрегацию.
Преимущества:
Быстрое снижение объема раствора.
Минимальный риск потери белка.
2. Диализ: Удаление остаточных солей и буферных компонентов
Цель: Очистка концентрата от низкомолекулярных соединений, таких как соли и метаболиты.
Процесс:
Используются полупроницаемые мембраны, помещенные в буферный раствор.
Концентрационный градиент обеспечивает диффузию примесей через мембрану.
Буферный раствор периодически обновляется для поддержания градиента.
Конфигурация:
Диализатор с высокой площадью мембраны для обработки больших объемов.
Буфер подбирается с учетом стабильности белка.
Особенности:
Медленный процесс, но с высокой селективностью.
Мягкие условия сохраняют белок активным.
3. Электродиализ: Регулировка ионного состава
Цель: Удаление избыточных ионов или регулировка pH в концентрате белка.
Принцип:
Раствор пропускается через мембранные ячейки, чередующиеся с анионо- и катионообменными мембранами.
Электрическое поле заставляет ионы перемещаться к соответствующим электродам, снижая их концентрацию в растворе.
Применение:
Удаление остаточных солей, стабилизирующих растворов или нежелательных ионов.
Подготовка раствора для конечного использования (например, в фармацевтическом производстве).
Параметры:
Контролируемый уровень pH.
Температура: 4–20 °C для предотвращения инактивации белка.
Преимущества:
Высокая точность в удалении ионов.
Регулировка pH без добавления химических реагентов.
Схема процесса
Ультрафильтрация → Концентрация раствора до 10–30% от начального объема.
Диализ → Удаление низкомолекулярных примесей, поддержание стабильности белка.
Электродиализ (при необходимости) → Финальная корректировка ионного состава, удаление остаточных солей.
4. Центрифугирование, основные методы.
Центрифугирование (от центр и лат. fuga — бегство, бег), разделение неоднородных систем под действием центробежных сил. Мы имеем дело с жидкостными системами – суспензиями (смесь веществ, где твёрдое вещество распределено в виде мельчайших частичек в жидком веществе во взвешенном (неосевшем) состоянии. Обычно размер частиц > 10 мкм) и эмульсиями (дисперсная система с жидкой дисперсионной средой и жидкой дисперсной фазой. Эмульсии состоят из несмешиваемых жидкостей).
Скорость осаждения, или седиментации, зависит от центробежного ускорения (G), прямо пропорционального угловой скорости ротора (ω, в рад/с) и расстоянию между частицей и осью вращения (К, в см) G = ω2γ
Угловая скорость ротора в оборотах в минуту N(об./мин)
ω =2πΝ/60=πΝ/30
Центробежное ускорение (об. /мин)
G =π2Ν2r/900
Центробежное ускорение обычно выражается в единицах g и называется относительным центробежным, ускорением
ОЦУ= G / g
g = 9,80665 м/с2
Время седиментации в результате зависит от
1. Разности плотностей частицы и окружающей среды
2. Размера частицы
3. Формы частицы (стоксов радиус)
Препаративное центрифугирование
o Аналог фильтрования
o Разделение объектов
Аналитическое
o Молекулярные веса
o Изучение конформаций макромолекул
Методы центрифугирования: Дифференциальное; Зонально-скоростное; Изопикническое
Дифференциальное центрифугирование - Препаративный метод, наиболее часто используется как аналог фильтрации, разделение сильно отличающихся компонентов.
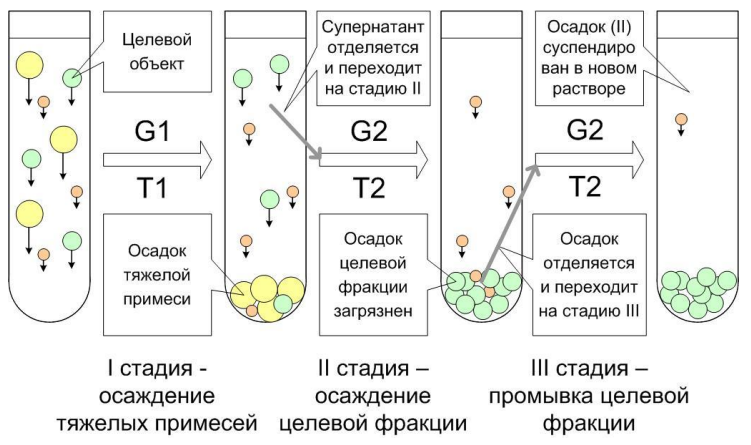
Смесь помещается в центрифугу, где более крупные и плотные частицы осаждаются быстрее.
После центрифугирования образуется осадок (пеллет) и надосадочная жидкость (супернатант), которые разделяются.
Зонально-скоростное центрифугирование- Частицы разделяются в градиенте плотности среды в зависимости от их скорости седиментации.
Процесс:
Градиент плотности (например, сахарозы или перколла) создаётся в пробирке.
Смесь наносится поверх градиента, и при центрифугировании частицы мигрируют на определённые расстояния, соответствующие их седиментационным коэффициентам.
В конце процесса частицы остаются в различных зонах, разделённых по размеру и плотности.
Применение:
Разделение сложных биологических смесей, таких как белки, нуклеиновые кислоты, вирусы.
Используется для более точного разделения, чем дифференциальное центрифугирование.
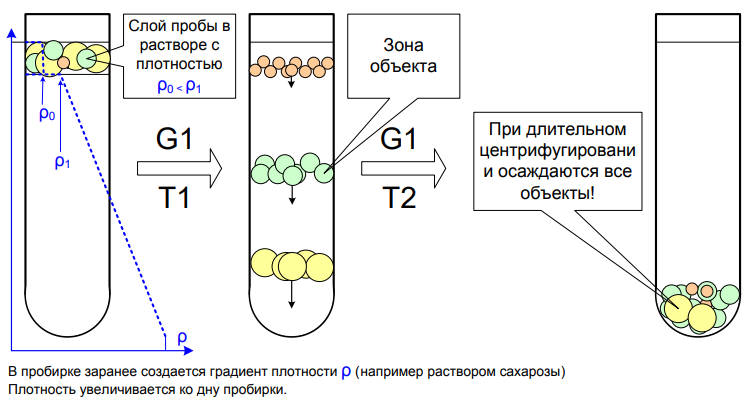
Плотность начальной точки градиента подбирается так, чтобы плотность пробы была меньше – это позволяет наслаивать пробу без смешивания. (см. коктейль Bloody Mary)
Градиент плотности играет вспомогательную роль – препятствует конвекционному размыванию разделяемых зон. Важно не «перекрутить» и не перейти в дифференциальный режим!
Изопикническое центрифугирование - Частицы распределяются в градиенте плотности в точке, где их плотность равна плотности среды.
Процесс:
Смесь вводится в подготовленный градиент плотности (CsCl2), градиент образуется во время центрифугирования.
Частицы мигрируют к зоне, где их плотность совпадает с плотностью среды.
После завершения центрифугирования частицы остаются в своих равновесных позициях.
Применение:
Разделение компонентов на основе различий в плотности, например, изолирование ДНК, РНК или органелл.
Обеспечивает высокую степень разделения.
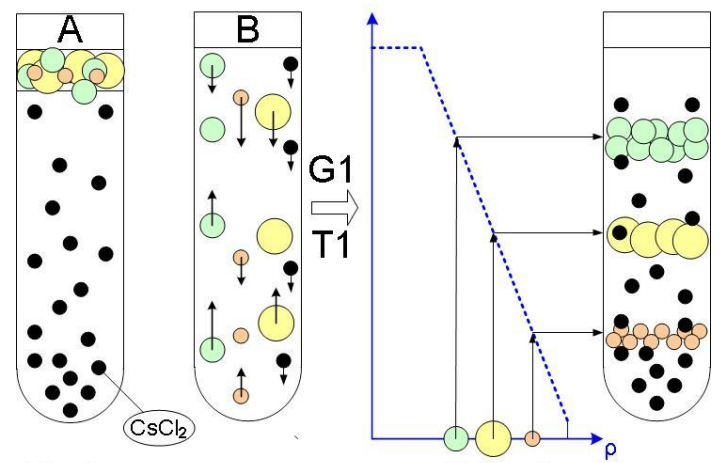
Градиент плотности играет основную роль – разделение по плотностям.
В данном методе идёт разделение только и именно по плотностям. Размеры не имеют значения.
На рисунке – важен цвет, обозначающий плотность. В случае В – градиент плотности формируется из-за противоположно действующих сил (центробежная сила и диффузия)
Виды центрифуг
Препаративные центрифуги
Центрифуги общего назначения o 8000 об./мин o ОЦУ до 6000 g.
Скоростные центрифуги o 25 000 об/мин o ОЦУ до 89 000 g
Препаративные ультрацентрифуги o 75 000 об./мин o ОЦУ до 510 000 g
Определение молекулярных весов
По скорости седиментации
Константа седиментации это скорость, отнесенная к единице ускорения, имеет размерность времени (ее выражают в секундах). Величина константы седиментации, равная 1•10–13 с, условно принята за единицу и названа сведбергом (S). Значения констант седиментации большинства белков лежат в пределах 1–50 S, хотя в ряде случаев эти значения превышают 100 S.
Молекулярный вес молекул определяют по уравнению Сведберга
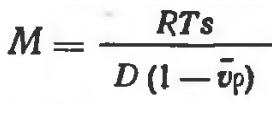
М — молекулярный вес молекулы, R — газовая постоянная, Т — абсолютная температура, s — коэффициент седиментации молекулы, D — коэффициент диффузии молекулы, v — парциальный удельный объем, который можно рассматривать как объем, занимаемый одним граммом растворенного вещества, ρ — плотность растворителя.
Метод седиментационного равновесия
Ультрацентрифугирование проводят вплоть до достижения частицами равновесия, устанавливающегося под действием центробежных сил, с одной стороны, и диффузионных — с другой, т. е. до тех пор, пока частицы не перестанут перемещаться. Затем по образовавшемуся градиенту концентрации рассчитывают молекулярный вес вещества согласно формуле
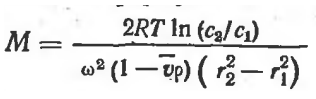
R — газовая постоянная, Т — абсолютная температура, ω — угловая скорость, ρ — плотность растворителя, ν — парциальный удельный объем, с1 и с2— концентрация растворенного вещества на расстояниях r1 и r2 от оси вращения
Недостатком данного метода является то, что для достижения седиментациоиного равновесия необходимо длительное время — от нескольких дней до нескольких недель при непрерывной работе центрифуги.
Метод приближения к седиментационному равновесию
Этот метод был разработан для того, чтобы избавиться от недостатков предыдущего метода, связанных с большими затратами времени, необходимого для установления равновесия. С помощью него можно определять молекулярные веса, когда центрифугируемый раствор находится в состоянии приближения к равновесию. Вначале макромолекулы распределяются по всему объему аналитической ячейки равномерно; затем по мере центрифугирования молекулы оседают, и плотность раствора в области мениска постепенно уменьшается. Изменение плотности тщательно регистрируют, а затем путем сложных расчетов, включающих большое число переменных, определяют молекулярный вес данного соединения по формулам.
Методы формирования градиента
Ступенчатый градиент - Градиент создается путем последовательного слияния растворов с разной плотностью.
Процесс:
Растворы с возрастающей плотностью аккуратно накладываются друг на друга (слои).
Слоение выполняется с использованием пипеток или автоматических систем, чтобы минимизировать смешивание слоев.
Особенности:
Градиент имеет четко выраженные границы между слоями.
Подходит для разделения крупных частиц или объектов с большими различиями в плотности.
Применение:
Используется для изопикнического разделения, например, клеток или органелл.
2. Метод сообщающихся сосудов-Градиент формируется естественным образом под действием силы тяжести в сообщающихся сосудах.
Процесс:
В одном сосуде размещают раствор с высокой плотностью, а в другом — с низкой.
Через соединительный шланг растворы перетекают, создавая линейный градиент плотности.
Особенности:
Метод прост в реализации и не требует сложного оборудования.
Подходит для экспериментов, где требуется плавный линейный градиент.
Применение:
Разделение белков, вирусов, нуклеиновых кислот.
3. Перистальтический насос - Растворы с разной плотностью перемешиваются и подаются в центрифужную пробирку или ротор через перистальтический насос.
Процесс:
Насос обеспечивает подачу растворов с заранее заданной скоростью.
За счет перемешивания растворов в процессе заполнения создается плавный или нелинейный градиент.
Особенности:
Высокая степень автоматизации.
Возможность точного контроля над формой градиента.
Применение:
Разделение мелких частиц, таких как нуклеопротеиды или мелкие органеллы.
4. Системы формирования градиента - Использование специализированных устройств для автоматической генерации градиента.
Процесс:
Устройство соединяет два резервуара с растворами разной плотности.
Смесь подается в центрифужную пробирку с регулируемой скоростью, создавая заданный тип градиента (линейный, экспоненциальный и т. д.).
Особенности:
Высокая точность и воспроизводимость.
Возможность создания сложных градиентов с заданными характеристиками.
Применение:
Используется в высокоточных экспериментах, например, при разделении вирусных частиц или комплексов белков.
5. Центрифугирование, применение в очистке генно-инженерных белков.
