- •1. Мембранные технологии, их использование в биотехнологии.
- •1. Пластинчатый диализатор
- •2. Диализатор типа «фильтр-пресс»
- •2. Роль мембранных технологий в очистке генно-инженерных белков.
- •1. Ультрафильтрация
- •2. Диализ
- •3. Электродиализ
- •3. Предложить вариант мембранной технологии для концентрирования большого количества раствора генно-инженерного белка
- •1. Ультрафильтрация: Первичный этап концентрирования
- •2. Диализ: Удаление остаточных солей и буферных компонентов
- •3. Электродиализ: Регулировка ионного состава
- •4. Центрифугирование, основные методы.
- •1. Этапы применения центрифугирования
- •1.1. Удаление клеточного мусора (клеточный лизат)
- •1.2. Концентрация белка
- •Тип ротора:
- •Условия центрифугирования:
- •Особенности
- •Виды колориметрии
- •Пример работы фотоколориметра
- •Строение и принцип работы спектрофотометра на диодной матрице:
- •Преимущества и особенности:
- •1. Поглощение белков в уф-области
- •2. Поглощение нуклеиновых кислот (нк) в уф-области
- •3. Изобестическая точка
- •Применение в бт:
- •1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
- •1. Источник инфракрасного излучения
- •2. Монохроматор
- •3. Оптическая система
- •4. Образец
- •5. Приемники излучения
- •Принцип работы
- •Особенности и преимущества Фурье-ик-спектрометра
- •1. Инфракрасная (ик) спектроскопия Описание метода:
- •Применяемые техники:
- •Применение:
- •2. Раман-спектроскопия (спектроскопия комбинационного рассеяния) Описание метода:
- •Применяемые техники:
- •3. Спектроскопия комбинационного рассеяния ближнего ик-диапазона (nir-спектроскопия)
- •Применение флуоресценции в биотехнологии
- •Тушение флуоресценции
- •Иммунофлуоресценция
- •Основные элементы устройства
- •Импульсные спектрометры с преобразованием Фурье (ft-nmr)
- •Основные этапы maldi масс-спектрометрии:
- •1. Время удерживания:
- •2. Время удерживания несорбируемого компонента или мертвое время:
- •3. Мертвый объём
- •4. Фактор удерживания к (коэффициент ёмкости)
- •5. Селективность (α):
- •6. Эффективность - число теоретических тарелок
- •7. Высота теоретической тарелки (h):
- •8. Пиковая емкость колонки
- •9. Разрешение Rs:
- •10. Фактор асимметрии для Асимметричные пики («с хвостом»)
- •1. Экстракция водорастворимых биологически активных соединений
- •2. Экстракция жирорастворимых биологически активных соединений
- •1. Лиофильные сушилки (фриз-драйеры)
- •Принцип действия:
- •2. Ротационные испарители
- •3. Сушильные шкафы
- •2. Спрей-сушилки (распылительные сушилки)
- •3. Вакуумные сушилки Принцип действия:
- •Применение:
- •1) Источники питания
- •38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
- •2. Типы анализируемых веществ:
- •5. Оборудование и сложность:
- •40. Капиллярный электрофорез, особенности и достоинства метода в сравнении с планарным электрофорезом.
38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
Сравнительный анализ
1. Принцип работы:
Хроматография: Основана на распределении компонентов смеси между подвижной и неподвижной фазами.
Электрофорез: Основан на миграции заряженных частиц под действием электрического поля.
2. Типы анализируемых веществ:
Хроматография: Подходит для разделения и анализа широкого спектра веществ, включая белки, пептиды, нуклеотиды, липиды, углеводы.
Электрофорез: Преимущественно используется для разделения и анализа макромолекул, таких как белки и нуклеиновые кислоты.
3. Точность и разрешение:
Хроматография: Высокая точность и разрешение, позволяет разделять сложные смеси.
Электрофорез: Хорошее разрешение для белков, но может быть менее точным при анализе малых молекул.
4. Применение в биотехнологии:
Хроматография: Широко используется для очистки и анализа биомолекул, контроля качества, исследования метаболитов.
Электрофорез: Применяется для анализа белковых смесей, идентификации изоформ, исследования генетического материала.
5. Оборудование и сложность:
Хроматография: Требует сложного оборудования, такого как насосы, детекторы, колонки.
Электрофорез: Менее сложное оборудование, но требует точного контроля параметров, таких как pH и напряжение.
Заключение
Хроматография и электрофорез являются взаимодополняющими методами, каждый из которых имеет свои уникальные преимущества и области применения в биотехнологии. Хроматография обеспечивает высокую точность и разрешение при разделении сложных смесей, тогда как электрофорез эффективен для анализа и разделения макромолекул, таких как белки. Выбор метода зависит от конкретной задачи и требуемой точности анализа.
39.Использование электрофореза для анализа биополимеров.
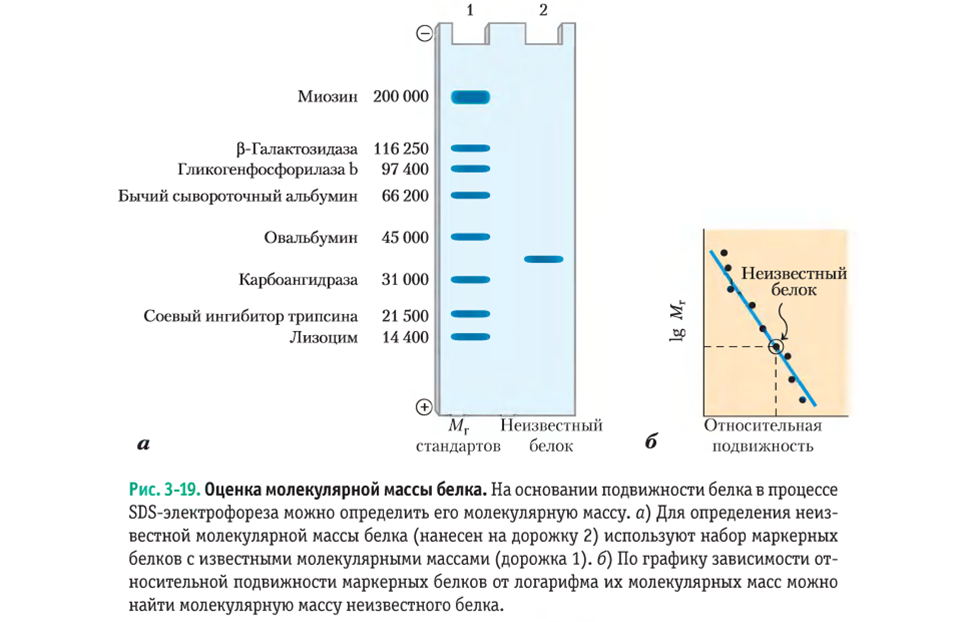
Оценка молекулярной массы белков
Оценка молекулярной массы белка. На основании подвижности белка в процессе SDS-электрофореза можно определить его молекулярную массу. а) Для определения не извесной молекулярной массы белка (нанесен на дорожку 2) используют набор маркерных белков с известными молекулярными массами (дорожка 1). б) По графику зависимости от относительной подвижности маркерных белков от логарифма их молекулярных масс можно найти молекулярную массу неизвестного белка.
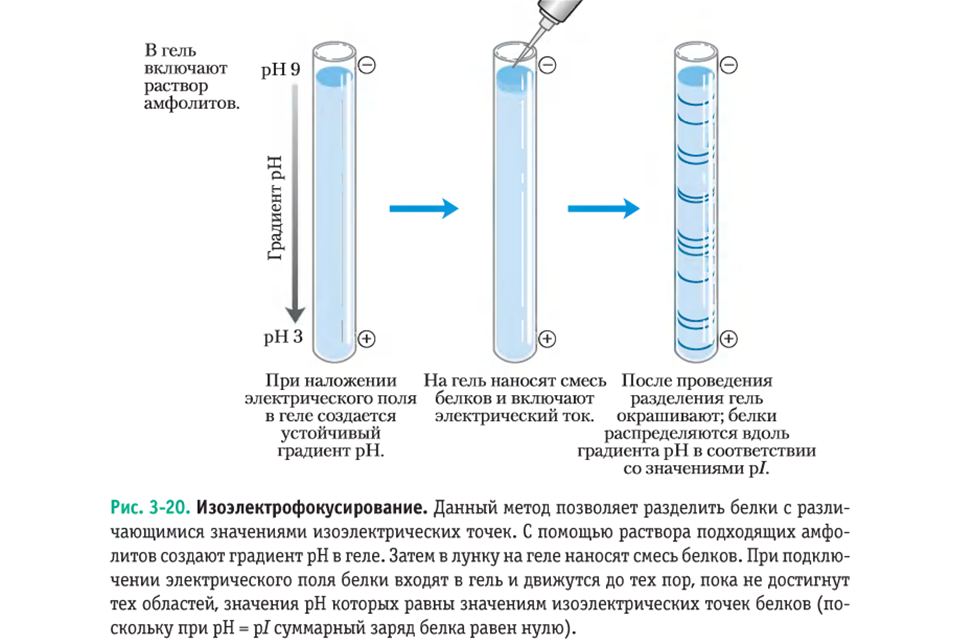
Определение изоэлектрической точки белков (кислотность среды (pH), при которой определённая молекула белка не несёт электрического заряда)
Изоэлектрофокусирование. Данный метод позволяет разделить белки с различающимися значениями изоэлектрических точек. С помощью раствора подходящих амфолитов создают градиент рН в геле. Затем в лунку на геле наносят смесь белков. При подключении электрического поля белки входят в гель и движутся до тех пор, пока не достигнут тех областей, значения рН которых равны значениям изоэлектрических точек белков (по-сколько при рH = pI суммарный заряд белка равен нулю).
Определение длины и оценка количества ДНК фрагментов с помощью маркеров
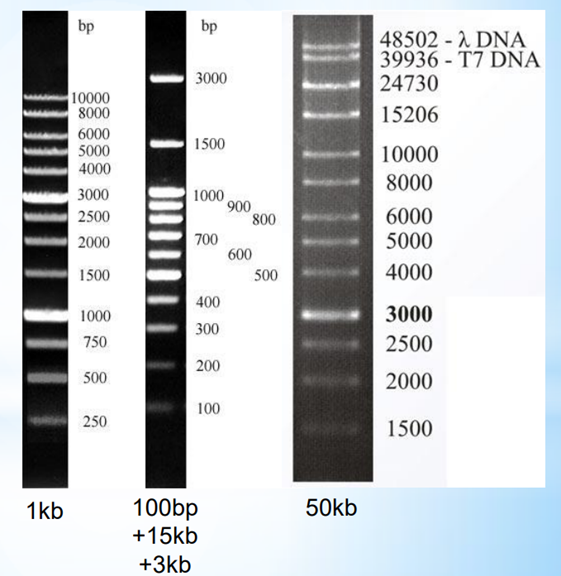
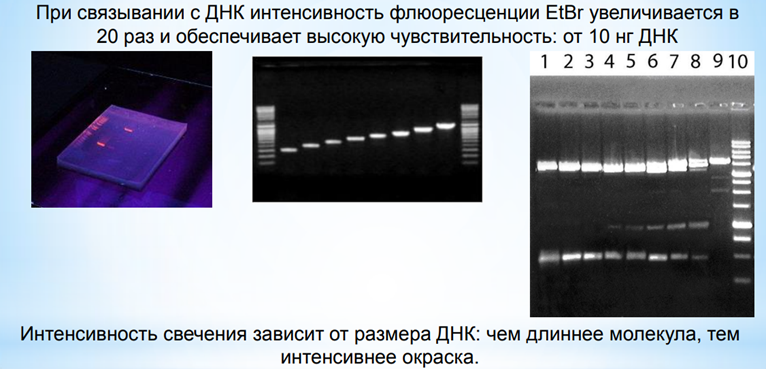
Чем больше размер, тем меньше электрофоретическая подвижность, крупные молекулы движутся медленнее из-за большего сопротивления
Для визуализации ДНК применяют флюоресцирующий интеркалирующий краситель – бромистый этидий (EtBr).
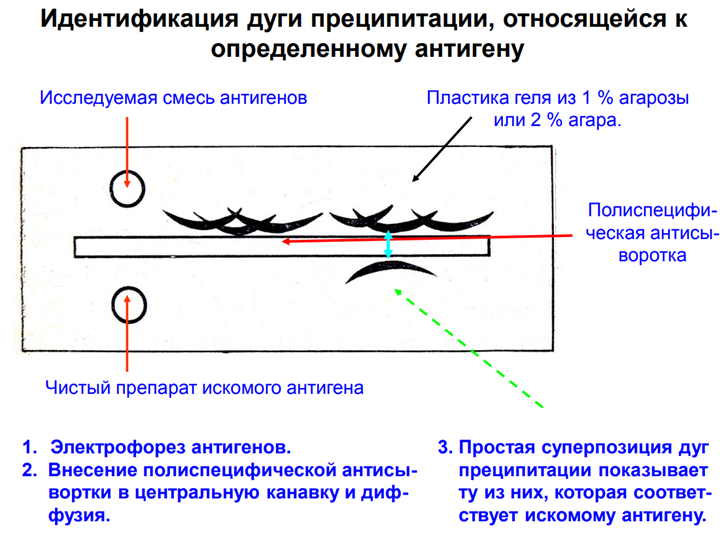
Иммунноэлектрофорез
Служит для количественного и качественного анализа смесей различных антигенов
1. Формируют пластину из 2% агарового геля. В центре пластины - гнездо для внесения смеси антигенов; вдоль длинного края пластины формируют желобок для внесения антител.
2. В гнездо в центре пластины вносят смесь антигенов и проводят электрофорез. При этом часть антигенов идут к катоду, а часть - к аноду. Продолжительность около 90 мин.
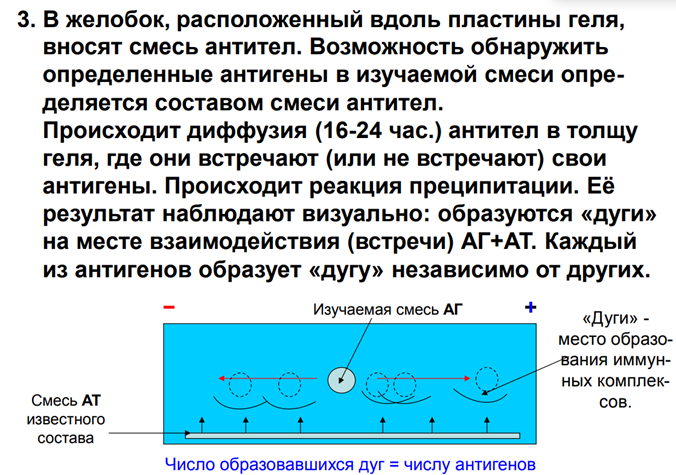
3. В желобок, расположенный вдоль пластины геля, вносят смесь антител. Возможность обнаружить определенные антигены в изучаемой смеси определяется составом смеси антител. Происходит диффузия (16-24 час. ) антител в толщу геля, где они встречают (или не встречают) свои антигены. Происходит реакция преципитации. Её результат наблюдают визуально: образуются «дуги» на месте взаимодействия (встречи) АГ+АТ. Каждый из антигенов образует «дугу» независимо от других.