- •1. Мембранные технологии, их использование в биотехнологии.
- •1. Пластинчатый диализатор
- •2. Диализатор типа «фильтр-пресс»
- •2. Роль мембранных технологий в очистке генно-инженерных белков.
- •1. Ультрафильтрация
- •2. Диализ
- •3. Электродиализ
- •3. Предложить вариант мембранной технологии для концентрирования большого количества раствора генно-инженерного белка
- •1. Ультрафильтрация: Первичный этап концентрирования
- •2. Диализ: Удаление остаточных солей и буферных компонентов
- •3. Электродиализ: Регулировка ионного состава
- •4. Центрифугирование, основные методы.
- •1. Этапы применения центрифугирования
- •1.1. Удаление клеточного мусора (клеточный лизат)
- •1.2. Концентрация белка
- •Тип ротора:
- •Условия центрифугирования:
- •Особенности
- •Виды колориметрии
- •Пример работы фотоколориметра
- •Строение и принцип работы спектрофотометра на диодной матрице:
- •Преимущества и особенности:
- •1. Поглощение белков в уф-области
- •2. Поглощение нуклеиновых кислот (нк) в уф-области
- •3. Изобестическая точка
- •Применение в бт:
- •1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
- •1. Источник инфракрасного излучения
- •2. Монохроматор
- •3. Оптическая система
- •4. Образец
- •5. Приемники излучения
- •Принцип работы
- •Особенности и преимущества Фурье-ик-спектрометра
- •1. Инфракрасная (ик) спектроскопия Описание метода:
- •Применяемые техники:
- •Применение:
- •2. Раман-спектроскопия (спектроскопия комбинационного рассеяния) Описание метода:
- •Применяемые техники:
- •3. Спектроскопия комбинационного рассеяния ближнего ик-диапазона (nir-спектроскопия)
- •Применение флуоресценции в биотехнологии
- •Тушение флуоресценции
- •Иммунофлуоресценция
- •Основные элементы устройства
- •Импульсные спектрометры с преобразованием Фурье (ft-nmr)
- •Основные этапы maldi масс-спектрометрии:
- •1. Время удерживания:
- •2. Время удерживания несорбируемого компонента или мертвое время:
- •3. Мертвый объём
- •4. Фактор удерживания к (коэффициент ёмкости)
- •5. Селективность (α):
- •6. Эффективность - число теоретических тарелок
- •7. Высота теоретической тарелки (h):
- •8. Пиковая емкость колонки
- •9. Разрешение Rs:
- •10. Фактор асимметрии для Асимметричные пики («с хвостом»)
- •1. Экстракция водорастворимых биологически активных соединений
- •2. Экстракция жирорастворимых биологически активных соединений
- •1. Лиофильные сушилки (фриз-драйеры)
- •Принцип действия:
- •2. Ротационные испарители
- •3. Сушильные шкафы
- •2. Спрей-сушилки (распылительные сушилки)
- •3. Вакуумные сушилки Принцип действия:
- •Применение:
- •1) Источники питания
- •38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
- •2. Типы анализируемых веществ:
- •5. Оборудование и сложность:
- •40. Капиллярный электрофорез, особенности и достоинства метода в сравнении с планарным электрофорезом.
3. Вакуумные сушилки Принцип действия:
Материал сушится при низком давлении, что снижает температуру испарения воды и предотвращает термическое повреждение соединений. можно сушить порошки, гранулы, пасты.
Применение:
Сушка фармацевтических препаратов.
Производство натуральных красителей и ароматизаторов.
Подготовка пищевых добавок.
37.Электрофорез, принципы метода, аппаратурное оформление.
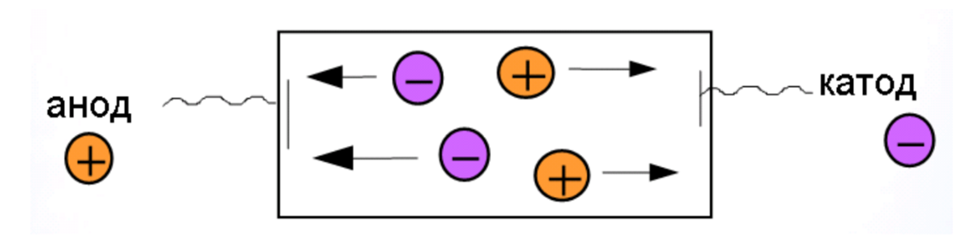
Движение заряженных коллоидных частиц под действием внешнего электрического поля.
Скорость движения заряженной частицы прямо пропорциональна напряжённости прикладываемого к ней внешнего электрического поля и её электрофоретической подвижности.
Электрофоретическая подвижность прямо пропорциональна заряду частицы (чем больше заряд, тем больше подвижность) и обратно пропорциональна её стоксову радиусу (чем больше радиус, тем меньше подвижность). Стоксов радиус – радиус гипотетической сферической частицы, движущейся с такой же скоростью, как и реальная частица.
Отношение эл. заряда молекулы к её радиусу Стокса q / r – можно управлять зарядом меняя pH. Форма молекулы – для частиц одной молекулярной массы и разной формы радиусы Стокса будут отличаться. Взаимодействие материала носителя с молекулами разделяемой смеси («эффект молекулярного сита») – замедление вплоть до остановки.
Прохождение тока вызывает неравномерный нагрев носителя. Это приводит к конвективным потокам, которые приводят к размыванию зон.
Носители для электрофореза
1. Хроматографическая бумага 2. Ацетат целлюлозы 3. Гели: агар, крахмал, полиакриламид (ПААГ)

Аппаратурное оформление
1) Источники питания

2) Аппаратное оформление электрофореза
Схема бумажного электрофореза
Принцип работы:
Бумажный электрофорез используется для разделения и анализа небольших молекул, таких как аминокислоты, пептиды и низкомолекулярные органические соединения.
На полоску фильтровальной бумаги наносится исследуемый образец. Бумага пропитывается буферным раствором для создания проводящей среды.
К двум концам полоски прикладываются электроды (анод и катод), подключенные к источнику постоянного напряжения.
Молекулы под действием электрического поля мигрируют к соответствующему электроду в зависимости от их заряда.
Схема:
Буферный резервуар.
Фильтровальная бумага, натянута над резервуаром и пропитанная буфером.
Источник питания для создания электрического поля.
Электроды на концах бумаги.
Образец, нанесенный ближе к середине бумаги.
После разделения молекулы детектируются окрашиванием.
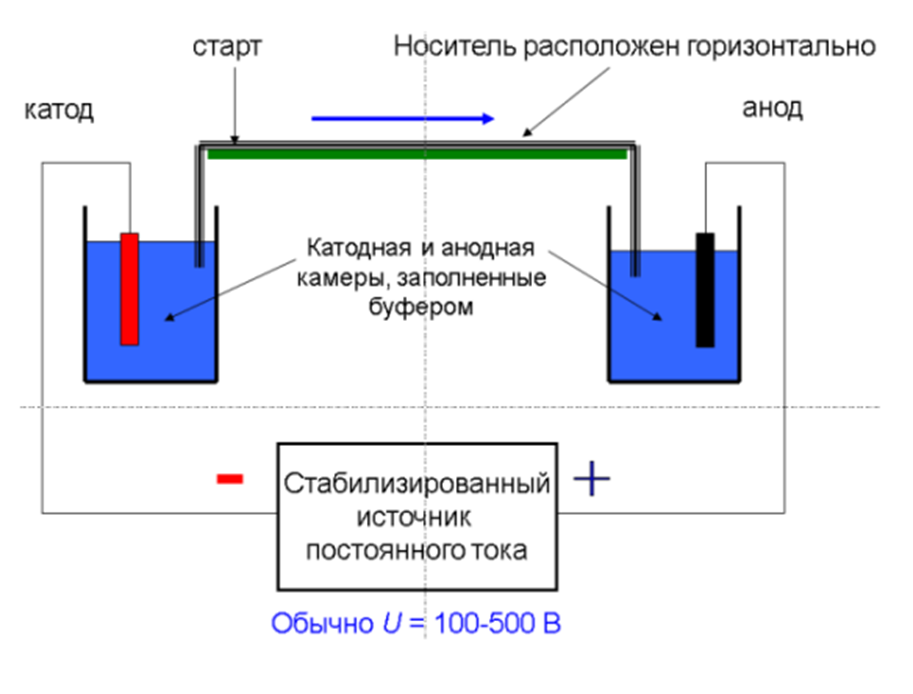
Схема диск-электрофореза
Принцип работы:
Используется для разделения белков или других макромолекул в полиакриламидном геле.
Гель состоит из двух частей: верхний концентрирующий гель (с низкой плотностью) и нижний разделяющий гель (с высокой плотностью).
Образец вводится в концентрирующий гель, где молекулы собираются в тонкую зону.
Под действием электрического поля молекулы перемещаются в разделяющий гель, где разделяются по размеру и заряду.
Схема:
Верхний концентрирующий гель.
Нижний разделяющий гель.
Буферный раствор в камерах электрофореза (верхняя и нижняя камеры).
Электроды (анод и катод).
Источник питания.
Образец вводится в лунки в верхнем геле.
Молекулы движутся через гель и разделяются по скорости миграции.
Аппарат для электрофореза нуклеиновых кислот (тоже самое, но гель другой)
Принцип работы:
Для разделения нуклеиновых кислот (ДНК, РНК) используется агарозный или полиакриламидный гель.
Гель заливается в специальную форму с лунками для образцов. После застывания форма помещается в буферный резервуар.
Образцы ДНК или РНК вводятся в лунки, а затем создается электрическое поле.
Нуклеиновые кислоты перемещаются через гель к аноду (поскольку они имеют отрицательный заряд благодаря фосфатным группам).
Разделение происходит по длине молекул: более короткие мигрируют быстрее.
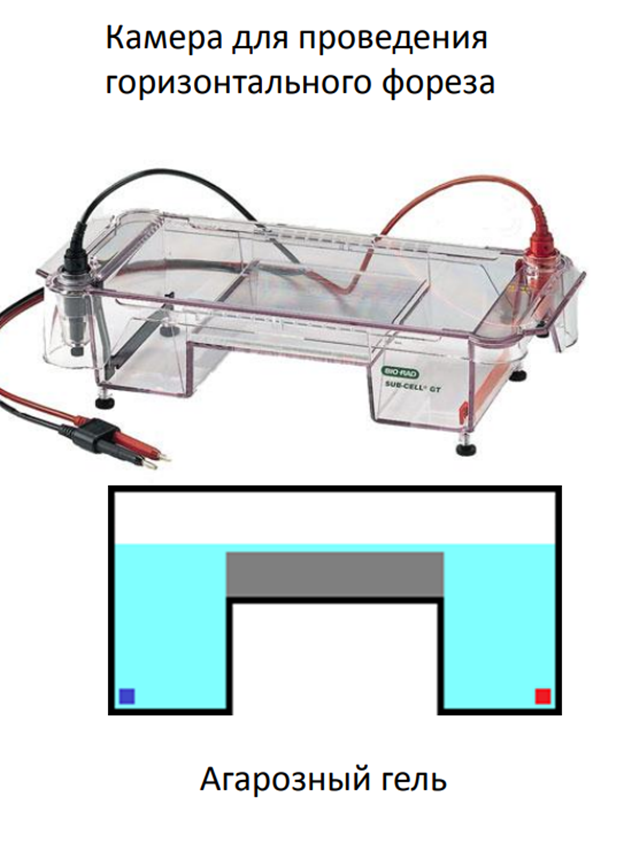
Аппарат для капиллярного электрофореза
Принцип работы:
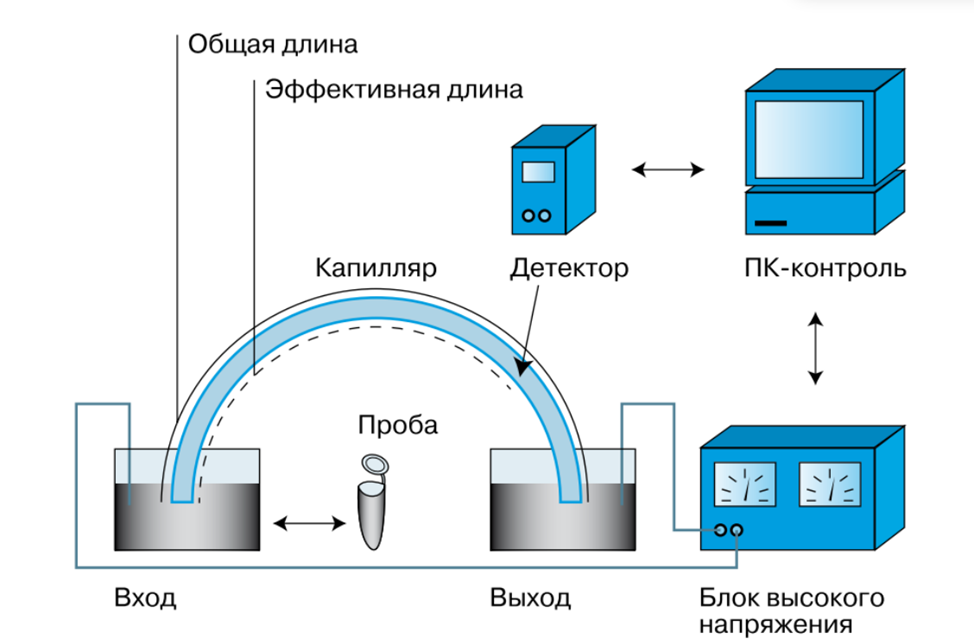
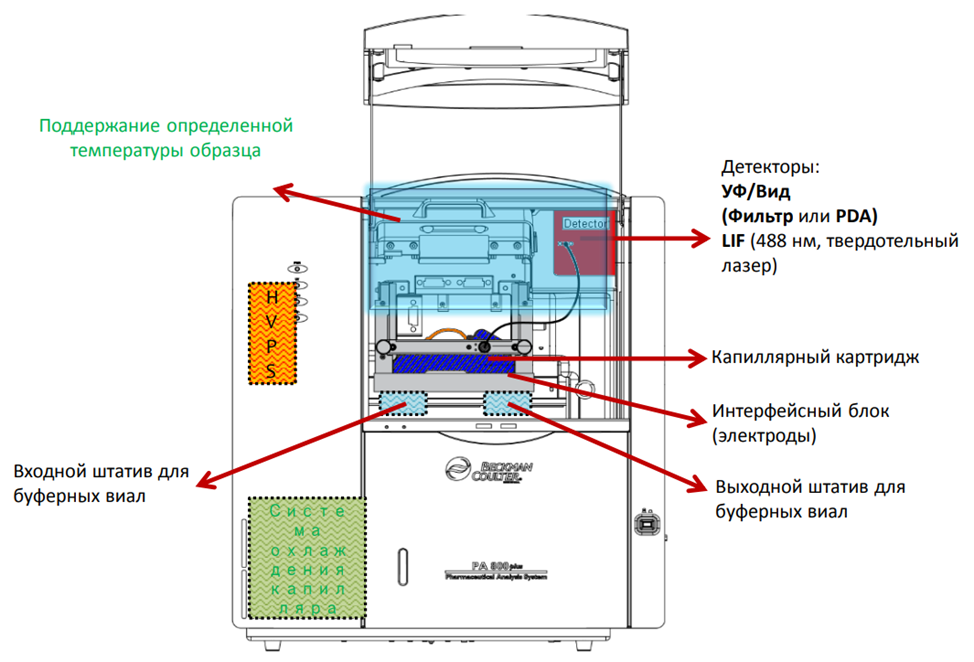
Это метод для разделения молекул в капилляре (тонкая стеклянная трубка, заполненная буфером).
Под действием электрического поля молекулы движутся через капилляр, разделяясь в зависимости от их заряда, размера и формы.
Основное преимущество — высокая скорость и разрешение.
Схема:
Капилляр, один конец капилляра погружают в раствор пробы, потом опускают в емкость где за счет перепада давления или электрики проба распределяется вместе с электролитическим буфером.
Электроды, установленные на обоих концах капилляра.
Источник высокого напряжения.
Автосамплер для подачи образца в капилляр.
Детектор (например, УФ-спектрофотометр), фиксирующий миграцию молекул.
Система управления (компьютер для анализа данных).
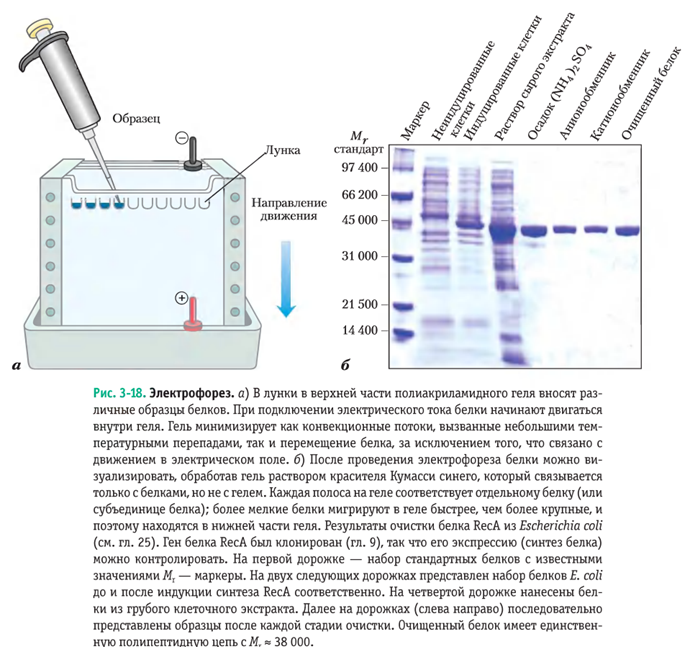
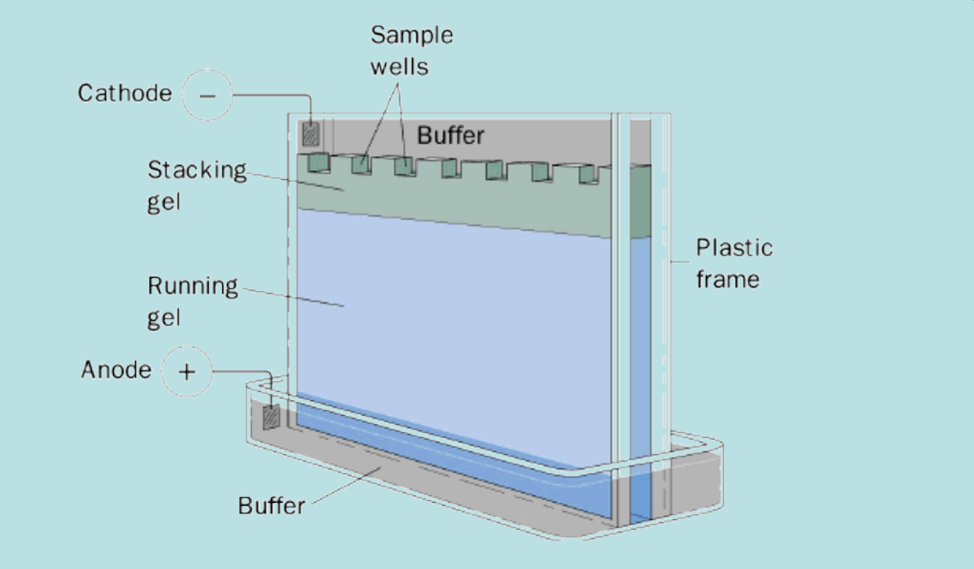
Электрофорез белков в полиакриламидном геле

Аппаратное оформление электрофореза в полиакриламидном геле
Электрофорез. а) В лунки в верхней части полиакриламидного геля вносят различные образцы белков. При подключении электрического тока белки начинают двигаться внутри геля. Гель минимизирует как конвекционные потоки, вызванные небольшими температурными перепадами, так и перемещение белка, за исключением того, что связано с движением в электрическом поле. б) После проведения электрофореза белки можно визуализировать, обработав гель раствором красителя Кумасси синего, который связывается только с белками, но не с гелем. Каждая полоса на геле соответствует отдельному белку (или субъединице белка); более мелкие белки мигрируют в геле быстрее, чем более крупные, и поэтому находятся в нижней части геля.