
- •1. Мембранные технологии, их использование в биотехнологии.
- •1. Пластинчатый диализатор
- •2. Диализатор типа «фильтр-пресс»
- •2. Роль мембранных технологий в очистке генно-инженерных белков.
- •1. Ультрафильтрация
- •2. Диализ
- •3. Электродиализ
- •3. Предложить вариант мембранной технологии для концентрирования большого количества раствора генно-инженерного белка
- •1. Ультрафильтрация: Первичный этап концентрирования
- •2. Диализ: Удаление остаточных солей и буферных компонентов
- •3. Электродиализ: Регулировка ионного состава
- •4. Центрифугирование, основные методы.
- •1. Этапы применения центрифугирования
- •1.1. Удаление клеточного мусора (клеточный лизат)
- •1.2. Концентрация белка
- •Тип ротора:
- •Условия центрифугирования:
- •Особенности
- •Виды колориметрии
- •Пример работы фотоколориметра
- •Строение и принцип работы спектрофотометра на диодной матрице:
- •Преимущества и особенности:
- •1. Поглощение белков в уф-области
- •2. Поглощение нуклеиновых кислот (нк) в уф-области
- •3. Изобестическая точка
- •Применение в бт:
- •1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
- •1. Источник инфракрасного излучения
- •2. Монохроматор
- •3. Оптическая система
- •4. Образец
- •5. Приемники излучения
- •Принцип работы
- •Особенности и преимущества Фурье-ик-спектрометра
- •1. Инфракрасная (ик) спектроскопия Описание метода:
- •Применяемые техники:
- •Применение:
- •2. Раман-спектроскопия (спектроскопия комбинационного рассеяния) Описание метода:
- •Применяемые техники:
- •3. Спектроскопия комбинационного рассеяния ближнего ик-диапазона (nir-спектроскопия)
- •Применение флуоресценции в биотехнологии
- •Тушение флуоресценции
- •Иммунофлуоресценция
- •Основные элементы устройства
- •Импульсные спектрометры с преобразованием Фурье (ft-nmr)
- •Основные этапы maldi масс-спектрометрии:
- •1. Время удерживания:
- •2. Время удерживания несорбируемого компонента или мертвое время:
- •3. Мертвый объём
- •4. Фактор удерживания к (коэффициент ёмкости)
- •5. Селективность (α):
- •6. Эффективность - число теоретических тарелок
- •7. Высота теоретической тарелки (h):
- •8. Пиковая емкость колонки
- •9. Разрешение Rs:
- •10. Фактор асимметрии для Асимметричные пики («с хвостом»)
- •1. Экстракция водорастворимых биологически активных соединений
- •2. Экстракция жирорастворимых биологически активных соединений
- •1. Лиофильные сушилки (фриз-драйеры)
- •Принцип действия:
- •2. Ротационные испарители
- •3. Сушильные шкафы
- •2. Спрей-сушилки (распылительные сушилки)
- •3. Вакуумные сушилки Принцип действия:
- •Применение:
- •1) Источники питания
- •38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
- •2. Типы анализируемых веществ:
- •5. Оборудование и сложность:
- •40. Капиллярный электрофорез, особенности и достоинства метода в сравнении с планарным электрофорезом.
7. Высота теоретической тарелки (h):
Определение: Длина колонки, приходящаяся на одну теоретическую тарелку. Рассчитывается как: H = L/N где L — длина колонки.
Значение: Характеризует эффективность колонки. Чем меньше H, тем эффективнее колонка.
8. Пиковая емкость колонки
Пиковая ёмкость колонки в хроматографии — это отношение времени градиента к средней ширине пиков на хроматограмме. Она показывает, сколько хроматографических пиков можно разделить с разрешением, равным единице, в данных условиях.

9. Разрешение Rs:
Определение: Количественная характеристика степени разделения двух соседних пиков.
РАЗРЕШЕНИЕ основной параметр оптимизации хроматографического разделения 2х пиков
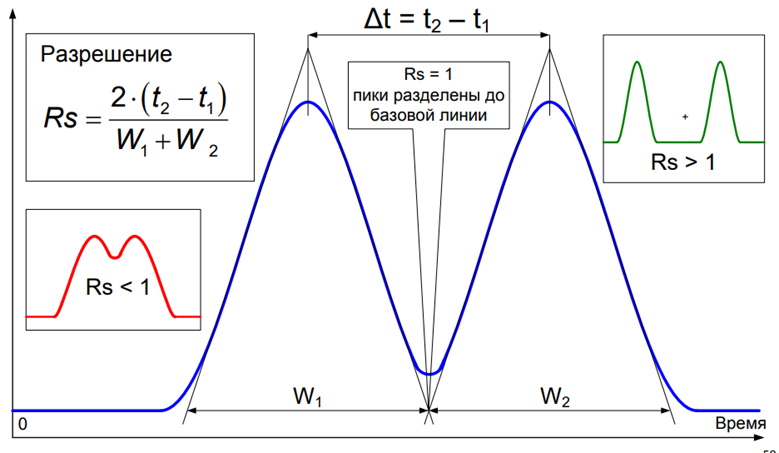
Реально пики разделены до базовой линии при Rs = 1.5 – 1.6 • Для рутинных анализов Rs = 1.7 обеспечивает адекватные результаты • Разрешение 2 – надёжнее • Слишком большое разрешение излишне
Современные программы рассчитывают значение разрешения не по ширине пиков у основания, а по ширине на половине высоты. Поправочный коэффициент 1.18 в числителе
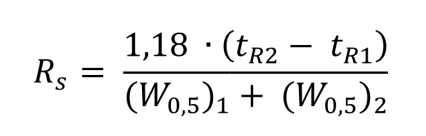
Классическая формула работает хорошо для симметричных пиков, в случае «хвостов» дает завышенные результаты
10. Фактор асимметрии для Асимметричные пики («с хвостом»)
Коэффициент асимметрии (asymmetry factor) - отношение правой полуширины пика к левой на 1/10 высоты пика.
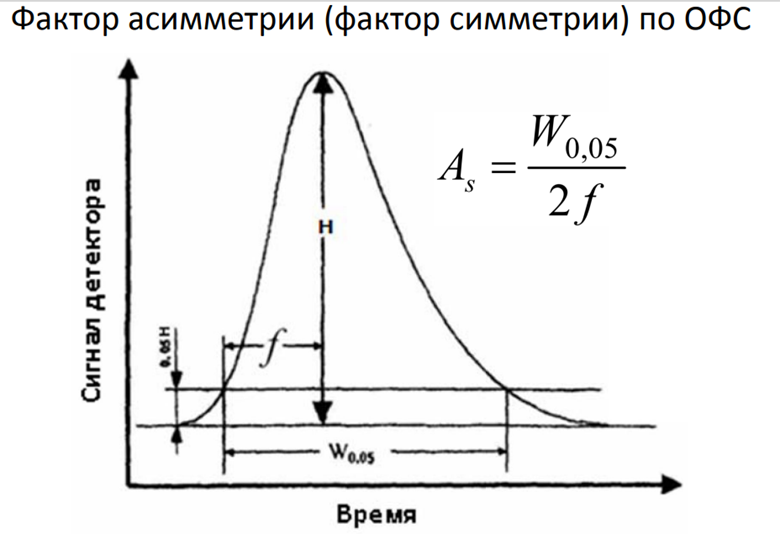
TF измеряется на уровне 5% от высоты пика, берет всю ширину пика и делится на удвоенную ширину передней части. Фактор асимметрии чаще используется в нефазовых полях. Он измеряется на уровне 10% от высоты пика и делит заднюю половину ширины на переднюю половину ширины.
*Кинетическая теория размывания (дополнительная информация)
Скорость перемещения по колонке отдельных молекул отличается от средней скорости, характерной для данного соединения - в результате зона размывается и образует в идеальном случае пик в форме Гауссовой кривой.
Влияют: Неоднородность потока подвижной фазы; Продольная диффузия в неподвижной и подвижной фазах; Кинетика массопередачи в неподвижной и подвижной фазах; Неравновесность процесса внутри застойных зон
Эффективность зависит от ВАС: Диаметра зерен сорбента, их геометрии и монодисперсности – какую колонку купите!; Качества набивки колонки – как повезет... ; Мертвого объема системы – как собрали прибор; Скорости потока элюента – какую установите!
Для ускорения разделения (без потери качества) необходима большая линейная скорость и, как следствие, большее давление
Оптимальные скорости потока элюента
Колонки с диаметром 3, 4, 4.6 мм 0.8-2.5 мл/мин Колонки с диаметром 1.5, 2 мм 0.2 - 1.0 мл/мин ВАЖНО – уравнение Ван Деемтера описывает только эффективность.
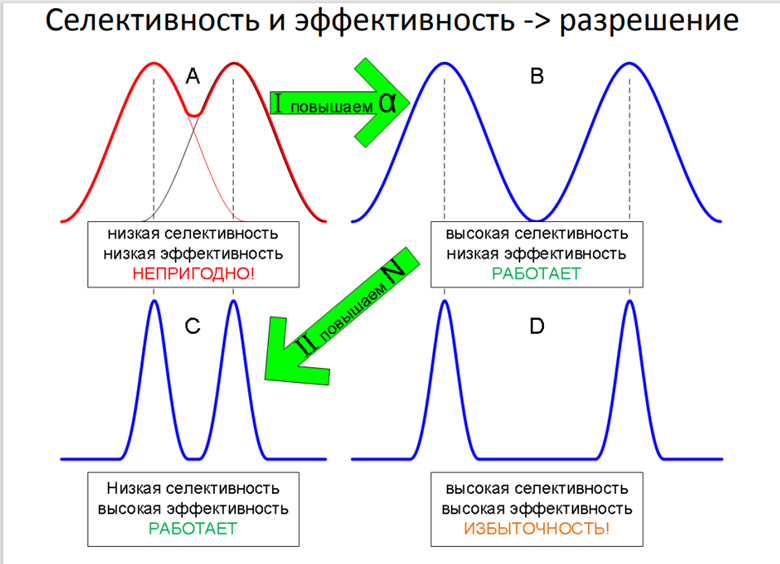
Критерий разделения в сложных случаях
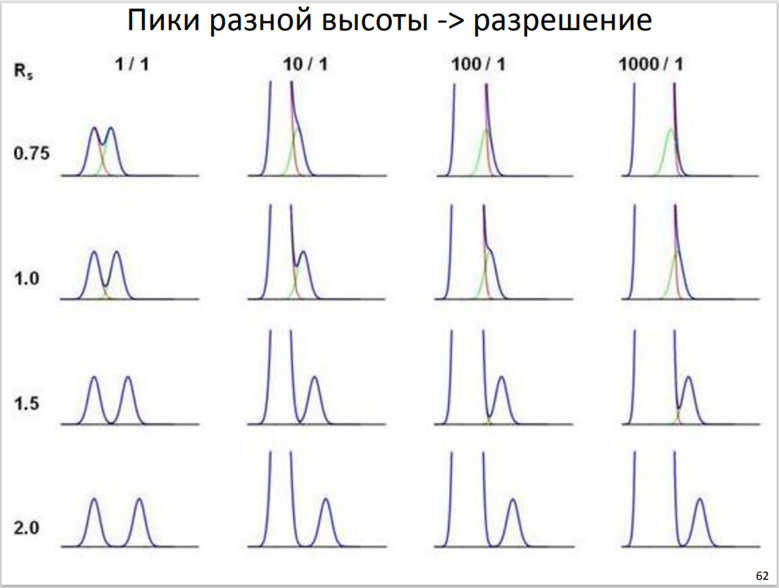
В случае, если пики несимметричны и если интенсивность пиков значительно различается, параметр Rs не всегда корректно описывает разделение хроматографических пиков. Таким образом, даже при значениях R s ≥ 1,5 может наблюдаться неполное разделение пиков. В этих случаях при оценке разделяющей способности можно заменить параметр Rs на параметр «отношение максимум/минимум» (p/v).
Отношение максимум/минимум (p/v), называемое также отношением «peak-to-valley», «пик – долина». Этот параметр позволяет оценить разделительную способность хроматографической системы. Значение p/v рассчитывается по формуле:
![]()
Критерии пригодности хроматографической системы - suitability, набор критериев, по которому можно судить о том, что данное хроматографическое разделение воспроизведено корректно, и не может стать причиной возможного неуспешного прохождения процедуры валидации. Основным и, фактически, единственным необходимым критерием пригодности хроматографической системы является разрешение критических пар на хроматограмме. Если критические пары разделяются выше некоторого заданного значения, то разделение является пригодным, и никакие другие критерии для подтверждения пригодности больше не требуются.
Некоторая проблема применения разрешения R как критерия пригодности заключается в том, что "классический" расчет разрешения основан на предположении об идеальной симметрии пиков, т.е. для асимметричных пиков он не работает. Выход заключается в том, чтобы применять иную, более корректную методику расчета разрешения.
Нередко в качестве критериев пригодности приводят такие характеристики как эффективность, удерживание, коэффициент асимметрии. В этом нет никакого смысла, поскольку корректно определенный параметр разрешения включает в себя все эти факторы. Критерии пригодности хроматографической системы - quantification, набор критериев, по которому можно судить о том, что относительная погрешность определения площади пика целевого соединения находится в заданных рамках.
Для веществ, определяемых на уровне следовых концентраций, значительную погрешность при измерении площади пика может вносить шум. Для таких соединений принято задавать некоторое наименьшее значение отношения высоты пика к высоте шума, которое называется отношением сигнал/шум (signal-to-noise ratio), и обозначается S/N. Для основных веществ подобным критерием служит относительное среднеквадратическое отклонение, рассчитанное из серии измерений площади пика при вводе в хроматограф стандартного раствора определенной концентрации.

Основное уравнение хроматографии
Эффективность, селективность и средний коэффициент ёмкости -> разрешение
• Влияние селективности максимально
• Фактор удерживания почти не влияет после 5
• Влияние эффективности минимально
• Работает тогда, когда имеется слабая зависимость между фактором удерживания и селективностью.
• Неприменимо к градиентным разделениям
Изотерма адсорбции (сорбции) — зависимость количества адсорбированного вещества (величины адсорбции, Сs) от парциального давления этого вещества в газовой фазе (или концентрации раствора, Сm) при постоянной температуре.

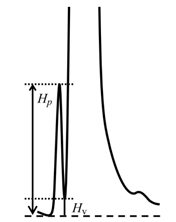
25.Аппаратное обеспечение ВЭЖХ. Основные узлы хроматографа.
Емкости для элюентов: Растворители готовятся заранее в соответствии с потребностями процесса разделения. Возможно наличие фильтра для дополнительной очистки.
Схема подачи элюента:
*Один или несколько насосов с датчикоим давления. Насосы подают желаемый поток и состав подвижной фазы через неподвижную фазу внутри колонки, а затем непосредственно в проточную ячейку внутри детектора.
*Смеситель: Создает нужный градиент или соотношение элюентов
*Дегазатор растворителя. Дегазатор удаляет растворённые газы из растворителей.
Узел ввода пробы - инжектор: Вводит смесь образцов в поток подвижной фазы, который затем уносит её в колонну.
Термостат: Позволяет регулировать температуру, при которой выполняется разделение.
Колонка: Область разделения пробы
Детектор. Детектор генерирует сигнал, пропорциональный количеству компонентов пробы, выходящих из колонки, что позволяет проводить количественный анализ компонентов пробы - аналитического сигнала.
Система обработки и управления: управляют прибором ВЭЖХ и обеспечивают анализ данных.
Коллектор фракций: Зона приема очищенных продуктов.
Принцип действия любого хроматографа заключается в следующем: раствор анализируемой смеси с помощью узла ввода пробы вводится в верхнюю часть хроматографической колонки. С помощью насоса анализируемая смесь прокачивается элюентом (подвижной фазой – ПФ) через хроматографическую колонку, в которой происходит разделение анализируемой смеси на отдельные вещества. Вытекающий из колонки элюат, содержащий отдельные компоненты анализируемой смеси, детектируется детектором, показания которого регистрируются регистратором (ПК).
Насосы: По характеру подачи растворителя насосы могут быть постоянной подачи (расхода) и постоянного давления. В основном при аналитической работе используется режим постоянного расхода, при заполнении колонок - постоянного давления.
Требования к насосам подачи подвижной фазы: Генерация давления до 15 МПа; слабые остаточные пульсации; химическая стойкость; Обеспечение скорости потока от 0,1 до 10 мл/мин; точный контроль скорости потока
Типы насосов: 1) Шприцевые; 2) Пневматические; 3) Плунжерные возвратно-поступательные
Почти все используемые сегодня в ВЭЖХ насосные системы являются вариациями возвратно-поступательных плунжерных насосов. Насосы с гидравлическим усилением используются для упаковки колонок и могут быть использованы в препаративных системах. Шприцевые насосы используются для калибровки ЖХ-МС систем, но не для подачи элюентов. Плунжерно-диафрагменные насосы когда-то использовались для ВЭЖХ-систем, но теперь популярностью не пользуются. Плунжерные возвратно-поступательные насосы с годами эволюционировали в надежные устройства, способные проработать сотни часов без поломок и обслуживания
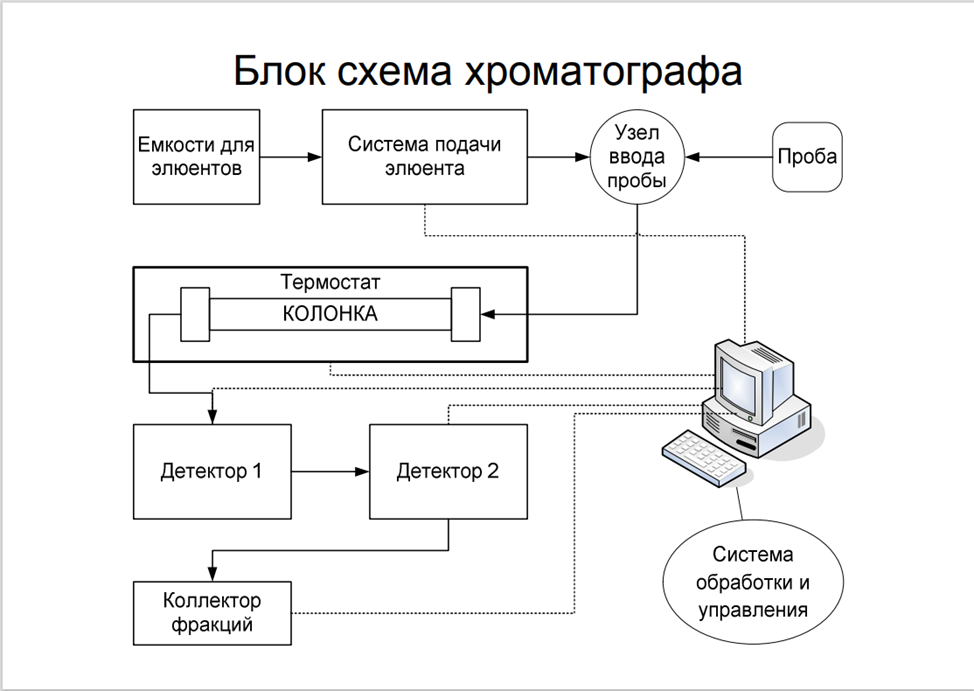
Шприцевые:
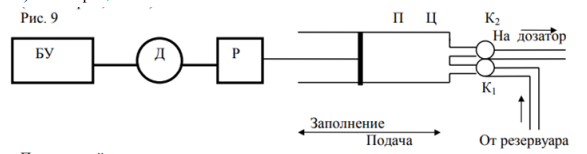
Принцип действия.
Блок управления БУ подает напряжение на двигатель Д, определяющее скорость и направление его вращения. Вращение двигателя с помощью редуктора Р преобразуется в перемещение поршня П внутри цилиндра Д. Работа насоса осуществляется в 2 цикла. В цикл заполнения клапан К2 закрыт, К₁ открыт, растворитель поступает из резервуара в цилиндр Ц. В режиме подачи клапан К, закрыт, а через клапан К2 подвижная фаза поступает в дозирующее устройство. Для насосов этого типа характерно практически полное отсутствие пульсаций потока подвижной фазы в ходе работы.
Преимущества: простота; дешевизна; отсутствие пульсаций потока
Недостатки: ограниченный объем шприца; невозможность создания градиента растворителя; большой расход времени и растворителя на промывку при смене растворителя
Возвратно-поступательные плунжерные насосы:
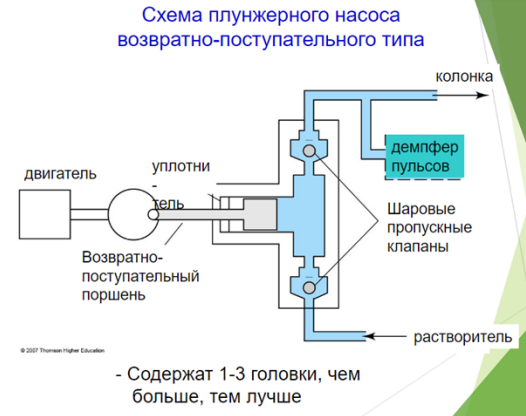
Основные части такого насоса: двигатель; плунжер; уплотнение плунжера; клапаны. Вращение кулачка, связанного с валом насоса и плунжером, приводит к возвратно-поступательному движению плунжера в голове насоса. Плунжер обычно изготавливают из сапфира, хотя в некоторых насосах он керамический. Уплотнение плунжера, сделанное из полимерного материала, необходимо для предотвращения утечек из головы насоса. Входной и выходной клапаны управляют направлением потока подвижной фазы.
Это 90% от всей массы насосов в ВЭЖХ Наиболее часто используется насос с двойным ходом поршня.
Преимущества: Маленький внутренний объем (35-400 мл); Высокое давление на выходе (300-500 атм.) ;Пригодны для градиентного элюирования
Недостатки: Создают пульсацию потока; Дорогие
Способы борьбы с пульсацией: Введение специальных узлов - гасителей пульсаций; Совершенствование конструкций насосов.
Двухплунжерные насосы
Одним из способов минимизации пульсаций одноплунжерного насоса является использование двух насосных голов, работающих параллельно следующим образом: в то время как одна из них заполняется элюентом, из другой он подается в выходной капилляр.
Накопительные плунжерные насосы
Альтернативой конструкции с двумя плунжерами является тандемная конструкция с дополнительным плунжером-аккумулятором (накопителем). В этом случае один плунжер (питающий) работает с удвоенной скоростью.
Дегазация подвижной фазы: Присутствие пузырьков воздуха в подвижной фазе является общей проблемой для функционирования ВЭЖХ-системы. Эти пузырьки могут привести к проблемам в работе насосов и паразитным пикам на хроматограмме. В большинстве случаев пузырьки можно удалить дегазацией подвижной фазы перед ее использованием.
Требования к дегазации: До тех пор, пока воздух растворен в подвижной фазе, проблемы с пузырьками возникают редко. В принципе, подвижную фазу для изократического элюирования, смешанную вручную, можно использовать и без дегазации, но раствор, насыщенный воздухом, может выделять газ уже при небольшом разрежении, например, в том случае, когда подвижная фаза проходит через встроенный в линию фильтр или когда она входит в пространство относительно низкого давления в ячейке детектора. По этой причине, а также для повышения общей эксплуатационной надежности ВЭЖХ-системы, все растворители, используемые в обращенно-фазовой хроматографии, настоятельно рекомендуется дегазировать. В случае нормально-фазовой ВЭЖХ проблема выделения пузырьков газа при смешивании растворителей стоит менее остро и потому дегазацию можно и не делать. Количество растворенного газа, который должен быть удален из подвижной фазы, будет разным в зависимости от конструкции ВЭЖХ-насосов.
Для большинства работ дегазация важна, прежде всего, для улучшения работы насоса. Тем не менее, в некоторых случаях, присутствие растворенного кислорода может ухудшить работу детектора: Для УФ-детектора - у подвижной фазы, насыщенной воздухом, изменяется показатель преломления; электрохимический детектор - растворенный кислород создает неприемлемый фоновый сигнал;
Растворенный кислород может в процессе разделения вступать в реакцию с некоторыми компонентами образца. Поэтому важно выбрать методику дегазации, решающую как химические проблемы (например, отклик детектора), так и физические (например, пузырьки в насосе), которые могут появиться из-за растворенного газа в подвижной фазе.
Дегазирование гелием
Дегазирование гелием является наиболее эффективным способом удаления растворенного газа из подвижной фазы (за исключением кипячение с обратным холодильником и перегонку). Оно удаляет 80-90% растворенного воздуха. Обычно в резервуар с элюентом помешают фильтр для диспергирования и подают через него под небольшим давлением (например, 0,345 бар) гелий. Чрезмерное барботирование подвижной фазы нежелательно, поскольку оно может изменить ее состав вследствие испарения летучих компонентов. Тем не менее, интенсивное барботирование элюентов для обращенно-фазовой хроматографии в течение нескольких минут не приведет к проблемам. Ситуация с элюентами для нормально-фазовой хроматографии иная и, так как они гораздо более летучи, гелий для их барботирования надо использовать осторожно, если вообще это стоит делать. Впрочем, барботирование чистых растворителей до того, как их смешали в потоке, к сложностям не приводит.
Вакуумное дегазирование и онлайн-дегазирование
Для большинства ВЭЖХ-систем использование вакуума для дегазации подвижной фазы позволяет удалить достаточное количество растворенного газа, чтобы избежать связанных с ним проблем. Вакуумная дегазация в течение 10—15 минут удаляет 60—70% растворенного газа.
В настоящий момент наиболее популярным способом является онлайн-дегазация. Большинство производителей ВЭЖХ-систем включают онлайн-дегазаторы и как стандартное, и как дополнительное оборудование в комплект приобретаемых хроматографов. Их работа основана на селективной проницаемости для газов некоторых полимерных трубок. Растворитель проходит через отрезок полимерной трубки, которая, в свою очередь, помещена внутрь вакуумной камеры. Вакуум заставляет растворенные газы выходить сквозь стенки трубки, а жидкая подвижная фаза остается внутри трубки. Конечно, такой метод дегазации не столь эффективен, как барботирование гелием, но удобство и дешевизна в сравнении с гелием сделало его популярнее. Для тех случаев, когда концентрация растворенного кислорода критична (например, при флуоресцентном и электрохимическом способах детектирования), или там, где необходимо постоянно поддерживать минимальные концентрации растворенных газов (например, при рефрактометрическом методе детектирования с максимальной чувствительностью), непрерывное барботирование гелием с последующей вакуумной дегазацией онлайн является оптимальным вариантом.
Капилляры и соединения (фитинги): необходимы для коммутации различных модулей ВЭЖХ-системы, между которыми происходит перемещение подвижной фазы и раствора образца. Выбор неподходящих соединений может привести к появлению нежелательных внеколоночных объемов, которые могут свести на нет саморазделение, особенно в случае пиков, элюируемых в малых объемах.
Капилляры для низкого давления
Обычно, при давлениях менее 7 бар используют полимерные капилляры. Они нужны, главным образом, для того, чтобы транспортировать подвижную фазу из резервуара в насос и для организации слива из детектора.
Капилляры для высокого давления
В то время как капилляры низкого давления используются, в основном, для транспортировки подвижной фазы из резервуара в насос или для организации слива из детектора, капилляры высокого давления нужны в других частях хроматографической системы. Обычные ВЭЖХ-системы сконструированы с учетом того, что давление между насосом и детектором может достигать 414 бар (6000 psi), и капилляры его должны выдерживать. Кроме того, капилляры, предназначенные для транспортировки образца от автосамплера до колонки и от колонки к детектору, должны быть достаточно инертны, чтобы образец не сорбировался и не разлагался по пути. Внутренний диаметр и длина капилляров должны быть такими, чтобы не происходило значительного уширения пиков. Для большинства случаев капилляры из нержавеющей стали и ПЭЭК удовлетворяют этим требованиям.
Инжектор: автоматическая система отбора проб, позволяющая выбирать метод, который может состоять из программируемой серии отбора определенного объема исследуемых образцов или одиночного закола. Автоматический дозатор необходим в случае многократного повторения анализа больших серий однотипных образцов. При этом используется один расход растворителя, одна колонка. После окончания анализа (выхода последнего пика) производится автоматический ввод следующей пробы. Сами пробы предварительно заливаются в ампулы, ампулы устанавливаются на специальном столике. Специальный насос засасывает из ампулы пробу, прокачивает ее через пробоотборную петлю дозатора. При повороте дозатора петля промывается элюентом, и проба попадает в колонку.
Колонки: Аналитическая колонка представляет собой трубку из нержавеющей стали, титана или стекла, заполненную сорбентом и закрытую с обеих сторон фильтрами для предотвращения высыпания сорбента. Фильтры имеют диаметр пор 2-5 мкм, что не создает сопротивления потоку. Для получения высокой эффективности колонок необходимо соблюдение некоторых условий:
1. Внутренняя поверхность колонки должна быть зеркально гладкой.
2. Сорбент должен иметь однородную фракцию (5+1мкм).
3. Переход от большого диаметра колонки к малому диаметру штуцера должен быть плавный, т.е. нужна конусная выточка в корпусе штуцера.
4. Стенка колонки должна быть достаточно прочной, чтобы выдержать давление 300- 500 атм. 5. Между торцом колонки и фильтром не должно быть мертвого объема (воздушного зазора)
Колонки: Имеют указатель направления потока, который не следует менять; Внутренняя поверхность гладкий металл, давление до 300 атм; Плавный переход от большего внутреннего диаметра к малому внешнему диаметру (под штуцер); Фильтры с диаметром пор 2-5 мкм на входе и выходе; Возможно использование предколонки меньшей длины.
Устройство термостатов:
Водонагревательные термостаты являются простым возможным решением, но они неудобны, и в настоящее время используются редко. Если по какой-либо причине колоночный термостат не используется, необходимо минимизировать температурные колебания с помощью заключения колонки в термоизолирующий материал (например, в пенопласт).
Три самых популярных конструкции колоночных термостатов: нагревательные без принудительной циркуляции воздуха; воздушные; с элементами Пельтье.
Нагревательные термостаты
В нагревательных термостатах происходит непосредственный контакт колонки с источником тепла. Тепло из нагревателя кассетного типа поступает в рифленый алюминиевый блок, который отдает его колонке, закрепленной внутри этого блока. Колонка и нагревательный блок находятся в изолированном отсеке. В другом исполнении вокруг колонки обернуто гибкое полотно нагревательной ленты. Непосредственный контакт колонки с нагревательным элементом обеспечивает эффективное нагревание
Воздушные термостаты
Воздушные термостаты используют поток нагретого воздуха для поддержания температуры колонок ВЭЖХ. Это может быть сделано с помощью циркуляции горячего воздуха внутри специального термостатирующего шкафа или камеры, в которой размещена колонка.
Термостаты с элементами Пельтье
Термостаты с элементами Пельтье основаны на термоэлектрическом эффекте Пельтье, который позволяет охлаждать или нагревать материалы в зависимости от направления электрического тока. Эти элементы состоят из полупроводниковых материалов, которые при прохождении тока создают разницу температур: одна сторона элемента охлаждается, а другая — нагревается. В большинстве конструкций термостатов с элементами Пельтье имеется устройство для предварительного нагрева, которое представляет собой отрезок капилляра, встроенного в алюминиевый нагревательный блок термостата. Часто этот отрезок капилляра вносит самый большой вклад в нагрев колонки. Если такое устройство не используется в термостате, то, скорее всего, заданная температура не будет соответствовать реальной температуре колонки. Должным образом сконструированный термостат с элементами Пельтье будет включать в себя нагревательный блок с рифленой поверхностью, на которой закреплена колонка, и устройство для предварительного нагрева, заключенное в изолированный отсек.
Система детектирования: Детектор является преобразователем концентрации анализируемого вещества, растворенного в подвижной фазе, в электрический сигнал. Для детектирования компонентов пробы может быть использовано любое физико-химическое свойство подвижной фазы (поглощение света, излучение света, электропроводность, показатель преломления и т.д.), которое изменяется при наличии в ней молекул разделяемых соединений. Подробнее по детекторам в следующем вопросе.
26. Детекторы, конструкции и выбор.
Система детектирования: Детектор является преобразователем концентрации анализируемого вещества, растворенного в подвижной фазе, в электрический сигнал.
Девять характеристик идеального ВЭЖХ-детектора:
высокая чувствительность и предсказуемый отклик;
реакция на все анализируемые вещества или напротив, предсказуемый отклик на специфические свойства элюата;
нечувствительность к перепадам температуры и изменению состава подвижной фазы;
независимость отклика от состава подвижной фазы;
не должен вносить вклад во внеколоночное уширение пиков;
должен быть надежным и удобным в эксплуатации;
отклик должен расти линейно с увеличением количества анализируемого вещества;
не должен разрушать анализируемые соединения;
должен давать качественную информацию о детектируемом пике.
В настоящее время, конечно, не существует детектора, который бы сочетал все эти характеристики. И в ближайшем будущем не предвидится. Однако у самых распространенных ВЭЖХ-детекторов есть большинство этих качеств.
Для детектирования компонентов пробы может быть использовано любое физико-химическое свойство подвижной фазы (поглощение света, излучение света, электропроводность, показатель преломления и т.д.), которое изменяется при наличии в ней молекул разделяемых соединений.
Существует четыре основных способа ВЭЖХ-детектирования:
• измерение какой-либо общей характеристики вещества и определение ее изменения в присутствии образца (дифференциальное измерение);
• измерение специфических характеристик образца;
• с помощью модификации подвижной фазы;
• «независимыми» приборами.
Наиболее распространенными детекторами в адсорбционной ВЭЖХ являются:
А) Спектрофотометрический. В процессе элюирования веществ в специально сконструированной микрокювете измеряется оптическая плотность элюата при заранее выбранной длине волны, соответствующей максимуму поглощения определяемых веществ. Такие детекторы измеряют поглощение света в ультрафиолетовой или видимой области спектра, причем первый вариант используется чаще. Это связано с тем, что большинство химических соединений имеют достаточно интенсивные полосы поглощения в диапазоне длин волн 200-360 нм.
Б) Флуоресцентный. Принцип действия флуориметрического детектора основан на измерении флуоресцентного излучения поглощенного света. Поглощение обычно проводят в УФ-области спектра, длины волн флуоресцентного излучения превышают длины волн поглощенного света. Флуориметрические детекторы обладают очень высокой чувствительностью и селективностью. Наиболее важная область их применение детектирование ароматических полициклических углеводородов.
В) Масс-спектрометрический. Данный детектор является исключительно информативным, поскольку обладает высокой чувствительностью и селективностью. Основная проблема, затрудняющая использование этого детектора, проблема ввода потока элюента в масс-спектрометр.
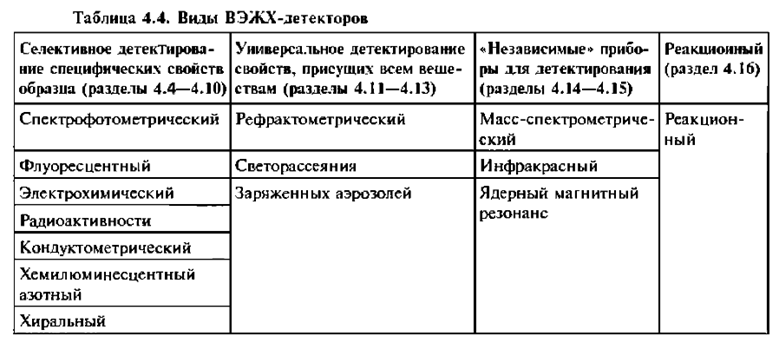
ВЭЖХ-детекторы устанавливают сразу же после колонки и таким образом сводят к минимуму размывание пика на выходе из колонки. Элюат из колонки направляется в ячейку детектора, где и происходит детектирование. В большинстве детекторов подвижная фаза остается в жидком состоянии в процессе детектирования, а элюат из ячейки детектора направляется в слив, коллектор фракций или другой детектор.
*Оптические детекторы — такие, как ультрафиолетовые и особенно рефрактометрические детекторы, обычно чувствительны к малым колебаниям температуры подвижной фазы. Эти колебания приводят к изменениям показателя преломления, а значит, меняется и количество проходящего через ячейку света. Для стабилизации температуры ячейка в корпусе детектора устанавливается там, где нет сквозняков, а иногда и в помещении с контролируемой температурой. Конструкция детектора обычно включает капиллярный теплообменник для стабилизации температуры поступающей подвижной фазы. Одно из распространенных исполнений такого теплообменника — капилляр, навитый вокруг корпуса ячейки детектора и залитый вместе с ней теплопроводящим герметикой. Детекторы, проводящие измерения в жидкости, могут быть восприимчивы к оптическим или электрическим помехам, вызванным наличием пузырьков. Чтобы предотвратить образование пузырьков в детекторе, обычно достаточно дегазировать подвижную фазу (раздел 3.3). В качестве дополнительной меры предосторожности помогает небольшое избыточное давление на выходном капилляре.
Детекторы, регистрирующие поглощение в УФ- и видимой областях спектра света
Наиболее широко используемыми детекторами в современной ВЭЖХ являются фотометры, принцип действия которых основан на поглощении ультрафиолетового (УФ) и/или видимого света (УФ/ВИД фотометр). Такие детекторы отличаются высокой чувствительностью ко многим анализируемым веществам, но эти вещества должны поглощать излучение в УФ- или в видимой областях электромагнитного спектpa (например, в диапазоне 190—600 нм). Концентрация вещества в проточной ячейке связана с долей света, прошедшего через ячейку, в соответствии с законом Бера.
Существует три конфигурации УФ-детекторов. Детекторы с фиксированной длиной волны позволяют определить поглощение при одной определенной длине волны, излучаемой лампой. В детекторах с переменной длиной волны и диодно-матричных детекторах можно выбрать одну или несколько длин волн из полного спектра света, излучаемого лампой.

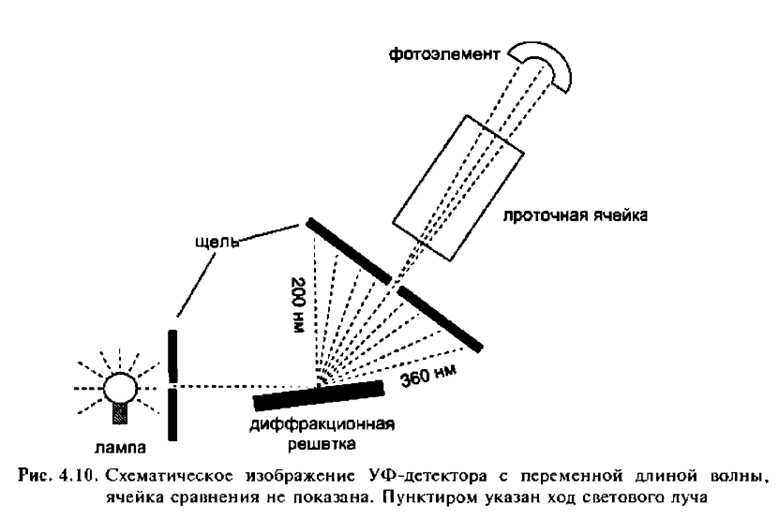

Общие характеристики Уф-детекторов
УФ-детекторы идеально подходят для анализов в градиентном режиме. В качестве подвижной фазы можно использовать большинство обычных, прозрачных в УФ-диапазоне растворителей со степенью чистоты «для ВЭЖХ». УФ-детектор очень полезен для обнаружения следовых количеств веществ, поглощающих в УФ-диапазоне. При этом его в значительной мере изменяющийся для различных веществ отклик может стать недостатком, особенно если интересующее соединение не поглощает в УФ (или видимой) области спектра.
Может иметь высокую чувствительность (для веществ, поглощающих в УФ-области)
Широкий линейный диапазон (> 105)
Может иметь ячейку небольшого объема, минимизирующую внеколоночное размывание пиков
Относительно нечувствителен к колебаниям температуры и скорости потока
Чрезвычайно надежен
Прост в обращении
Не разрушает образец
Значительно изменяющийся отклик при анализе различных веществ
Подходит для градиентного элюирования
Возможен выбор длин волн
Как правило, есть встроенная самодиагностика и калибровка
Детектируемые вещества: Соединения, поглощающие УФ или видимый свет, например, ароматические соединения, соединения с двойными связями, некоторые неорганические ионы.
Флуоресцентные детекторы
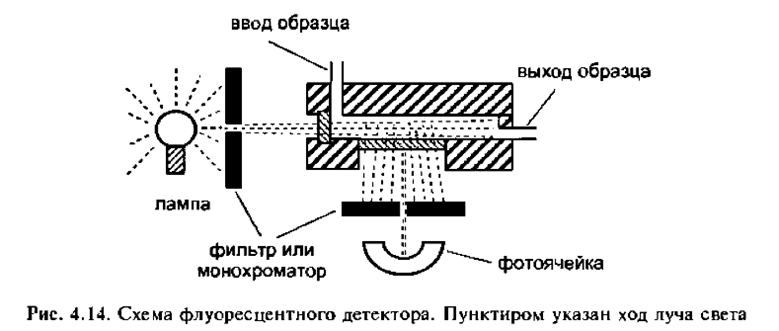
Флуоресцентные детекторы (флуориметры) очень чувствительны и селективны к тем соединениям, которые при возбуждении УФ-излучением флуоресцируют. Не флуоресцирующие компоненты образца не могут быть зарегистрированы детектором и поэтому процедура пробоподготовки может быть упрощена. Если вещества не флуоресцируют, то их можно дериватизировать таким образом, чтобы они флуоресцировали. Такой подход может быть полезен для селективного обнаружения соединений, для которых нет других чувствительных и селективных методов детектирования.
Детектируемые вещества: Флуоресцирующие соединения, например, полиароматические углеводороды, некоторые витамины, аминокислоты с флуоресцентными метками.
Обычно в этих детекторах в качестве источника света используется УФ-лампа, излучающая свет в широком диапазоне длин волн, например, дейтериевая, как в УФ-детекторах, или ксеноновая импульсная лампа. Нужную длину волны возбуждения получают с помощью фильтра или монохроматора. Свет с заданной длиной волны проходит через проточную ячейку, облучая образец и вызывая его флуоресценцию. Светофильтром или монохроматором из потока излучаемого образцом света (эмиссии) выделяют свет с необходимой длиной волны, который и направляют на фотоприемник, где световой поток измеряется и преобразуется в электрический сигнал, используемый для обработки данных. Поскольку интенсивность флуоресцентной эмиссии одинакова во всех направлениях, то регистрируют, как правило, свет, испускаемый под прямым углом к падающему свету. Такая компоновка упрощает оптическую схему детектора и снижает шум. обусловленный фоновым излучением. В недорогих флуориметрах установлены фильтры, позволяющие выбирать длины волн возбуждения и эмиссии, в то время как в самых дорогих флуоресцентных детекторах есть два монохроматора, которые обеспечивают широкий выбор длин волн как света возбуждения, так и света эмиссии. Помните, что явление флуоресценции не имеет 100% эффективности, поскольку часть энергии возбуждения теряется. Это значит, что энергия эмиссионного света всегда должна быть ниже энергии света, используемого для возбуждения молекул; следовательно, длина волны излучаемого света, обратно пропорциональная его энергии, всегда больше длины волны поглощенного света. Для многих образцов флуоресцентные детекторы в 100 раз чувствительнее УФ-детекторов. Кроме того, флуоресцентный детектор —один из самых чувствительных ВЭЖХ-детекторов.
Электрохимические (амперометрические)детекторы
Многие соединения под воздействием электрического потенциала могут окисляться или восстанавливаться. Такие вещества можно обнаружить в очень малых концентрациях с помощью селективных электрохимических (ЭХ) измерений. При таком подходе ток между поляризуемым электродом и электродом сравнения измеряется как функция приложенного напряжения. Поскольку обычно между электродами приложено постоянное напряжение, в ходе протекающей в растворе реакции меняется только сила тока, и поэтому электрохимические детекторы точнее называть амперометрическими. ЭХ-детекторы могут быть чувствительны к целому ряду соединений (таблица 4.6). ЭХ-детекторы обычно используют для определения катехоламинов и других нейромедиаторов. Многие из приведенных в таблице 4.6 соединений можно обнаружить и с помощью УФ-детекторов, но некоторые из них (например, алифатические меркаптаны, гидропероксиды) регистрируются только ЭХ-детектором. УФ-детекторы либо вообще не чувствительны к таким соединениям, либо процесс их регистрации сложен, его чувствительность низкая, и длины волн должны быть короткими.
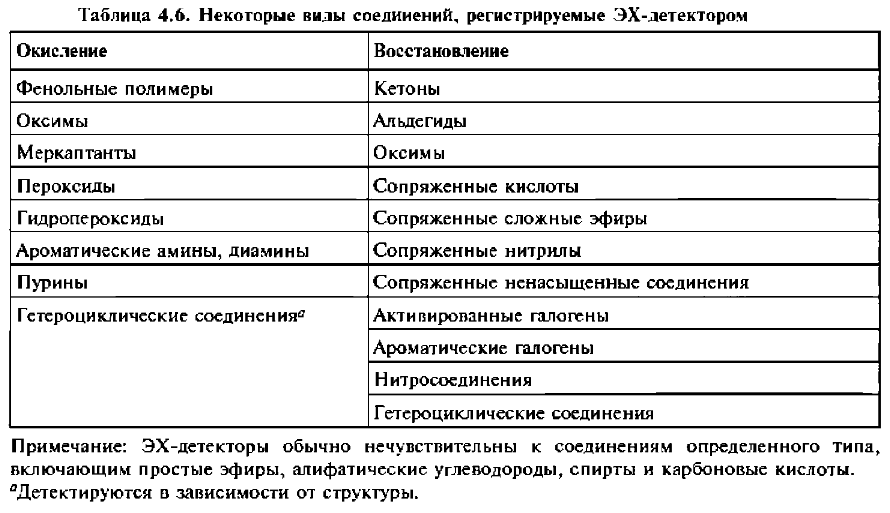
ЭХ-детекторы можно использовать только с подвижной фазой, обладающей электрической проводимостью. Это несущественное ограничение, поскольку в настоящее время большинство разделений проводят на обращенной фазе, элюируя подвижной фазой, содержащей воду или водный буфер. Точная настройка потенциала детектора позволяет увеличить чувствительность к электроактивным соединениям. ЭХ-детектор один из самых чувствительных ВЭЖХ-детекторов. Пределы обнаружения допамина, к примеру, составляют 50 фемтограмм. При этом чтобы работать в условиях высокой чувствительности, необходимо все делать чрезвычайно аккуратно, в частности, для снижения фоновых помех использовать высокочистые подвижные фазы. В некоторых методиках подвижную фазу перед тем, как она достигнет автосамплера, пропускают через ячейку с высоким потенциалом для того, чтобы восстановить или окислить содержащиеся в ней примеси и таким образом снизить фоновые помехи.
Кондуктометрические детекторы
Кондуктометри́я — совокупность электрохимических методов анализа, основанных на измерении электропроводности растворов. В кондуктометрических детекторах используют ячейки малого объема, в которых определяют изменение проводимости элюата по мере прохождения его через ячейку.Такие детекторы наиболее популярны в ионной и ионообменной хроматографии в тех случаях, когда вещества не имеют УФ-хромофоров. Лучше всего кондуктометрические детекторы использовать для обнаружения неорганических ионов (например, лития, натрия, алюминия, калия) при анализе воды, содержимого гальванических ванн, охлаждающих жидкостей электростанций и т.п. Кроме того, с помощью такого детектора удобно определять ионы органических кислот, такие как ацетаты, формиаты и цитраты. Кондуктометрическому детектированию может помешать присутствие в подвижной фазе ионов буфера. Буфер значительно повышает проводимость подвижной фазы, которая в присутствии ионов образца увеличивается лишь незначительно. Один из способов минимизировать эту проблему — использовать подходящий буфер вместе с подавительной колонкой (ионообменником) для снижения фоновой проводимости подвижной фазы.
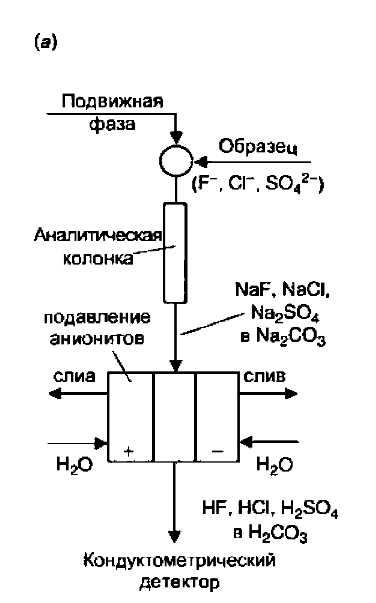
Рефрактометрические детекторы
Дифференциальные рефрактометры или детекторы показателя преломления (ДПП) реагируют на изменения показателя преломления элюата, проходящего через ячейку детектора. Рефрактометр относится к детекторам, отклик которых основан на свойствах, присущим всем веществам, и поэтому он чувствителен ко всем соединениям, показатели преломления которых существенно отличаются от показателя преломления подвижной фазы. Наиболее распространенное исполнение ДПП —рефрактометр оптического отклонения.
Свет от лампы (обычно вольфрамовой) проходит через пару клинообразных проточных ячеек. Одна из них, ячейка сравнения, обычно заполнена подвижной фазой и используется как непроточная, другая —измерительная, и в нее направляется элюат из колонки. Свет, проходя через ячейки детектора, по-разному преломляется в зависимости от состава раствора, находящегося в ячейке сравнения или проходящего через измерительную ячейку в данный момент времени. Пара фотодиодов позволяет определить изменение положения пучка света, а, следовательно, изменение показателя преломления жидкости, проходящей через проточную ячейку. Соответствующая электронная схема преобразует это изменение в выходное напряжение. В обычном рефрактометрическом детекторе установлены два фотодиода. По мере изменения показателя преломления элюата свет отклоняется так, что меняется его количество, достигающее каждого фотодиода. Совсем недавно технологию фотодиодной матрицы применили к ДПП, что позволило использовать большее число фотодиодов для детектирования света. Утверждается, что такая конфигурация позволяет расширить динамический диапазон ДПП и улучшить его чувствительность.
Детектируемые вещества: Практически любые вещества, изменяющие показатель преломления раствора.

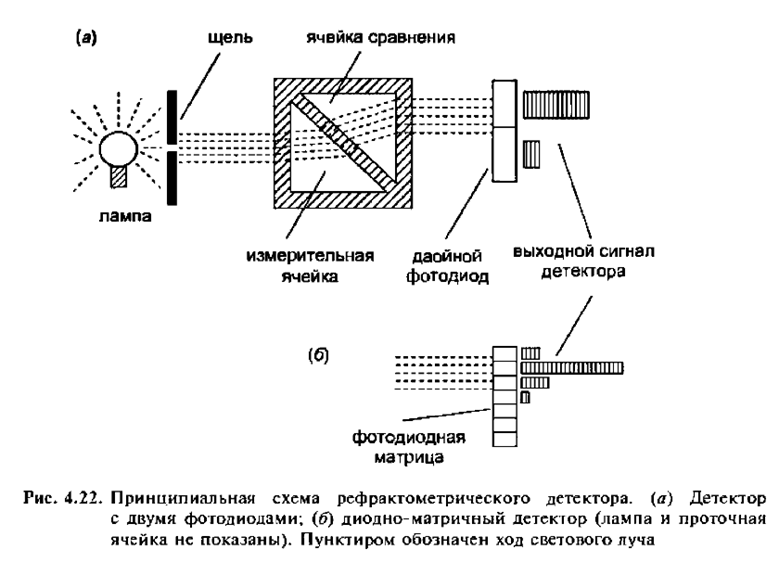
Детекторы светорассеяния
ИДС работает по следующему принципу:
Испарение подвижной фазы:
Элюент (подвижная фаза) из ВЭЖХ-колонки поступает в детектор.
Поток проходит через испарительную камеру, где подвижная фаза испаряется под действием нагрева и потока инертного газа (например, азота).
Температура испарения подбирается так, чтобы компоненты подвижной фазы испарялись, а аналиты оставались в виде аэрозольных частиц.
Формирование аэрозоля:
Оставшиеся частицы аналита образуют аэрозоль, который переносится потоком газа в область детектирования.
Рассеяние света:
Аэрозольные частицы освещаются лазером или другим источником света.
Молекулы рассеивают свет пропорционально их размеру и концентрации.
Регистрация рассеянного света:
Интенсивность рассеянного света фиксируется фотодетектором и преобразуется в электрический сигнал.
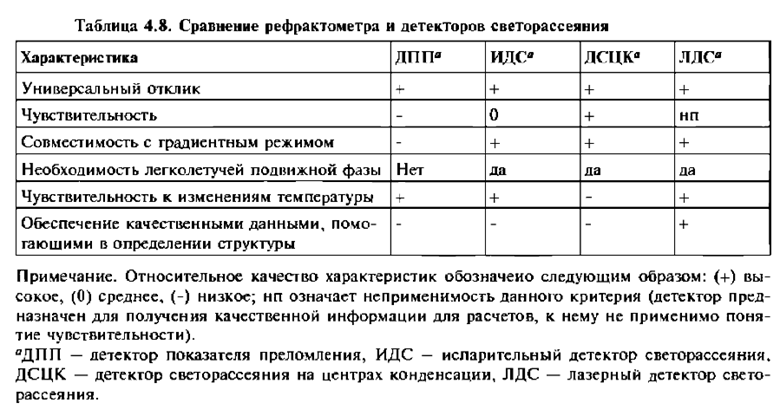
В последние годы усовершенствование детекторов светорассеяния привело к тому, что во многих методиках они вытеснили рефрактометрические детекторы. Это было, в частности, обусловлено способностью детектора светорассеяния эффективно распылять элюат и испарять подвижную фазу. (Это же обстоятельство способствовало широкому применению масс-спектрометрических детекторов). Наиболее популярным является испарительный детектор светорассеяния (ИДС). Детектор светорассеяния на центрах (ядрах) конденсации (ДСЦК) —это модификация ИДС с повышенной эффективностью. В верхнем ценовом диапазоне находится лазерный детектор светорассеяния (ЛДС), который по сравнению с ИДС и ДСЦК занял более специализированную нишу. Сравнение некоторых свойств рефрактометрических детекторов и детекторов светорассеяния представлено в таблице 4.8.
Детектируемые вещества: Нелетучие соединения, которые не поглощают УФ-излучение.
Масс-спектрометрический детектор (МС):
Амням ням, масы
Принцип действия: Измеряет отношение массы к заряду ионов, образующихся из анализируемых веществ.
Детектируемые вещества: Широкий спектр веществ, которые можно ионизировать.
Преимущества: Высокая чувствительность, селективность, возможность идентификации веществ по масс-спектрам.
27.Современные ВЭЖХ-системы.
HILIC (Хроматография гидрофильного взаимодействия)
*Жидко-жидкофазная хроматография
*Аналит распределяется между подвижной и неподвижной жидкими фазами
*Сорбенты – силикагель, полярные модифицированные силикагели.
*Сорбент и элюент - полярные
*Разделяет сильно полярные и заряженные соединения
*Порядок выхода аналитов – сначала неполярные
*Не разделяет неполярные соединения
*Элюенты, как правило, на основе ацетонитрильно-водных систем с добавками солей
Хроматография гидрофильного взаимодействия hydrophilic interaction liquid chromatography
Вариант нормально-фазовой жидкостной хроматографии.
HILIC использует гидрофильные неподвижные фазы с элюентами с обращенной фазой . Название было предложено доктором Эндрю Альпертом в его статье 1990 года по этому вопросу. Он описал хроматографический механизм для этого как жидкостно-жидкостную распределительную хроматографию, при которой аналиты элюируются в порядке возрастающей полярности
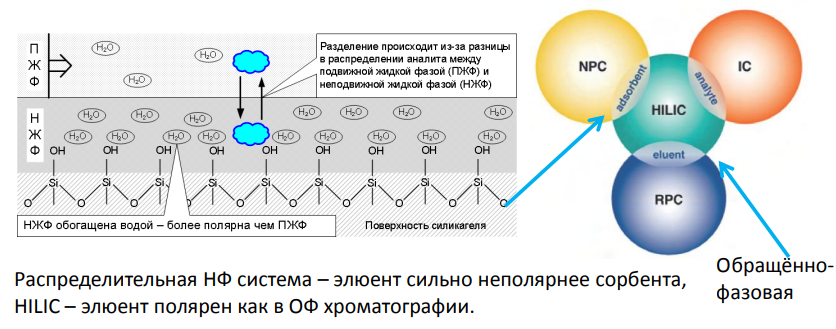
Обычно считается, что в HILIC образуется обогащённый водой слой на поверхности полярной НФ, создавая систему жидкость / жидкость. Аналит распределяется между этими двумя слоями. Однако HILIC также включает в себя взаимодействия доноров водорода между нейтральными полярными частицами, а также слабые электростатические механизмы в условиях высокого содержания органических растворителей. Более полярные соединения будут сильнее взаимодействовать со стационарным водным слоем, чем менее полярные соединения. Таким образом, происходит разделение на основе полярности соединения и степени сольватации.
Применение: Разделяет сильно полярные и заряженные соединения по суммарной полярности молекул, но может быть чувствительна и к типу, количеству и расположению полярных групп. Не разделяет неполярные и среднеполярные соединения. Менее полярные соединения выходят первыми.
Достоинства: позволяет разделять сильно полярные и заряженные соединения, которые не разделяет ОФ и НФ хроматографии
Недостатки: В общем случае более сложный для подбора условий и оптимизации метод чем ОФ хроматография.
Сорбенты
Для разделения HILIC можно использовать любую полярную хроматографическую поверхность. Даже неполярные связанные силики использовались с чрезвычайно высоким органическим составом растворителей, когда диоксид кремния, используемый для хроматографической среды, был особенно полярным. За этим исключением, фазы HILIC могут быть сгруппированы в пять категорий нейтральных полярных или ионных поверхностей: простые несвязанные кремнеземные фазы силанола или диола; амино- или анионные фазы; амидные связанные фазы; катионные связанные фазы; цвиттерионные связанные фазы
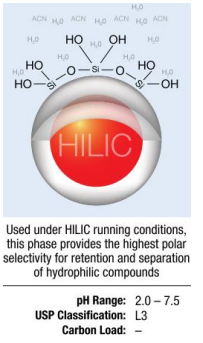
При использовании в условиях работы HILIC эта фаза обеспечивает наивысшую полярную селективность для удерживания и разделения гидрофильных соединений.
Элюенты
Типичной подвижной фазой для хроматографии HILIC является ацетонитрил с небольшим количеством воды. Тем не менее, можно использовать любой апротонный растворитель, смешиваемый с водой (например, ТГФ или диоксан). Спирты также могут использоваться, однако их концентрация должна быть выше, чтобы достичь такой же степени удержания для анализируемого вещества относительно комбинации апротонный растворитель – вода. Ионные добавки, такие как ацетат аммония и формиат аммония, обычно используются для контроля рН подвижной фазы и ионной силы. В HILIC они также могут влиять на полярность анализируемого вещества, что приводит к дифференциальным изменениям в удержании. Для чрезвычайно полярных аналитов (например, аминогликозидных антибиотиков (гентамицина) или аденозинтрифосфата) требуются более высокие концентрации буфера (около 100 мМ), чтобы гарантировать, что аналит будет находиться в одной ионной форме. В противном случае будет наблюдаться асимметричная форма пика, хроматографическое хвостообразование и/или плохое восстановление из неподвижной фазы. Для отделения нейтральных полярных аналитов (например, углеводов) буфер не требуется. Использование других солей, таких как перхлорат натрия 100-300 мМ, которые растворимы в смесях с высоким содержанием органических растворителей (около 70%-90% ацетонитрила), может быть использовано для увеличения полярности подвижной фазы для влияния на элюирование. Эти соли не являются летучими, поэтому этот метод менее полезен при использовании масс-спектрометра в качестве детектора. Обычно градиента (до увеличения количества воды) достаточно, чтобы способствовать элюированию. Все ионы в той или иной степени разделяются на неподвижную фазу, поэтому для обеспечения воспроизводимой стационарной фазы требуется периодическая «промывка» водой.
Аналиты
Значение logP аналита (коэффициент разделения октанол – вода) позволяет выбрать подходящий режим разделения. Как показано на рисунке 1, аналит с logP < 0 подходит для HILIC, в то время как logP > 0 больше подходит для обратной фазы. В области перекрытия между двумя режимами может быть использован любой из них, и решение, как правило, зависит от приложения. Как правило, если аналит элюирует перед кофеином в RPLC (logP ~0), он может лучше подходить для режима HILIC
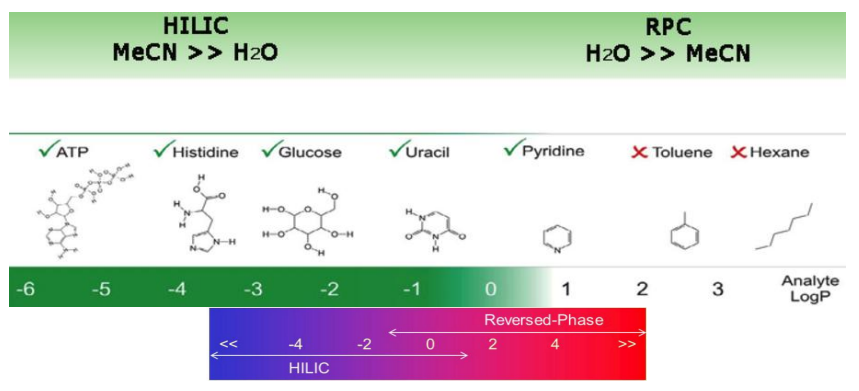
Разделение энантиомеров
Энантиомерами (оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с другими оптически активными веществами и физических свойств в хиральной среде).
Хиральность - (англ. chirality, от греч. chéir — рука), понятие в химии, характеризующее свойство объекта быть несовместимым со своим отображением в идеальном плоском зеркале. Хиральные молекулы принадлежат к точечным группам симметрии, имеющим в качестве элементов симметрии только простые поворотные оси,- это группы Сп, Dn, Т, О, I.
ЭЛЕМЕНТЫ СИММЕТРИИ, ИСКЛЮЧАЮЩИЕ ХИРАЛЬНОСТЬ: • плоскость симметрии, • центр симметрии (L) • зеркально-поворотные оси высших порядков (Sn, n>2)
СТАРШИНСТВО АТОМА = порядковый номер самый младший заместитель - удален и заслонен в каком направлении ПАДАЕТ старшинство R от латинского "rectus"правый – по часовой S от латинского "sinister"-левый – против часовой
Разделение энантиомеров методом ВЭЖХ – один из основных способов получения чистых энантиомерных форм. Он основан на различном взаимодействии энантиомеров с хиральной стационарной фазой.
Основы метода:
Разделение энантиомеров достигается за счет образования временных диастереомерных комплексов между энантиомерами анализируемого вещества и хиральным селектором, который является частью неподвижной фазы. Разная стабильность этих комплексов приводит к разной скорости миграции энантиомеров через колонку, что и позволяет их разделить.
Используемые сорбенты (хиральные стационарные фазы):
Разработки хиральной стационарной фазы Пиркле (CSP) было основано на следующем: если хиральная молекула должна иметь различное сродство к энантиомерам, она должна иметь как минимум три точки взаимодействия, по крайней мере одна из которых должна быть стереохимически зависимой. При использовании CSP Pirkle хиральное распознавание происходит в местах связывания. Основные сайты связывания классифицируются как π-основные или π-кислотные ароматические кольца, кислые сайты, основные сайты и сайты стерического взаимодействия. Ароматические кольца обладают потенциалом для взаимодействия π-π. Кислотные участки поставляют водород для потенциальных межмолекулярных водородных связей. Основные сайты, такие как π электронов, также могут образовывать водородные связи. Стерические взаимодействия также могут происходить между большими группами.
Существует несколько типов хиральных стационарных фаз:
* На основе полисахаридов: Наиболее распространенный тип. Хиральные селекторы иммобилизованы на силикагеле. Примеры: целлюлоза, амилоза, хитозан. Эти фазы обеспечивают разделение широкого спектра энантиомеров.
Спиральные полимеры типа II (полисахариды)
Модифицированные полисахариды:
Химически модифицированные полисахариды (крахмал или целлюлоза) абсорбируются на кремнеземе.
Преимущества
Разделить широкий спектр энантиомеров
Достаточно хорошая эффективность
Достаточно хорошая вместительность
Недостатки
CSP имеет низкую стабильность/долговечность
Плохая совместимость с растворителями.
Невозможно инвертировать порядок элюирования
Часто непредсказуемые свойства разрешения структуры
* На основе белков: Например, гликопротеины, альбумин. Обладают высокой селективностью, но ограниченной емкостью и стабильностью.
Белок типа V
Белковые CSP
В белковых CSP селектор белка иммобилизован на хроматографической подложке.
Преимущества
Показать широкую общность в хиральном распознавании большого ныряльщика
Сити энантиомеров
Хорошая эффективность
Недостатки
Низкая производительность - непригоден для препаративного разделения.
Плохая совместимость с растворителями.
Невозможно инвертировать порядок элюирования
* На основе циклодекстринов: Циклические олигосахариды, способные образовывать комплексы включения с энантиомерами. Примеры: α-, β-, γ-циклодекстрины.
Полость типа III
Циклодекстрины:
Циклодекстрины могут использоваться в качестве добавки к подвижной фазе или неподвижной фазы как для ГХ, так и для ЖХ. Их можно считать короткозамкнутыми молекулами крахмала.
Преимущества
Высокая емкость
Стабильный
Совместим с широким спектром растворителей
Недостатки
Ограничено соединениями, которые могут проникать в полость циклодекстрина
Небольшие изменения в структуре аналита часто приводят к непредсказуемым эффектам при разрешении.
Невозможно инвертировать порядок элюирования
Часто низкая эффективность
* На основе макроциклических антибиотиков: Например, ванкомицин, рифамицин. Высокоселективны, но дорогие.
* На основе лигандов с переходными металлами (лиганд-обменная хроматография): Хиральный селектор – комплекс переходного металла с хиральным лигандом.
Хиральная лиганд обменная хроматография
то метод разделения энантиомеров (хиральных изомеров) на основе их различной способности образовывать комплексы с хиральным селектором через координационные связи.
ХЛЭХ основана на взаимодействии между:
Хиральным селектором — хиральным соединением, добавляемым в стационарную или подвижную фазу.
Аналитом — смесью энантиомеров, которые необходимо разделить.
Разделение происходит благодаря тому, что энантиомеры образуют комплексы с хиральным селектором с различной степенью стабильности, что приводит к их разному времени удерживания на колонке.
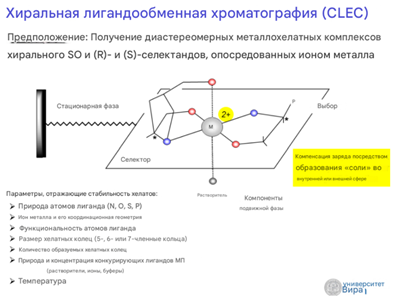
Используемые элюенты (подвижные фазы):
Выбор элюента зависит от типа хиральной стационарной фазы и природы анализируемых веществ. Часто используются:
* Нормальная фаза: гексан, гептан, изопропанол, этанол, дихлорметан с добавлением небольшого количества спирта или амина.
* Обращенная фаза: вода, метанол, ацетонитрил, буферные растворы.
* Сверхкритическая флюидная хроматография: сверхкритический диоксид углерода с добавлением модификаторов (метанол, этанол).
Аналиты:
Методом ВЭЖХ можно разделять широкий спектр хиральных соединений, включая:
* Лекарственные препараты
* Аминокислоты
* Пестициды
* Углеводы
* Природные соединения
Достоинства метода:
* Высокая эффективность разделения: Позволяет разделять даже близкородственные энантиомеры.
* Широкая применимость: Подходит для различных классов хиральных соединений.
* Возможность масштабирования: Может быть использован как для аналитических, так и для препаративных целей.
* Автоматизация: ВЭЖХ системы легко автоматизируются.
Недостатки метода:
* Стоимость хиральных колонок: Хиральные колонки обычно дороже, чем ахиральные.
* Ограниченная стабильность некоторых хиральных фаз: Некоторые хиральные фазы, например, на основе белков, могут быть менее стабильны, чем ахиральные.
* Подбор условий разделения: Выбор подходящей хиральной стационарной фазы и элюента может потребовать оптимизации.
* Необходимость наличия хирального стандарта для идентификации энантиомеров.
28.Адсорбционная и распределительная хроматография.
Адсорбционная хроматография
Жидко-твердофазная хроматография
Аналит адсорбируется на поверхности сорбента
Взаимодействие слабое – силы Ван-дер-Ваальса, водородные связи, π- π взаимодействия
Сорбенты – силикагель, окись алюминия, силикат магния, модифицированные силикагели, полиамид, целлюлоза и т.д.
Порядок выхода аналитов – сначала неполярные
Сорбент всегда полярнее чем элюент
Разделяет низко- и среднеполярные вещества без заряда
Не разделяет неполярные (например алканы)
С этого вида хроматографии все и начиналось. Были изучены разнообразные полярные органические и неорганические соединения. В результате из неорганики в жидкостной хроматографии (низкого давления) остался силикагель, окись алюминия и флоризил (Florisil – силикат магния). В ВЭЖХ –остался, по сути, только силикагель. При этом адсорбционная хроматография на не модифицированном силикагеле почти не применяется – плохо воспроизводится, могут быть «хвосты» и т.д.
Классический сорбент - СИЛИКАГЕЛЬ
Полярный адсорбент, применяется в режиме НФ ВЭЖХ для разделения веществ низкой и средней полярности
• Достоинства
– хороший химизм поверхности
– хорошая сорбция, можно модифицировать
– сильно пористый, большая удельная поверхность
– технологичность - легко получить нужного размера, формы, пористости и относительно дёшево
– механическая стойкость
• Недостатки:
– влияние на структуру поверхности следов воды в элюенте
– силанольные группы проявляют кислотные свойства => сложно разделять основные соединения – большой разброс сорбционной силы силанольных групп (сильно зависит от чистоты силикагеля, особенно от содержания металлов)
– небольшой диапазон устойчивости pH 2 – 7
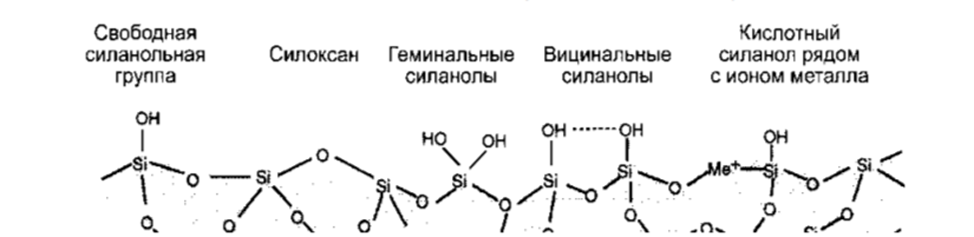
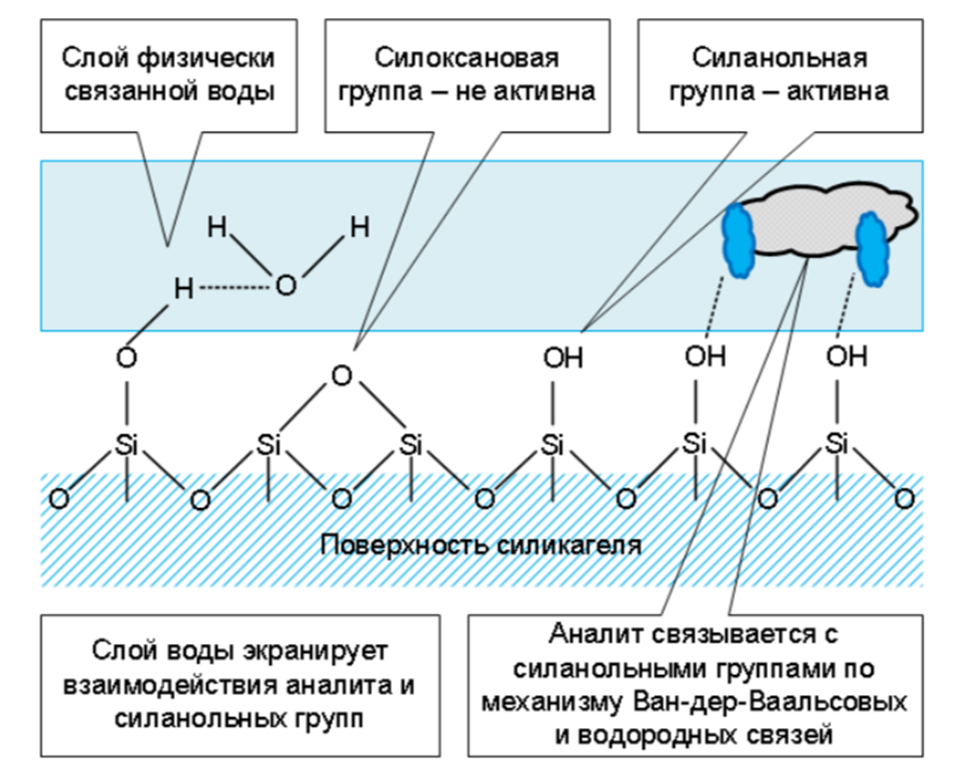
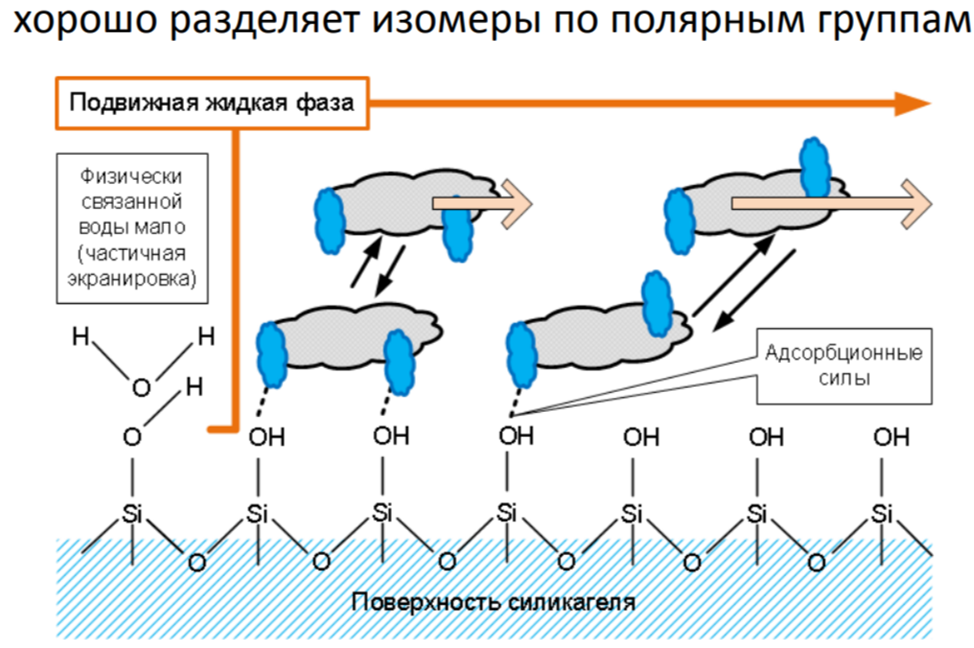
Адсорбционная хроматография на силикагеле
Разделяет низко- и среднеполярные соединения по типу, количеству и расположению полярных групп. Сорбент – полярный, элюенты – низко- и среднеполярные. Взаимодействие сорбат-сорбент происходят на поверхности.
Достоинства:
· Чувствительность к пространственному строению молекулы
· Большое разнообразие растворителей в качестве элюентов
· Относительная дешевизна
Недостатки:
· Плохая воспроизводимость (влияние воды)
· Трудности с разделением оснований (кислые силанольные группы)
· Влияние разброса адсорбционных свойств силанольных групп на форму пиков и их удерживание
· Малая ёмкость сорбента (в основном важно для препаративной ВЭЖХ)
· Затруднена работа в градиентных режимах (долгое уравновешивание)
Распределительная хроматография
Жидко-жидкофазная хроматография
Аналит распределяется между подвижной и неподвижной жидкими фазами
Сорбенты – вода на поверхности силикагеля, окиси алюминия, силиката магния, модифицированные силикагели, полиамиды, целлюлоза и т.д.
Сорбент всегда полярнее чем элюент
Разделяет полярные соединения
Порядок выхода аналитов – сначала неполярные
Не разделяет неполярные соединения
В классическом варианте – тройные системы типа
H2O – iPrOH – гексан
H2O – MeOH – CHCl3
Раньше в ВЭЖХ пробовали распределительную хроматографию на силикагеле но теперь практически не используют этот классический вариант.
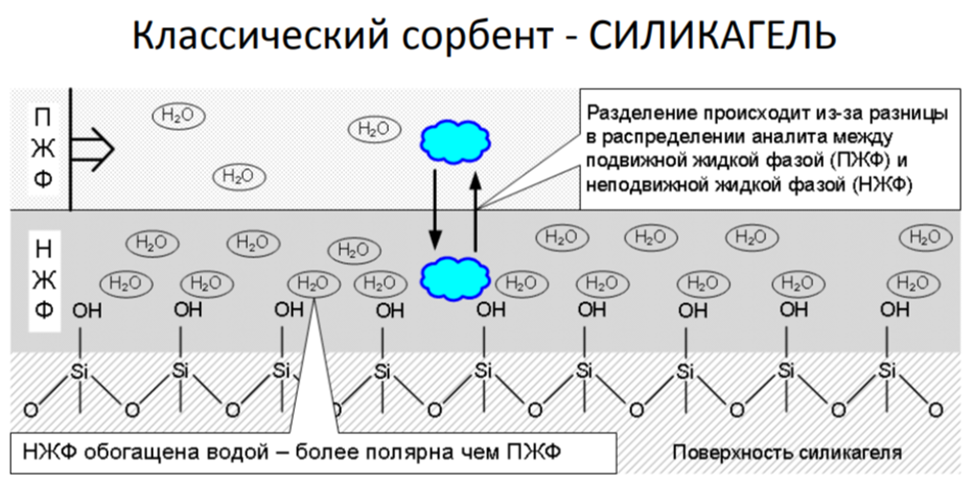
Распределительная хроматография на силикагеле
Разделяет полярные соединения по суммарной полярности молекул (коэффициент распределения) Сорбент – полярный, элюенты – среднеполярные двойные и тройные системы (например CHCl3 – MeOH – H2O и гептан – iPrOH – H2O) Взаимодействие происходят в объеме (абсорбция).
Достоинства:
• Возможность разделять сильнополярные и/или заряженные вещества
• Большая емкость сорбента
• Относительная дешевизна
Недостатки:
• Очень плохая воспроизводимость
• В варианте ВЭЖХ вызывает проблемы с детектированием – унос неподвижной жидкой фазы повышает шум детектора
Адсорбционная и распределительная хроматография
В начале развития хроматографии, при работе на открытых колонках было исследовано множество сорбентов. Оксиды, гидроксиды, нерастворимые соли, полярные био- и обычные полимеры. Из них в настоящее время на открытых колонках применяют силикагель и окись алюминия (есть еще полиамид и силикат магния – флоризил (Florisil – силикат магния). В ВЭЖХ – остался только силикагель.
Окись алюминия как сорбент хуже
• Сложнее сделать сорбент физически – пористость, размер, форма частицы и распределение размеров.
• Это кислота Льюиса – каталитическая активность поверхности
• Но есть и плюс – может быть кислой, нейтральной и основной
29.Эксклюзионная хроматография. Принципы метода и применение в БТ.
Эксклюзионная хроматография – жидко-жидкофазная хроматография
Механизм: разделение по размерам
Сорбенты: твердые пористые полимеры, модифицированные силикагели, стекла.
Элюенты – любые растворители.
Сорбент не должен взаимодействовать с веществом.
Заканчивается там, где начинаются другие виды хроматографии.
Низкая пиковая емкость.
Желательно увеличение длины колонок.
Фактор удерживания К (коэффициент ёмкости), селективность не зависят от температуры.
Эксклюзионная хроматография SE-HPLC, SEC (Size Exclusion Chromatography).
Принципиальной особенностью метода является возможность разделения молекул по их размеру в растворе в диапазоне практически любых молекулярных масс - от 102 до 108, что делает его незаменимым для исследования синтетических и биополимеров. По традиции процесс, проводимый в органических растворителях, все еще часто называют гель-проникающей, а в водных системах - гельфильтрационной хроматографией. Принят единый термин, который происходит от английского «Size Exclusion» - исключение по размеру - и в наиболее полной степени отражает механизм процесса.
· Жидко-жидкофазная хроматография
· Механизмы: разделение по размеру
· Сорбенты: силикагель с диольными группами, стекла, жесткие гели, мягкие гели
· Сорбент должен обеспечивать отсутствие неспецифической сорбции (особенно для белков!)
· Порядок выхода аналитов – сначала большие
· Разделяет молекулы по размерам и форме (стоксов радиус)
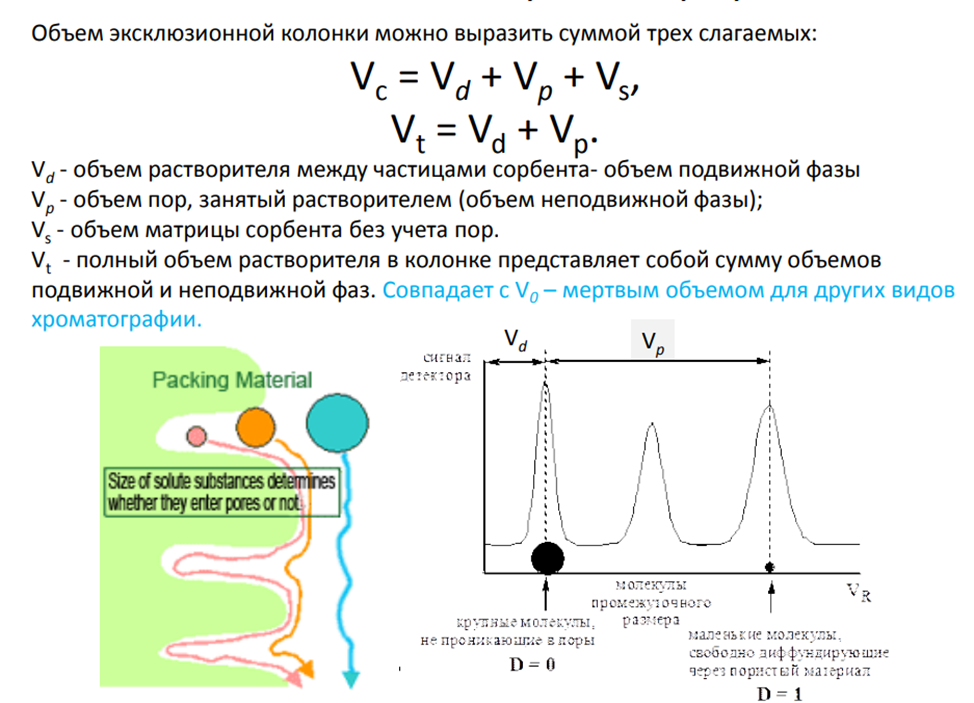
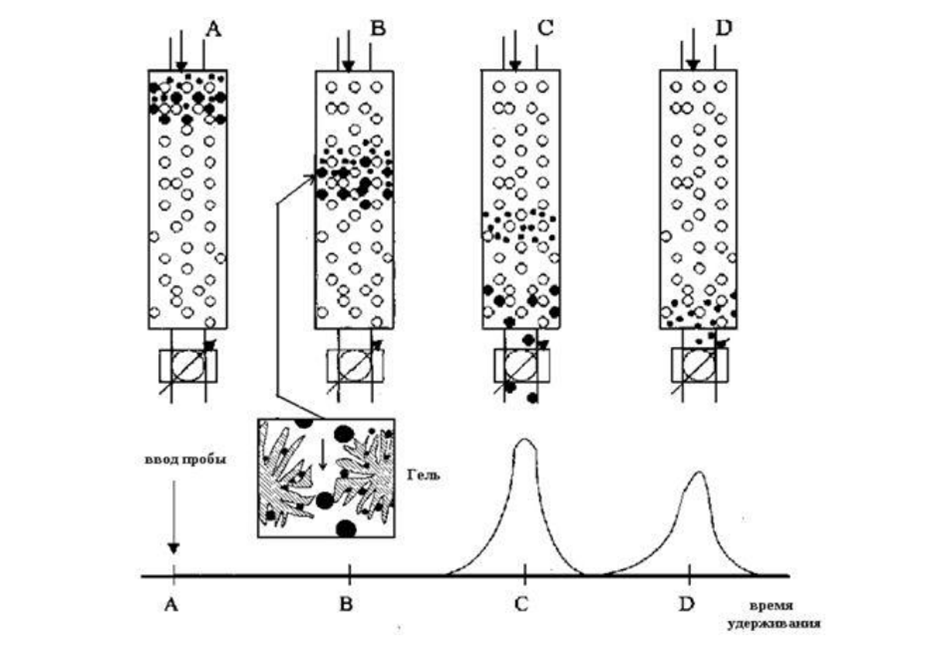
Если какое-либо вещество элюируется с удерживаемым объемом больше Vt , то это указывает на проявление других механизмов разделения (чаще всего адсорбционного). Адсорбционные эффекты обычно проявляются на жестких сорбентах, но иногда наблюдаются и на полужестких гелях, видимо, из-за повышенного сродства к матрице геля. Примером может служить адсорбция ароматических соединений на стиролдивинилбензольных гелях. В общем случае в эксклюзионной хроматографии стремятся полностью подавить адсорбционные и другие побочные эффекты, так как они, особенно при исследовании молекулярно-массового распределения (ММР) полимеров, могут существенно исказить результаты анализа. В эксклюзионной хроматографии полимеров предъявляются наиболее жесткие требования к стабильности потока подвижной фазы. Точность результатов в эксклюзионной хроматографии полимеров заметно зависит от температуры. При ее изменении на 10°С ошибка определения средних молекулярных масс превышает ±10%. Поэтому в данном варианте ВЭЖХ обязательно термостатирование разделительной системы. Как правило, достаточна точность поддержания температуры ±1°С в пределах до 80-100°С. В некоторых случаях, например, при анализе полиэтилена и полипропилена, рабочая температура составляет 135-150°С. Наиболее распространенным детектором в эксклюзионной хроматографии полимеров является дифференциальный рефрактометр.
Элюенты для SEC
Требования к элюентам – они должны
1. полностью растворять образец при температуре разделения;
2. смачивать поверхность сорбента и не ухудшать эффективность колонки;
3. предотвращать адсорбцию (и другие взаимодействия) разделяемых веществ с поверхностью сорбента;
4. обеспечивать максимально высокую чувствительность детектирования;
5. иметь низкую вязкость и токсичность.
Кроме того, при анализе полимеров имеет существенное значение термодинамическое качество растворителя: весьма желательно, чтобы он был "хорошим" по отношению к разделяемому полимеру и матрице геля, т.е. были максимально выражены концентрационные эффекты. Растворимость образца обычно является главным лимитирующим фактором, ограничивающим ассортимент пригодных подвижных фаз. Наилучшим органическим растворителем для эксклюзионной хроматографии синтетических полимеров по комплексу свойств является ТГФ (тетрагидрофуран).
Сорбенты для SEC
Для разделения макромолекул в режиме эксклюзионная хроматография используют колонки двух типов: работающие в узком = 102 и широком ( = 104 — 105 диапазонах.
Колонки широкого диапазона M имеют широкое распределение пор сорбента по размерам (бимодальное, тримодальное). Это распределение подбирается т. обр., чтобы при заданных степени линейности калибровочной мол.-массовой зависимости и диапазона масс обеспечивалась наиб. степень селективности С2. Можно также составлять колонки для широкого диапазона М из колонок первого типа.

30. Ионообменная хроматография. Принципы метода и применение в БТ.
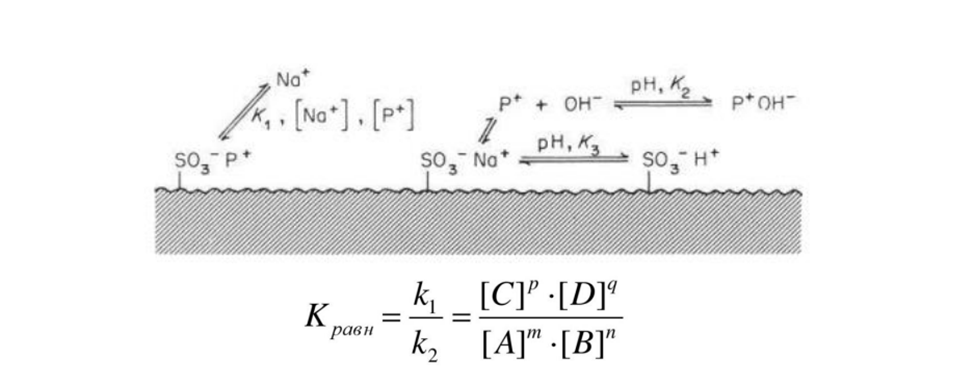
Ионообменная хроматография (ИОХ) представляет собой метод, позволяющий разделять ионы и полярные молекулы на основе их заряда. Она может быть использована для разделения практически любых заряженных молекул, в том числе крупных белков, небольших нуклеотидов и аминокислот. Взаимодействие образца и сорбента основано на обратимом кулоновском взаимодействии. Сорбент имеет на поверхности ионные функциональные группы, которые взаимодействуют с ионами аналита противоположного заряда.
· Жидко-твердофазная хроматография
· Механизмы: кулоновские взаимодействия
· Сорбенты: полимерные катионо и анионообменники, силикагели с кислотными и основными группами
· Разделяет заряженные соединения, растворимые в воде (или водно-органических смесях) по количеству и виду ионогенных групп
· Использует водные буферные растворы
· Часто требует градиентных режимов
· Ионная хроматография – частный случай для малых ионов, отличается аппаратурным оформлением
Принцип ионообменной хроматографии

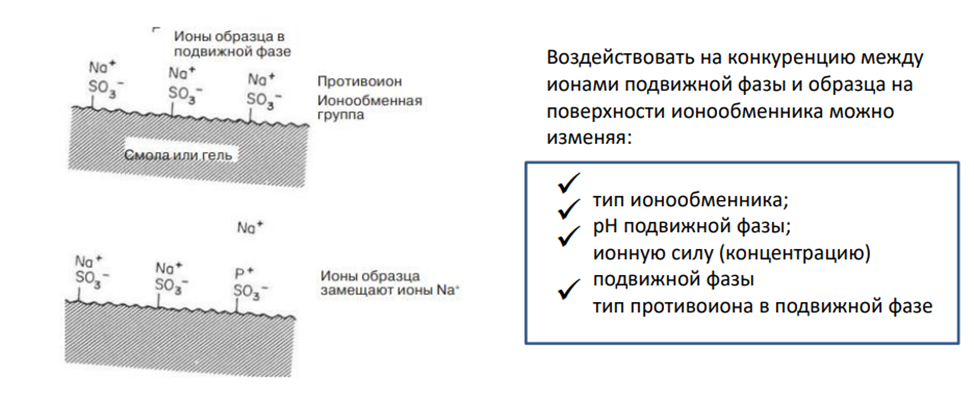
Этапы хроматографирования

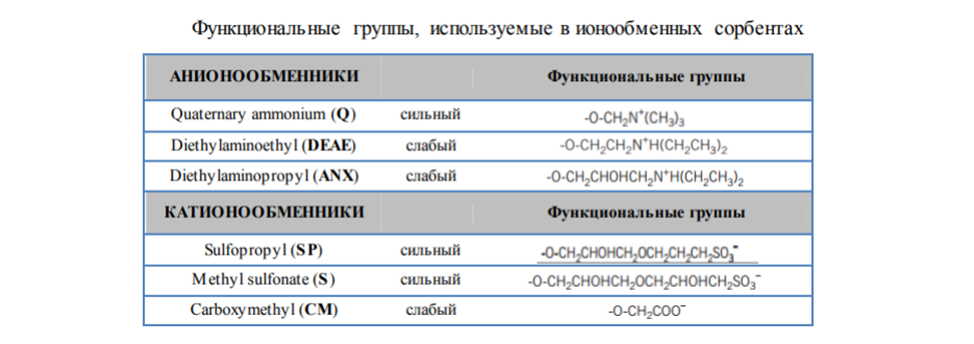
Ионообменники, используемые в ИОХ

Функциональные группы в ионообменных сорбентах
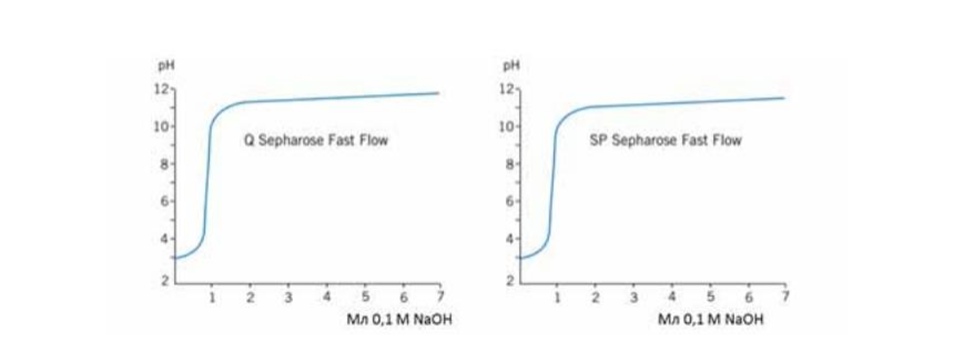
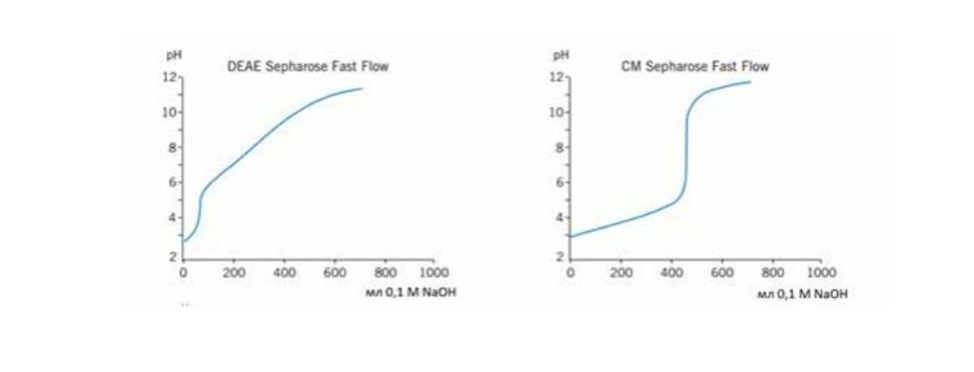
Влияние подвижной фазы
Практическое применение
31. Обращенно-фазовая хроматография. Принципы метода и применение в БТ.
· Жидко-твердофазная хроматография
· Механизмы: гидрофобные взаимодействия, адсорбция и распределение
· Сорбенты:
силикагель с алкильными группами (С2, С4, С8, С18...),
силикагель с другими гидрофобными группами,
силикагель с нитрильными группами
· Сорбент всегда менее полярен чем элюент
· Порядок выхода аналитов – сначала полярные
· Разделяет почти все классы соединений, кроме очень полярных (углеводы)
· Хуже чем НФ (нормально-фазовая хроматография) разделяет изомеры
RP-HPLC (Reversed Phase)
ОФХ использует полярную (водную) подвижную фазу. В результате, гидрофобные молекулы в полярной мобильной фазе адсорбируются на гидрофобной неподвижной фазе, а гидрофильные молекулы будут проходить через колонку и элюироваться в первую очередь. Гидрофобные молекулы могут быть элюированы с колонки при уменьшении полярности подвижной фазы за счет увеличения концентрации менее полярных растворителей, которые снижают гидрофобные взаимодействия. Чем более молекула гидрофобна, тем сильнее она свяжется с неподвижной фазой и тем выше концентрация органического растворителя, которая потребуется для элюирования этой молекулы.
Гидрофобные взаимодействия
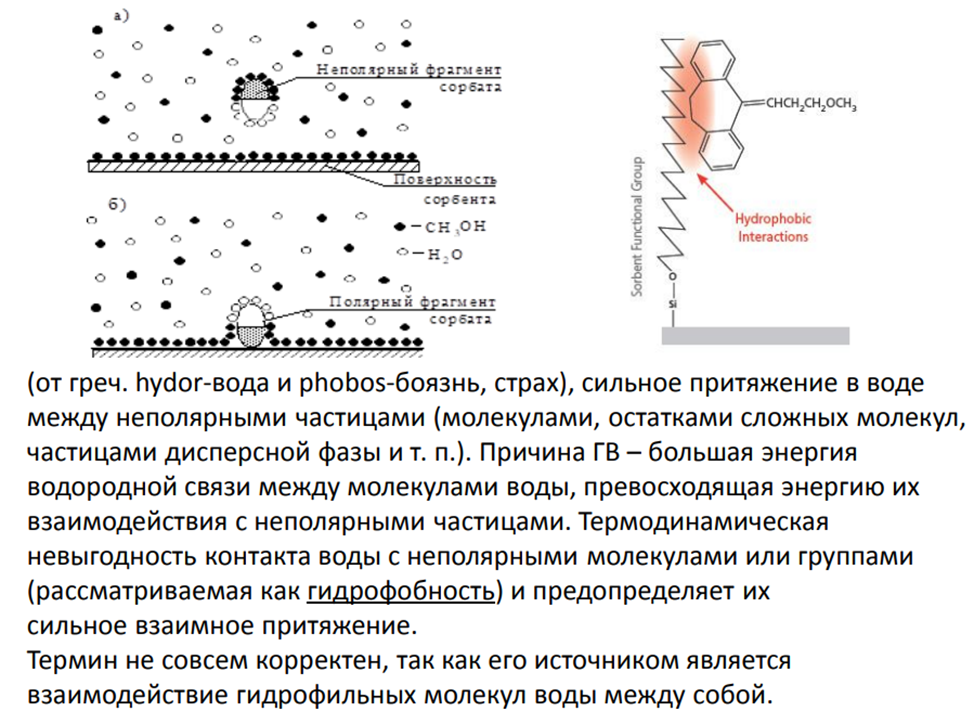
Обращённо-фазовая хроматография разделяет соединения по виду, количеству и расположению гидрофобных участков и/или суммарной полярности молекул Сорбент – гидрофобный, элюенты – вода + органический компонент. Взаимодействие сорбат-сорбент происходят как на поверхности, так и в объёме гидрофобного покрытия.
Достоинства:
o Широкий диапазон разделяемых соединений – от углеводородов до кислот и многоатомных спиртов
o Подавляющее большинство разделений можно проводить используя смеси воды с ацетонитрилом, метанолом и тетрагидрофураном
o Возможность выбрать специфический сорбент (-OH, -CN, -NH2 , etc)
Недостатки:
o Стоимость модифицированных сорбентов – не важна для ВЭЖХ
o Сложности с разделением заряженных и сильно гидрофобных соединений – преодолимы
o Не может разделять сахара – у них углеводородный неполярный скелет экранирован гидроксилами.
Основные растворители для ОФ ВЭЖХ
Ацетонитрил – основание
Метанол – кислота
Тетрагидрофуран – диполь
Вода – изменение полярности ПФ
Низкая вязкость
Высокая степень чистоты
Прозрачность в УФ-области спектра
Образование истинных растворов при смешении.
Особая радость – разделение практически всего диапазона полярностей (от углеводородов до многоатомных спиртов) достигается с использованием ограниченного количества растворителей и воды!
Базовые растворители
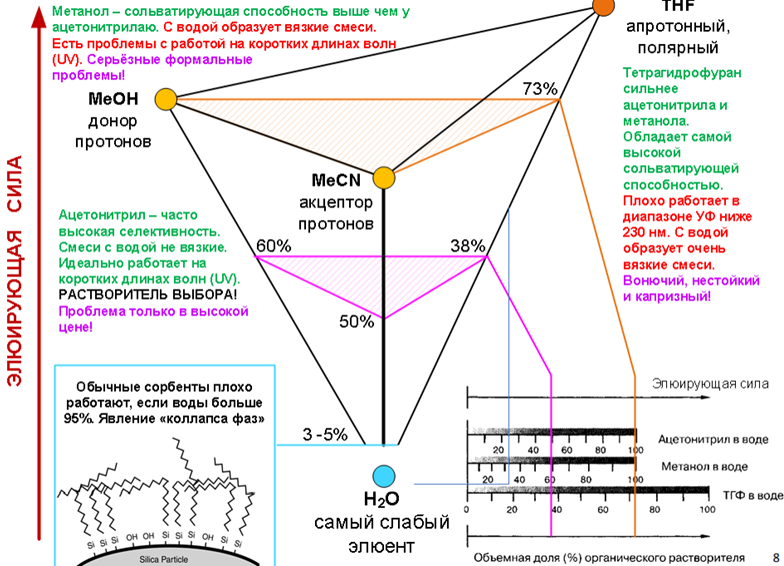
Базовые растворители для сильно неполярных аналитов
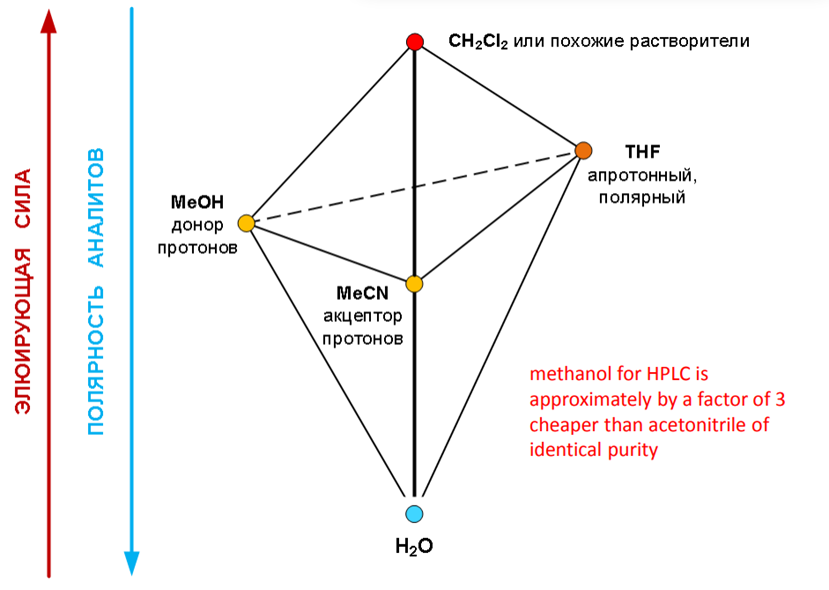
Растворители по Снайдеру
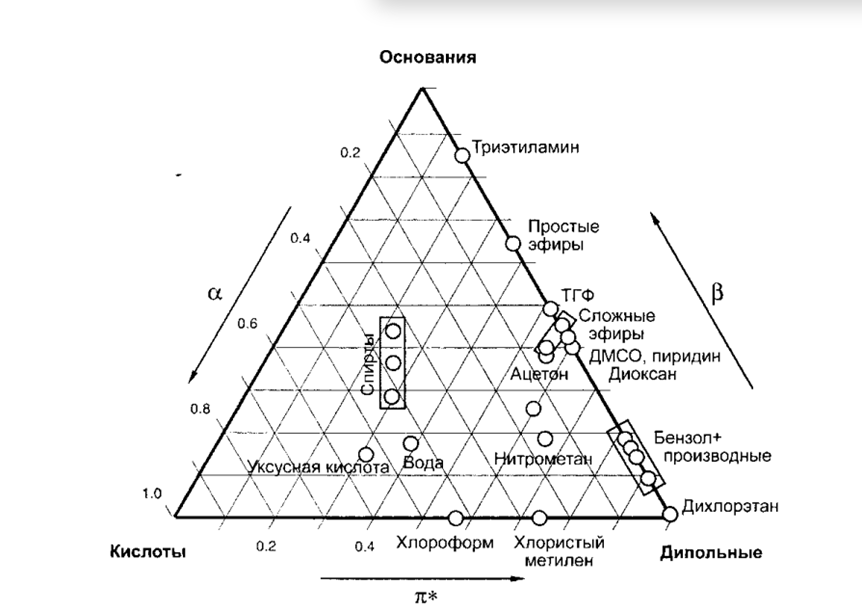
Изоэлюотропные составы
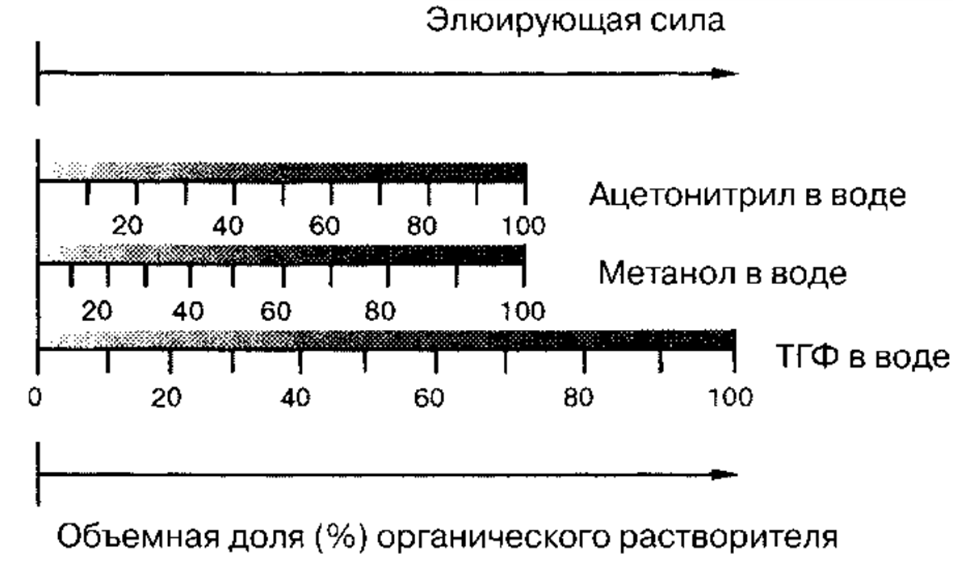
Влияние состава элюента на удерживание в ОФ ВЭЖХ
если механизм - чистая «обращёнка» то, как правило, имеется полулогарифмическая зависимость коэффициента ёмкости от объёмной концентрации органического компонента.

Выбор элюента
Если полярности аналитов не очень отличаются и нет зарядов, то работаем в изократическом режиме иначе переходим на градиент 0.
Проводим литературный поиск (включая каталоги) и выбираем сорбент и систему. Если нет, работаем по аналогиям, иначе только эксперимент. Берем самую доступную колонку и алгоритм:
1. Начинаем работу на ацетонитриле. Не вышло => 2.
2. Переходим на метанол (вязкость!)
3. Ацетонитрил с другим(и) сорбентами
4. Метанол с другими сорбентами
5. Пробуем тройные смеси
6. Пробуем ТГФ...
Учитываем:
1. Стоимости растворителей (ацетонитрил дороже раза в три)
2. Ацетонитрил позволяет работать на более низких давлениях
3. Не хроматографические проблемы с MeOH (журналы и прочее...)
4. ТГФ вонюч, вязок с водой, капризен...
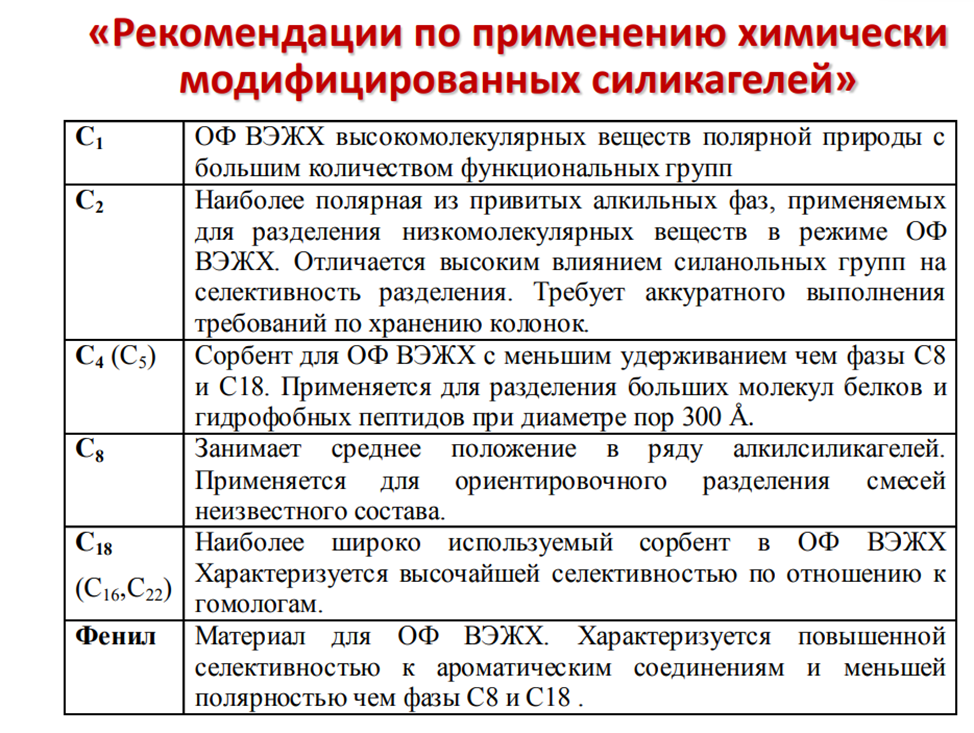
Сорбенты для ОФ ВЭЖХ
Матрица - пористость, удельная поверхность •
· Силикагель •
· силикагель с вставками органики •
· полимеры •
· экзотика – оксид циркония, углерод etc. •
Функциональная группа •
C2, C4, C8, C18, C20 etc. – линейные
•фенильная и т.п.
• полифункциональные •
Способ прививки и последующей обработки (эндкепирован сорбент или нет)
Сорбенты с химически привитыми фазами на основе силикагеля появились позже сорбентов, на которые неподвижная фаза (в виде индивидуальных веществ или, чаще, полимеров различной структуры и полярности) наносилась физически. Силанольные группы, находящиеся в большом количестве на поверхности силикагеля (особенно полностью гидроксилированного), обладают слабокислыми свойствами и довольно легко вступают в многочисленные реакции. Первые из полученных таким путем привитофазных сорбентов, названных «щеточные» (привитые молекулы, как щетина в щетке, покрывали поверхность силикагеля), изготовляли этерификацией силанолов спиртами с образованием простой эфирной связи Si – O – C. Однако обратимость реакции, особенно в кислой и щелочной средах и в присутствии водных подвижных фаз, в большой мере ограничивала как срок работы таких сорбентов, так и области их применения. Позднее были разработаны методы получения привитых фаз разного типа с использованием гораздо более прочных и устойчивых к гидролизу связей Si – О – Si и Sj – С. Практически все имеющиеся в продаже привитофазные сорбенты относятся к этому типу.
Полимерный сорбент для ОФ
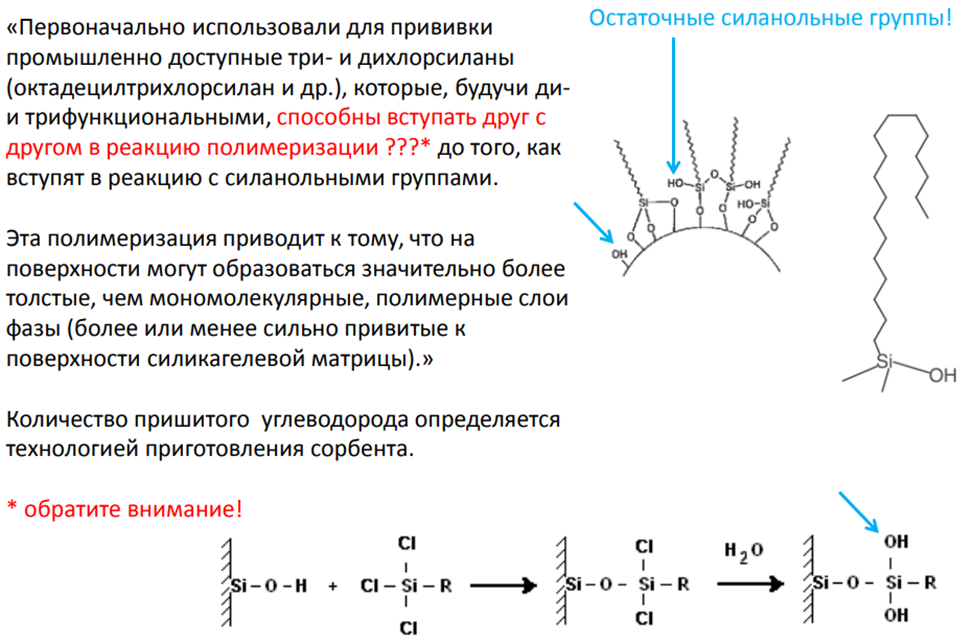
Мономерный (щёточный) сорбент для ОФ
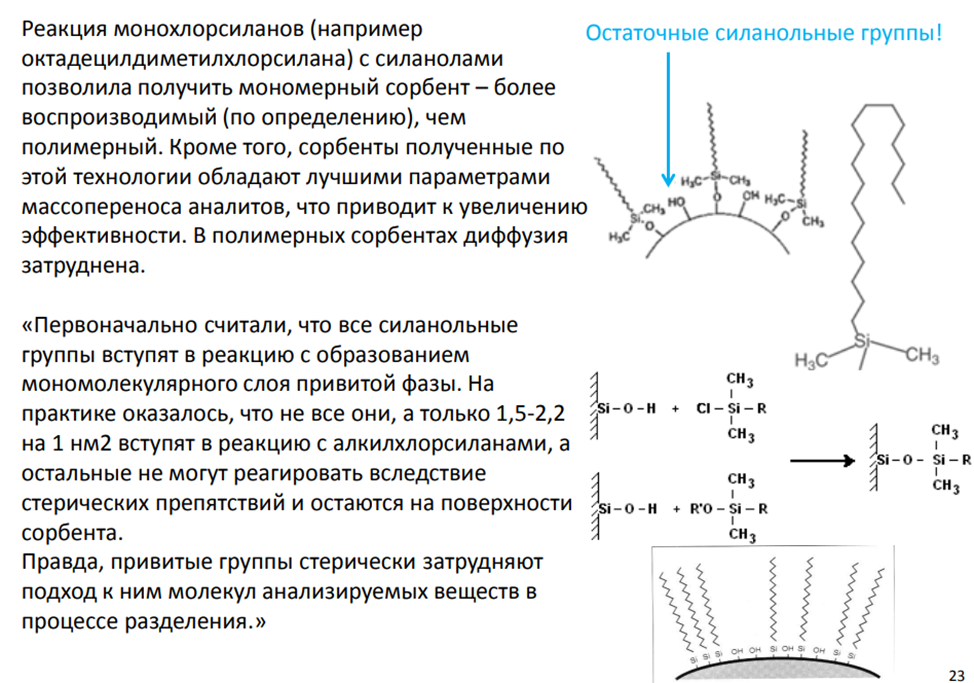
Остаточные силанольные группы

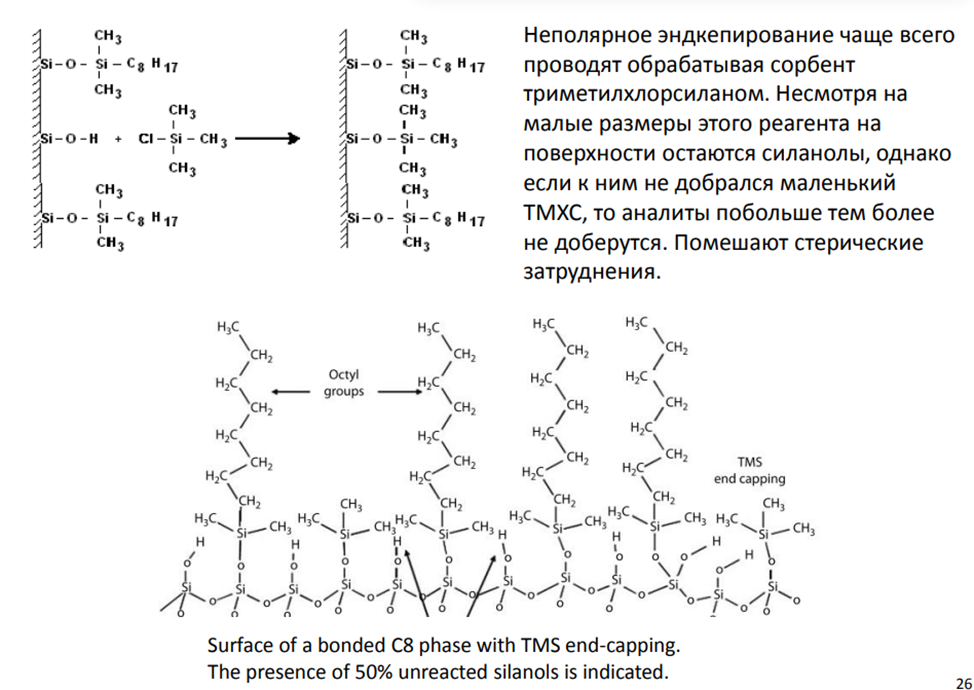
Эндкэпинг силанольных групп
Разнообразие сорбентов для ОФ
v Неполярная группа (С4, С8, С18, фенил – стандартный набор) и т.д.
v Матрица – силикагель, полимеры и т.д.
§ Силикагельная матрица – отличия по размерам, форме, пористости
§ Разница в степени покрытия (количество углерода на силикагеле)
· Полимерный сорбент
С остаточными силанолами
Эндкепирован гидрофобно (ТМС группы)
Эндкепирован гидрофильно
· Мономерный (щёточный) сорбент
С остаточными силанолами
Эндкепирован гидрофобно (ТМС группы)
Эндкепирован гидрофильно
Таким образом, сказать «сорбент С18» – это не сказать ничего... без указания конкретного производителя и марки! НЕТ «ЛУЧШЕГО» СОРБЕНТА – важен контекст!
Стерически защищённые фазы
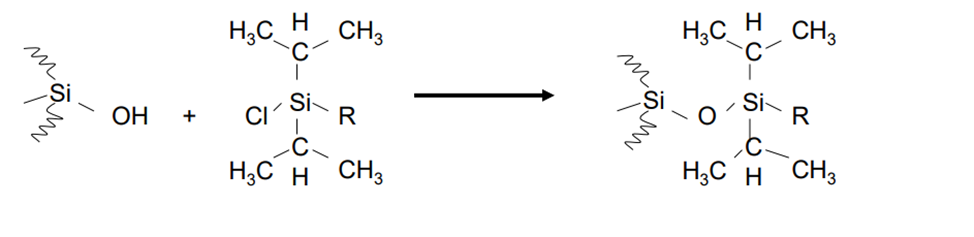
Цель – увеличение гидролитической стабильности, работа с кислыми элюентами >25 000 объемов колонки при рН 0,9 и 90 ºС.
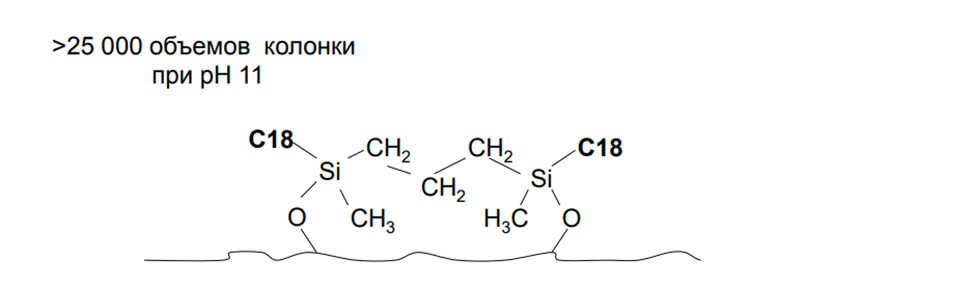
Бидентантные фазы
Цель – увеличение гидролитической стабильности, как в области кислых, так и щелочных рН
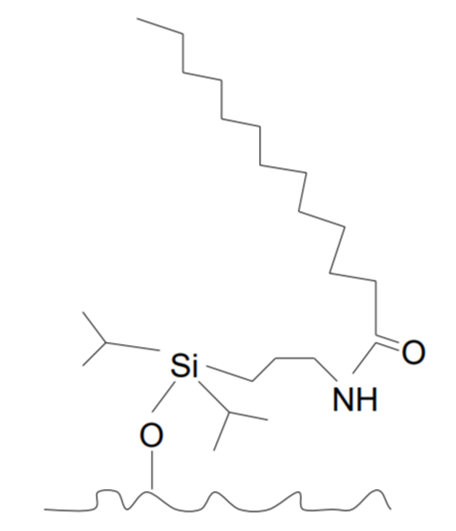
С полярной вставкой (амид, карбамат, сульфамид, мочевина)/с полярным эндкепингом
Цель – улучшение удерживания полярных соединений, увеличение смачивания фазы и возможность работы с элюентами, содержащими менее 5% органического модификатора
Закономерности удерживания веществ в ОФ ВЭЖХ
• Удерживание возрастает с появлением неполярных заместителей (CH3 , CH2 , Cl, Br, I)
• Удерживание уменьшается с появлением полярных заместителей (CN, NO2 )
• Еще более удерживание снижается с появлением функциональных групп, способных к образованию водородных связей (СООН, ОН)
• Значительное снижение удерживания происходит с появлением заряженных групп (SO3 - , NH3 +)
• Разветвленные изомеры удерживаются слабее, чем изомеры нормального строения
С увеличением метиленовых звеньев в ряду гомологов возрастает удерживание
В общем случае с уменьшением полярности соединения увеличивается его удерживание
Влияние длины алкильного радикала на удерживание неполярных соединений
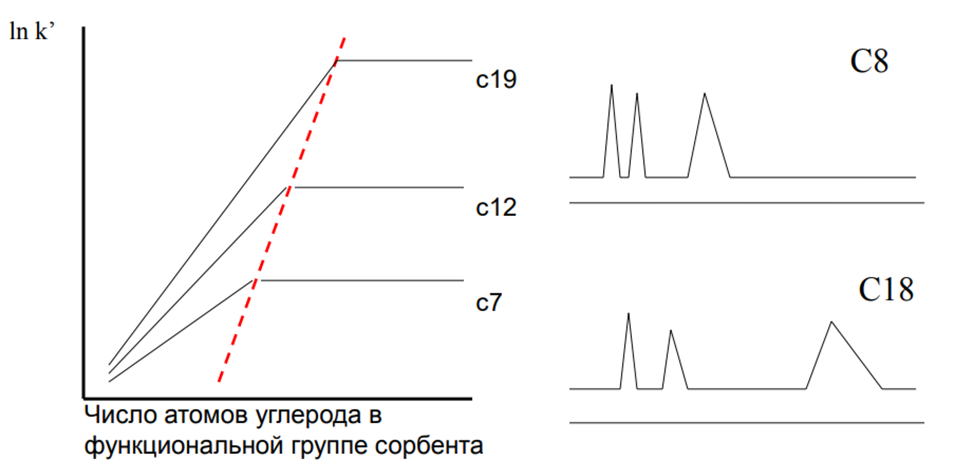
При увеличении углеводородной цепи сорбента удерживание в-ва сначала увеличивается, а затем выходит на плато. В ряду гомологов селективность удерживания возрастает с увеличением функциональной группы. Кроме того, чем более гидрофобен гомолог, тем позже наблюдается момент выхода удерживания на плато.
Влияние полярности колонки на удерживание при одновременном разделении полярных и неполярных компонентов
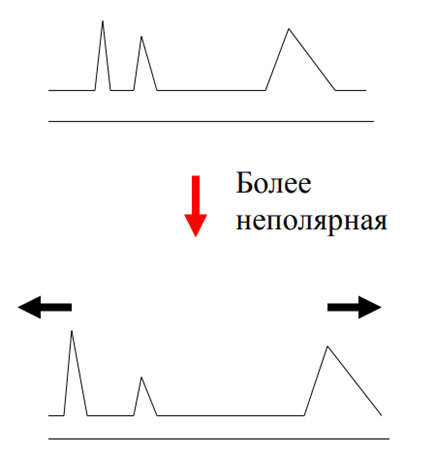
Применение в бт.

32. Аффинная хроматография. Принципы метода и применение в БТ.
Аффинная хроматография
Задача: выделить белок (пептид) с низким содержанием в смеси (клеточный экстракт, биологические жидкости)
Принцип: биоспецифическое связывание (сродство) лиганда и белка
Носитель: инертный пористый материал (агароза, полиакриламид, кросс-сшитый декстран, стеклянные шарики), к которому ковалентно через спейсер присоединен лиганд.
Лиганд (моноспецифический): гормоны (рецепторы), ингибиторы ферментов или аналоги ферментных субстратов (ферменты), антитела (антигены), белки (рекомбинантные белки), лектины (гликопротеины), фосфорилхолин (С-реактивный белок).

Аффинная хроматография характеризуется наиболее высокими коэффициентами специфичности. Используемые сорбенты относятся к двум большим группам. Сорбенты первой группы в качестве аффинных лигандов включают присоединенные к нерастворимому носителю субстраты или ингибиторы ферментов. Сюда же можно отнести и иммуносорбенты, представляющие собой иммобилизованные антитела к целевому продукту или его фрагментам. Принципы конструирования таких сорбентов достаточно просты и понятны. Следует отметить, что сорбенты эти обладают относительно узкой специфичностью и, следовательно, для каждого продукта необходимо конструировать свой сорбент. Это может приводить к удорожанию как технологического процесса, так и продукта.
Ко второй группе аффинных сорбентов относятся материалы, содержащие в качестве лигандов далекие по строению от субстратов и кофакторов ферментов и вообще от природных лигандов белков группировки, с которыми, тем не менее, эти белки связываются достаточно прочно и селективно. Соответствующие соединения зачастую оказываются сильными ингибиторами ферментов. Среди таких сорбентов в течение последнего десятилетия получили распространение иммобилизованные (обычно на полисахаридных матрицах) красители. Известны примеры, когда за одну стадию сорбции и элюции достигается очистка почти в 1 500 раз практически без потерь активности.
• В качестве матриц для синтеза аффинных сорбентов используются нейтральные полимеры, чаще всего полисахариды.
• Некоторые требования к матрицам сформулированы Поратом:
- нерастворимость в воде;
- достаточная проницаемость и большая удельная поверхность;
- высокая жесткость и подходящая форма частиц;
- нулевая (или минимальная) сорбционная ёмкость;
- химическая стабильность в условиях присоединения лиганда, осуществления хроматографии и регенерации;
- устойчивость к микробной и ферментативной деградации;
- гидрофильность.
Основные типы полисахаридных носителей для синтеза аффинных сорбентов:
А) декстран;
Б) целлюлоза;
В) агароза
Те же носители могут использоваться для синтеза ионообменников, молекулярных сит и других сорбентов
Аналог ТФЭ (твердофазная экстракция)

Условия сорбции-десорбции определяются сочетанием трех базовых свойств элюента: кислотности (pH), ионной силы и полярности и/или добавлением реагентов, которые вызывают десорбцию (изменяют афинность или конкурируют за центр связывания.

Применение в БТ
Поскольку авидин, получаемый из яиц, прочно связывается с биотином с константой диссоциации Kd ≈ 10−15 М, биотинилированные соединения, представляющие интерес, можно выделить из образца, используя это очень стабильное взаимодействие. Во-первых, химически модифицированные биотиновые реагенты связываются с целевыми соединениями в растворе с помощью процесса, называемого биотинилированием. Выбор химической модификации, которая будет использоваться, влияет на связывание биотинового реагента с конкретным белком. Во-вторых, образец инкубируют с авидином, связанным с шариками, затем промывают, удаляя все несвязанные белки и оставляя только биотинилированный белок, связанный с авидином. Наконец, биотинилированный белок можно элюировать с шариков с помощью избытка свободного биотина. В этом процессе также можно использовать стрептавидин, полученный из бактерий и связанный с шариками, но поскольку он имеет более высокую константу диссоциации, чем авидин, для элюирования биотинированного белка с шариков требуются очень жёсткие условия, которые часто приводят к денатурации интересующего белка.
33. Экстракция водорастворимых биологически активных соединений, лабораторные и промышленные установки и аппараты.
