- •1. Мембранные технологии, их использование в биотехнологии.
- •1. Пластинчатый диализатор
- •2. Диализатор типа «фильтр-пресс»
- •2. Роль мембранных технологий в очистке генно-инженерных белков.
- •1. Ультрафильтрация
- •2. Диализ
- •3. Электродиализ
- •3. Предложить вариант мембранной технологии для концентрирования большого количества раствора генно-инженерного белка
- •1. Ультрафильтрация: Первичный этап концентрирования
- •2. Диализ: Удаление остаточных солей и буферных компонентов
- •3. Электродиализ: Регулировка ионного состава
- •4. Центрифугирование, основные методы.
- •1. Этапы применения центрифугирования
- •1.1. Удаление клеточного мусора (клеточный лизат)
- •1.2. Концентрация белка
- •Тип ротора:
- •Условия центрифугирования:
- •Особенности
- •Виды колориметрии
- •Пример работы фотоколориметра
- •Строение и принцип работы спектрофотометра на диодной матрице:
- •Преимущества и особенности:
- •1. Поглощение белков в уф-области
- •2. Поглощение нуклеиновых кислот (нк) в уф-области
- •3. Изобестическая точка
- •Применение в бт:
- •1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
- •1. Источник инфракрасного излучения
- •2. Монохроматор
- •3. Оптическая система
- •4. Образец
- •5. Приемники излучения
- •Принцип работы
- •Особенности и преимущества Фурье-ик-спектрометра
- •1. Инфракрасная (ик) спектроскопия Описание метода:
- •Применяемые техники:
- •Применение:
- •2. Раман-спектроскопия (спектроскопия комбинационного рассеяния) Описание метода:
- •Применяемые техники:
- •3. Спектроскопия комбинационного рассеяния ближнего ик-диапазона (nir-спектроскопия)
- •Применение флуоресценции в биотехнологии
- •Тушение флуоресценции
- •Иммунофлуоресценция
- •Основные элементы устройства
- •Импульсные спектрометры с преобразованием Фурье (ft-nmr)
- •Основные этапы maldi масс-спектрометрии:
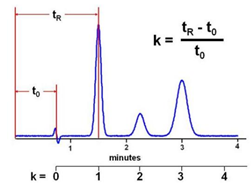
- •1. Время удерживания:
- •2. Время удерживания несорбируемого компонента или мертвое время:
- •3. Мертвый объём
- •4. Фактор удерживания к (коэффициент ёмкости)
- •5. Селективность (α):
- •6. Эффективность - число теоретических тарелок
- •7. Высота теоретической тарелки (h):
- •8. Пиковая емкость колонки
- •9. Разрешение Rs:
- •10. Фактор асимметрии для Асимметричные пики («с хвостом»)
- •1. Экстракция водорастворимых биологически активных соединений
- •2. Экстракция жирорастворимых биологически активных соединений
- •1. Лиофильные сушилки (фриз-драйеры)
- •Принцип действия:
- •2. Ротационные испарители
- •3. Сушильные шкафы
- •2. Спрей-сушилки (распылительные сушилки)
- •3. Вакуумные сушилки Принцип действия:
- •Применение:
- •1) Источники питания
- •38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
- •2. Типы анализируемых веществ:
- •5. Оборудование и сложность:
- •40. Капиллярный электрофорез, особенности и достоинства метода в сравнении с планарным электрофорезом.
1. Время удерживания:
Определение: Время, прошедшее от момента ввода пробы до достижения максимума пика компонента на детекторе. Включает время, проведенное компонентом в подвижной фазе - время удерживания несорбируемого компонента, например, метка) и время, проведенное в неподвижной фазе.
Значение: Характеризует скорость миграции компонента в хроматографической системе. Разные компоненты имеют разные времена удерживания.
Использовать время удерживания, как характеристику вещества (например в статье или МВИ) в случае изократической хроматографии методически неправильно из-за зависимости этого параметра от скорости элюента и размеров колонки! Необходимо использовать коэффициент ёмкости (фактор удерживания) для расчета которого необходимо знать нулевое время (или нулевой объем) колонки.
2. Время удерживания несорбируемого компонента или мертвое время:
Определение: Время, за которое несорбируемый компонент (не взаимодействующий с неподвижной фазой) проходит через колонку. Это время, которое подвижная фаза затрачивает на прохождение через колонку.
Значение: Необходимо для расчета других важных параметров, таких как фактор удерживания.
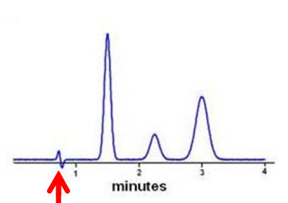
Артефактный пик в начале хроматограммы, соответствующий выходу растворителя пробы. Особенно характерен для UV детекторов (из-за особенностей аппаратуры детектор может отследить изменение коэффициента преломления). Часто выглядит как первая производная гаусовой кривой.
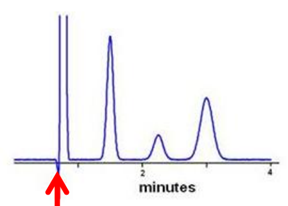
В случае наличия в пробе неудерживающихся соединений – мертвое время можно определять как время удерживания такого соединения (или начало большого пика). Точность определения зависит от того, насколько не удерживается данный аналит.
Экспериментальное определение мёртвого (нулевого) времени колонки достаточно сложно. Необходимо вводить совершенно не связывающееся с сорбентом вещество, которое можно увидеть на используемом детекторе. Если детектор UV, то для ОФ можно использовать урацил или нитрат. Для НФ иногда пригоден бензол. При рефрактометрии ОФ можно использовать D2O, а для НФ алканы с более длинными цепочками, чем в элюенте. В коммерчески доступных тестовых смесях для различных колонок всегда присутствует компонент с нулевым (с достаточной точностью) временем удерживания.
3. Мертвый объём
В лабораторный паспорт колонки удобнее вносить не мёртвое время, а мёртвый объем, поскольку могут использоваться разные расходы элюента. Пересчёт при этом тривиален.
![]()
Для новой колонки можно сразу рассчитать мёртвый объем по результатам тестовой хроматограммы (фирменной или своей самой первой). Кроме того, можно воспользоваться приближенными формулами Для колонки ID 4.6 мм:
![]()
Обобщённая формула:
![]()
4. Фактор удерживания к (коэффициент ёмкости)
Определение: Безразмерная величина, показывающая, насколько сильнее компонент взаимодействует с неподвижной фазой по сравнению с подвижной.
Значение: Позволяет сравнивать удерживание разных компонентов в разных условиях. Чем больше k', тем сильнее взаимодействие с неподвижной фазой и тем дольше компонент удерживается в колонке. Оптимальный диапазон k' обычно находится в пределах 1-5.
![]()
Зависит от: сорбента, элюента, аналита; температуры (если есть физико-химические взаимодействия. В эксклюзионной – НЕТ)
Не зависит от: размеров колонки; скорости подачи элюента Имеет смысл только для изократики!