
- •1. Мембранные технологии, их использование в биотехнологии.
- •1. Пластинчатый диализатор
- •2. Диализатор типа «фильтр-пресс»
- •2. Роль мембранных технологий в очистке генно-инженерных белков.
- •1. Ультрафильтрация
- •2. Диализ
- •3. Электродиализ
- •3. Предложить вариант мембранной технологии для концентрирования большого количества раствора генно-инженерного белка
- •1. Ультрафильтрация: Первичный этап концентрирования
- •2. Диализ: Удаление остаточных солей и буферных компонентов
- •3. Электродиализ: Регулировка ионного состава
- •4. Центрифугирование, основные методы.
- •1. Этапы применения центрифугирования
- •1.1. Удаление клеточного мусора (клеточный лизат)
- •1.2. Концентрация белка
- •Тип ротора:
- •Условия центрифугирования:
- •Особенности
- •Виды колориметрии
- •Пример работы фотоколориметра
- •Строение и принцип работы спектрофотометра на диодной матрице:
- •Преимущества и особенности:
- •1. Поглощение белков в уф-области
- •2. Поглощение нуклеиновых кислот (нк) в уф-области
- •3. Изобестическая точка
- •Применение в бт:
- •1. Ультрафиолетовая видимая спектроскопия (uv-Vis)
- •1. Источник инфракрасного излучения
- •2. Монохроматор
- •3. Оптическая система
- •4. Образец
- •5. Приемники излучения
- •Принцип работы
- •Особенности и преимущества Фурье-ик-спектрометра
- •1. Инфракрасная (ик) спектроскопия Описание метода:
- •Применяемые техники:
- •Применение:
- •2. Раман-спектроскопия (спектроскопия комбинационного рассеяния) Описание метода:
- •Применяемые техники:
- •3. Спектроскопия комбинационного рассеяния ближнего ик-диапазона (nir-спектроскопия)
- •Применение флуоресценции в биотехнологии
- •Тушение флуоресценции
- •Иммунофлуоресценция
- •Основные элементы устройства
- •Импульсные спектрометры с преобразованием Фурье (ft-nmr)
- •Основные этапы maldi масс-спектрометрии:
- •1. Время удерживания:
- •2. Время удерживания несорбируемого компонента или мертвое время:
- •3. Мертвый объём
- •4. Фактор удерживания к (коэффициент ёмкости)
- •5. Селективность (α):
- •6. Эффективность - число теоретических тарелок
- •7. Высота теоретической тарелки (h):
- •8. Пиковая емкость колонки
- •9. Разрешение Rs:
- •10. Фактор асимметрии для Асимметричные пики («с хвостом»)
- •1. Экстракция водорастворимых биологически активных соединений
- •2. Экстракция жирорастворимых биологически активных соединений
- •1. Лиофильные сушилки (фриз-драйеры)
- •Принцип действия:
- •2. Ротационные испарители
- •3. Сушильные шкафы
- •2. Спрей-сушилки (распылительные сушилки)
- •3. Вакуумные сушилки Принцип действия:
- •Применение:
- •1) Источники питания
- •38.Сравнительный анализ хроматографических и электрофоретических задач в биотехнологии.
- •2. Типы анализируемых веществ:
- •5. Оборудование и сложность:
- •40. Капиллярный электрофорез, особенности и достоинства метода в сравнении с планарным электрофорезом.
Основные этапы maldi масс-спектрометрии:
Приготовление образца:
Образец смешивается с матрицей — органическим соединением, которое поглощает энергию лазера.
Матрица обычно представляет собой небольшую кислоту с хромофором, например, α-циано-4-гидроксикоричную кислоту (CHCA) или 2,5-дигидроксибензойную кислоту (DHB).
Смесь наносится на мишень и высушивается.
Ионизация и десорбция:
Кристаллизованный образец облучается лазером (обычно ультрафиолетовым).
Энергия лазера передаётся матрице, вызывая испарение матрицы вместе с образцом и его ионизацию.
Анализ ионов:
Полученные ионы ускоряются электрическим полем и направляются в масс-анализатор.
Время пролёта (TOF — Time of Flight) часто используется для измерения массы ионов, поскольку оно пропорционально их массово-зарядному отношению m/zm/zm/z.
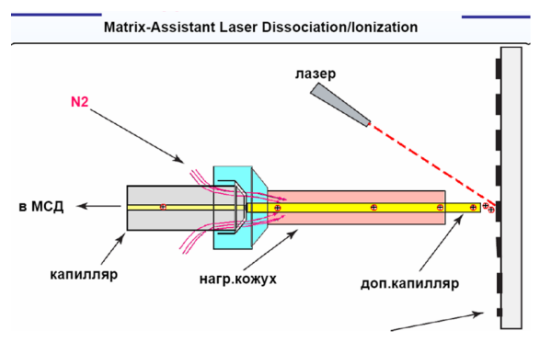

Более подробно:
При облучении лазером с длительностью импульса несколько наносекунд и высокими величинами интенсивности излучения (106 — 107 Вт/см²) из образца, представляющего собой твердый раствор или смесь анализируемого вещества и матрицы, происходит выброс материала в виде микрочастиц. Такие частицы могут достигать размеров несколько сотен микрометров. Над поверхностью образца возникает область высокого локального давления — так называемый факел (от англ. англ. plume — факел, шлейф, султан), который преимущественно состоит из нейтральных частиц. Вместе с тем, в нем присутствуют и заряженные частицы, доля которых по разным оценкам составляет 10−5—10−3 от полного числа всех частиц.
На начальном этапе образования факела его плотность близка к плотности вещества в конденсированном состоянии. C расширением факела (в первые наносекунды) происходит распад конгломератов вплоть до образования отдельных молекул или их фрагментов, а также заряженных (преимущественно матричных) частиц. Ионизацию молекул, происходящую непосредственно при выбросе материала из конденсированного состояния, принято рассматривать как первичную. В расширяющемся факеле происходят непрерывные соударения между частицами, в том числе возможны ион-молекулярные реакции между матричными заряженными частицами и молекулами анализируемого вещества, которые приводят к ионизации последнего.
Такого рода ионизацию относят к вторичной. Картинка относится к подробному объяснению.
Области применения МАЛДИ-МС. К настоящему времени методом МАЛДИ успешно анализируют самые разнообразные классы веществ:
1. Биоорганические соединения (полипептиды, белки, олигонуклеотиды, олиго- и полисахариды и т. п.);
2. синтетические полимеры;
3. органические комплексные соединения;
4. высокомолекулярные материалы;
5. гуминовые кислоты;
6. синтетические дендримеры;
7. фуллерены и др.
Метод МАЛДИ используют прежде всего для установления молярной массы соединения. Примеры использования МАЛДИ-МС в фармацевтической разработке. Этот метод используется для определения многих фармацевтических субстанций, например, металлокомплексы хлоринов и бактериохлоринов (когда нельзя использовать ЯМР-спектроскопию) в совокупности с другим методом (Ик-спектроскопию) анализ дает более информативный анализ структуры вещества.
Ограничения:
Требуется подходящая матрица для каждого типа анализа.
MALDI не всегда подходит для анализа низкомолекулярных веществ (< 500 Да), так как сигнал матрицы может мешать результатам.
Требует высококачественной подготовки образцов для получения точных данных.
Разделение ионов
Задача масс-анализатора – разделение ионов, поступающих из источника ионизации согласно их m/z, передача их на детектор
Различают масс-анализаторы: сканирующего типа (в определенный момент фиксируют только ионы определенного типа, остальные ионы теряются)
Масс-анализаторы фиксирующие все поступающие ионы
Основные характеристики масс-анализаторов
• ТОЧНОСТЬ ОПРЕДЕЛЕНИЯ МАССЫ, ppm
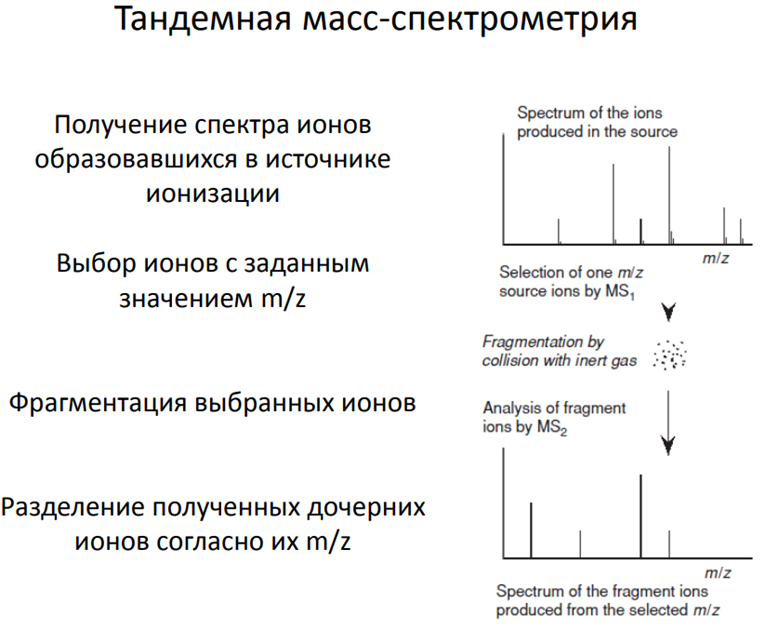
• ТАНДЕМНАЯ МАСС-СПЕКТРОМЕТРИЯ, МС/МС и МСn
• ЦЕНА
•Скорость сканирования a.e.м./сек
Для того, чтобы проанализировать все ионы по отношению их массы к заряду, он должен сканировать, то есть параметры его поля должны за заданный промежуток времени пройти все значения, нужные для пропускания к детектору всех интересующих ионов. Эта скорость разворачивания поля называется скоростью сканирования и должна быть как можно больше. Чем больше скорость сканирования, тем хуже чувствительность
•Разрешение M/∆M
Наглядно разрешение (разрешающую способность) можно определить как возможность анализатора разделять ионы с соседними массами. Очень важно иметь возможность точно определять массу ионов, это позволяет вычислить атомную композицию иона или идентифицировать молекулу путем сравнения с базой данных
•Динамический диапазон (точнее м/z), а.е.м.
Способность с одинаковой точностью регистрировать любые концентрации вещества. Если мы анализируем смесь, содержащую 99,99 % одного соединения или какого-либо элемента и 0,01% какой-либо примеси, мы должны быть уверены, что правильно определяем и то и другое. Для того, чтобы быть уверенным в определении компонентов в этом примере, нужно иметь диапазон линейности в 4 порядка. Динамический диапазон в 10 порядков означает, что примесь в пробе будет видна даже тогда, когда она составляет 10 миллиграмм на 10 тонн.
•Чувствительность
Величина, показывающая какое количество вещества нужно ввести в масс-спектрометр для того, чтобы его можно было детектировать
Виды анализаторов:
1. Секторные приборы 2. Квадрупольные приборы 3. Ионные ловушки 4. Времяпролетные приборы 5. Приборы ИЦР (МСПФ) 6. Орбитра
Магнитный масс-анализатор
Для разделения ионов используют однородное магнитное поле. Физическая основа изменение траектории заряженной частицы под действием магнитного поля. Согласно законам физики, траектория заряженных частиц в магнитном поле искривляется, причем радиус кривизны зависит от их массы и заряда.
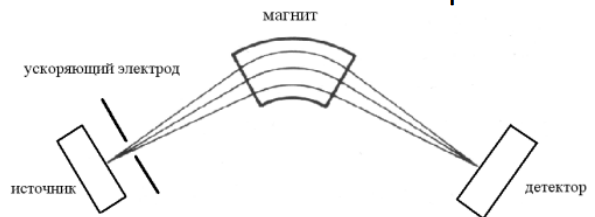
Ион, образовавшийся в источнике, выводится оттуда благодаря системе электродов и ускоряется потенциалом V (2-8кВ) по направлению к анализатору. Пусть m – масса иона, е – единичный заряд, z – число таких зарядов у иона, v – скорость иона. Тогда кинетическая энергия иона, на входе в магнитный анализатор, выражается следующим уравнением:
![]()
Попадая в магнитное поле напряженностью В перпендикулярно магнитным силовым линиям, этот ион будет двигаться по окружности R, причем сила Лоренца будет уравновешиваться центробежной силой:
![]()
Уравнение может быть представлено в форме:
![]()
Т.е. магнит является анализатором именно моментов, а не масс. Комбинация уравнений приводит к основному уравнению разделения ионов в магнитном анализаторе:
![]()
Дисперсия ионов: Попадая в электростатический сектор, ион движется по круговой орбите с радиусом R таким образом, что сила электрического поля уравновешивается центробежной силой:
![]()
Следовательно, через анализатор пройдут ионы с одинаковой энергией вне зависимости от их массы.
Электрический (электростатический) МА
Как правило, этот вид анализатора применяется в дополнение к магнитному анализатору для обеспечения большего разрешения прибора (такие приборы называются «приборами C двойной фокусировкой») и для облегчения измерения точных масс, т.к. электрическое поле возможно варьировать более точно, чем магнитное.
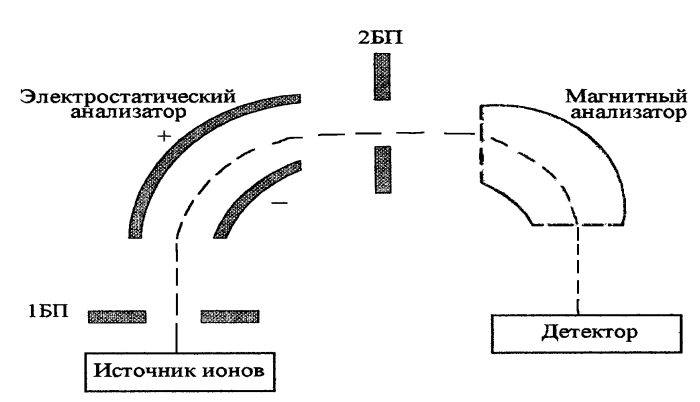
Принципиальная схема магнитного секторного прибора двойной фокусировки прямой геометрии. БП – бесполевое пространство
Масс-спектрометрия с преобразованиями Фурье (Fourier Transform Mass Spectrometry, FT-MS)
При большой величине напряженности магнитного поля ион описывает окружность
F=ma = mv²/r = zevB,
где т - масса иона, - компонента скорости иона в направлении перпенди- кулярном магнитному полю, г- радиус траектории кругового движения иона, е - единичный заряд, и число единичных зарядов у иона, В напряженность магнитного поля.
Если с угловая (циклотронная) частота ионов в радианах в секунду, то уравнение можно представить следующим образом:
![]() или
или
![]()
Обычно используется выражение для циклотронной частоты иона в герцах:
![]() или
или
![]()
Достоинства: • Самое высокое разрешение (до 1000000) • Высокая точность измерения массы (до 1 ppm) • Возможность в течение длительного времени сохранять • и накапливать ионы • Метод детектирования – недеструктивный • Верхняя граница рабочего диапазона m/z до 1000000
Недостатки: • Разрешение уменьшается для очень тяжелых ионов • Сверхглубокий вакуум (10-9 – 10-11) • Сложность • Цена прибора и цена эксплуатации (прибор потребляет жидкий гелий)
Квадраупольный анализатор
• Ионный пучок направляют в пространство между четырьмя параллельными электродами
•Это стержни (0,6 х15 см) из нержавеющей стали, одна пара по диагонали противоположных стержней заряжена положительно, другая отрицательно
• Одновременно на электроды наложено высокочастотное переменное напряжение
Под действием электрических полей заряженные частицы колеблются и при фиксированном значении частоты и амплитуды переменного поля только ионы с определенным значением m/z проходят через квадруполь
Частицы с другими значениями масс сталкиваются со стержнями и выбывают из потока. При этом происходит своеобразная фильтрация ионов
Чтобы зафиксировать ионы с другим массовым числом, меняют либо частоту, либо амплитуду переменного поля. Так формируется масс-спектр
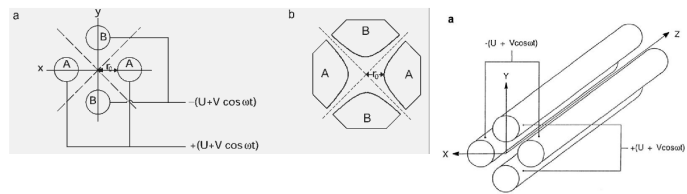
Противоположные стержни электрически соединены и находятся под напряжением, складывающимся из компоненты постоянного тока U и радиочастотной компоненты V0cosωt. Вторая пара стержней имеет равную по величине, но противоположную по знаку компоненту, постоянного тока, а фаза радиочастотной компоненты сдвинута на 180о .
Достоинства: • Квадруполь легко управляется компьютером • Имеет хороший динамический диапазон (105 ) • Стыкуется со всеми системами ввода • Способен без модифицирования разделять и положительные, и отрицательные ионы • Быстрота сканирования • Небольшие размеры • Дешевизна • Возможность работы при повышенном (до 5 10-5 мм рт.ст.) давлении
Недостатки: • Низкое разрешение (2000 – 4000) • Верхняя граница m/z (3000 – 4000) • Прибор на основе одинарного квадруполя не способен работать в режиме тандемной масс-спектрометрии
Трехмерная ионная ловушка (Ion trap)
Разновидность квадрупольного масс-анализатора
Два концевых (полюсных) гиперболических по форме электрода заземлены, между ними располагается электрод кольцевой формы, на который подается радиочастотное напряжение мегагерцового диапазона
• Эта система электродов создает поле, позволяющее удерживать ионы достаточно долгое время
• Для ионизации образца используется электронная или химическая ионизация в импульсном режиме (0,110 мс)
• Импульсное изменение амплитуды радиочастотного напряжения на центральном электроде заставляет ионы с определенным т/г переходить на нестабильные траектории и покидать ловушку (образованную полем центрального электрода), попадая в систему регистрации на электронный умножитель

Достоинства • Режим тандемной масс-спектрометрии. Можно получить информацию о нескольких последовательных поколениях фрагментных ионов. Такая техника зачастую обозначается в литературе (MS) n . • Возможность достижения разрешающей способности 25000 • Небольшие размеры • Возможность расширения диапазона регистрируемых масс десятков тысяч • Высокая чувствительность Недостатки • Протекание в ловушке ионно-молекулярных реакций, что приводит к искажениям стандартного масс-спектра • В приборах старых серий – полуколичественный анализатор • Легко перегрузить ловушку – узкий динамический диапазон • Правило «одной трети»
Времяпролетный МА:
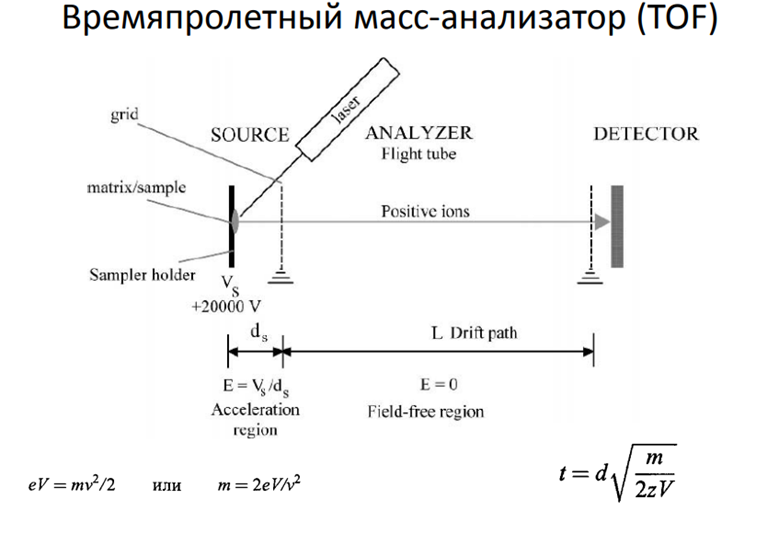
• Действие времяпролетных масс-анализаторов основано на зависимости скорости движения ионов от их массы. Их особенность: ионы движутся в бесполевом пространстве
• После ускорителя все ионы обладают одинаковой кинетической энергией E = mv²/2, следовательно, чем больше их масса, тем меньше скорость, тем больше время пролета иона через анализатор
1= Л/м/2zU
• Время пролета составляет несколько микросекунд
Метод применим для определения массы больших молекул (десятки и сотни тысяч атомных единиц)
Достоинства • имеет более высокую чувствительность по сравнению со сканирующими приборами; • имеет очень высокую скорость записи спектра (до нескольких сот спектров в секунду); • имеет практически неограниченный диапазон масс; • имеет разрешающую способность более 30000; • может работать с самыми разнообразными источниками ионов; • является идеальным вторым анализатором для работы в режиме тандемной масс-спектрометрии; Недостатки • Габариты • Цена
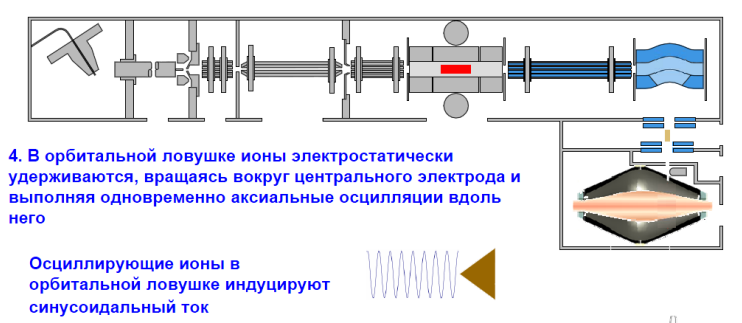
«ORBITRAP
![]()
1. В начале ионы удерживаются в линейной ловушке радиочастотным полем
2. Затем они выталкиваются в сторону С-ловушки, где происходит уменьшение их кинетической энергии
3. Из С-ловушки ионы выталкиваются в сторону орбитальной ионной ловушки
Гибридные масс-спектрометры
Тройной квадруполь QqQ • Квадруполь – линейная ионная ловушка QTRAP • Квадруполь – времяпролетный масс-анализатор • Времяпролетный масс-анализатор - времяпролетный масс-анализатор • Трехмерная ионая ловушка - времяпролетный масс-анализатор
20.Интерпретация масс-спектров.
КАК ОБНАРУЖИТЬ ПРОТОНИРОВАННУЮ МОЛЕКУЛУ ПРИ ИОНИЗАЦИИ В АТМОСФЕРНОМ ДАВЛЕНИИ
1. Если определяемое вещество известно, то пик протонированной молекулы имеет m/z равное сумме атомных масс наиболее интенсивных изотопов каждого элемента, присутствующего в молекуле плюс 1.
2. Правило азота: Молекула, содержащая нечетное число атомов азота имеет нечетную молекулярную массу; поэтому протонированный молекулярный пик будет четным. И наоборот, если молекула будет содержать четное число атомов азота, то протонированный молекулярный пик будет четным.
3. Обратите внимание на катионированные ионы [M+23]+ и [M+39]+. Они свидетельствуют о присутствии протонированной молекулы.
4. В масс-спектре могут присутствовать димер протонированной молекулы. M/z димера будет в два раза больше, чем у протонированной молекуле минус 1. К примеру, 101 и 201.
5. Молекулы растворителя могут образовывать кластеры с протонированной молекулой.
6. Не перепутайте протонированную молекулу с многозарядными ионами. Фрагменты этих ионов можно обнаружить в область больших m/z.
7. Не перепутайте с фоновыми пиками. Для этого постройте масс- хроматограмму для отдельных ионов.
Представление масс-спектров
• На графике по оси абсцисс откладывается отношение массы иона к его заряду, т/г, а по оси ординат интенсивность, характеризующая относительное количество ионов данного вида
• Интенсивность выражается в процентах по отношению к полному ионному току (суммарной интенсивности всех ионов в масс-спектре) или по отношению к максимальной интенсивности ионного тока в масс-спектре
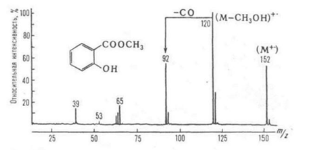
Основные характеристики масс-спектров:
*Пик молекулярного иона (M+): Соответствует массе интактной молекулы. Самый тяжелый ион в спектре (за исключением изотопных пиков). Его интенсивность зависит от стабильности молекулярного иона.
Молекулярный ион: Имеет самую большую массу в спектре; Нечетноэлектронный; Образует важнейшие ионы с большой массой за счет выброса нейтральных частиц; Включает все элементы, наличие которых в образце можно увидеть по фрагментным ионам
* Изотопные пики: Пики, расположенные рядом с пиком молекулярного иона, обусловленные присутствием изотопов элементов в молекуле. Расстояние между изотопными пиками и их относительная интенсивность зависят от изотопного состава элементов в молекуле.
* Фрагментные ионы: Образуются в результате разрыва связей в молекулярном ионе. Характер фрагментации зависит от структуры молекулы и условий ионизации. Анализ фрагментных ионов позволяет получить информацию о структуре молекулы.
* Базовый пик: Самый интенсивный пик в масс-спектре. Ему присваивается относительная интенсивность 100%, а интенсивности остальных пиков выражаются относительно базового.
* Относительная интенсивность пиков: Показывает относительное количество каждого иона, образующегося в процессе ионизации и фрагментации.

Факторы, изменяющие характеристики масс-спектров:
1. Метод ионизации:
* Электронный удар (EI): Высокоэнергетический метод, приводящий к обширной фрагментации. Пик молекулярного иона может быть слабым или отсутствовать. Хорошо подходит для идентификации веществ по библиотекам спектров.
* Химическая ионизация (CI): Мягкий метод ионизации, приводящий к меньшей фрагментации. Пик молекулярного иона обычно более интенсивный, что облегчает определение молекулярной массы.
* Электроспрей (ESI): Мягкий метод, часто используемый для анализа больших молекул (белков, пептидов). Образует многозарядные ионы, что позволяет анализировать молекулы с высокой массой. Фрагментация минимальна.
* MALDI (Matrix-Assisted Laser Desorption/Ionization): Мягкий метод, подходящий для анализа больших молекул. Образует преимущественно однозарядные ионы.
2. Энергия электронов (в EI): Более высокая энергия электронов приводит к большей фрагментации.
3. Температура ионного источника: Более высокая температура может увеличить фрагментацию.
4. Структура молекулы: Стабильность молекулярного иона и пути фрагментации зависят от структуры молекулы. Наличие функциональных групп, разветвленность цепи, ароматичность влияют на масс-спектр.
5. Столкновительная энергия (в тандемной МС): В тандемной МС (МС/МС) ионы, выделенные первым масс-анализатором, фрагментируются в камере столкновений. Энергия столкновений влияет на степень фрагментации.
Как факторы изменяют масс-спектры:
* Изменение интенсивности пика молекулярного иона: Мягкие методы ионизации (CI, ESI, MALDI) увеличивают интенсивность пика M+. Высокая энергия электронов в EI уменьшает интенсивность M+.
* Изменение относительной интенсивности фрагментных ионов: Высокая энергия электронов, высокая температура и высокая столкновительная энергия увеличивают интенсивность фрагментных ионов.
* Появление новых фрагментных ионов: Изменение условий ионизации и фрагментации может привести к появлению новых фрагментных ионов.
Разрешающая способность масс-спектрометра:
Определение: Разрешающая способность (R) масс-спектрометра характеризует его способность разделять ионы с близкими значениями массы. Она определяется как отношение массы (m) к разности масс (Δm) двух пиков, которые можно различить: R = m/Δm. Под разрешением (R) понимается способность получать на данном приборе раздельное изображение двух ионов с массами m и (m +Δm). Величина R формально соответствует отношению m к Δm.
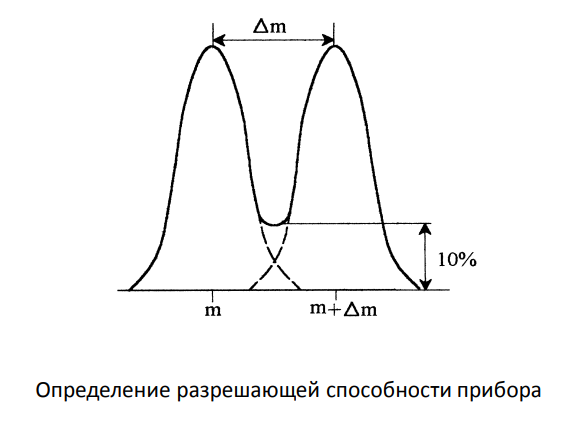
Влияние на спектр: Высокая разрешающая способность позволяет различать ионы с очень близкими массами, что приводит к более узким и четким пикам на масс-спектре. Это критически важно для:
* Определения элементного состава: Высокое разрешение позволяет точно определить массу иона, что необходимо для определения его элементного состава, так как массы разных изотопов немного отличаются.
* Разделения изобарных ионов: Изобарные ионы имеют одинаковую номинальную массу, но разный элементный состав. Высокое разрешение позволяет разделить эти ионы и идентифицировать их.
* Улучшения соотношения сигнал/шум: Разделение перекрывающихся пиков улучшает соотношение сигнал/шум и облегчает идентификацию и количественное определение компонентов.
* Низкая разрешающая способность приводит к уширению пиков и их перекрыванию, что затрудняет интерпретацию спектра, особенно для сложных смесей.
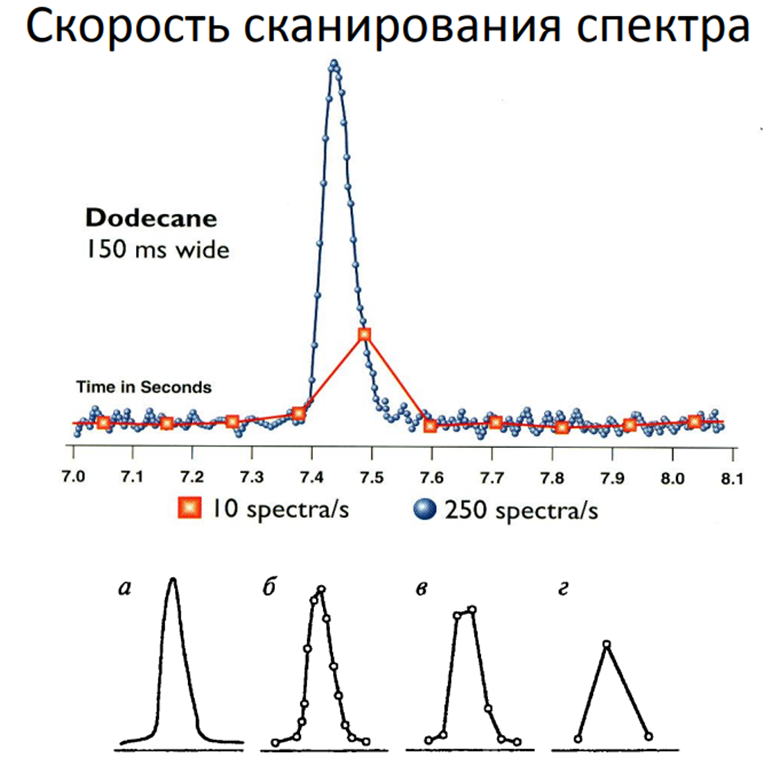
Скорость сканирования:
Определение: Скорость сканирования масс-спектрометра — это скорость, с которой масс-анализатор сканирует диапазон масс. Она измеряется в атомных единицах массы в секунду (а.е.м./с) или в герцах (Гц).
Роль в образовании масс-спектра: Скорость сканирования влияет на количество точек данных, собранных для каждого пика на масс-спектре.
* Высокая скорость сканирования позволяет получить больше точек данных для каждого пика, что приводит к более точному определению массы и формы пика. Это особенно важно для количественного анализа и для работы с быстро протекающими процессами, например, в хроматографии.
* Низкая скорость сканирования может привести к искажению формы пика и снижению точности определения массы, особенно для узких пиков, характерных для хроматографического разделения.
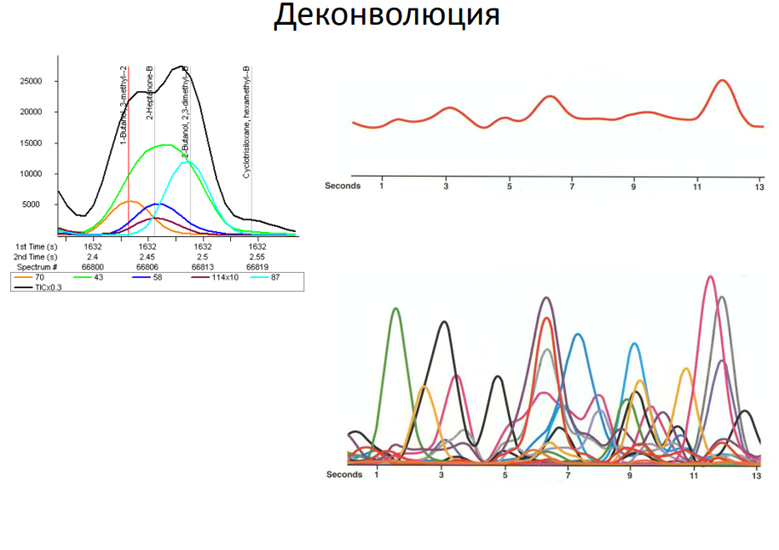
Деконволюция:
Определение: Деконволюция — это математический метод, используемый для преобразования сложных масс-спектров, полученных с помощью мягких методов ионизации (ESI, MALDI), в спектры, представляющие распределение масс анализируемых молекул. Мягкие методы ионизации часто приводят к образованию многозарядных ионов, что усложняет интерпретацию спектра.
Деконволюция позволяет:
* Определить молекулярную массу: Преобразует спектр многозарядных ионов в спектр, показывающий распределение масс исходных молекул.
* Упростить интерпретацию спектра: Деконволюция «распутывает» сложные спектры, делая их более понятными и облегчая идентификацию компонентов.
* Повысить точность определения массы: Улучшает точность определения молекулярной массы, особенно для больших молекул.
Способы снятия Масс-спектра:
Хроматография по полному ионному току: Для каждой пика на хроматограмме в файле данных содержится полный масс-спектр. Регистрируются все ионы, выходящие из колонки хроматографа.
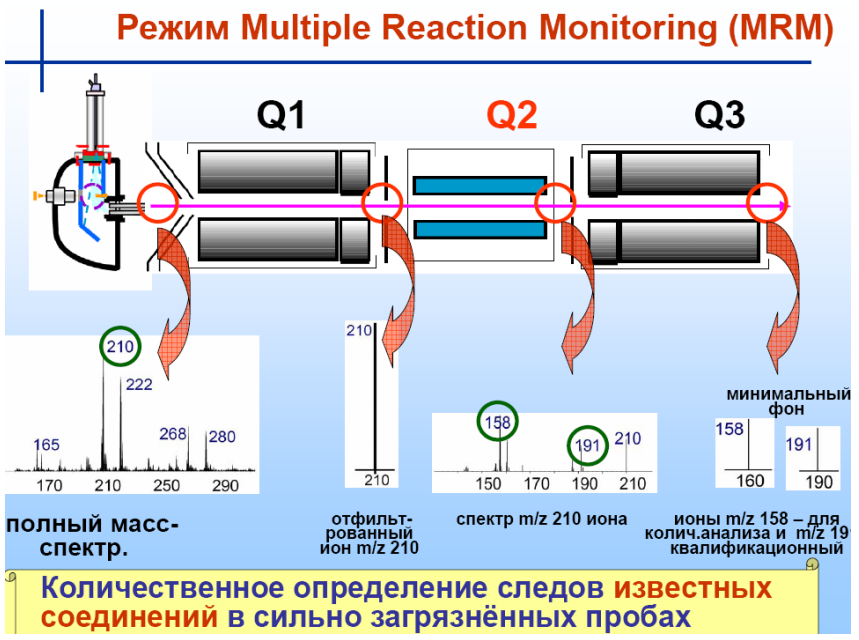
Тандемная масс-спектрометрия
21.Сочетание масс-спектрометрии с хроматографией.
Масс-спектрометрия прямого ввода (DIMS):
Суть: Образец вводится непосредственно в ионный источник масс-спектрометра без предварительного хроматографического разделения.
Преимущества:
* Простота и быстрота: Анализ проводится быстро, так как отсутствует этап хроматографического разделения.
* Минимальные потери образца: Отсутствие хроматографической колонки минимизирует потери образца.
Недостатки:
* Ограниченная применимость: Подходит только для относительно чистых образцов или образцов с небольшим количеством компонентов. Сложные смеси анализировать трудно, так как масс-спектры различных компонентов будут накладываться друг на друга.
* Сложность интерпретации: Интерпретация масс-спектров сложных смесей может быть затруднена из-за перекрывания пиков.
* Риск загрязнения ионного источника: Прямой ввод образца может привести к загрязнению ионного источника.
Хромато-масс-спектрометрия (GC-MS, LC-MS):
Сочетание масс-спектрометрии (МС) с хроматографией — чрезвычайно мощный аналитический инструмент, используемый для разделения, идентификации и количественного определения компонентов сложных смесей. Хроматография разделяет компоненты смеси, а масс-спектрометрия определяет их массу и структуру. Это сочетание обеспечивает высокую чувствительность, селективность и специфичность анализа.
Суть: Образец сначала разделяется с помощью хроматографии (газовой (ГХ) или жидкостной (ЖХ)), а затем каждый компонент, выходящий из хроматографической колонки, анализируется масс-спектрометром.
Как это работает:
1. Хроматографическое разделение: Образец вводится в хроматографическую систему (газовая хроматография (ГХ) или жидкостная хроматография (ЖХ)), где компоненты смеси разделяются на основе их физико-химических свойств (например, летучесть в ГХ, полярность в ЖХ). Каждый компонент выходит из хроматографической колонки в разное время, образуя хроматограмму с отдельными пиками.
2. Ионизация: Компоненты, выходящие из хроматографической колонки, поступают в ионный источник масс-спектрометра. Здесь они ионизируются различными методами, такими как электронный удар (EI), химическая ионизация (CI), электроспрей ионизация (ESI) или ионизация в матрице с помощью лазера (MALDI). Выбор метода ионизации зависит от природы анализируемых веществ и типа хроматографии.
3. Разделение ионов по массе: Ионизированные молекулы (ионы) ускоряются электрическим полем и попадают в масс-анализатор. Масс-анализатор разделяет ионы на основе их отношения массы к заряду (m/z). Существуют различные типы масс-анализаторов, такие как квадрупольные, времяпролетные (TOF), ионные ловушки и орбитальные ловушки.
4. Детектирование: Разделенные ионы регистрируются детектором, который измеряет их количество. Полученный сигнал преобразуется в масс-спектр, представляющий собой график зависимости интенсивности сигнала от отношения массы к заряду (m/z).
5. Анализ данных: Масс-спектры анализируются с помощью специализированного программного обеспечения, которое позволяет идентифицировать компоненты смеси на основе их масс-спектров и сравнения с базами данных. Также можно проводить количественный анализ, определяя концентрацию каждого компонента в исходной смеси.
Преимущества:
* Анализ сложных смесей: Хроматографическое разделение позволяет анализировать сложные смеси, так как компоненты разделяются во времени.
* Высокая чувствительность и селективность: Сочетание разделения и масс-спектрометрического детектирования обеспечивает высокую чувствительность и селективность анализа.
* Идентификация и количественное определение: Позволяет идентифицировать и количественно определять отдельные компоненты смеси.
* Специфичность: Возможность однозначной идентификации компонентов на основе их масс-спектров.
* Универсальность: Применимо к широкому спектру анализируемых веществ.
* Структурная информация: МС предоставляет информацию о структуре молекул.
Недостатки:
* Более сложная и длительная процедура: Требует больше времени из-за этапа хроматографического разделения.
* Возможны потери образца: Небольшие потери образца могут происходить во время хроматографического разделения.
* Требуется оптимизация параметров хроматографии: Необходимо оптимизировать параметры хроматографического разделения для каждого типа образца.

В каких случаях какой метод лучше:
* DIMS: Подходит для анализа чистых веществ, определения молекулярной массы, анализа термически стабильных и летучих соединений, быстрого скрининга простых смесей.
* Хромато-масс-спектрометрия: Предпочтительна для анализа сложных смесей, идентификации неизвестных компонентов, количественного определения компонентов, анализа термолабильных соединений (ЖХ-МС), анализа нелетучих соединений (ЖХ-МС).
В итоге, выбор метода зависит от конкретной задачи и свойств анализируемого образца. DIMS предлагает простоту и скорость, но ограничен в применимости. Хромато-масс-спектрометрия, хоть и более сложна, обеспечивает гораздо более широкие возможности для анализа сложных смесей и получения детальной информации о составе образца.
1. Идентификация белков в биологическом образце (ЖХ-МС):
* Задача: Идентифицировать белки, присутствующие в образце сыворотки крови.
* Метод: Жидкостная хроматография в сочетании с масс-спектрометрией (ЖХ-МС).
* Процесс:
* Подготовка образца: Белки в сыворотке крови расщепляются на пептиды с помощью фермента, например, трипсина.
* ЖХ разделение: Пептиды разделяются в колонке жидкостного хроматографа на основе их гидрофобности и других свойств.
* МС детектирование: Выходящие пептиды ионизируются (обычно электроспреем). Ионы разделяются в масс-анализаторе (например, квадрупольном или времяпролетном) по отношению m/z.
* Идентификация: Масс-спектры пептидов анализируются и сравниваются с базами данных белковых последовательностей для идентификации исходных белков.
2. Анализ лекарственного препарата в плазме крови (ЖХ-МС/МС):
* Задача: Определить концентрацию лекарственного препарата в плазме крови пациента для мониторинга эффективности лечения.
* Метод: Жидкостная хроматография в сочетании с тандемной масс-спектрометрией (ЖХ-МС/МС).
* Процесс:
* Подготовка образца: Лекарственный препарат экстрагируется из плазмы крови.
* ЖХ разделение: Лекарственный препарат и внутренний стандарт (вещество с известной концентрацией, близкое по свойствам к анализируемому препарату) разделяются в колонке ЖХ.
* МС/МС детектирование: Первый масс-анализатор выделяет ионы, соответствующие лекарственному препарату. Эти ионы фрагментируются в камере столкновений. Второй масс-анализатор анализирует фрагменты, обеспечивая высокую селективность и чувствительность.
* Количественное определение: Концентрация лекарственного препарата определяется путем сравнения отношения сигнал/шум для препарата и внутреннего стандарта.
Масс-спектрометрия прямого ввода (Direct Inlet Mass Spectrometry, DIMS) и хромато-масс-спектрометрия (Chromatography-Mass Spectrometry, hyphenated MS or just GC-MS or LC-MS) представляют собой два разных подхода к масс-спектрометрическому анализу, каждый со своими преимуществами и недостатками. Основное различие заключается в наличии или отсутствии предварительного хроматографического разделения.
22.Теория хроматографического разделения. Принципы хроматографии.
Хроматография - физико-химический метод разделения и анализа смесей, основанный на распределении их компонентов между двумя фазами: неподвижной - сорбентом и подвижной – элюентом.
Хроматографией называется метод разделения смесей веществ, основанный на их многократном перераспределении между двумя контактирующими фазами, одна из которых неподвижна, а другая имеет постоянное направление движения.
Хроматография – это физический метод разделения веществ, в котором разделяемые компоненты распределяются между двумя фазами, одна из которых неподвижна, а другая движется в определённом направлении относительно первой.
Достоинства хроматографии: • универсальность в смысле объектов анализа, • возможность разделения веществ, близких по свойствам, •отсутствие химических изменений в разделяемых веществах, • высокая чувствительность.
Разделение происходит благодаря различной скорости миграции компонентов смеси через хроматографическую систему. Скорость миграции различно, потому что возможно образование различных видов взаимодействия:• межмолекулярные • водородная связь • донорно-акцепторные • ионный обмен • лигандный обмен • слабое комплексообразование
*Все взаимодействия должны быть обратимыми (хемосорбция не применяется).
Терминология
Подвижная фаза - поток жидкости, сверхкритического флюида или газа, перемещающий компоненты разделяемой смеси вдоль неподвижной фазы.
Неподвижная фаза - твёрдый сорбент или несмешивающаяся с подвижной фазой жидкость, на которых осуществляется дифференцированное удерживание и разделение компонентов смеси.
Адсорбент - твёрдый сорбент, концентрирующий на своей поверхности газы, пары или растворенные вещества.
Абсорбент - твёрдый или жидкий сорбент, растворяющий в своем объёме газы, пары или компоненты жидких смесей.
Сорбент - твёрдое вещество, жидкость или их смесь, способные поглощать или удерживать растворенные вещества.
Сорбат - вещество, удерживаемое сорбентом (в хроматографии - компонент разделяемой смеси).
Аналит - компонент, искомый или определяемый в пробе вещества или материала объекта аналитического контроля.
Хроматограмма - кривая, изображающая зависимость концентрации соединений, выходящих из колонки с потоком подвижной фазы, от времени с момента начала разделения.
Элюент - жидкость используемая в качестве подвижной фазы.
Элюат - подвижная фаза выходящая из колонки
Изократический режим - способ разделения, при котором состав элюента не изменяется
Градиентный режим - способ разделения, при котором состав элюента изменяется по определённой программе, увеличивая «силу» растворителя за счет изменения полярности, pH или ионной силы. Используется в случае необходимости разделения веществ, которые сильно отличаются по степени связывания с сорбентом
Система – в зависимости от контекста – сам жидкостной хроматограф («Система Аджилент с УФ-детектором»). – элюент («Приготовить систему вода – ацетонитрил, 60:40 (v/v)») – элюент вместе с конкретной колонкой («Получилась селективная система»)
Сорбция (от лат. sorbeo — поглощаю) — поглощение твёрдым телом либо жидкостью различных веществ из окружающей среды. Поглощаемое вещество, находящееся в среде, называют сорбатом, поглощающее твёрдое тело или жидкость — сорбентом. По характеру поглощения сорбата сорбционные явления делятся на два типа: адсорбцию — концентрирование сорбата на поверхности раздела фаз или его поглощение поверхностным слоем сорбента и абсорбцию — объёмное поглощение, при котором сорбат распределяется по всему объёму сорбента.
Адсорбция (лат. ad — на, при, в; sorbeo — поглощаю) —процесс увеличения концентрации растворённого вещества у поверхности раздела двух фаз
Абсо́рбция (лат. absorptio от absorbere — поглощать) — поглощение сорбата всем объёмом сорбента.
Принципы хроматографии (GPT):
1. Дифференциальная миграция: Ключевой принцип хроматографии заключается в том, что компоненты смеси взаимодействуют с неподвижной и подвижной фазами с разной силой. Компоненты, сильнее взаимодействующие с неподвижной фазой, будут двигаться медленнее, а те, которые сильнее взаимодействуют с подвижной фазой, будут двигаться быстрее. Это различие в скоростях и приводит к разделению компонентов.
2. Равновесие распределения: Разделение основано на динамическом равновесии между двумя фазами. Компонент смеси постоянно переходит из подвижной фазы в неподвижную и обратно. Константа распределения (K) характеризует это равновесие для каждого компонента. Чем больше K, тем сильнее компонент взаимодействует с неподвижной фазой и тем медленнее он движется.
3. Эффективность разделения: Эффективность разделения зависит от нескольких факторов:
* Длина колонки: Более длинные колонки обеспечивают лучшее разделение, так как дают больше времени для дифференциальной миграции.
* Размер частиц сорбента: Мелкие частицы сорбента увеличивают площадь поверхности контакта между фазами и улучшают эффективность разделения. Однако, слишком мелкие частицы увеличивают сопротивление потоку подвижной фазы.
* Скорость потока подвижной фазы: Оптимальная скорость потока позволяет достичь наилучшего компромисса между скоростью анализа и эффективностью разделения.
* Температура: Температура может влиять на константу распределения и, следовательно, на эффективность разделения.
Принципы хроматографии (ЛК):
В хроматографии, особенно в высокоэффективной жидкостной хроматографии (ВЭЖХ), существует два основных режима элюирования: изократический и градиентный. Выбор режима зависит от сложности анализируемой смеси и свойств разделяемых компонентов.
Изократический режим:
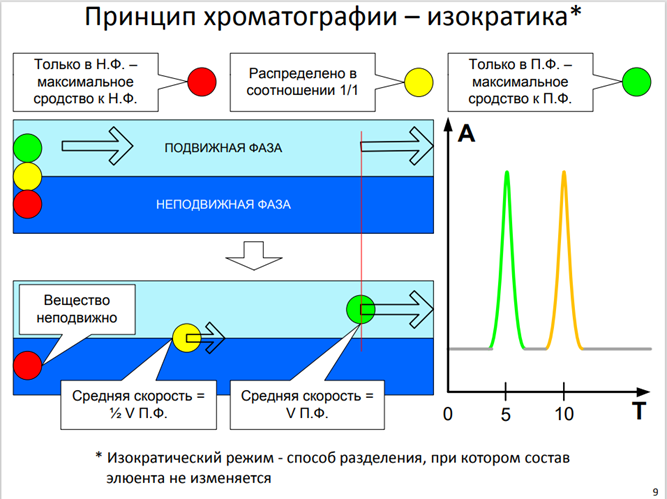
Принцип: В изократическом режиме состав подвижной фазы остается постоянным на протяжении всего анализа. Это значит, что концентрация растворителей и добавок в подвижной фазе не изменяется со временем.
Преимущества:
* Простота: Метод проще в реализации и требует меньше подготовки.
* Воспроизводимость: Результаты более воспроизводимы, так как условия элюирования остаются неизменными.
* Меньше времени на подготовку: Не требуется программирования градиента.
Недостатки:
* Ограниченная эффективность разделения: Может быть неэффективен для разделения смесей с компонентами, имеющими сильно различающиеся свойства удерживания. Слабо удерживаемые компоненты элюируются быстро, а сильно удерживаемые – слишком медленно или вообще не элюируются. Это приводит к пикам, расположенным слишком близко друг к другу или к их «хвостам».
* Длительное время анализа: Разделение сильно удерживаемых компонентов может занять много времени.
Градиентный режим:

Принцип: В градиентном режиме состав подвижной фазы изменяется во время анализа. Обычно это осуществляется путем плавного увеличения концентрации более сильного растворителя (элюента) в подвижной фазе. Более сильный растворитель уменьшает время удерживания компонентов, позволяя элюировать их быстрее и улучшая разделение.
Преимущества:
* Улучшенное разделение: Градиентный режим позволяет эффективно разделять сложные смеси с компонентами, имеющими широкий диапазон свойств удерживания. Более сильный элюент «смывает» сильно удерживаемые компоненты, улучшая разделение и уменьшая время анализа.
* Более короткое время анализа: Разделение достигается быстрее, так как сильно удерживаемые компоненты элюируются быстрее.
Недостатки:
* Сложность: Требует более сложной подготовки и программирования градиента.
* Меньшая воспроизводимость: Незначительные изменения в градиенте могут существенно повлиять на результаты.
* Более длительная очистка системы: Изменение состава подвижной фазы требует более тщательной промывки системы между анализами.
* Более сложный анализ данных: Необходимо учитывать изменение условий элюирования при интерпретации хроматограмм.
В итоге: Изократический режим подходит для простых смесей с компонентами, имеющими близкие свойства удерживания. Градиентный режим необходим для сложных смесей с широким диапазоном свойств удерживания, когда требуется улучшить разрешение и сократить время анализа. Выбор между этими двумя режимами является критическим этапом оптимизации метода ВЭЖХ.
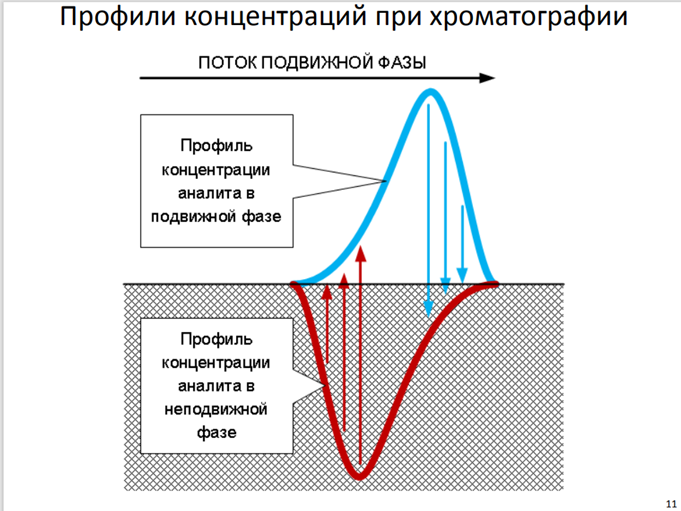
Профили концентраций при хроматографии
Профили концентраций при хроматографии представляют собой изменение концентрации разделяемых веществ в зависимости от времени их выхода из колонки. Они образуются в результате размывания хроматографической зоны, когда скорость перемещения отдельных молекул отличается от средней скорости, характерной для соединения. Это приводит к постепенному нарастанию концентрации сорбата в элюенте до некоторого максимального значения и последующему спаду до нулевого уровня. Концентрационные профили на выходе из колонки имеют колоколообразный вид, описываемый кривой статистического распределения Гаусса.
23.Классификация видов хроматографии.
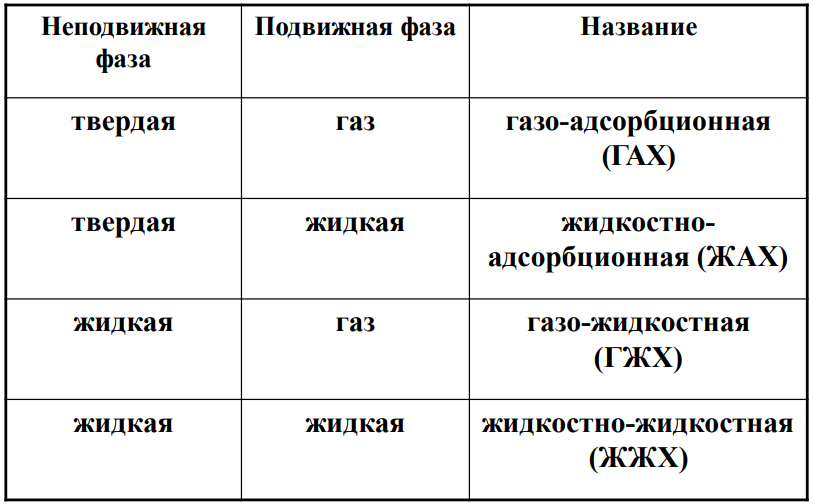
Классификация по агрегатному состоянию:
*Газо – жидкостная (ГЖХ)
*Газо - твердофазная (ГАХ)
*Жидко - твердофазная
*Жидко - жидкостная
*Сверхкритический флюид (СКФ)+
Классификация по задачам:
*Аналитическая хроматография ( Есть/нет, какое, сколько?)
*Препаративная хроматография (Получение вещества (в любом количестве)) *Строгое определение препаративного метода («в любом количестве») в хроматографии обычно не используется.
Классификация по технике исполнения:
*Планарная:
-Бумажная
-Тонкослойная
*Колоночная:
-Низкого давления (на открытых колонках)
- Среднего давления (< 30 бар)
-ВЭЖХ ( HPLC - High-performance liquid chromatography) ранее – ЖХВД (но также HPLC)
Классификация по перемещению сорбата:
*Фронтальный анализ
*Проявительная хроматография
*Вытеснительная хроматография
Фронтальный анализ
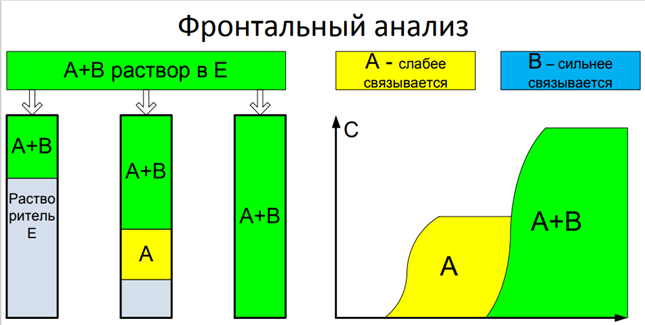
На колонку, заполненную растворителем «E» (связывается с сорбентом слабее чем А и B) начинаем подавать раствор A и B в E. За счёт разницы в силе вначале образуется зона чистого А, потом идет исходная смесь. Метод не имеет ни аналитического, ни препаративного значения. По сути, это фильтрация через сорбент. Используется для определения изотерм сорбции.
(Из лекции с БАСОВ)
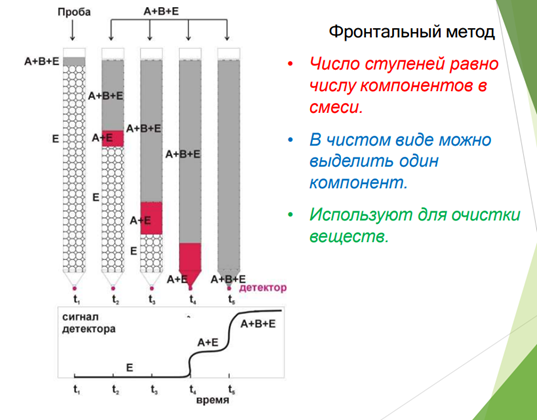
Фронтальный метод наиболее прост по выполнению. Через хроматографическую колонку с сорбентом непрерывным потоком пропускают раствор или газовую смесь исследуемых веществ, сорбируемость которых увеличивается в ряду А < В < С. Соответственно этому компоненты располагаются в колонке. Однако они разделяются не полностью.В чистом виде может быть выделен лишь первый, наиболее слабо сорбирующийся компонент, который движется вдоль слоя сорбента впереди остальных. За зоной первого компонента следует в непосредственном контакте зона, содержащая первый и второй компоненты. Третья зона содержит смесь первого, второго и третьего компонентов. В некоторый момент времени сорбент насыщается, и наступает «проскок», т.е. из колонки начинают выходить компоненты в соответствии с их сорбируемостью. Если пропускать жидкость или газ, выходящие из колонки, через детектор концентраций и наносить показания его в течение всего опыта на график, то полученная выходная кривая будет иметь форму ступенчатой кривой.
Фронтальный метод не нашел широкого применения в анализе, т.к. не дает полного разделения компонентов анализируемой смеси. Однако этот метод весьма эффективен для препаративного выделения чистого вещества из технического образца при условии, что это вещество удерживается в колонке слабее всех других компонентов объекта анализа. Типичные примеры применения фронтального анализа: очистка и умягчение воды ионообменными материалами; очистка воздуха активированными углями от отравляющих веществ в противогазах и вентиляционных фильтрах химических предприятий; концентрирование ценных веществ из сточных промышленных вод металлургических предприятий; очистка лекарственных препаратов и пищевых продуктов с помощью ионообменников и т.д.
Вытеснительная хроматография
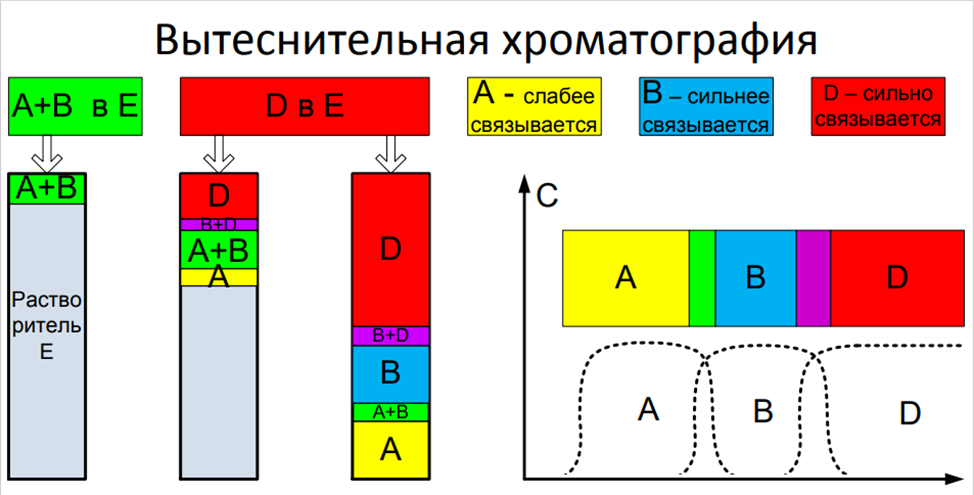
На колонку, заполненную растворителем «E» (связывается с сорбентом слабее чем А и B) наносим пробу (зону) раствора A и B в E. Далее начинаем подавать раствор вытеснителя D. За счёт разницы в силе связывания образуются зоны чистых растворов А и В, разделенные смешанными зонами. Метод не имеет аналитического значения. Может использоваться как препаративный метод, поскольку наиболее полно использует емкость сорбента.
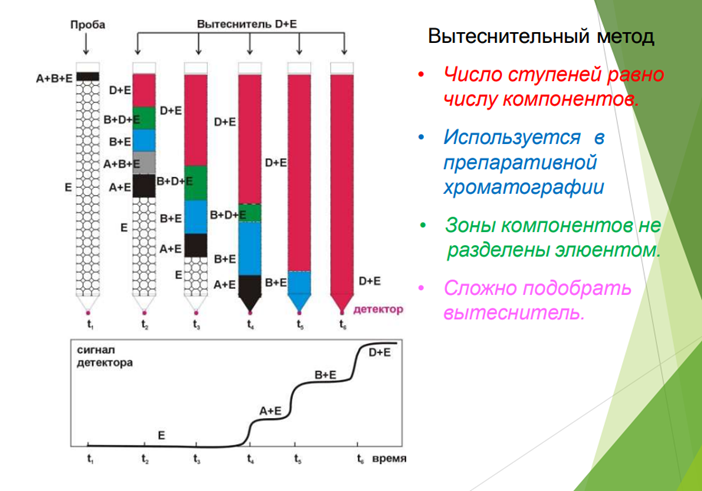
Вытеснительный метод отличается от фронтального и проявительного тем, что после введения пробы исследуемой смеси колонку промывают растворителем или газомносителем, к которым добавляют раствор вещества (вытеснитель), обладающего большей сорбируемостью, чем любое из разделяемых веществ. По мере продвижения по колонке элюент вытесняет вещество С, которое в свою очередь вытесняет вещество В и т.д. В результате вытесняемая смесь перемещается впереди фронта вытеснителя и скорость движения вещества равна скорости движения вытеснителя. Разделяемые вещества и на колонке, и в элюате располагаются последовательно друг за другом. Каждый из компонентов выделяется в чистом виде, но не количественно, так как зоны компонентов не разделены промежутками чистого сорбента.
Невозможность получения на выходе из колонки достаточно чистых компонентов разделяемой смеси, а также длительность процесса разделения затрудняют использование этого метода в аналитических целях. Однако для препаративных целей метод не потерял значения, так как возможность применения таких высокоактивных и доступных адсорбентов, как активированные угли, позволяет достигнуть высокой производительности. Достоинством метода является также то, что зоны не размываются в отличие от проявительного анализа.
Проявительная хроматография
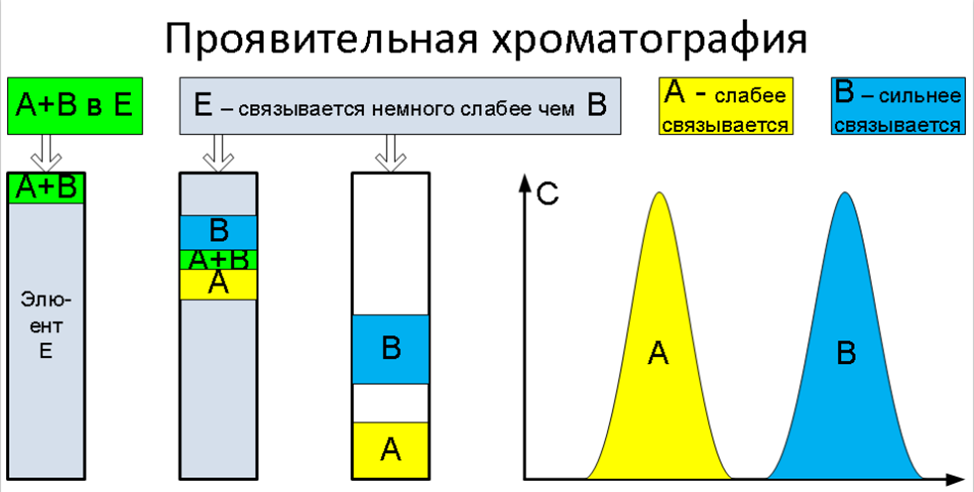
На колонку, заполненную элюентом «Е» (связывается с сорбентом слабее чем А и В) наносим пробу (зону) раствора А и В в Е. Далее начинаем подавать чистый элюент. За счёт разницы в силе связывания образуются зоны чистых растворов А и В, разделенные зонами чистого элюента. Основной аналитический метод. Препаративный метод при работе в области линейной изотермы адсорбции и при небольших перегрузках.
Основной современный метод! В отличие от предыдущих в этом методе элюирующий раствор обладает немного меньшим сродством к сорбенту, чем любой из компонентов вносимой на колонку или пластинку смеси веществ. Молекул элюента сильно больше, чем аналита, поэтому при его немного большем сродстве все молекулы аналита будут вытеснены с мест связывания => вещество не удерживается! Если сродство сильно меньше – наоборот аналит «засядет» на колонке или старте ТСХ
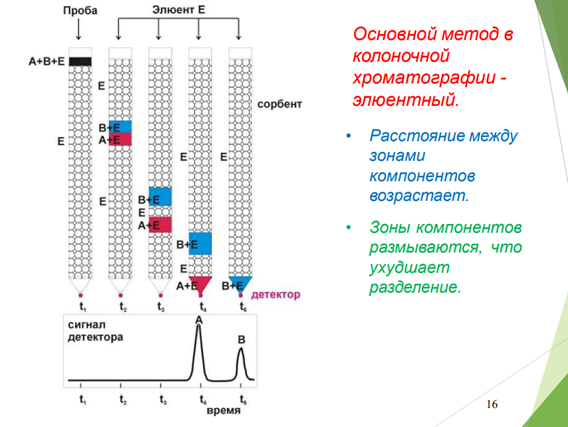
Проявительный (элюентный) метод выгодно отличается от фронтального тем, что он позволяет полностью разделить многокомпонентную смесь. Хроматографическую колонку промывают растворителем или газом носителем (элюентом), обладающим меньшей сорбируемостью, чем любое из разделяемых веществ. Затем в колонку вводят исследуемую смесь в виде порции раствора или газа, и непрерывно продолжают пропускать элюент. При этом разделяемые вещества перемещаются вдоль колонки с разными скоростями в соответствии с их сорбируемостью. На выходе из колонки детектор фиксирует непрерывно концентрацию компонентов, а связанный с ним регистрирующий прибор записывает выходную кривую в виде ряда пиков, число которых соответствует числу разделенных компонентов.
Проявительный метод анализа получил широкое применение как в жидкостной, так и в газовой хроматографии. Это объясняется тем, что при правильном выборе условий разделения компоненты смеси выходят из колонки в чистом виде, и их можно выделить для исследования другими методами анализа. Кроме того, качественный и количественный состав анализируемой смеси можно определить простым измерением объемов удерживания и площадей пиков соответствующих компонентов на полученной хроматограмме.
По механизму разделения:
*Нормально-фазовая хроматография
-Адсорбционная хроматография
-Распределительная хроматография
*Обращённо-фазовая хроматография
*Ионообменная хроматография
*Эксклюзионная хроматография
*HILIC хроматография

*Дополнительная информация, в следующих вопросах рассмотрено подробнее
ьше в ВЭЖХ пробовали распределительную хроматографию на силикагеле но теперь практически не используют этот классический вариант.
Нормально-фазовая хроматография
§ Жидко-твердофазная хроматография
§ Механизмы: и адсорбция и распределение
§ Сорбенты: § силикагель с диольными группами § силикагель с аминными группами § силикагель с нитрильными группами § силикагель (редко)
§ Сорбент всегда полярнее чем элюент
§ Разделяет низко- и среднеполярные вещества без заряда
§ Порядок выхода аналитов – сначала неполярные
§ Не разделяет неполярные (например, алканы)
Адсорбционная хроматография
§ Жидко-твердофазная хроматография
§ Аналит адсорбируется на поверхности сорбента
§ Взаимодействие слабое – силы Ван-дер-Ваальса, водородные связи, π- π взаимодействия
§ Сорбенты – силикагель, окись алюминия, силикат магния, модифицированные силикагели, полиамид, целлюлоза и т.д.
§ Порядок выхода аналитов – сначала неполярные
§ Сорбент полярный, элюент не полярный
§ Разделяет низко- и среднеполярные вещества без заряда § Не разделяет неполярные (например алканы)
С этого вида хроматографии все и начиналось. Были изучены разнообразные полярные органические и неорганические соединения. В результате из неорганики в жидкостной хроматографии (низкого давления) остался силикагель, окись алюминия и флоризил (Florisil – силикат магния). В ВЭЖХ –остался, по сути, только силикагель. При этом адсорбционная хроматография на не модифицированном силикагеле почти не применяется – плохо воспроизводится, могут быть «хвосты» и т.д.
Распределительная хроматография
§ Жидко-жидкофазная хроматография
§ Аналит распределяется между подвижной и неподвижной жидкими фазами
§ Сорбенты – вода на поверхности силикагеля, окиси алюминия, силиката магния, модифицированные силикагели, полиамиды, целлюлоза и т.д.
§ Сорбент полярный, элюент не полярный
§ Разделяет полярные соединения
§ Порядок выхода аналитов – сначала неполярные
§ Не разделяет неполярные соединения
§ В классическом варианте – тройные системы типа H2O – iPrOH – гексан H2O – MeOH – CHCl3
Обращённо-фазовая хроматография
§ Жидко-твердофазная хроматография
§ Механизмы: гидрофобные взаимодействия, адсорбция и распределение
§ Сорбенты: § силикагель с алкильными группами (С2, С4, С8, С18...) § силикагель с другими гидрофобными группами § силикагель с нитрильными группами
§ Сорбент всегда менее полярен чем элюент
§ Порядок выхода аналитов – сначала полярные
§ Разделяет почти все классы соединений, кроме очень полярных (углеводы)
§ Хуже чем НФ разделяет изомеры
Ионообменная хроматография
§ Жидко-твердофазная хроматография
§ Механизмы: кулоновские взаимодействия
§ Сорбенты: § полимерные катионо и анионообменники § силикагели с кислотными и основными группами
§ Разделяет заряженные соединения, растворимые в воде (или водно-органических смесях) по количеству и виду ионогенных групп
§ Использует водные буферные растворы (сорбент не полярный, элюент полярный)
§ Часто требует градиентных режимов
§ Сначала выходят полярные
Эксклюзионная хроматография
§ Жидко-жидкофазная хроматография
§ Механизм: разделение по размерам
§ Сорбенты: § твердые пористые полимеры § модифицированные силикагели § стекла
§ Элюенты – любые растворители
§ Сорбент не должен взаимодействовать с веществом
§ Заканчивается там, где начинаются другие виды хроматографии
§ Низкая пиковая емкость
§ Желательно увеличение длины колонок
HILIC хроматография
§ Жидко- жидкофазная хроматография
§ Механизм: распределение и адсорбция
§ Сорбенты: § как для НФ хроматографии § силикагель, диол, амин, нитрил
§ Элюенты – как в ОФ. Смеси воды и CH3CN, часто добавляют соли типа AcONH4 (сорбент полярный, элюент полярный)
§ Порядок выхода аналитов – как в НФ (сначала неполярные)
§ Позволяет разделять сильно полярные и заряженные соединения
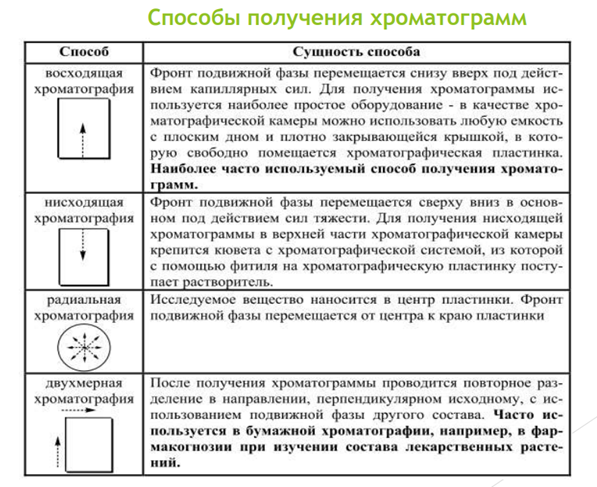
ТСХ является планарной разновидностью жидкостной хроматографии, в которой подвижная фаза движется в пористой среде слоя адсорбента.

ОСНОВЫ МЕТОДА:
Неподвижные фазы - тонкий слой мелкодисперсного адсорбента, нанесенного на стекло, алюминиевую или пластиковую пластинку, и закрепленного при помощи подходящего связующего материала.
Анализируемый образец наносят на край хроматографической пластинки капилляром или микропипеткой.
Пластинку опускают ее нижним краем в подходящий элюент.
Под действием капиллярных сил растворитель поднимается вверх по пластинке, увлекая за собой компоненты анализируемой пробы.
Скорости перемещения компонентов пробы будут неодинаковы, так их сродство к данному адсорбенту неодинаково.
Каждый из компонентов пробы переместится вдоль пластинки на разное расстояние,
Местоположение на пластинке определяют окрашиванием различными способами.
Окрашивание разделенных зон различными способами на хроматографической пластинке называют проявлением хроматограммы.
Требования к адсорбенту: Химическая инертность к компонентам разделяемой смеси; отсутствие каталитической активности к растворителю и разделяемым веществам; Селективность; Изодисперсность; Достаточная механическая прочность; Постоянство и стандартность свойств; Линейность изотермы адсорбции; Доступность
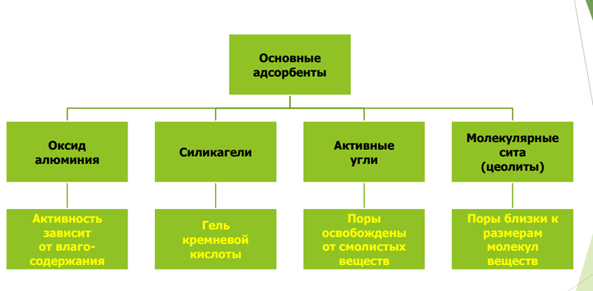
Требования к ПФ (растворителям):Хорошо растворять все компоненты анализируемой смеси; Обладать химической инертностью по отношению к растворенным веществам, адсорбенту и О2 воздуха; Не содержать примесей; Быть маловязким; Не вызывать отклонений в работе детектора; Из него должно быть возможно выделение разделенных компонентов; Быть доступным; Быть малотоксичным.
В качестве подвижных фаз используют элюенты. Элюенты характеризуются элюирующей силой. Элюирующая сила элюента характеризует силу взаимодействия молекул элюента и неподвижной фазы. Взаимодействие элюента и неподвижной фазы приводит к вытеснению с поверхности неподвижной фазы адсорбированных соединений. Для элюирования соединений с большим сродством к неподвижной фазе необходимы элюенты с большей элюирующей силой. С увеличением полярности растворителя их элюирующая сила в отношении полярных неподвижных фаз (силикагеля, оксида алюминия) возрастает. Элюирующую силу оценивают при помощи специальной шкалы, называемой элюотропным рядом.В качестве подвижной фазы можно использовать одно соединение, либо двух-трехкомпонентную смесь. Смешанные подвижные фазы часто бывают более селективными, а, следовательно, более эффективными
Проявление или детектирование хроматограммы
Физический способ: Хроматограмму освещают ультрафиолетовой лампой. Зоны сорбента, где находятся разделенные компоненты пробы, начинают флуоресцеировать, для четкого фиксирования положения пятен их следует обвести карандашом.
Химический способ: Пластину опрыскивают реагентами, образующими с разделяемыми веществами окрашенные соединения. Применяют универсальные и специфичные реагенты: Универсальные реагенты – концентрированные растворы серной, азотной кислот, пары иода. Применяются для детектирования большинства органических соединений; Специфические реагенты образуют окрашенные продукты с соединениями определенного класса.
Идентификация веществ на хроматограмме
Хроматографирование в присутствии свидетеля: Свидетель - стандартное вещество (т.е. точно известного строения), наличие которого предполагают в пробе.
Достоинства метода: это единственный хроматографический метод, позволяющий проводить полный анализ неизвестной смеси; простое и дешевое оборудование; высокая селективность; нет ограничений в выборе растворителей; одновременное разделение нескольких образцов; полученные результаты разделения легко оценить визуально u экспрессность (продолжительность разделения 10-100 мин)
Недостатки метода: ограниченная разделяющая способность из-за сравнительно небольшой длины разделяющей зоны (3- 10 см); чувствительность ниже, чем в случае ВЭЖХ; зависимость результатов анализа от окружающей среды: относительной влажности, температуры, а также наличия загрязняющих веществ в воздухе; трудности в работе с образцами, имеющими высокую летучесть, а также с веществами, чувствительными к действию кислорода, воздуха или света.
24.Основные величины, характеризующие хроматографическое разделение.
Хроматографическое разделение характеризуется несколькими важными величинами, которые позволяют оценить эффективность разделения и воспроизводимость результатов. К основным величинам относятся:
1. Время удерживания*
2. Время удерживания несорбируемого компонента или мертвое время
3. Мертвый объём
4. Фактор удерживания К (коэффициент ёмкости)
5. Селективность (α)
6. Эффективность - число теоретических тарелок
7. Высота теоретической тарелки (H)
8. Пиковая ёмкость колонки
9. Разрешение
10. Фактор асимметрии
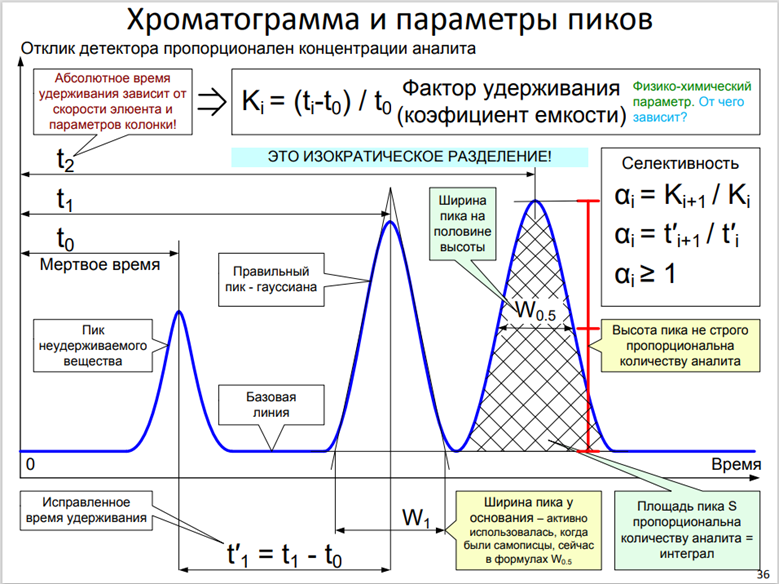
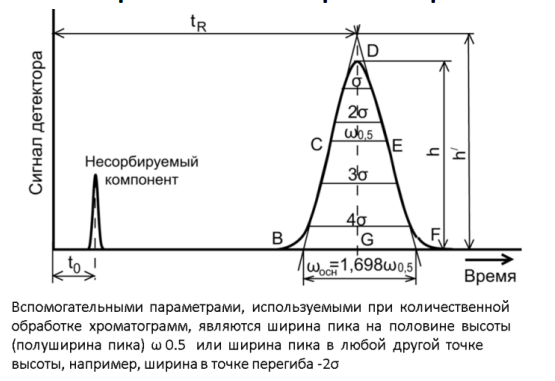
В современной ВЭЖХ разделения практически всегда проводят при постоянной объёмной скорости элюента. Соответственно, по оси абсцисс можно откладывать и объем. Так, например, часто поступают в эксклюзионной хроматографии. Объёмную скорость потока традиционно выражают в мл/мин.
V мл = 𝑇 мин ∗ 𝑊(мл/мин)
Базовая линия соответствует тому промежутку времени, в течение которого детектор регистрирует сигнал только от подвижной фазы.
