
Все лк фарм бт
.pdf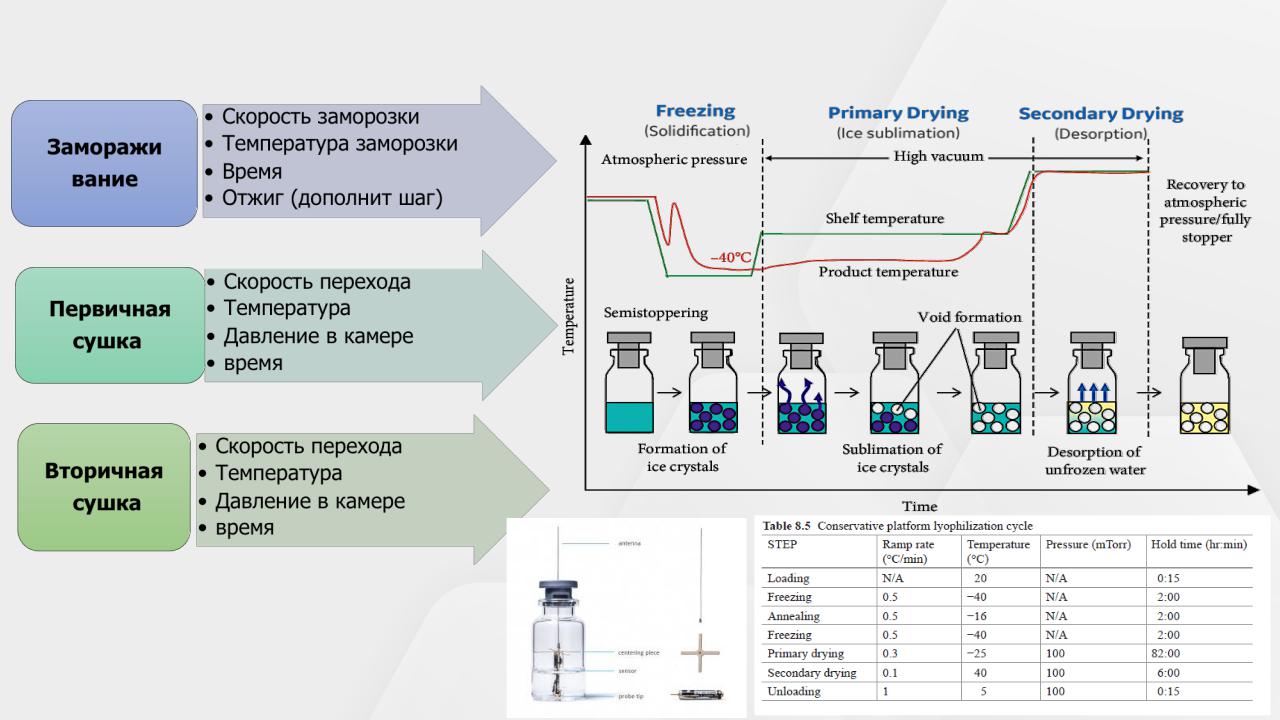
Фармацевтическая разработка
9599% Н2О 5-10% Н2О 1-2% Н2О
Фармацевтическая разработка
Лекарственная форма - лиофилизат
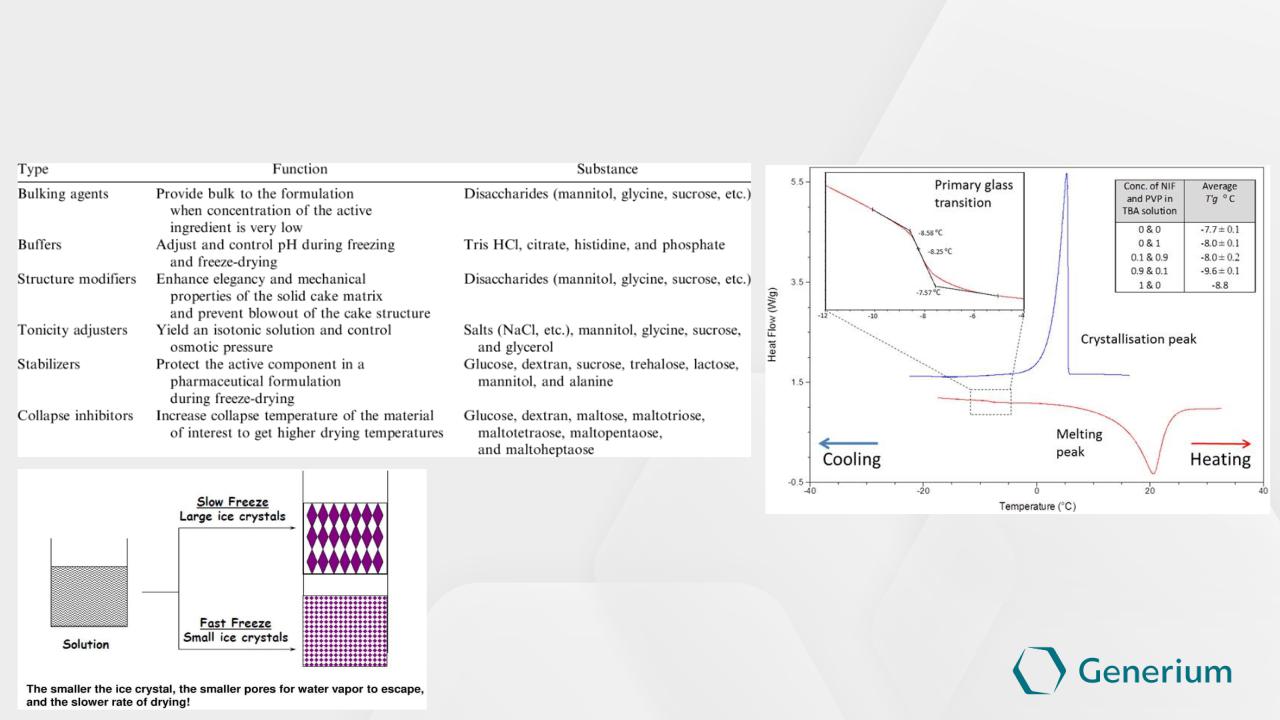
Выбор вспомогательных веществ
(криопротекоры, лиопротекторы, наполнители)
Определение температур стеклования,
плавления, кристализации – ДСК анализ
L Remmele, Richard, Sampathkumar Krishnan, and William J Callahan. "Development of stable lyophilized protein drug products." Current pharmaceutical biotechnology 13.3 (2012): 471-496.
Фармацевтическая разработка
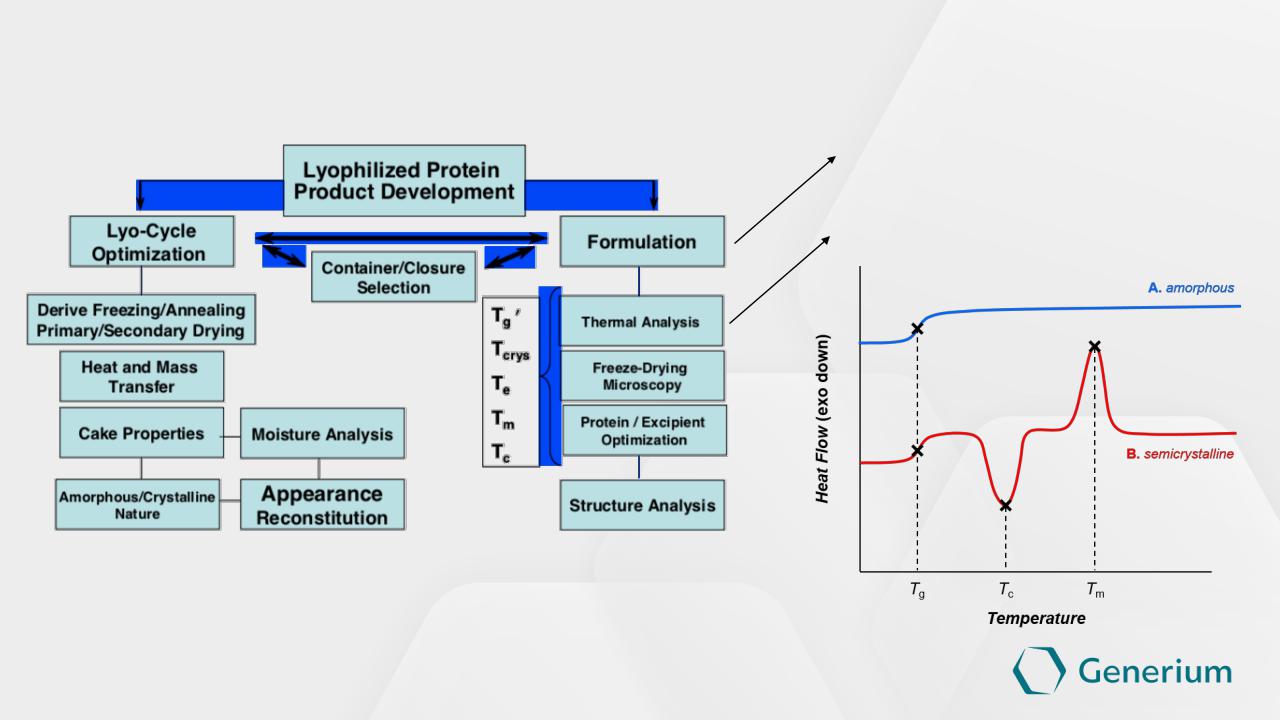
Лекарственная форма - лиофилизат
Выбор вспомогательных веществ (криопротекоры, лиопротекторы, наполнители)
Определение температур стеклования, плавления, кристализации – ДСК анализ




Фармацевтическая разработка
Программа изучения стабильности
Назначение Ответственность Информация о препарате
o Состав
o Первичная упаковка
o Срок годности, условия хранения
o Спецификация на выпуск / период обращения Критерии выбора серий План отбора проб
Параметры тестирования образцов o Объем тестирования
o Периодичность тестирования
o Обоснование уменьшения объема испытаний Условия прекращения исследований Оформление результатов Библиография История документа


Фармацевтическая разработка
Входе изучения стабильности необходимо подтвердить:
Срок годности;
Условия хранения;
Приемлемость состава;
Эффективность антимикробных консервантов;
Приемлемость первичной упаковки.
На основании данных по изучению стабильности принимаются решения о:
Приемлемости состава ЛС;
Вероятных продуктах разложения (примеси);
Отсутствии взаимодействий АФС/АФС и АФС/ВВ;
Отсутствии взаимодействий (диффузия, экстракция) контейнера первичной упаковки и укупорочных элементов с ЛФ.
Изучение стабильности должно включать исследование КРИТИЧЕСКИХ ПОКАЗАТЕЛЕЙ КАЧЕСТВА ПРЕПАРАТА, КОТОРЫЕ ЧУВСТВИТЕЛЬНЫ К ИЗМЕНЕНИЯМ в процессе хранения и, как предполагается, могут оказывать влияние на качество, безопасность и эффективность.

Фармацевтическая разработка
Стрессовые испытания могут помочь ВЫЯВИТЬ ВЕРОЯТНЫЕ ПРОДУКТЫ РАЗЛОЖЕНИЯ, что в свою очередь, позволяет определить:
Пути разложения; Стабильность, присущую молекуле (препарату);
Подтвердить пригодность используемых аналитических методик.
Исследования при принудительном разложении [forced degradation testing studies]
Исследования, которые проводят для ПРЕДНАМЕРЕННОГО РАЗРУШЕНИЯ образца. Такие исследования, как правило, проводят на этапе разработки, и используют для оценки общей стабильности АФС в целях разработки метода определения примесей и/или для выяснения пути разложения.
