
Все лк фарм бт
.pdf

Фармацевтическая разработка
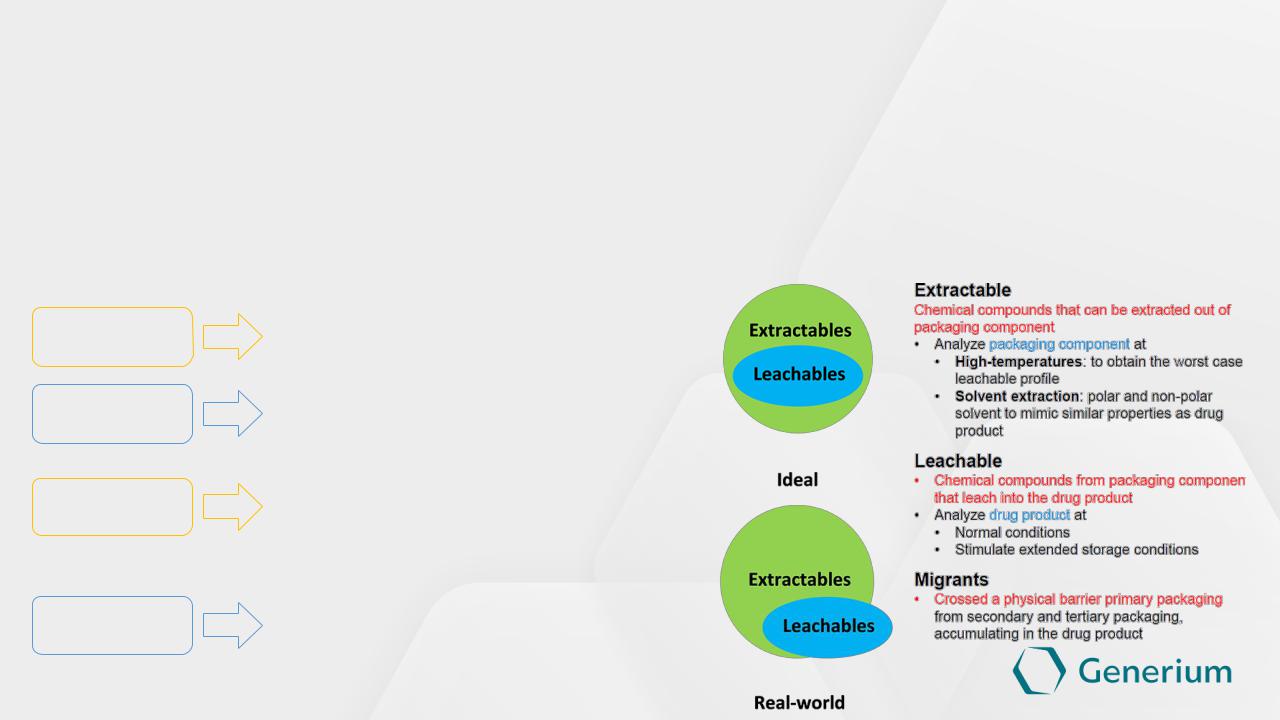
Экстрагируемые/вымываемые вещества из компонентов первичной упаковки
Процесс исследования экстрагируемых веществ для одноразовых систем согласно BPOG протоколу (The BioPhorum Operations Group):
1.Использование растворителей различной полярности, включая кислотные, основные, органические и водные растворители:
WFI neutral pH;
50% раствор этанола;
1% раствор Полисорбата 80;
5М раствор NaCl;
0,1М раствор H3PO4;
0,5N раствор NaOH
2.Применение различных методов экстракции:
Ультразвуковая обработка;
Экстракция с помощью экстрактора Сокслета (soxhlet);
Микроволновая обработка;
Автоклавирование (130ºС в течение 75 мин; 135ºС в течение 60 мин)
3.Условия взаимодействия с растворителем:
25ºС в течение 30 мин;
40ºС в течение 7 д, 24 ч, 21 д, 70 д
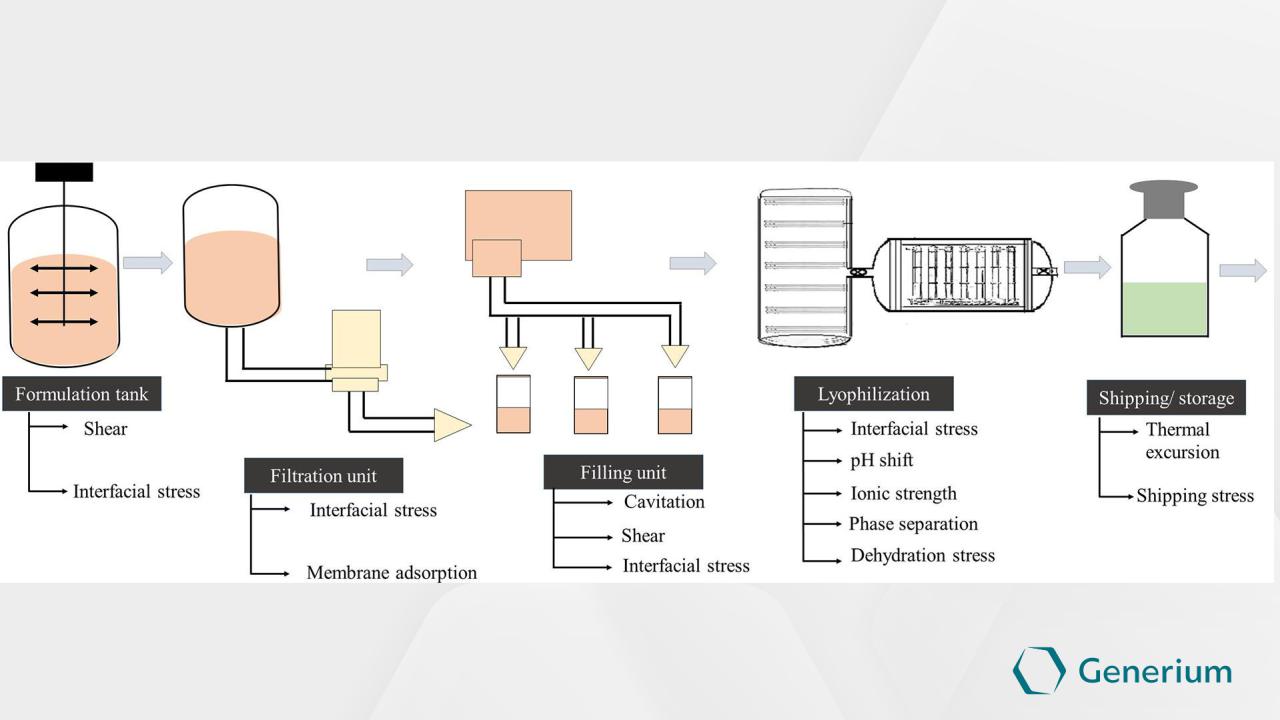
Исследование стабильности лекарственного средства
в рамках разработки технологического процесса
Раздел CTD 3.2.P.2.3 Manufacturing Process Development
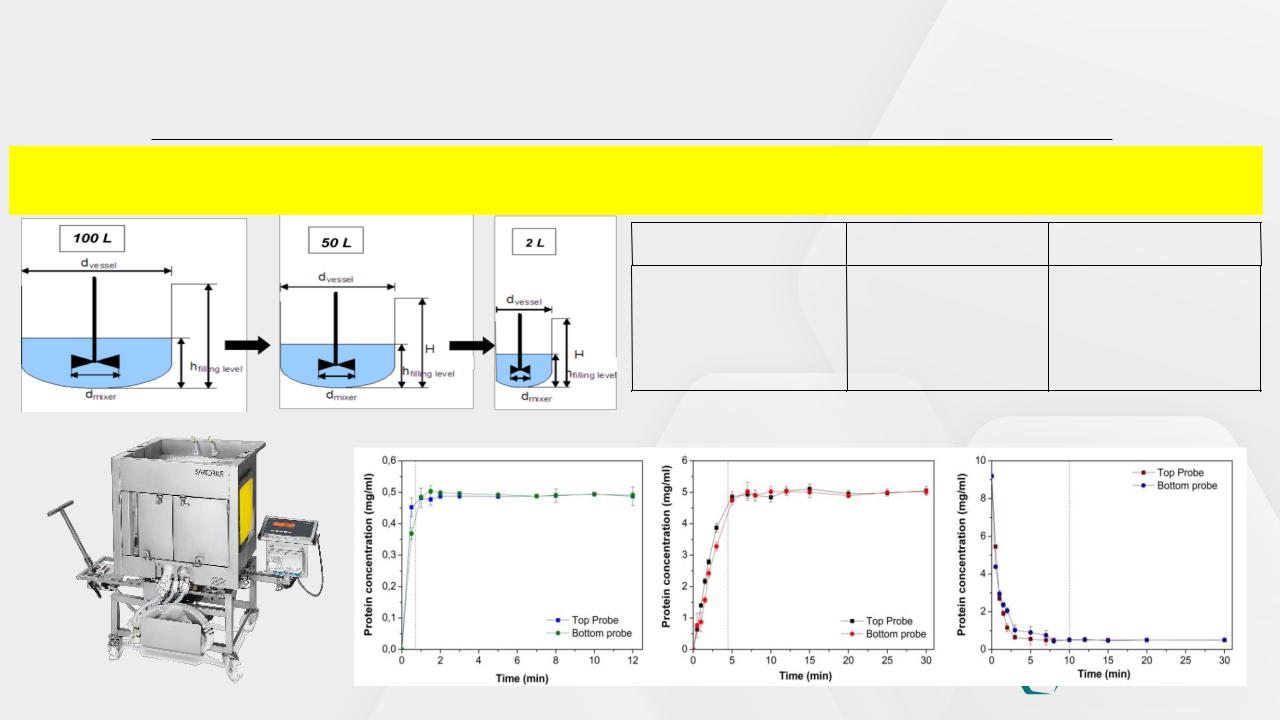
Пример: исследование стабильности субстанции-раствора GNR-045 в процессе приготовления технологического раствора
Коммерческий выпуск |
Пилотная модель |
Лабораторная модель |
|
Palletank, 100 л |
Palletank, |
50 л |
установки, 2 л |
157 мм |
150 мм |
|
|
Исследование стабильности лекарственного средства
врамках разработки технологического процесса
Исследование фотостабильности АФС и ЛП необходимо при выборе и обосновании условий хранения выбора первичной/вторичной упаковки, условий производства, включающие в себя стадию розлива маркировки и фасовки (ICH Q1B)
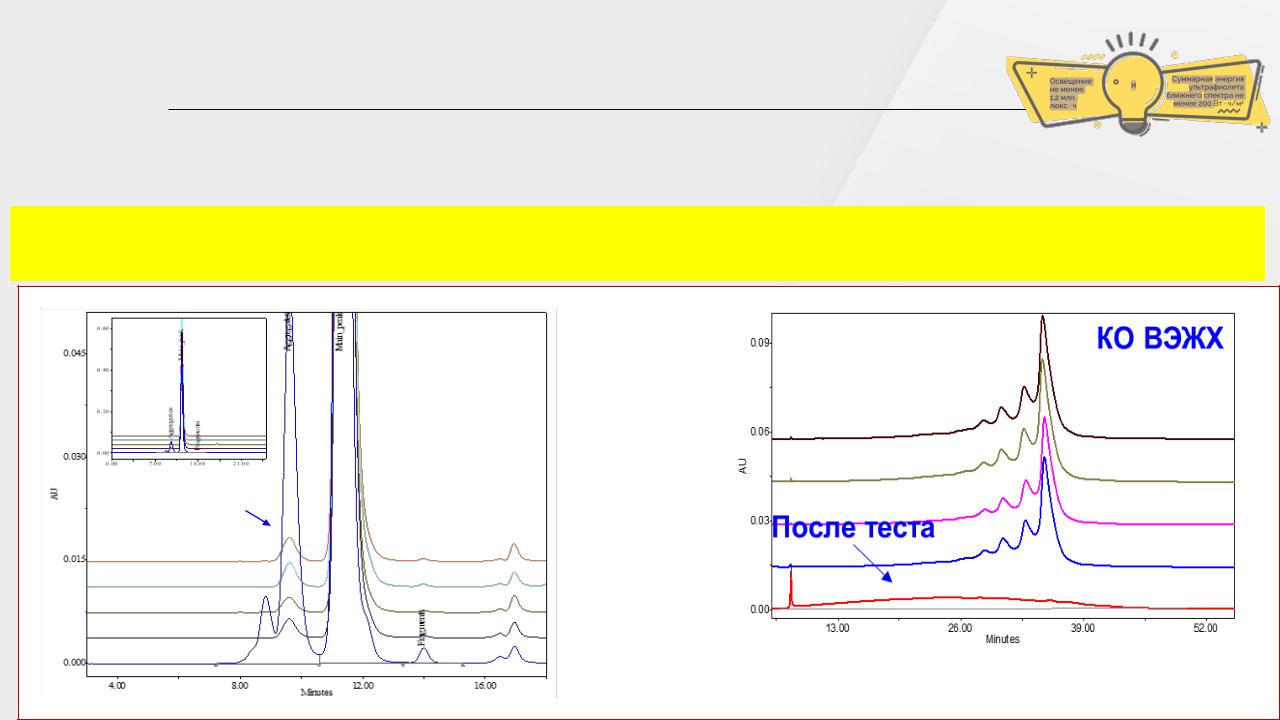
Пример: исследование фотостабильности субстанции-раствора GNR-068
в соответствии с ICH Q1B (7 сут при 6500 люкс/ч)
ГФ ВЭЖХ |
До: |
|
99,2 %; |
||
|
||
|
0,7 % ; |
|
|
0,1% |
После |
После: |
теста |
84,0 %; |
|
15,6 %; |
|
0,4 % |
До – 46,8 %; 51,3 %; 1,9 %
После – невозможно проинтегрировать пики
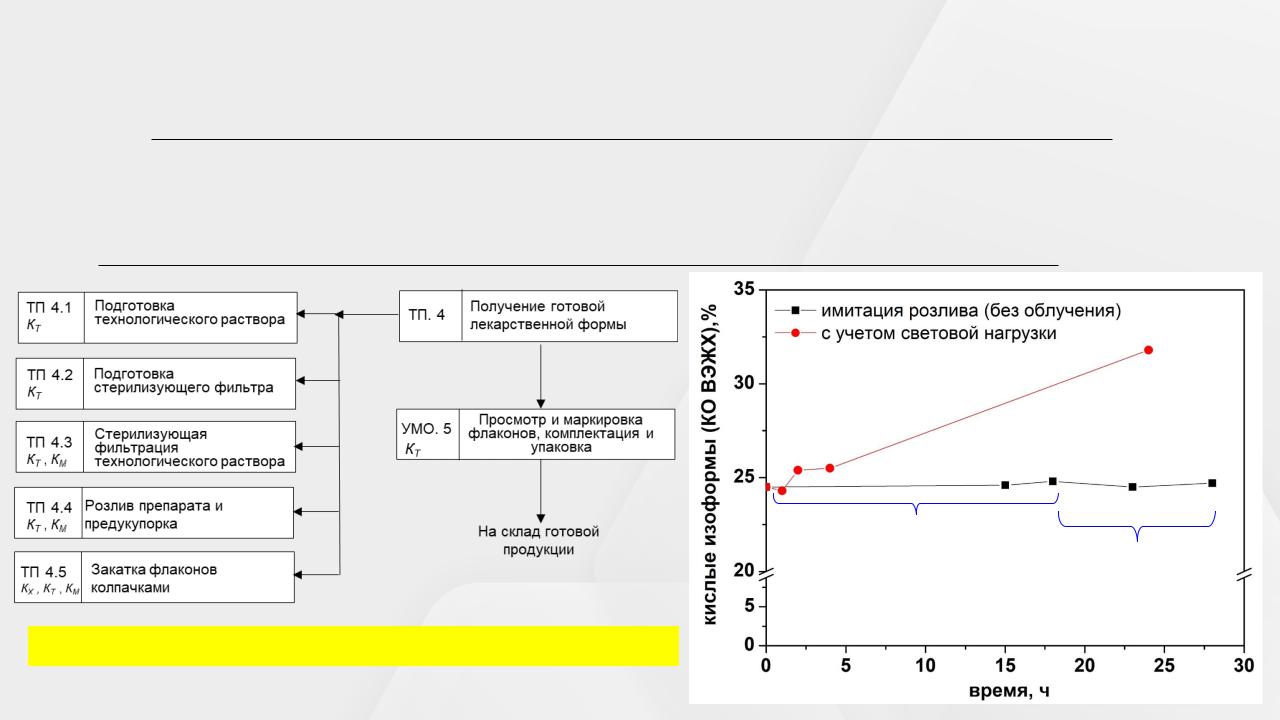
Исследование стабильности лекарственного средства
в рамках разработки технологического процесса
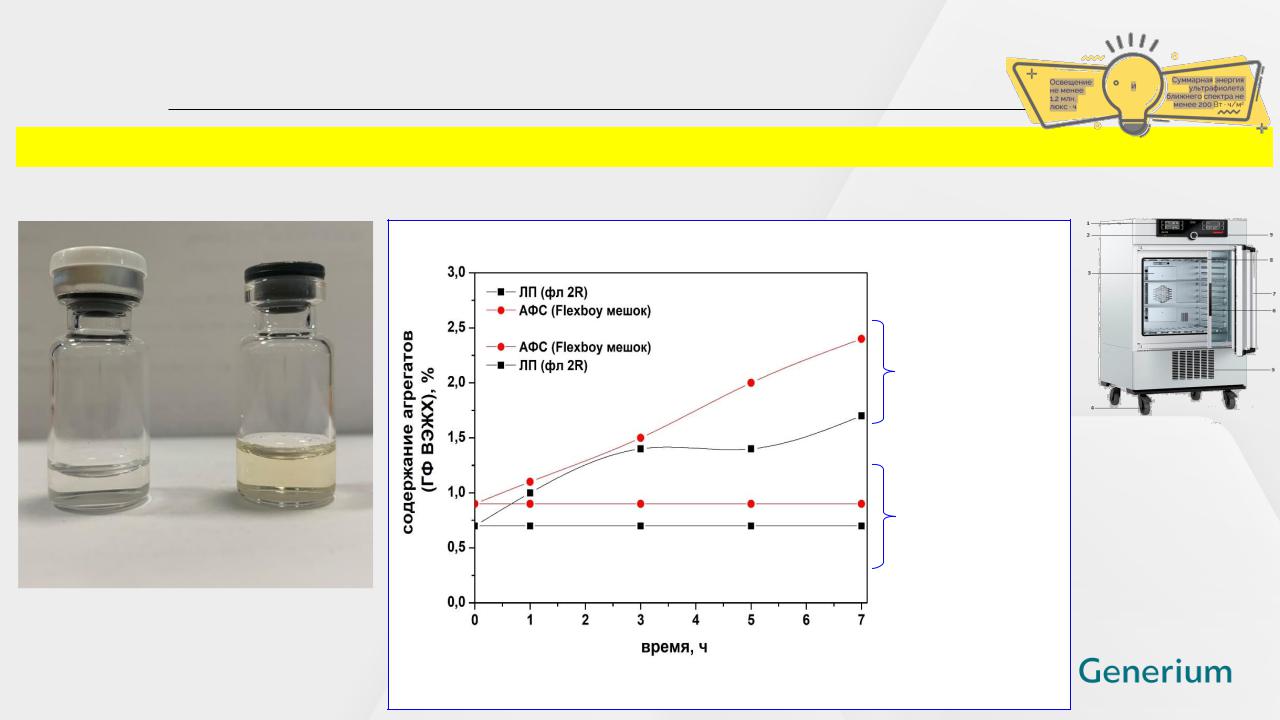
Пример: исследование стабильности субстанции-раствора под влиянием световой нагрузки
ICH Q1B: не менее 1,2 млн. люкс-ч и суммарную энергию ультрафиолета ближнего спектра не менее 200 Вт × ч/м2
Фотостабильность при комн температуре в процессе розлива
контроль тест |
Под |
|
|
|
облучением |
|
|
В защищенном |
|
|
от света |
Не превышает |
Не превышает |
месте |
эталон Y6 |
эталон Y5 |
|
Нарастание агрегатов
в АФС и ЛП GNR-068 за 3 ч облучения на 0,6% и 0,7%
Фармацевтическая разработка
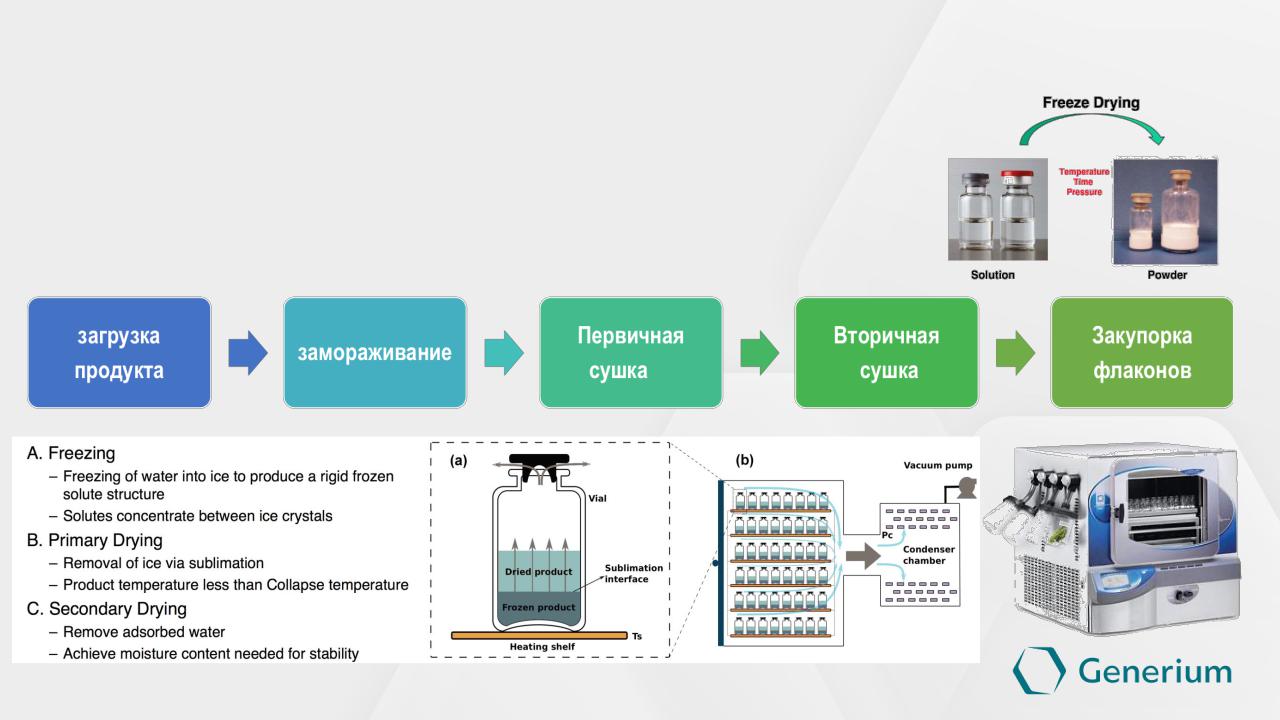
Лекарственная форма - лиофилизат
Лекарственная форма – состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого эффекта.
Лиофилизат – это твердая лекарственная форма в виде порошка или пористой массы, полученная лиофилизацией лекарственных средств жидкой или мягкой консистенции.
Основные стадии процесса лиофилизации:

