
Все лк фарм бт
.pdf

Семейство сорбентов на матрице SOURCE
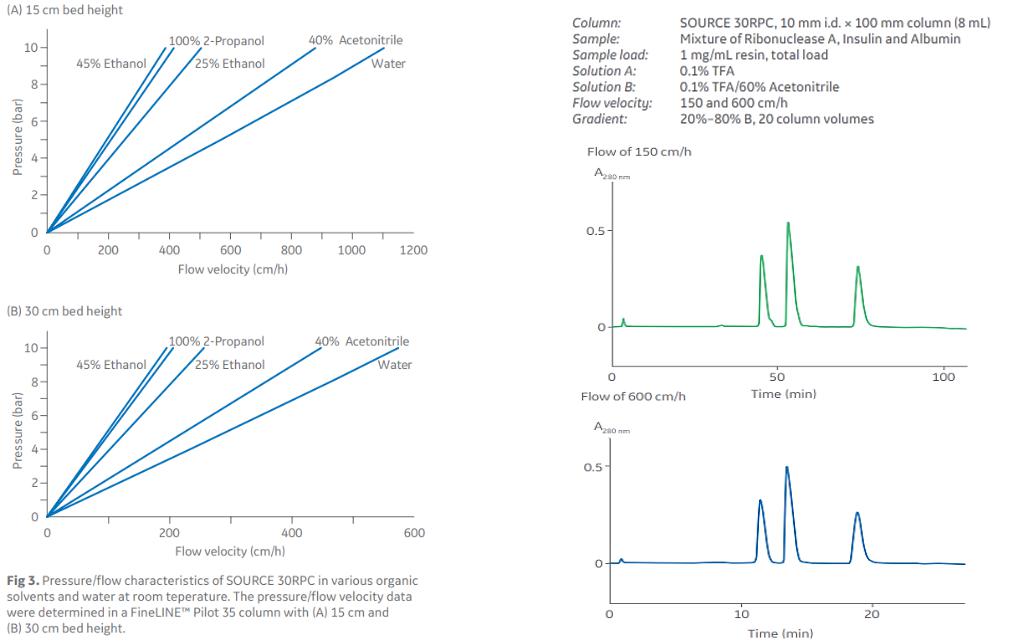
SOURCE 30 RPC – устойчивость к высоким скоростям потока
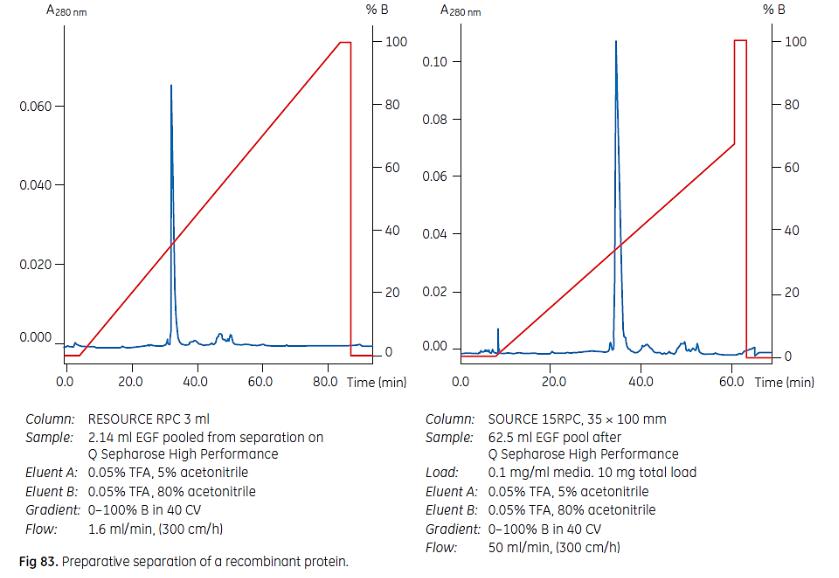
SOURCE RPC – отличная масштабируемость
Figure 83 shows a highresolution preparative separation of recombinant human epidermal growth factor (EGF) expressed in yeast. Most impurities have been removed by an initial hydrophobic interaction chromatography step on Phenyl Sepharose 6 Fast Flow (high sub) followed by ion exchange on
Q Sepharose High Performance. The final polishing step on SOURCE 15RPC was optimized on a RESOURCE 3 ml column before scale-up to a pilotscale column
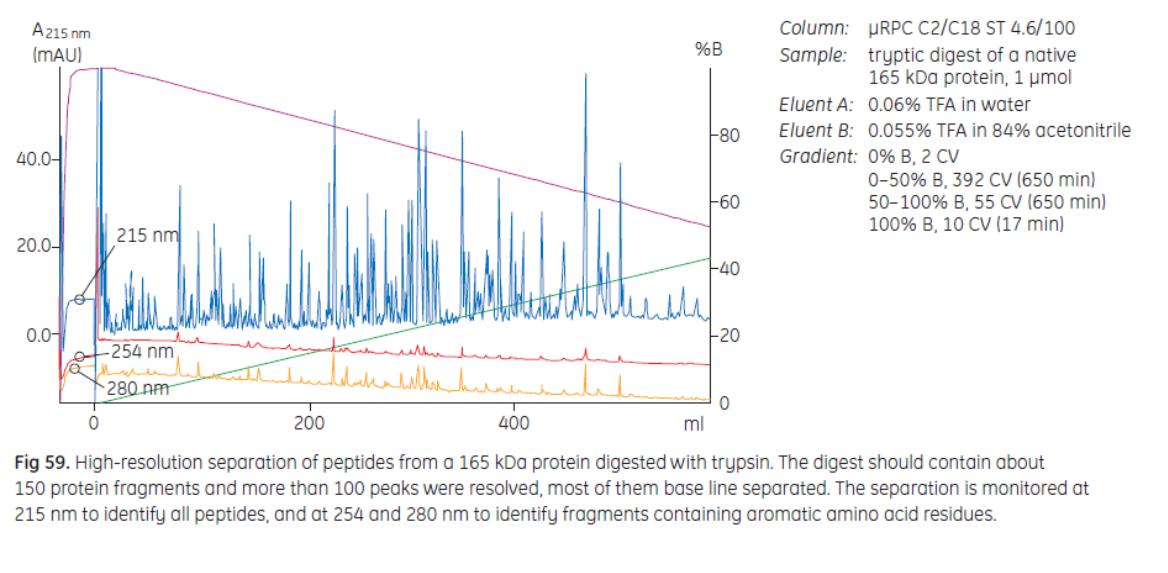
Применение RPC – пептидное картирование
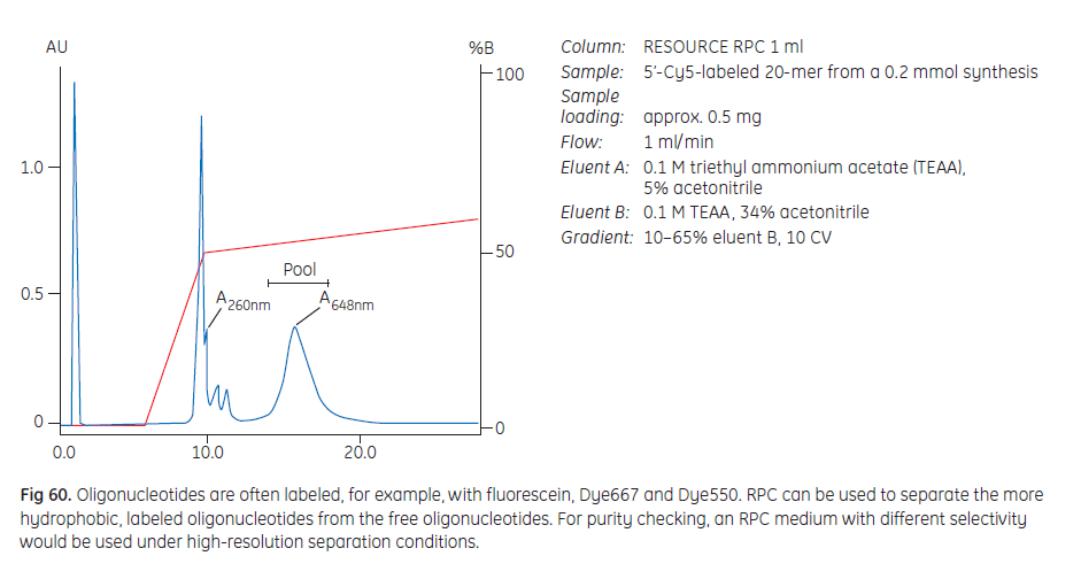
Применение RPC – разделение меченых олигонуклеотидов


ЛЕКЦИЯ НА ТЕМУ:
Механизмы деградации белковых молекул. Подбор формуляции, выбор стабилизаторов, формы готового лекарственного препарата, режим хранения. Исследование стабильности. Разработка процесса получения ГЛФ
Евдокимова Ольга Львовна
начальник лаборатории разработки формуляции Отдел фармацевтической разработки АО «ГЕНЕРИУМ»

Фармацевтическая разработка
ICH Q8 «Фармацевтическая разработка»
КАЧЕСТВО ПРЕПАРАТА ДОЛЖНО БЫТЬ ЗАЛОЖЕНО ПРИ РАЗРАБОТКЕ
Фармацевтическая разработка – комплекс исследований, направленных на создание лекарства соответствующего качества и разработку процесса его производства, чтобы постоянно выпускать продукцию с заданными характеристиками качества.
Фармацевтическая разработка направлена на научное обоснование состава лекарственного препарата в данной лекарственной форме, производственного процесса и его контроля, выбора упаковочных материалов, а также на изучение физико-химических, биологических и микробиологических свойств лекарственного средства.
Оригинальный лекарственный препарат – лекарственный препарат с новым действующим веществом, который был
первым зарегистрирован и размещен на мировом фармацевтическом рынке на основании регистрационного досье,
содержащего результаты полных доклинических (неклинических) и клинических исследований, подтверждающих его качество, безопасность и эффективность, эквивалентного по содержанию требованиям, установленным частью I приложения N 1 к Правилам регистрации и экспертизы лекарственных средств для медицинского применения.
Воспроизведенный лекарственный препарат – лекарственный препарат, имеющий такой же качественный и
количественный состав действующих веществ (активных фармацевтических субстанций) и ту же лекарственную форму, что и референтный лекарственный препарат, и биоэквивалентность которого референтному лекарственному препарату подтверждается соответствующими исследованиями биодоступности.

