
- •3. Третичная структура
- •28. Супервторичная структура. Мотивы вторичной структуры (на примере днк-связывающих белков). Силы, стабилизирующие пространственную структуру белков.
- •2. Строение β-белков
- •4. Характерные мотивы укладки белковой цепи
- •30. Структурные классы белков, типичные архитектуры и типичные мотивы укладки цепи (топологии).
- •10. Doubly wound:Двойная рана….
- •31. Складывание (folding) белков, роль молекулярных посредников. Факторы, влияющие на скорость сворачивания белков. Теория расплавленной глобулы.
- •Фолдинг белков:
- •Фолдинг белков: решеточная модель
- •Фолдинг белков: фрагментная сборка
- •32. Двигательные белки: актин, миозин, особенности их структуры, взаимодействие в процессе мышечного сокращения. Вспомогательные белки акто-миозиновой системы подвижности.
- •1.Тропомиозин:
- •2. Тропонин:
- •3. Небулин:
- •4. Титин (коннектин (сисин, конект с мужчиннами)):
- •6. Миомезин:
- •33. Глобулярные белки, выполняющие структурообразующие функции (тубулин, динеин). Строение микротрубочек, устройство аксонемы ресничек. Динамическая нестабильность микротрубочек. Map-белки.
- •34. Фибриллярные белки: коллаген (особенности первичной структуры, коллагеновая спираль; особенности сборки).
- •1. Синтез предшественника
- •2. Посттрансляционные модификации
- •3. Секреция и преобразование проколлагена
- •4. Формирование фибрилл
- •5. Созревание и формирование поперечных связей
- •35. Фибриллярные белки: a- и b-кератины, фиброин, эластин – особенности структуры, функциональная роль.
- •1. Типы мембранных белков
- •2. Суперсемейства транспортных белков
- •1. Переносчики (Carriers)
- •2. Ионные каналы (Channels)
- •3. Первичные активные транспортеры (Primary Active Transporters)
- •4. Вторичные активные транспортеры (Secondary Active Transporters)
- •5. Унипортеры (Uniporters)
- •37. Типы мембранных рецепторов: каналообразующие, тирозинпротеинкиназные (трк)-рецепторы, рецепторы, ассоциированные с g-белками; механизм действия.
- •Тирозинпротеинкиназные рецепторы (трк-рецепторы)
Антипараллельные β-шпильки:
Основной строительный блок β-белков.
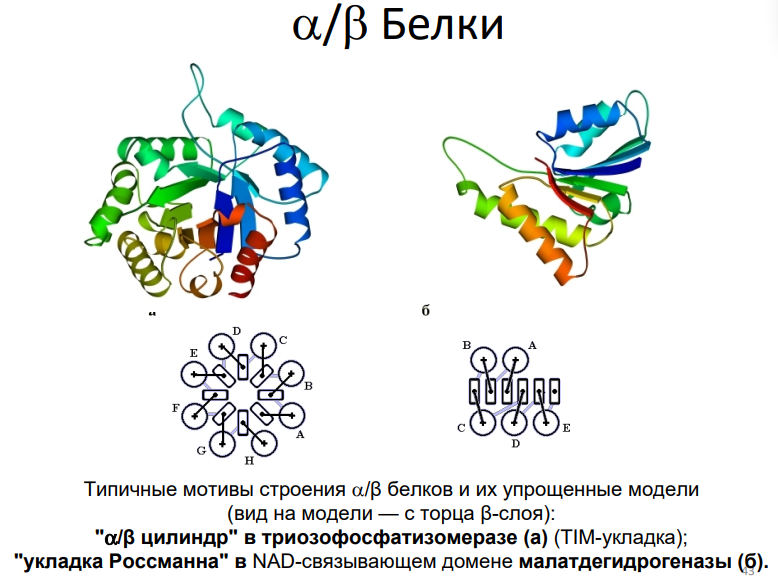
3. Строение α/β- и α+β-белков
α/β-белки:
Содержат чередующиеся α-спирали и β-листы, образующие слоистую структуру.
Примеры:
TIM-баррель (α/β-цилиндр):
Включает центральный цилиндр из β-листов, окружённый α-спиралями.
Пример: триозофосфатизомераза.
Укладка Россманна:
Чередование α-спиралей и β-листов, связывающих нуклеотиды.
α+β-белки:
Содержат отдельные области, богатые α-спиралями и β-листами, но без строгого чередования.
Пример: рибосомальный белок S6.
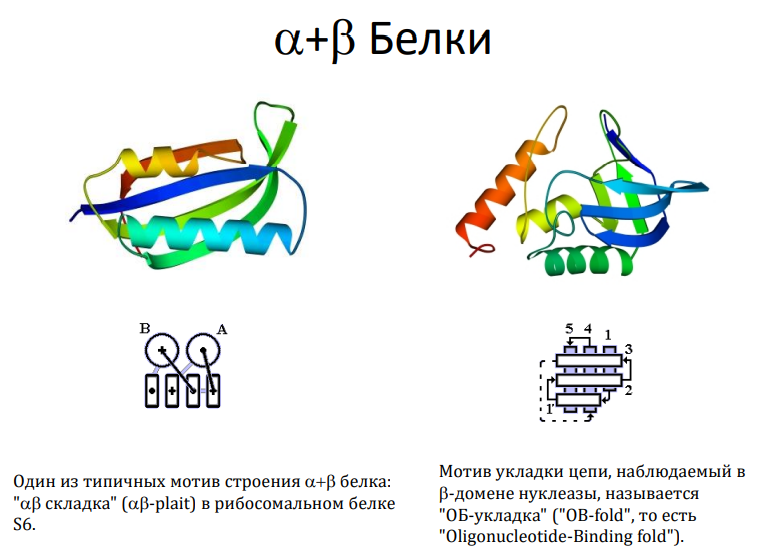
4. Характерные мотивы укладки белковой цепи
В α-белках:
Пучки α-спиралей.
Коилд-койл.
Мотивы «спираль-поворот-спираль».
В β-белках:
Мотив «греческий ключ».
β-сэндвичи и β-цилиндры.
Антипараллельные β-шпильки.
В α/β-белках:
TIM-баррель.
Укладка Россманна.
β-α-β-петли.
В α+β-белках:
Мотивы «αβ-складка».
OB-укладка (oligonucleotide-binding fold):
Пример: β-домены в нуклеазах.
30. Структурные классы белков, типичные архитектуры и типичные мотивы укладки цепи (топологии).
Структурные классы и типичные архитектуры см вопрос 29.
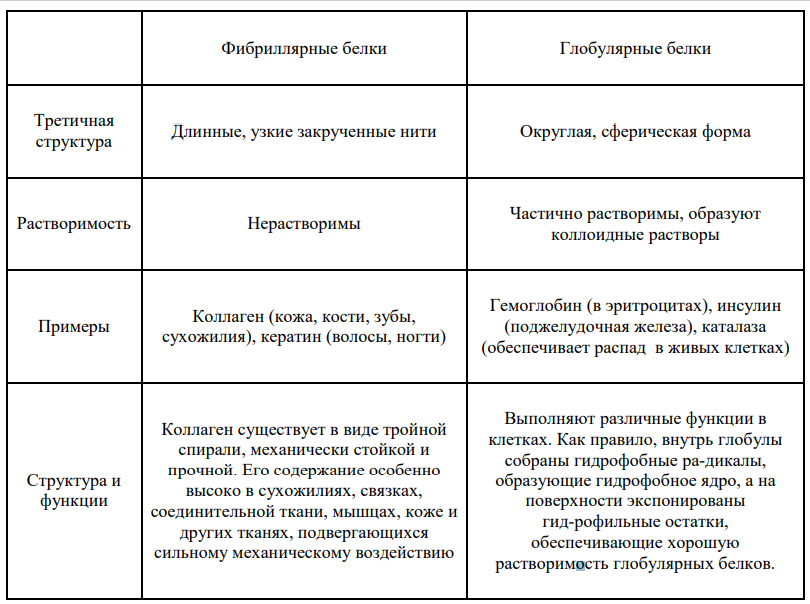
Типичные архитектуры и мотивы Белки разделяют на две группы по их общей морфологии: глобулярные и фибриллярные.
Третичная структура глобулярных белков представляет глобулу (или клубок) и имеет сферическую или округлую форму. Третичная структура фибриллярных белков имеет форму узкой закрученной нити. Кератин и коллаген — примеры фибриллярных белков.
Топология белка широко относится к форме белка. Термин использован, чтобы описать особенности белка включая ориентацию цепи белка относительно окружающих структур или относительную ориентацию бета-складок и альфа-спиралей.
Топология белка включает структурные особенности, которые являются инвариантными при непрерывных деформациях.
Взаимная ориентация регулярных вторичных, таких как альфа-спирали и бета-складки в структуре белка упоминается как топология белка. Например, две смежных взаимодействующих альфа-спирали или бета-складки могут войти в то же самое или в противоположных направлениях.
Выделены следующие главные типы пространственной структуры (вопрос 29):
1. α-Спиральные белки, построенные преимущественно из α-спиралей. Простейший структурный мотив в таких белках пучок четырех α -спиралей, оси которых более или менее параллельны. Именно такую структуру имеют миогемэритрин, Н-субъединица ферритина. Типично α -спиральными белками являются глобины.
2. β -Белки, образованные преимущественно β -складчатыми слоями. В большинстве таких белков β -слои наложены под небольшим углом или ортогональны. Примерами таких белков могут служить пепсин и другие аспартильные протеиназы, супероксиддисмутаза, большое семейство белков-переносчиков метаболитов (например, жирных кислот).
3. α/ β -Белки, в которых а-спирали и отрезки β -структуры чередуются. Обычно это приводит к формированию центрального β -складчатого листа, окруженного с обеих сторон α -спиралями, экранирующими его от воды. Этот тип пространственной структуры очень распространен. К нему принадлежат NAD-связывающие домены дегидрогеназ, триозофосфатизомераза и около десятка других белков, структурно близких к этому ферменту.
4. (α + β)-Белки, в которых α -спирали и отрезки β -структуры не чередуются, а скорее группируются с себе подобными так, что часть молекулы приобретает пространственную укладку чисто спирального типа, другая - чисто β -типа, нередко с элементами (α / β)-структуры. К этому типу, относится лизоцим куриного яйца
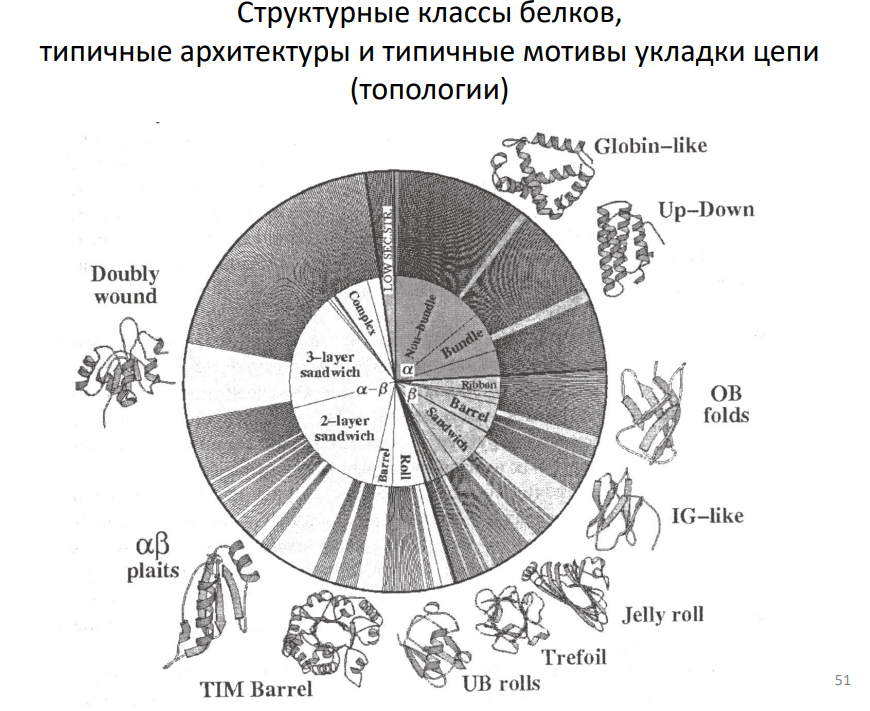
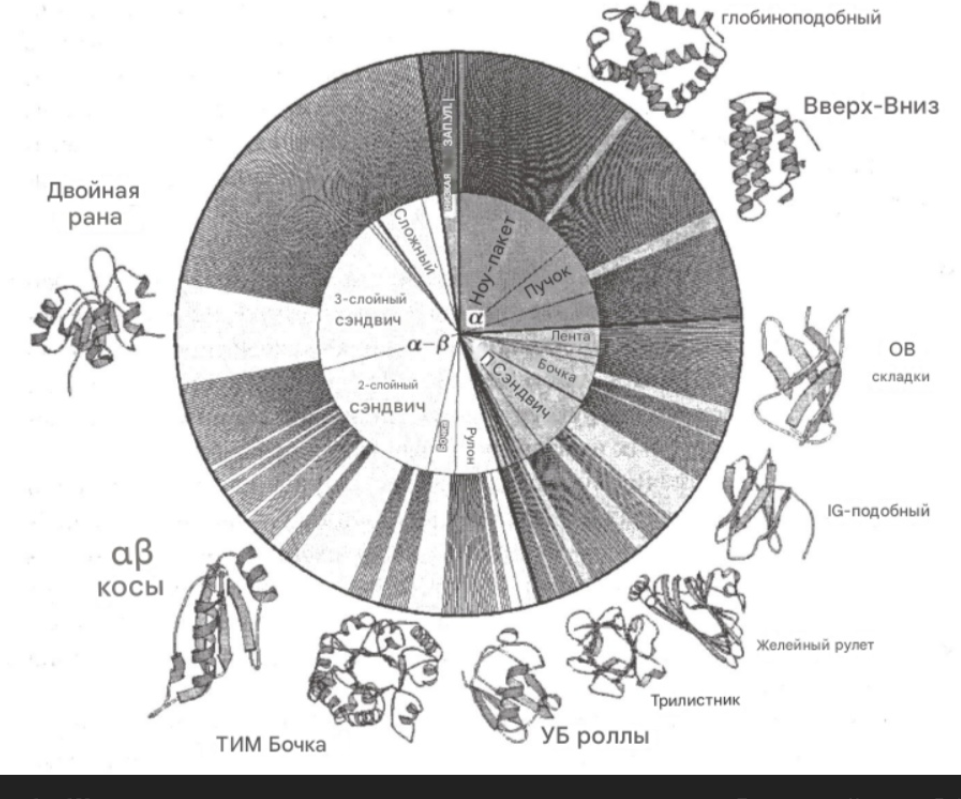
Общие архитектурные типы:
* Bundle (пучок): Это общий термин, описывающий группу параллельных или антипараллельных структурных элементов (α-спиралей или β-тяжей), плотно упакованных вместе. `α-bundle` (α-пучок) состоит из α-спиралей, а `β-bundle` (β-пучок) — из β-тяжей.
* Ribbon (лента): Обычно относится к протяженному β-листу, часто скрученному или изогнутому.
* Barrel (бочка): Замкнутая цилиндрическая структура, образованная β-тяжами (β-бочка) или α-спиралями (α-бочка, менее распространена).
* Sandwich (сэндвич): Два или более β-листа, упакованных друг против друга, как ломтики хлеба в сэндвиче. `2-layer sandwich` (двухслойный сэндвич) и `3-layer sandwich` (трехслойный сэндвич) уточняют количество слоев в такой структуре. IG-like fold (из предыдущего вопроса) — пример двухслойного β-сэндвича.
* Roll (рулет): Структура, образующаяся при скручивании β-листа в цилиндрическую форму. Jelly roll (из предыдущего вопроса) — пример такой структуры.
Более специфические термины:
* Knotted (узловатая): Белок, полипептидная цепь которого образует узел. Это относительно редкое явление.
* Complex (сложная): Этот термин слишком общий и не описывает конкретный тип архитектуры. Он может относиться к белкам, состоящим из нескольких доменов с различной укладкой, или к белкам с нерегулярной структурой.
* Low secstr: Вероятно, сокращение от "low secondary structure content" (низкое содержание вторичной структуры). Относится к белкам с большим количеством неупорядоченных участков, не формирующих α-спирали или β-листы. Иногда их называют IDP (intrinsically disordered proteins) — белки с внутренне неупорядоченной структурой.
Связь с классами белков:
* Все-α белки часто образуют `bundles(пучки)` из α-спиралей.
* Все-β белки образуют `sandwiches`, `barrels`, `rolls` и `ribbons` из β-листов.
* α/β и α+β белки могут содержать комбинации различных архитектурных элементов, включая `barrels`, `plaits` и другие более сложные структуры.
Ряд распространенных структурных мотивов и топологий, встречающихся в белках.
1. Globin-like:
* Класс: Все-α
* Архитектура: Глобулярная, состоящая из 8 α-спиралей, образующих гидрофобный карман для связывания гема (в глобинах) или других лигандов.
* Топология: Характерная укладка спиралей, обозначенная буквами от A до H.
* Примеры: Миоглобин, гемоглобин, нейроглобин.
2. Up-down:
* Класс: Все-β
* Архитектура: β-лист, состоящий из антипараллельных β-тяжей, соединенных короткими петлями. Тяжи укладываются в структуру, напоминающую меандр, где соседние тяжи идут "вверх" и "вниз".
* Топология: β-меандр. Часто встречается как часть более сложных белковых структур.
* Примеры: Некоторые домены белков, связывающих металлы.
3. OB-fold (Oligonucleotide/oligosaccharide Binding fold)(Складка, связывающая олигонуклеотид/олигосахарид) :
* Класс: Все-β
* Архитектура: Пятитяжевой β-лист, свернутый в β-бочку, с закрытой одной стороной.
* Топология: β-бочка.
* Примеры: Cold shock proteins, стафилококковый протеин А.
4. IG-like (Immunoglobulin-like):
* Класс: Все-β
* Архитектура: Два β-листа, упакованных друг против друга, образуя β-сэндвич. Каждый лист состоит из антипараллельных β-тяжей.
* Топология: β-сэндвич, греческий ключ.
* Примеры: Антитела, рецепторы клеточной поверхности.
5. Jelly roll (Swiss roll) Джелли-ролл (швейцарский рулет): Спасибо, что не Голландский штурвал(можно погуглить)
* Класс: Все-β
* Архитектура: Восемь β-тяжей, организованных в два антипараллельных β-листа, свернутых в "рулет".
* Топология: β-сэндвич.
* Примеры: Вирусные капсидные белки.
6. Trefoil:Трилистник
* Класс: Все-β
* Архитектура: Три β-листа, каждый из которых образует петлю, напоминающую лист клевера.
* Топология: Псевдотрехкратная симметрия.
* Примеры: Fibroblast growth factors (FGF).
7. UB rolls (Ubiquitin-like rolls):(убиквитиноподобные роллы)
* Класс: α+β
* Архитектура: Комбинация α-спиралей и β-листов. Характеризуется короткими β-тяжами и α-спиралями, которые обворачивают β-лист.
* Примеры: Убиквитин.
8. TIM Barrel (Triosephosphate Isomerase Barrel):триозефосфатизомеразный баррель):
* Класс: α/β
* Архитектура: Восемь параллельных β-тяжей, образующих цилиндрическую структуру (бочку), окруженную восемью α-спиралями.
* Топология: α/β-бочка.
* Примеры: Триозофосфатизомераза, многие ферменты.
9. αβ-plaits:жгуты
* Класс: α/β
* Архитектура: Параллельные β-тяжи, соединенные α-спиралями, образующими "складки".
* Примеры: Flavodoxin.
10. Doubly wound:Двойная рана….
* Класс: α/β
* Архитектура: Два β-листа, упакованных друг против друга, с α-спиралями, расположенными по обе стороны от β-листов.
* Примеры: Рибонуклеаза.
31. Складывание (folding) белков, роль молекулярных посредников. Факторы, влияющие на скорость сворачивания белков. Теория расплавленной глобулы.
Фолдинг – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру.
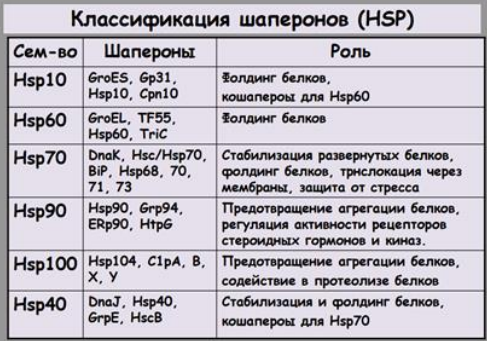
В большинстве случаев фолдинг белков изучают in vitro. С помощью специальных агентов вначале разрушают нативную структуру белка, а затем наблюдают за восстановлением исходной структуры (за ренатурацией или рефолдингом).Для обеспечения фолдинга используется группа вспомогательных белков под названием шапероны (chaperon, франц. – спутник, нянька). Они предотвращают взаимодействие новосинтезированных белков друг с другом, изолируют гидрофобные участки белков от цитоплазмы и "убирают" их внутрь молекулы, правильно располагают белковые домены. Шапероны представлены семействами, состоящими из гомологичных по строению и функциям белков, которые отличаются по характеру экспрессии и присутствию в разных компартментах клетки.
In vivo:
1. Рибосома выдает белковую цепь постепенно, с паузами (приостановка биосинтеза цепи на «редких» кодонах). Предполагается, что соответствие пауз границам структурных доменов способствует их спокойному созреванию. Ко-трансляционноесворачивание.
2. В клетке белковая цепь сворачивается под опекой специальных белков –шаперонов, которые препятствуют агрегации белков.
3. Самоорганизация белков может ускоряться некоторыми ферментами типа пролилизомеразы или дисульфид-изомеразы.
In vitro: Спонтанная самоорганизация белка происходит при ренатурации белка в растворе при соответствующих внешних условиях (малая концентрация белка, нужный окислительно восстановительный потенциал). Если белок свернулся in vitro, то он свернулся в ту же структуру, что и in vivo.
Парадокс Левинталя: самоорганизующийся белок следует по специальному «пути сворачивания», его нативная структура определяется не стабильностью, не термодинамикой, а кинетикой, т.е. она соответствует не глобальному, а просто быстро достижимому минимуму свободной энергии цепи.
Это означает, что необходимая для построения трехмерной структуры белка информация содержится в химической последовательности аминокислот в его цепи.
Отсюда и возникло представление о вспомогательных белках (или факторах) фолдинга. Затем было обнаружено, что данные факторы можно разделить на две группы.
а) Первая группа– это белки с каталитической активностью, т. е. ферменты фолдинга, или фолдазы. Пока обнаружено только два таких белка.
б) Вторая группа - молекулярные шапероны. Полагают, что сюда входят белки с самыми разными механизмами действия.
Объединяют же их следующие два обстоятельства: - они требуются в количествах, сравнимых по величине с концентрацией сворачиваемых белков; несмотря на это, они, как и фолдазы, не входят в состав конечных продуктов фолдинга. В целом, шапероны способствуют переходу структуры белков от первичного уровня до третичного и четвертичного, но они не входят в состав конечной белковой структуры.
Роль молекулярных посредников:
В клетке процесс фолдинга часто затруднен из-за высокой концентрации макромолекул, что увеличивает риск агрегации развернутых или неправильно свернутых белков. Для предотвращения этого и обеспечения правильного фолдинга существуют специальные молекулярные посредники, называемые шаперонами.
*Шапероны: Связываются с развернутыми или частично свернутыми белками, предотвращая их агрегацию и направляя процесс фолдинга по правильному пути. Они создают защищенную среду, в которой белок может правильно свернуться. Примерами шаперонов являются белки семейств Hsp70 и Hsp90.
* Шаперонины: Это крупные белковые комплексы, образующие "бочки", внутри которых белки могут сворачиваться изолированно от цитоплазмы. Примером является GroEL/GroES система у бактерий.
* Протеиндисульфидизоимеразы (PDI): Катализируют образование и перегруппировку дисульфидных связей, которые играют важную роль в стабилизации третичной структуры некоторых белков. PDI катализирует удаление промежуточных продуктов фолдинга с неправильным расположением дисульфидных мостиков
* Пептидил-пролил цис-транс изомеразы (PPI): Ускоряют изомеризацию пептидных связей, связанных с пролином, что может быть лимитирующей стадией в процессе фолдинга.
Свойства молекулярных шаперонов
•Участвуют в сборке белков и белковых комплексов (вновь синтезированных), но не входят в конечный продукт;
•Есть во всех компартментах клетки, где происходит сборка белков;
•Большинство шаперонов - ATФ-зависимые;
•Защищают белки от нежелательных процессов, в том числе от агрегации;
•Участвуют в некоторых видах внутриклеточного транспорта, предупреждая преждевременный фолдинг (митохондрии);
•Могут осуществлять рефолдинг (многие шапероны являются белками теплового шока (heat shock proteins, Hsp);
•Поддерживают ряд белков в определенной конформации, в состоянии незавершенного фолдинга (рецептор к глюкокортикоидным гормонам
Оба найденных класса шаперонов распространены почти во всех организмах
Класс 1: Hsp70(heat shock proteins) белки теплового шока
Роль: Эти белки связываются с участками развернутого полипептида, имеющими много гидрофобных оснований, и предотвращают аномальную агрегацию. Таким образом эти шапероны защищают денатурированные тепловым воздействием белки, а также только что синтезированные и еще не свернутые пептиды.
Особенности:
Молекулярная масса около 70 000( название 70)
Увеличение количества при тепловом стрессе
Некоторые шапероны облегчают образование четвертичной структуры олигомерных белков. Вместе с белками Hsp70 в цикле связывания и высвобождения полипептидов участвуют и другие белки (например, Hsp40).
Класс 2: GroEL/GroES(growth рост) необходимы для роста бактерий
Развернутые белки связываются в карманах комплекса GroEL, после чего эти карманы на некоторое время закрываются, как крышкой, белками GroES. Затем GroEL подвергается последовательным конформационным изменениям, сопряженным с гидролизом АТР, а также высвобождением GroES, способствующим фолдингу связанного полипептида.
Особенности:
Необходимость для 10-15% белков E. coli (при тепловом стрессе 30%)
Увеличение потребности при тепловом стрессе
Механизм не изучен до конца
Механизм работы шаперонов ( белок выходит из рибосом и далее)
1. Связывание: Шапероны связываются с гидрофобными участками развернутых белков.
2. Защита: Шапероны предотвращают аномальную агрегацию развернутых белков.
3. Фолдинг: Шапероны помогают белкам правильно свернуться и достичь стабильной нативной структуры.
4.Предотвращение агрегации: Шапероны предотвращают включение неправильно уложенных белков в нерастворимые и нефункциональные агрегаты.
Факторы, влияющие на скорость сворачивания белков:
* Аминокислотная последовательность: Первичная структура белка определяет его нативную конформацию и, следовательно, путь фолдинга.
* Температура: Повышение температуры может ускорить фолдинг, но слишком высокие температуры приводят к денатурации.
* pH: Изменение pH влияет на заряд аминокислотных остатков и, следовательно, на электростатические взаимодействия, важные для фолдинга.
* Концентрация солей: Ионы солей могут экранировать заряды на белке и влиять на гидрофобные взаимодействия.
* Присутствие денатурирующих агентов: Вещества, такие как мочевина или гуанидингидрохлорид, разрушают нековалентные связи, стабилизирующие белковую структуру, и приводят к денатурации.
* Молекулярные краудеры(это большие молекулы или макромолекулярные комплексы, которые занимают значительный объем в клетке и создают переполненную среду): Высокая концентрация макромолекул в клетке может влиять на фолдинг, как положительно (за счет эффекта вытеснения), так и отрицательно (за счет увеличения риска агрегации).
Модели процесса:
Фолдинг белков:
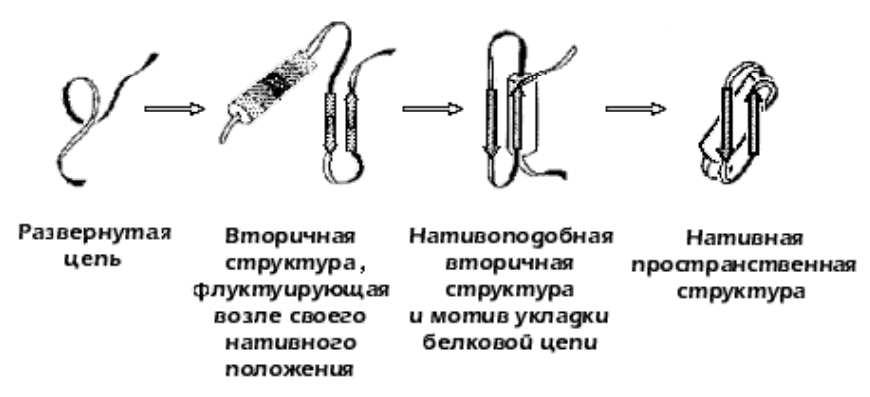
(1) Быстрое и обратимое образование локальных вторичных структур
(2) Формирование доменов посредством кооперативной агрегации складчатых ядер
(3) Формирование «расплавленной глобулы» из собранных доменов
(4) Изменение конформации доменов
(5) Конечный мономер белка
Фолдинг белков: решеточная модель
Алгоритм:
• генерируется случайная трехмерная решетка;
• определяется целевая функция из возможных взаимодействий в решетке;
• целевая функция оптимизируется методом Монте-Карло или генетическим алгоритмом
Фолдинг белков: фрагментная сборка
•В настоящий момент накоплено большое количество структур коротких пептидов. Для длины 5 в PDB есть хотя бы по одному варианту для любого аминокислотного набора.
•В близких по последовательности и функции белках одинаковые фрагменты собираются похожим образом.
•Последовательность проходится окном, для каждой последовательности рассматривается ансамбль возможных структур.
•Фолдинг получается путем выбора по одному представителю из каждого ансамбля для получения максимально согласующейся итоговой структуры с минимальной энергией.
Схема фолдинга вновь синтезированных белков в бактериальной клетке
Фолдинг белков начинается до окончания трансляции при участии шаперонов. Возможно несколько циклов укладки белка в нативную структуру
Если после этого белок продолжает находиться в состоянии незавершенного фолдинга (в виде расплавленной глобулы)
Завершение фолдинга таких белков происходит при участии шаперониновой системы
Одним из способов изучения сворачивания полипептидной цепи в трехмерную структуру является денатурация и последующая ренатурация белковой молекулы.
Теория расплавленной глобулы (0.1-1сек):
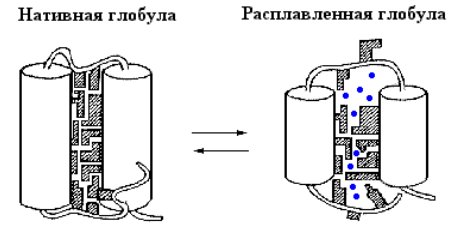
Эта теория предполагает, что на промежуточной стадии фолдинга белок существует в виде компактного, но относительно неупорядоченного состояния, называемого "расплавленной глобулой". В этом состоянии вторичная структура уже частично сформирована, но третичная структура еще не полностью определена.
Несколько этапов самосборки белков:
1. В развернутой полипептидной цепи с помощью водородных связей и гидрофобных взаимодействий образуются отдельные участки вторичной структуры, служащие как бы затравками для формирования полных вторичных и супервторичных структур.
2. Когда число этих участков достигает определенной пороговой величины, происходит переориентация боковых радикалов и переход полипептидной цепи в новую более компактную форму, причем число нековалентных связей значительно увеличивается. Характерной особенностью этой стадии является образование специфических контактов между атомами, находящимися на удаленных участках полипептидной цепи, но оказавшихся сближенными в результате образования третичной структуры.
3. На последнем этапе формируется нативная конформация белковой молекулы, связанная с замыканием дисульфидных связей и окончательной стабилизацией белковой конформации. Не исключена также неспецифическая агрегация частично свернутых полипептидных цепей, что можно квалифицировать как ошибки образования нативных белков. Частично свернутая полипептидная цепь (этап 2) называется расплавленной глобулой, а этап 3 является самым медленным при образовании зрелого белка.
Расплавленная глобула характеризуется:
* Компактностью: Размер расплавленной глобулы близок к размеру нативного белка.
* Наличием вторичной структуры: Хотя третичная структура еще не сформирована, некоторые элементы вторичной структуры, такие как α-спирали и β-листы, уже присутствуют.
* Динамичностью: Расплавленная глобула является динамическим состоянием, в котором происходят перестройки структуры до достижения нативной конформации.
В соответствии с другой моделью фолдинг начинается со спонтанного перехода полипептида в компактное состояние; действующей силой этого перехода являются гидрофобные взаимодействия между неполярными остатками. В результате подобного «гидрофобного коллапса» некоторые участки молекулы могут организовать соответствующие вторичные структуры, однако значительная часть боковых цепей аминокислотных остатков не зафиксированы окончательно.
С термодинамической точки зрения, процесс фолдинга можно представить в виде некой «воронки». Развернутые состояния характеризуются высокой конформационной энтропией и сравнительно высокой свободной энергией. По мере свертывания цепи происходит сужение «воронки», отражающее снижение числа возможных конформационных состояний. Промежуточные энергетические минимумы соответствуют частично свернутым состояниям белка, которые несколько тормозят приближение к окончательному варианту. На дне «воронки» число возможных конформаций снижается до одной-единственной нативной конформации (или одной из небольшого числа возможных нативных конформаций).

32. Двигательные белки: актин, миозин, особенности их структуры, взаимодействие в процессе мышечного сокращения. Вспомогательные белки акто-миозиновой системы подвижности.
Миозин

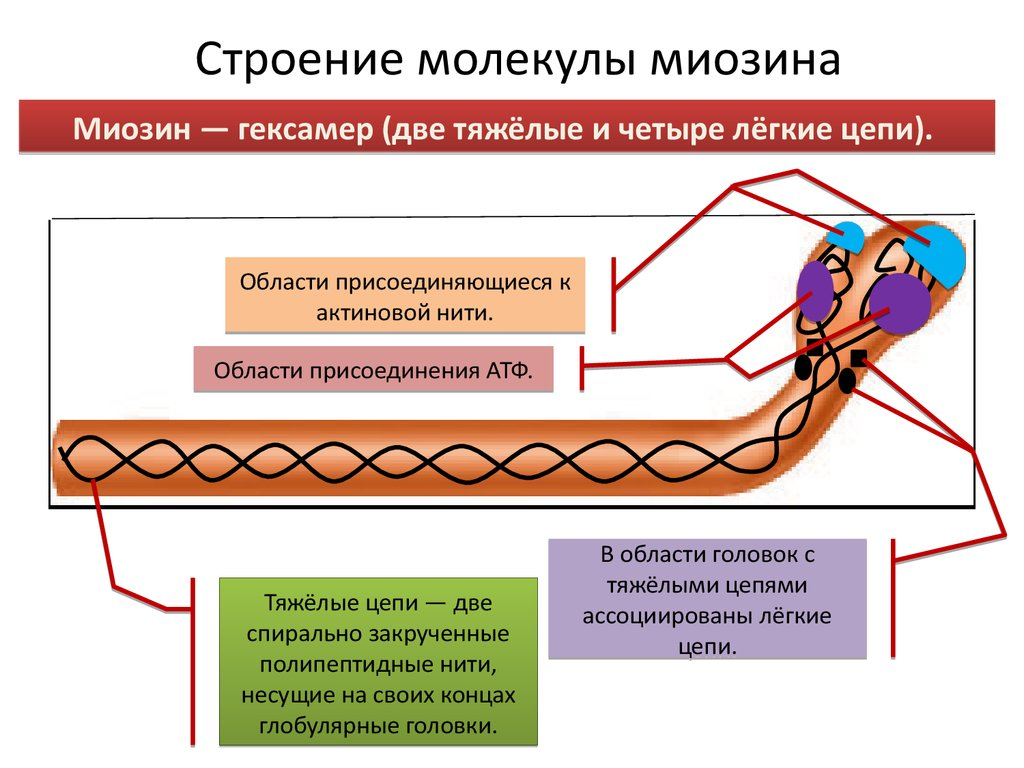
Миозин и актин - основные белки мышц. Движущей силой мышечных сокращений является взаимодействие двух белков миозина и актина. Эти белки организованы в виде нитей, скольжение которых друг относительно друга приводит к сокращению мышц. Вместе актин и миозин составляют более 80% белковой массы мышц.
Миозин (М.-540 000) состоит из шести полипептидных цепей: двух тяжелых (М.- 220 000) и четырех легких (М, 20000). Тяжелые цепи составляют основу структуры миозина. С-концы тяжелых цепей организованы в виде протяженных а-спиралей и переплетаются между собой, образуя левую суперскрученную спираль, напоминающую спираль α-кератина. На N-конце каждая тяжелая цепь содержит большой глобулярный домен с участком, на котором происходит гидролиз АТР. С глобулярными доменами связаны легкие цепи. При быстрой обработке протеазой трипсином длинный «хвост» молекулы миозина расщепляется, в результате чего образуются два фрагмента, называемые тяжелым и легким меромиозином. Содержащий глобулярную часть суб фрагмент S1, или просто «головка» миозина, отделяется от тяжелого меромиозина при обработке папаином.
«Головка» миозина представляет собой моторный участок, с помощью которого осуществляется сокращение мышц. Фрагмент S1 можно кристаллизовать. Разные типы миозина имеют различные структуры хвостов, что определяет их специфические функции.
В клетках мышц молекулы миозина агрегируют, образуя толстые нити, или филаменты. Эти палочковидные структуры служат стержнем сократительной единицы. В толстых нитях сотни молекул миозина организованы таким образом, что их «хвосты» образуют длинную биполярную структуру. Глобулярные домены выступают с каждой стороны нити в регулярном порядке.
Актин
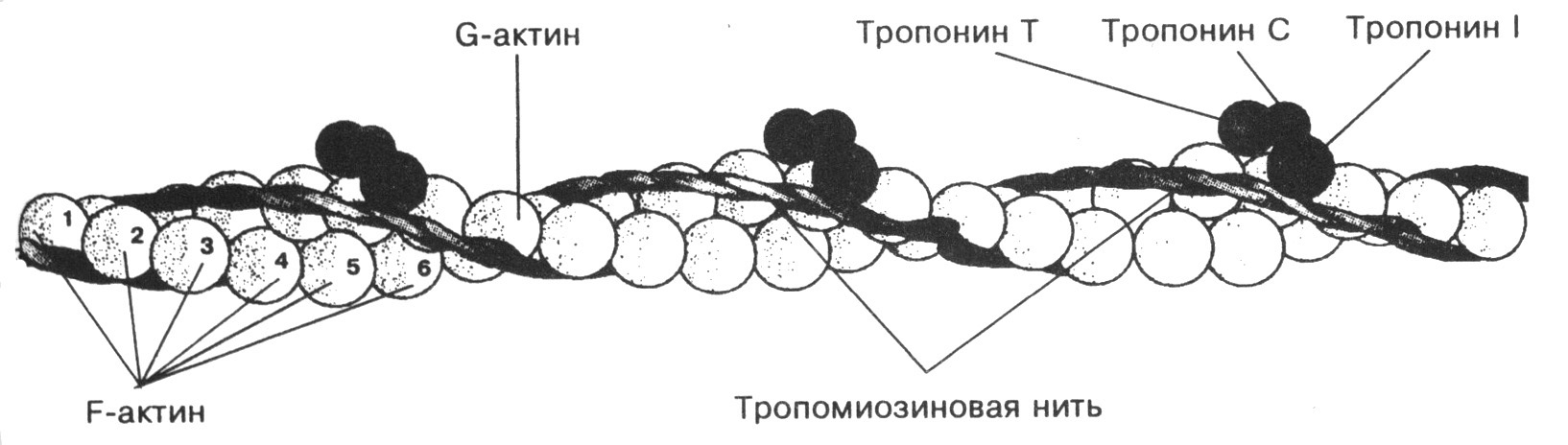
В мышцах молекулы мономерного актина - G-актина (глобулярный актин; М. - 42000) связаны в длинные полимерные цепи F-актина (фибриллярный актин). Тонкие нити (филаменты) образованы F-актином при участии белков тропонина и тропомиозина. F-актин имеет полярность (+/- концы), влияющую на направление движения миозина. Формирование тонких нитей происходит по мере последовательного присоединения мономерных молекул актина к одному концу. Кроме того, каждая молекула актина связывает молекулу АТР и гидролизует ее до ADP, так что каждый мономер актина в составе нити находится в комплексе с ADP. Таким образом, гидролиз АТР под действием актина происходит только при сборке нитей: АТР не передаст энергию непосредственно в момент сокращения мышцы. Каждый мономер актина в составе тонкой нити может специфически и прочно связываться с одной головкой молекулы миозина.
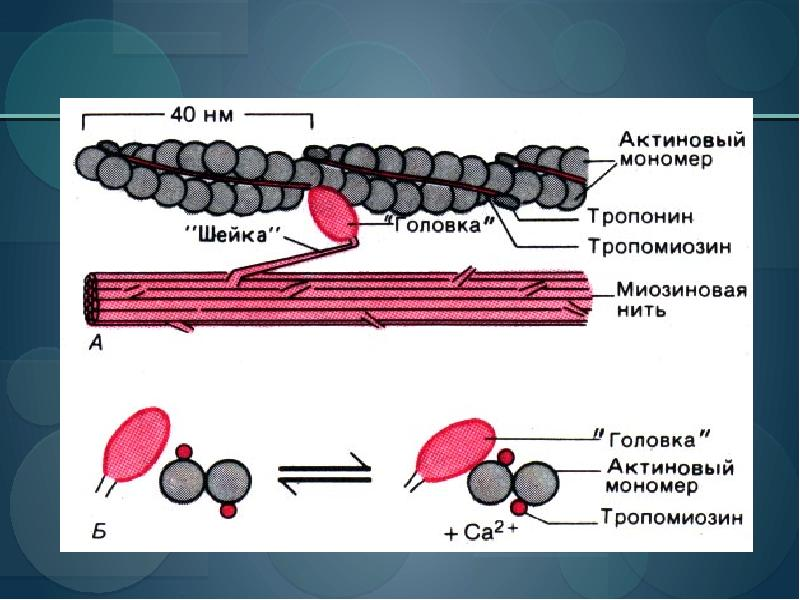
Упорядоченные структуры тонких и толстых нитей образуются при участии других белков
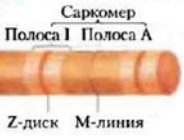
Скелетные мышцы состоят из параллельных пучков мышечных волокон. Каждое волокно представляет собой одну очень большую многоядерную клетку с диаметром от 20 до 100 мкм. Эти клетки образуются в результате слияния многих клеток и часто распространяются на длину всей мышцы. Волокно состоит примерно из 1000 миофибрилл диаметром 2 мкм, каждая из которых содержит огромное количество регулярным образом упакованных тонких и толстых нитей в комплексе с другими белками. Каждую миофибриллы окружает система плоских мембранных везикул саркоплазматический ретикулум. Под электронным микроскопом в мышечном волокне можно различить чередующиеся области высокой и низкой электронной плотности, называемые полосами А и І . Эти полосы возникают в результате специфической укладки тонких и толстых нитей, при которой они частично перекрываются.
Полоса І(актиновая) представляет собой область пучка, который в поперечном сечении состоит только из тонких нитей. Более темная полоса А (миозиновая) соответствует участку сосредоточения толстых нитей, а также включает в себя места перекрывания параллельно идущих тонких и толстых нитей.
Полоса І в середине разделена Z-диском - тонкой структурой, расположенной перпендикулярно к оси тонкой нити и служащей в качестве якоря, к которому прикрепляются тонкие нити.
Полоса А в свою очередь также разделена посредине линией М, или М-диском, областью высокой электронной плотности в центре толстых нитей. Целиком вся сократительная единица, состоящая из пучков толстых нитей, перемежающихся на обоих концах с пучками тонких нитей, называется саркомером.
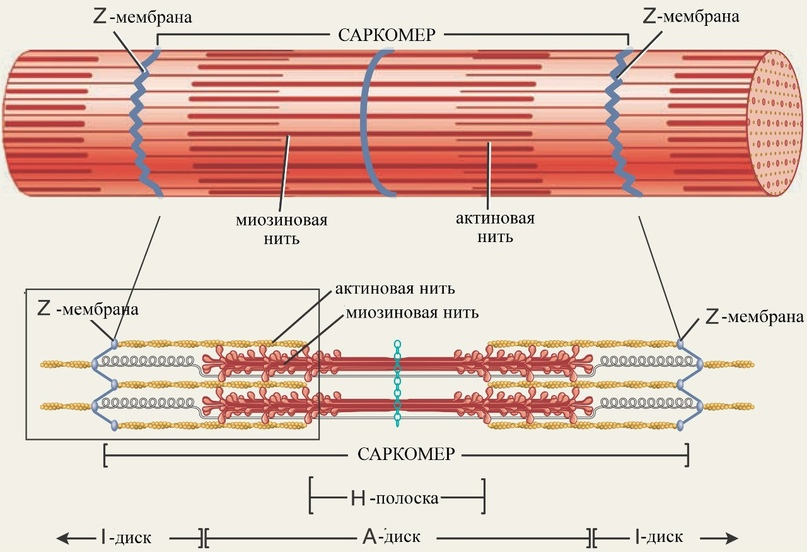
Тонкие нити актина одним концом прикреплены к Z-диску. В образовании этого контакта участвуют также белки α-актинин, десмин и виментин. Тонкие нити, кроме того, содержат гигантский белок небулин (состоит примерно из 7000 аминокислотных остатков), который, как полагают, организован в виде α-спирали, перекрывающей длину всей нити.
Аналогичным образом М-линия организует толстые филаменты. В этом участвуют такие белки, как парамиозин, С-белок и М-белок. Еще один класс белков титины наиболее крупные из известных на сегодняшний день белков, состоящих из единственной полипептидной цепи (титин сердечной мышцы человека состоит из 26926 аминокислотных остатков). Титин связывает толстые филаменты с Z-диском, обеспечивая дополнительный уровень организации всей структуры. Считается, что небулин и титин служат своего рода «молекулярной линейкой», регулирующей длину и толщину соответственно тонких и толстых филаментов. Титин простирается от Z-диска до М-линии, регулируя длину самого саркомера и предотвращая перерастяжение мышцы. Длина саркомера в разных тканях различается, что, в частности, связано с наличием в организме позвоночных нескольких вариантов титина.
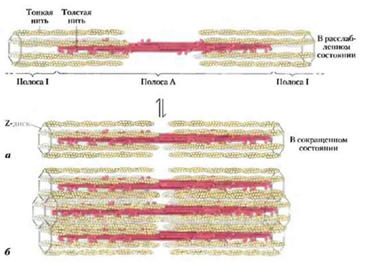
Вспомогательные белки акто-миозиновой системы: В мышцах и других клетках присутствуют вспомогательные белки, регулирующие и обеспечивающие эффективное взаимодействие актина и миозина:
1.Тропомиозин:
* Строение: Длинный, фибриллярный белок, состоящий из двух α-спиральных полипептидных цепей, скрученных друг вокруг друга. Существует несколько изоформ тропомиозина, которые экспрессируются в различных типах мышц и немышечных клетках.
* Функции: В мышечных клетках тропомиозин располагается вдоль актиновых филаментов, закрывая сайты связывания миозина. Это предотвращает взаимодействие актина и миозина в расслабленном состоянии мышцы. При повышении концентрации кальция в цитоплазме, тропомиозин смещается, открывая сайты связывания и позволяя миозину взаимодействовать с актином, что приводит к сокращению мышцы. В немышечных клетках тропомиозин участвует в регуляции организации цитоскелета и подвижности клеток.
2. Тропонин:
Комплекс из трех субъединиц:
* Тропонин C (TnC): Связывает ионы кальция. Имеет две пары сайтов связывания кальция: два высокоаффинных сайта, обычно занятых кальцием или магнием, и два низкоаффинных сайта, связывающих кальций при мышечном сокращении.
* Тропонин I (TnI): Ингибирует взаимодействие актина и миозина.
* Тропонин T (TnT): Связывает тропонин с тропомиозином.
* Функции: Тропонин является кальций-чувствительным переключателем мышечного сокращения. Связывание кальция с TnC вызывает конформационные изменения в тропониновом комплексе. Эти изменения передаются на тропомиозин, заставляя его смещаться и открывать сайты связывания миозина на актине.
3. Небулин:
* Строение: Длинный, нерастяжимый белок, состоящий из повторяющихся модулей, каждый из которых связывается с одним мономером актина. Длина небулина коррелирует с длиной тонких филаментов.
* Функции: Регулирует длину актиновых филаментов в мышцах, действуя как "линейка". Также может играть роль в стабилизации актиновых филаментов и взаимодействии актина с другими белками.
4. Титин (коннектин (сисин, конект с мужчиннами)):
* Строение: Самый большой известный белок в организме человека. Состоит из множества доменов, включая иммуноглобулиноподобные домены, фибронектиноподобные домены и PEVK-домен (богатый пролином, глутаматом, валином и лизином).
* Функции: Центрирует миозиновый филамент в саркомере, соединяя его с Z-диском. Обеспечивает эластичность мышц, возвращая саркомер к исходной длине после сокращения. Также играет роль в сборке саркомеров и передаче сигналов в мышцах.
5. α-актинин:
* Строение: Димерный белок, состоящий из двух антипараллельных мономеров. Каждый мономер содержит актин-связывающий домен.
* Функции: Сшивает актиновые филаменты в Z-диске, формируя структуру, к которой крепятся концы тонких филаментов.
6. Миомезин:
* Строение: Димерный белок, принадлежащий к семейству иммуноглобулиноподобных белков.
* Функции: Сшивает миозиновые филаменты в M-линии, поддерживая структуру толстых филаментов в центре саркомера
Механизм
Толстые нити миозина скользят по тонким нитям актина
Взаимодействие между актином и миозином, как и всех белков с лигандами, основано на действии слабых сил. Если с миозином не связана молекула АТР, то головка миозина связывается с актином. Если миозин связывает молекулу АТР и гидролизует ее до ADP и фосфата, происходит циклическая серия конформационных изменений, при которых миозин высвобождает одну субъединицу F-актина и связывает следующую за ней.
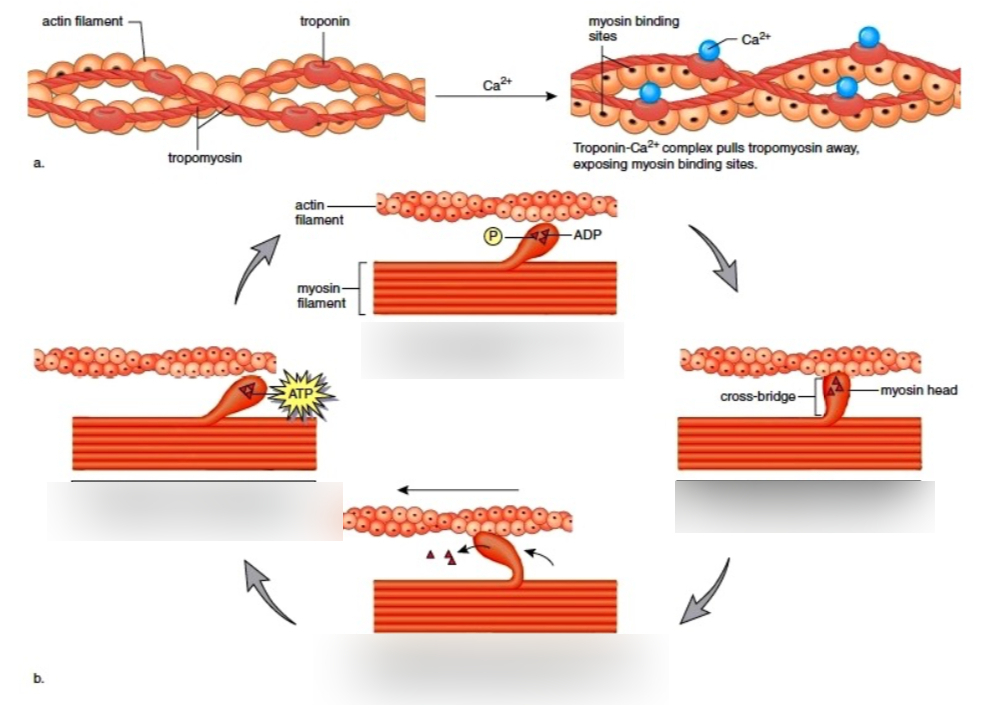
Этот цикл состоит из четырех основных стадий.
На стадии 1 молекула АТР связывается с миозином, акто-миозиновый комплекс распадается, и актин высвобождается.
На стадии 2 молекула АТР гидролизуется, вызывая конформационные изменения в белке и его переход в состояние с более высоким уровнем энергии, в результате чего «головка» миозина поворачивается и меняет свою ориентацию относительно нити актина. Затем между «головкой» миозина и следующим мономерным звеном актина, расположенным ближе к Z-диску, возникает слабая связь.
На стадии 3 от миозина отсоединяется фосфат, образовавшийся в процессе гидролиза АТР, что сопряжено с очередным конформационным изменением в молекуле миозина, приводящим к более прочному взаимодействию в актомиозиновом комплексе.
Далее на стадии 4 «головка» миозина приходит в исходное состояние, так что в результате «хвост» миозина смещается относительно нити актина в сторону Z-диска. В завершение цикла молекула ADP высвобождается.
В результате каждого такого цикла совершается работа, эквивалентная 3-4 пН, и толстая нить смещается относительно тонкой нити на 5-10 нм.
На толстой нити находится множество «головок» миозина, и в каждый конкретный момент лишь немногие из них (вероятно, 1-3%) связаны с тонкими нитями. Это не позволяет толстой нити проскальзывать назад в тот момент, когда отдельная «головка» миозина высвобождает субъединицу актина, с которой была связана. Таким образом толстые нити активно сдвигаются относительно тонких нитей. Этот процесс, скоординированный во всех саркомерах мышечного волокна, приводит к сокращению мышцы.
Взаимодействие между актином и миозином должно регулироваться таким образом, чтобы мышечное сокращение происходило только в ответ на соответствующий сигнал нервной системы. Эта регуляция осуществляется с помощью двух белков тропомиозина и тропонина. Тропомиозин связывается с тонкими нитями и блокирует центры связывания «головок» миозина. Тропонин является Са2+-связывающим белком. Нервный импульс вызывает высвобождение Са2+ из саркоплазматического ретикулума. Ионы Са2+ связываются с тропонином (еще один пример взаимодействия белка с лигандом), что приводит к конформационным изменениям в комплексе тропонина с тропомиозином, в результате которых освобождается участок связывания миозина на тонкой нити. Происходит мышечное сокращение.
Миозин - это не просто белок, связывающий актин, но еще и фермент (АТРаза), тк он окисляет ATP до ADP.
Регуляция мышечного сокращения тропомиозином и тропонином. Тропомиозин и тропонин связаны с F-актином в тонких мышечных волокнах. При расслаблении мышцы оба белка располагаются вокруг актинового волокна, блокируя участки связывания миозина. Тропомиозин представляет собой α-спиральный белок, состоящий из двух пептидов, образующих двойную спираль (тот же структурный мотив, что и в α-кератине). Он образует полимеры типа «голова-хвост», которые закручиваются вокруг двух цепей актина. Тропонин присоединяется к комплексу актин/тропомиозин через регулярные интервалы 38,5 нм. Тропонин состоит из трех различных субъединиц: І, С и Т.
Когда мышца получает сигнал начать сокращение, из саркоплазматического ретикулума высвобождаются ионы кальция и связываются с тропонином С. Это приводит к конформационным изменениям в тропонине С, который меняет положение тропонина І и тропомиозина таким образом, что ингибирование тропонином І снимается, и мышечное сокращение становится возможным.
33. Глобулярные белки, выполняющие структурообразующие функции (тубулин, динеин). Строение микротрубочек, устройство аксонемы ресничек. Динамическая нестабильность микротрубочек. Map-белки.
Глобулярные белки́ — белки, в молекулах которых полипептидные цепи плотно свёрнуты в компактные шарообразные структуры — глобулы (третичные структуры белка) Глобулярная структура белков обусловлена гидрофобно-гидрофильными взаимодействиями. К глобулярным белкам относятся ферменты, иммуноглобулины, некоторые гормоны белковой природы (например, инсулин) а также другие белки, выполняющие транспортные, регуляторные и вспомогательные функции.
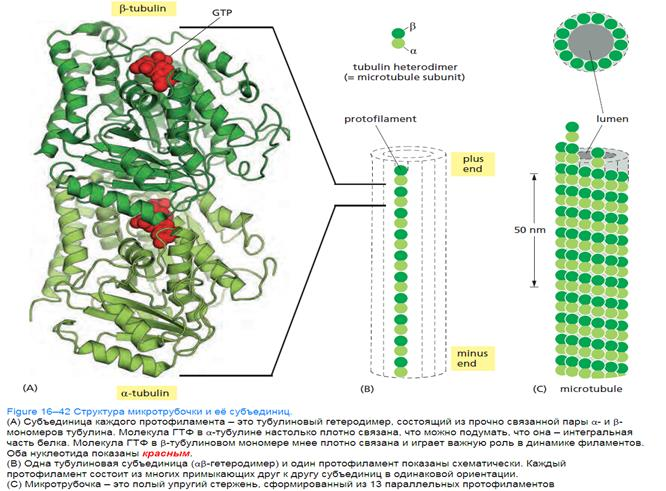
Тубулин – это глобулярный белок, существующий в виде димера α- и β - субъединиц с М~55 кДа. Каждая субъединица содержит около 450 аминокислот, и АКП (аминокислотные последовательности) субъединиц гомологичны друг другу примерно на 40%. Тубулин – GTP (Гуанозин-5'-трифосфат (ГТФ) или дифостат если D) -связывающий белок, причем β -субъединица содержит лабильно связанную молекулу GTP или GDP, способную обмениваться с GTP в растворе, а α-субъединица – прочно связанную молекулу GTP.
Белки транслокаторы
Динеины — это группа моторных белков, которые перемещаются по поверхности микротрубочек цитоскелета и преобразуют химическую энергию, содержащуюся в АТФ, в механическую энергию движения, транспортируя различные грузы, такие как везикулы и митохондрии. Динеины движутся по микротрубочкам от плюс-концов к минус-концам, которые обычно закреплены в районе клеточного центра. В отличие от динеинов, кинезины перемещаются в противоположном направлении. В аксонах динеины осуществляют ретроградный транспорт. Также динеины бывают задействованы в движении хромосом и влияют на месторасположение веретена деления при делении клетки. (принцип похода аналогичен кинезинам)
Кинезины – движутся по микротрубочкам в направлении от минуса к плюсу (т.е от центросомы к клеточной периферии) Динеины – от плюса к минусу.
Строение(обоих белков): хвост + голова, к хвосту крепится то, что нужно транспортировать (органеллы, продукты синтеза). Хвост липофилен для крепления веществ. Чтобы головки не слипались, они гидрофобны.
В исходном положении головка кинезина, не связанная с микротрубочкой, содержит молекулу АДФ. Другая головка, которая в это время контактирует с микротрубочкой, свободна от нуклеотидов. После связывания АТР второй головкой изменяется конформация молекулы кинезина, в результате чего первая головка, содержащая АДФ, смещается вправо. После отсоединения АДФ свободная головка связывается с микротрубочкой. Затем происходят гидролиз АТФ и отсоединение фосфата (Рi), в результате чего головка, с которой связана молекула АДФ, отходит от микротрубочки. В конечном положении углы наклона головок кинезина относительно микротрубочки такие же, как в исходном состоянии , но при этом молекула кинезина оказывается смещенной вдоль микротрубочки на расстояние, соответствующее двум мономерным звеньям тубулина α и тубулина β.
До сих пор не совсем понятно, каким образом молекула кинезина «шагает». Весьма вероятно, что на определенной стадии происходит поворот рычагов относительно хвоста кинезинового димера. Один «шаг» димерного комплекса кинезина приводит к его смещению вдоль микротрубочки на расстояние S = 8 нм. Длина «шага» S в точности соответствует размеру двух мономерных глобул (α- и β-тубулина), из которых построена микротрубочка. Молекула кинезина обычно совершает не менее 100 «шагов», прежде чем отделиться от микротрубочки. За одну секунду он делает приблизительно 100 «шагов», перемещаясь за это время на расстояние 800 нм.
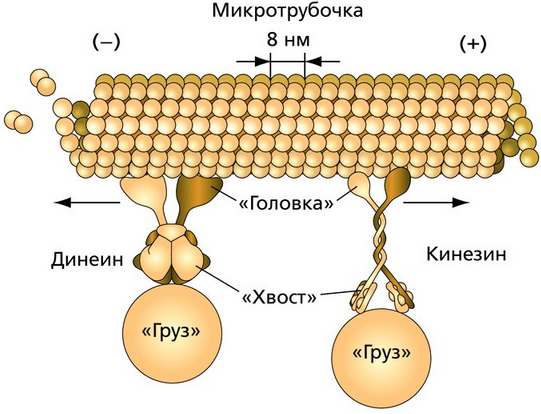
Механизм работы динеина
Движение головки динеина сопровождается разложением молекулы АТФ и высвобождением молекул АДФ и фосфата, при этом кольцевой домен поворачивается относительно “хвоста” тяжелой цепи. Динеины являются одними из самых быстрых молекулярных моторов, способных вызывать скольжение микротрубочек со скоростью до 14 мкм/с.
Роль динеина в клетке
Транспорт грузов: Цитоплазматические динеины перемещают различные клеточные компоненты.
Деление клетки: Динеины участвуют в движении хромосом и влияют на расположение веретена деления.
Подвижность клеток: В аксонах динеины осуществляют ретроградный транспорт.
Таким образом, динеины играют ключевую роль в различных клеточных процессах, обеспечивая транспорт и правильное распределение клеточных компонентов.
Строение микротрубочек
МТ имеет форму полого цилиндра, стенка которого состоит из линейных цепочек тубулиновых димеров, так называемых протофиламентов. В протофиламентах α-субъединица предыдущего димера соединена с β- субъединицей следующего. Димеры в соседних протофиламентах смещены друг относительно друга, образуя спиральные ряды.
МТ – диаметр около 25 нм, длина до нескольких десятков микрометров; толщина их стенок – около 6 нм. Они являются обязательным компонентом цитоплазмы эукариотических клеток. Микротрубочки образуют веретено деления (ахроматиновую фигуру) в митозе и в мейозе, аксонему (центральную структуру) подвижных ресничек и жгутиков, стенку центриолей и базальных телец.
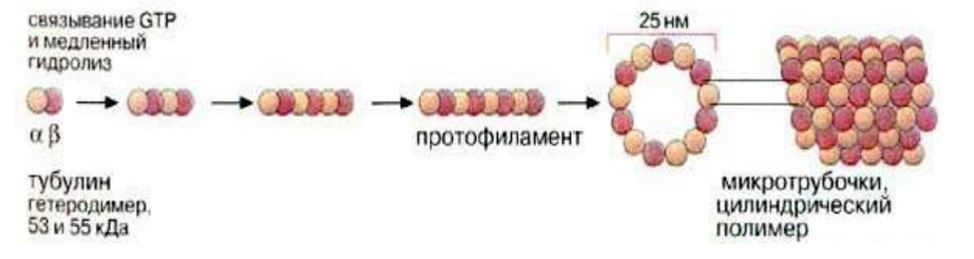

Тубулин способен к спонтанной полимеризации in vitro. Такая полимеризация возможна при физиологических температурах и благоприятных ионных условиях (отсутствие ионов Ca2+) и требует наличия двух факторов: высокой концентрации тубулина и присутствия GTP. Полимеризация сопровождается гидролизом GTP, и тубулин в составе МТ остается связанным с GDP, а неорганический фосфат выходит в раствор.
Полимеризация тубулина состоит из двух фаз: нуклеации и элонгации. При нуклеации происходит формирование затравок, а при элонгации – их удлинение с образованием МТ.
Есть положительный и отрицательный концы, с положительного конца МТ растет, с отрицательного разбирается в случае необходимости (низкая концентрация мономера). В клетке (-)-концы МТ, как правило, ассоциированы с центросомой, а (+)-концы направлены к периферии и нередко доходят до самого края клетки.
Полимеризацию и деполимеризацию МТ индуцируют изменениями температуры, ионных условий или использованием специальных химических агентов. Среди веществ, вызывающих необратимую разборку, широко используются индольные алкалоиды (колхицин, винбластин, винкристин и др.).
Устройство аксонемы ресничек
Базальное тельце
Лежащее в цитоплазме клетки основание аксонемы — кинетосома, или базальное тельце — нередко связанное с клеточным центром, отличается от дистальной части аксонемы тем, что в ней отсутствуют центральные микротрубочки, а на периферии располагается девять триплетов, а не дублетов. Базальное тельце жгутика играет роль центра организации микротрубочек (ЦОМТ) при самосборке аксонемы. С ним обычно связан так называемый корешковый аппарат — система фибриллярных элементов, образующих несколько закономерно расположенных лент (корешков), уходящих от базального тельца в цитоплазму.
Аксонема — это центральная структура ресничек и жгутиков эукариотических клеток, обеспечивающая их подвижность и выполняющая роль цитоскелета. Аксонема состоит из микротрубочек, организованных в характерную структуру, и множества белков, необходимых для её функционирования.
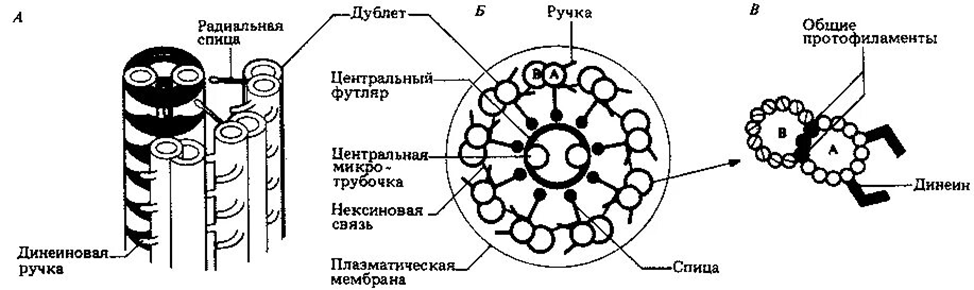
Основные компоненты аксонемы:
1. Микротрубочки:
· Дублеты микротрубочек: Аксонема состоит из девяти внешних дуплетов микротрубочек, образующих кольцо вокруг центральной пары микротрубочек (структура 9 + 2).
· Центральные микротрубочки: Две одинокие микротрубочки в центре.
2. Динеиновые ручки:
· Двигательные комплексы: Динеиновые ручки прикреплены к дублетам микротрубочек и создают усилие, необходимое для изгибания аксонемы.
· Механизм действия: Динеины скользят по микротрубочкам, вызывая их взаимное перемещение и изгиб аксонемы.
3. Радиальные спицы:
· Белковый комплекс: Т-образные структуры, соединяющие периферические дублеты микротрубочек с центральной парой микротрубочек.
· Функция: Регулируют движение аксонемы и поддерживают её структурную целостность.
4. Нексиновые связи:
· Межмикротрубочковые связи: Соединяют соседние дублеты микротрубочек, обеспечивая их координацию и синхронное движение.
Структура аксонемы в первичной и подвижной ресничках:
Первичные реснички:
Структура: Состоят из девяти внешних дуплетов микротрубочек без центральных микротрубочек и динеиновых ручек (структура 9 + 0).
Функция: Выполняют сенсорные функции, например, в фоторецепторах сетчатки.
Подвижные реснички:
Структура: Имеют девять дуплетов микротрубочек, окружающих две центральные микротрубочки (структура 9 + 2).
Функция: Обеспечивают подвижность, как, например, в сперматозоидах или клетках дыхательных путей.
Основные различия в структуре аксонемы:
Компонент |
Подвижные реснички (9+2) |
Первичные реснички (9+0) |
Центральные микротрубочки |
Присутствуют (2 штуки) |
Отсутствуют |
Динеиновые ручки |
Присутствуют |
Отсутствуют |
Подвижность |
Подвижны |
Неподвижны |
Функция |
Движение |
Сенсорная |
Процесс движения ресничек и жгутиков:
Скольжение микротрубочек: когда динеиновые ручки активируются, они скользят по соседним микротрубочкам, вызывая изгиб аксонемы.
Синхронное движение: Микротрубочки на одной стороне аксонемы тянут вниз, а на другой стороне — вверх, что приводит к волнообразному движению ресничек или жгутиков.
Динамическая нестабильность МТ
При постоянном количестве полимера происходит спонтанный рост или укорочение отдельных МТ вплоть до полного их исчезновения. Из-за запаздывания гидролиза GTP по отношению к встраиванию тубулина на конце МТ, находящейся в процессе роста, формируется GTP-кэп, состоящий из 9-18 молекул GTP-тубулина.
GTP-кэп стабилизирует конец МТ и способствует ее дальнейшему росту. Если же скорость включения новых гетеродимеров оказывается меньше скорости гидролиза GTP или в случае механического разрыва МТ, образуется конец, лишенный GTP-кэпа. Такой конец обладает пониженным сродством к новым молекулам тубулина; он начинает разбираться.

Белки, ассоциированные с микротрубочками (MAP)
Белки, ассоциированные с микротрубочками (MAPs), играют ключевую роль в поддержании и регуляции структуры микротрубочек в клетках. Эти белки связываются с субъединицами микротрубочек, влияя на их полимеризацию и деполимеризацию, а также на взаимодействие микротрубочек с другими клеточными компонентами.
Общие свойства структурных MAP
Ассоциация с микротрубочками:
Постоянно связаны с микротрубочками.
Связываются с C-концевой частью молекулы тубулина (~4 кДа).
Функции:
Регуляция стабильности микротрубочек, стимулирование полимеризации.
Стабилизация и дестабилизация микротрубочек.
Направление микротрубочек к специфическим клеточным местоположениям.
Перекрестное связывание микротрубочек.
Взаимодействие микротрубочек с другими белками.
Механизмы действия:
Связываются как с полимеризованным, так и с деполимеризованным тубулином.
C-концевой домен связывается с тубулином, N-концевой домен может связываться с везикулами, промежуточными филаментами или другими микротрубочками.
Регуляция:
Регуляция связывания MAP осуществляется через фосфорилирование белков киназами (например, MARK).
Фосфорилирование вызывает отсоединение MAP от микротрубочек, что обычно приводит к их дестабилизации.
Основные типы MAP
MAP1 (MAP1A и MAP1B):
Присутствуют в аксонах и дендритах нервных клеток.
Связываются с микротрубочками через зарядовые взаимодействия.
C-концы связываются с микротрубочками, а N-концы — с другими частями цитоскелета или плазматической мембраной.
MAP1B участвует в контроле расстояния между микротрубочками.
MAP2:
Обнаруживается исключительно в дендритах нервных клеток млекопитающих.
Стабилизирует микротрубочки путем связывания с их внешней поверхностью.
Термоcтабильный белок, сохраняет свойства после нагревания до 90°C.
Связывается кооперативным образом, способствуя стабилизации микротрубочек.
Tau-белки:
Присутствуют в аксонах нервных клеток.
Стабилизируют микротрубочки и способствуют их сшиванию.
Роль в патологии:
При болезни Альцгеймера наблюдается гиперфосфорилирование тау.
Гиперфосфорилированные тау-белки отсоединяются от микротрубочек, что снижает их стабильность и приводит к дисфункции нейронов.
MAP4:
Присутствует во всех типах клеток.
Стабилизирует микротрубочки.
Участвует в процессах клеточного деления.
34. Фибриллярные белки: коллаген (особенности первичной структуры, коллагеновая спираль; особенности сборки).
Фибриллярные белки не растворяются в воде, что связано с высокой концентрацией гидрофобных аминокислотных остатков как внутри белка, так и на его поверхности. Гидрофобные поверхности белков в значительной степени скрыты, поскольку сходные полипептидные цепи укладываются рядом и образуют надмолекулярные комплексы..
Коллагены представляют собой семейство, состоящее более чем из 20 различных белков внеклеточного матрикса. Все коллагены организованы в тройные спирализованные «коллагеновые субъединицы», обладающие суперспиральной структурой и состоящие из трех отдельных полипептидов
Коллагеновые субъединицы выходят из клеток и затем, во внеклеточном пространстве, собираются в более крупные фибриллы и волокна

Последовательность аминокислот в коллагене обычно представляет собой чередование трипептидных звеньев [Gly-X-Y]338 X = Pro; Y = Hyp(4-гидроксипролин)
Молекула тропоколлагена имеет форму стержня длиной 3000Å и диаметром 15Å; 3 АКО/виток; расстояние между АКО 0,29 нм. Три левые спирали закручены в правую суперспираль.
Для первичной структуры характерно высокое содержание глицина, малое количество серосодержащих кислот и отсутствие триптофана. Коллаген один из немногих белков, содержащих нестандартные аминокислоты: 3-гидроксипролин, 4-гидроксипролин и 5-гидроксилизин (около 21% кислотных остатков).
Коллагеновая спираль
Она состоит из трех спиралевидных тропоколлагенов, имеющих форму стержня диаметром 1,5 нм и длиной около 300 нм.
Спиралевидные цепи закручиваются одна вокруг другой и образуют суперспираль. Расстояние между двумя аминокислотными остатками по оси спирали составляет 0,29 нм. Коллагеновая спираль стабилизируется водородными связями, возникающими между водородом пептидных NH-групп остатков аминокислоты одной цепи и кислородом СО - групп аминокислотных остатков другой. Такая структура придает коллагену упругость и прочность.
Так как в тройке ак есть маленький глицин, только он может встраиваться в щелях между цепями, поэтому пролин и 4-гидроксипролин как раз и заворачивают спираль.
Особенности сборки
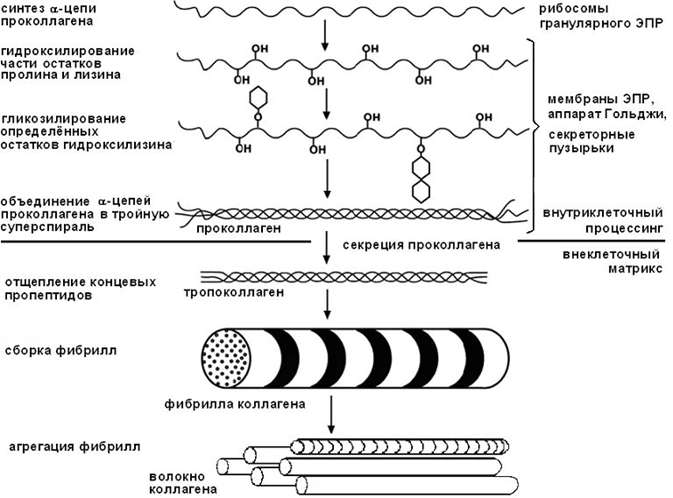
Сборка молекулы коллагена — это сложный многостадийный процесс, который начинается в фибробластах и продолжается в межклеточном веществе.
1. Синтез предшественника
Коллаген синтезируется в виде препропептида на рибосомах шероховатого эндоплазматического ретикулума (ШЭР). После отщепления сигнального пептида образуется проколлаген, состоящий из трех полипептидных цепей с N- и С-концевыми пропептидами, формирующими глобулярные структуры. Эти концевые участки способствуют правильной сборке тройной спирали, стабилизируя молекулу через межцепочечные дисульфидные связи.
2. Посттрансляционные модификации
В процессе созревания проколлагена происходят ключевые изменения:
Гидроксилирование остатков пролина и лизина. Этот процесс катализируется пролил- и лизил-гидроксилазами в присутствии железосодержащих ферментов и витамина C.
Гликозилирование гидроксилизина. На этот этап приходится добавление углеводов, что влияет на дальнейшую сборку коллагена.
Формирование дисульфидных связей. Происходит окисление остатков цистеина, что способствует правильному сворачиванию тройной спирали.
3. Секреция и преобразование проколлагена
Проколлаген секретируется в межклеточное пространство, где специфические проколлагенпептидазы удаляют N- и С-концевые глобулярные домены. После этого образуется тропоколлаген — базовая молекула с тройной спиралью, характеризующаяся повторяющимся мотивом Gly-X-Y.
4. Формирование фибрилл
Молекулы тропоколлагена упаковываются в коллагеновые фибриллы с характерным сдвигом на 1/4 длины молекулы. Межмолекулярные просветы, образующиеся в этих структурах, служат местами минерализации, например, для осаждения гидроксиапатита в костной ткани. В межклеточном веществе молекулы тропоколлагена собираются в микрофибриллы (по 5 штук), затем в фибриллы и коллагеновые волокна.
5. Созревание и формирование поперечных связей
Ферментативное окисление ε-аминогрупп остатков лизина с образованием альдегидных групп способствует формированию поперечных ковалентных связей. Эти связи определяют механические свойства коллагеновых волокон, такие как прочность и эластичность.
35. Фибриллярные белки: a- и b-кератины, фиброин, эластин – особенности структуры, функциональная роль.
Кератин
Вся структура стабилизируется за счёт протяженных водородных связей между бета-слоями и Ван-дер ваальсовых взаимодействийю. Но при этом такая структура довольно гибкая, поскольку слои удерживаются между собой еще ковалентными связями и др слабыми взаимодействиями.
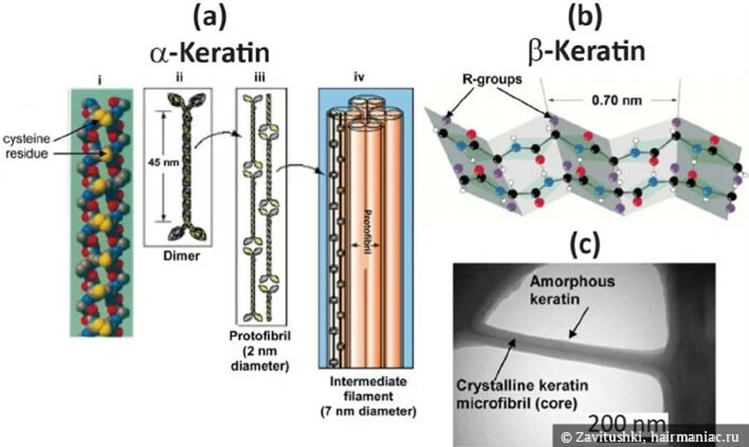
По вторичной структуре белка семейство кератинов разделяется на две группы:
· α-кератины имеют конформацию в виде плотных витков вокруг длинной оси молекулы (αспираль); эти кератины являются основой волос (включая шерсть), рогов, когтей и копыт млекопитающих. У людей в основном встречаются α-кератины.
· β-кератины, более твёрдые и имеющие форму несколько зигзагообразных полипептидных цепей (т.н. β-листы); эти кератины обнаружены в когтях и чешуе рептилий, в их панцирях (у черепах), в перьях, клювах и когтях птиц, в иглах дикобразов.
Для первичной структуры α-кератинов характерно большое содержание цистеина и множество дисульфидных связей. Молекулярная масса — от 10 до 50 кДа. Периодичность в чередовании аминокислотных остатков в молекулах отсутствует.
В отличие от α-кератинов поперечные дисульфидные связи между соседними полипептидными цепями у β-кератинов отсутствуют. В полипептидной цепи каждый второй элемент — глицин. Характерно повторение последовательности «GSGAGA».
Для α-кератинов основным структурным компонентом являются цилиндрические микрофибриллы диаметром 75 А, состоящие из спирализованных, скрученных попарно протофибрилл. Две ориентированные параллельно нити а-кератина (т. е. с N-концами с одной и той же стороны) закручиваются одна вокруг другой, образуя суперскрученную спираль. Супервитки а-спирали образуют левую спираль, т. е. направлены противоположно направлению витков а-спирали. Поверхности соприкосновения двух а-спиралей состоят из гидрофобных аминокислотных остатков, а их R-групны сцеплены друг с другом регулярным образом. Это создает компактную упаковку полипептидных цепей в левозакрученной суперспирали.
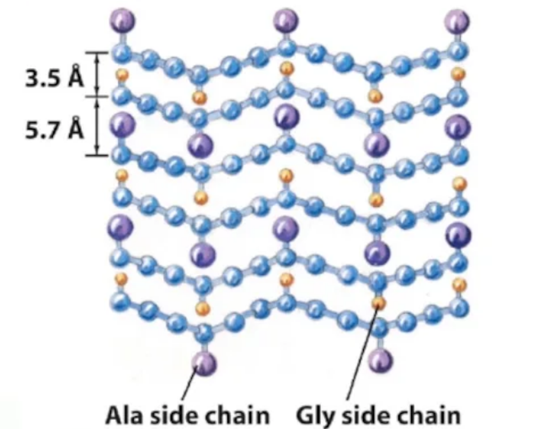
Фиброин – белок паутины и шелка. Состоит из антипараллельных β складок, вместе образует пилообразную структуру, обеспечивающую его феноменальную прочность.
«Лицом к лицу, спина к спине»: двойной слой глицинов (3,5Å) – двойной слой Ala/Ser (5,7Å) –
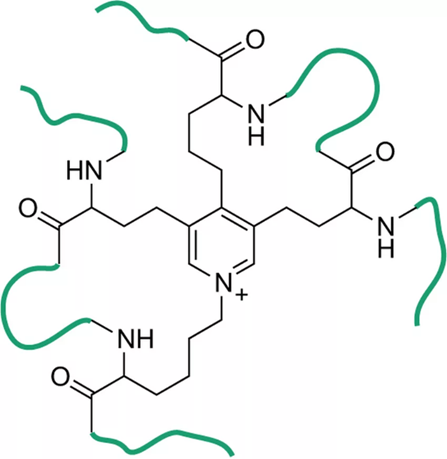
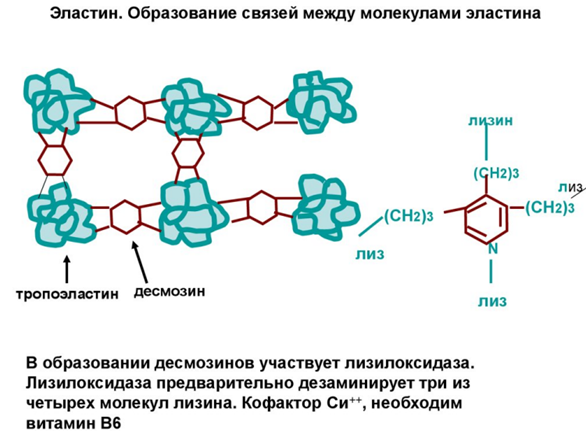
Эластин
обладает расширенной в две стороны структурой, сшитые замещенный пиридином из 4 остатков лизина. Не обладают выраженной вторичной структуры. Растягивается во всех направлениях, так как субъединицы имеют неправильную укладку в разных направлениях, а сшиты между собой. Основная функция эластина состоит в обеспечении эластических свойств тканей артерий, легких и связок.
Полипептидная цепь его предшественника - тропоэластина, - синтезируемая, как и коллаген, фибробластами, состоит примерно из 760 аминокислотных остатков. Более половины из них приходится на глицин и аланин, четверть - на типично гидрофобные аминокислоты, среди которых особенно много валина, в то время как число гидрофильных аминокислот очень невелико.
Прочность этих волокон обусловлена образованием ковалентных сшивок между боковыми цепями лизина, находящегося в соседних мономерах эластина
Для первичной структуры эластина характерно обилие повторяющихся участков последовательности, например последовательность Pro Gly Val Gly Val встречается в эластине по меньшей мере 11 раз подряд. Гидрофильные участки обогащены лизином. При созревании тропоэластина почти все остатки лизина превращаются в аль-лизин под действием медьсодержащего фермента лизиноксидазы, который модифицирует коллаген.
Образовавшиеся при этом альдегидные группы вступают в реакции конденсации с другими остатками L-лизина (и далее не аль), а также с є-аминогруппой еще, не окисленного остатка лизина, в результате чего четыре сближенных в агрегате остатка лизина дают десмозин - аминокислоту с пиридиниевым ядром, объединяющую в один узел четыре участка пептидной цеци эластина.
Сшивки такого типа делают эластин нерастворимым в воде, в то время как участки между ними, имеющие конформацию неупорядоченного клубка, сохраняют способность к обратимому растяжению, чем и обусловлена растяжимость связок и стенок артерий. • Сборка волокон тропоэластина происходит во внеклеточном пространстве и находится под контролем трехступенчатого процесса.
Десмозин в структуре эластина:
36. Трансмембранные белки: каналы и насосы. Белки, участвующие в преобразовании энергии (Na+-K+-АТР-аза, АТР-синтетаза).
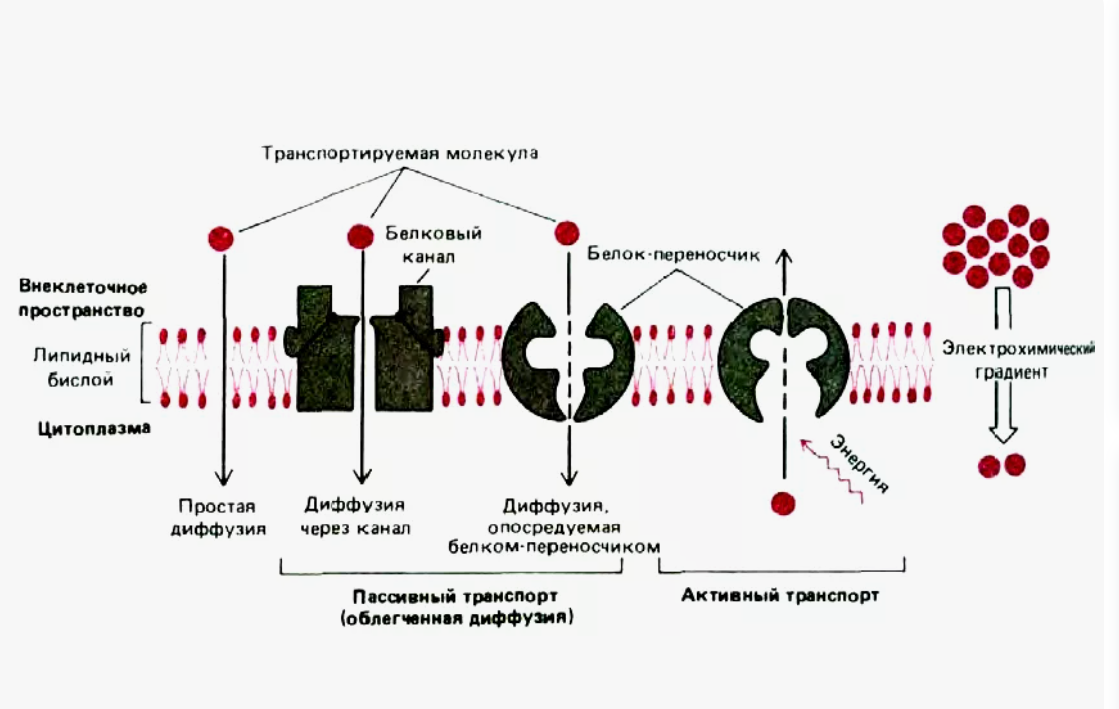
1. Типы мембранных белков
Интегральные мембранные белки
Прочно встроены в мембрану, пронизывая её полностью или частично.
Удерживаются за счёт гидрофобных взаимодействий между липидами мембраны и гидрофобными участками белков.
Для их удаления из мембраны требуются детергенты, органические растворители или другие агенты, нарушающие липид-белковые взаимодействия.
Пример:
Каналы и поры для пассивного транспорта по градиенту концентрации без дополнительной затраты энергии.
Переносчики и насосы для активного транспорта против градиента концентрации, затрачивая при этом энергию за счет гидролиза АТФ.
Периферические мембранные белки
Связаны с мембраной слабыми нековалентными взаимодействиями:
Электростатические взаимодействия с полярными головками липидов.
Водородные связи с гидрофильными доменами интегральных белков.
Удаляются мягкими методами, такими как обработка карбонатом при высокой pH.
Пример:
Белки, участвующие в сигнальных путях.
Амфитропные белки
Могут находиться как в цитозоле, так и связываться с мембраной.
Их взаимодействие с мембраной регулируется:
Фосфорилированием.
Связыванием с липидами или другими белками.
2. Суперсемейства транспортных белков

1. Переносчики (Carriers)
Строение:
Это мембранные белки с несколькими трансмембранными сегментами, организованными в специфические сайты связывания для субстрата.
Структура изменяется при связывании субстрата, что позволяет перенести молекулу через мембрану.
Функции:
Обеспечивают транспорт специфических молекул, таких как глюкоза, аминокислоты и ионы.
Регулируют концентрацию веществ в клетке.
Механизм:
Субстрат связывается с активным центром белка на одной стороне мембраны.
Происходит конформационное изменение белка.
Субстрат высвобождается на противоположной стороне мембраны.
Белок возвращается в исходное состояние.
Пример:
GLUT1: переносчик глюкозы, который осуществляет пассивный транспорт глюкозы по градиенту концентрации.
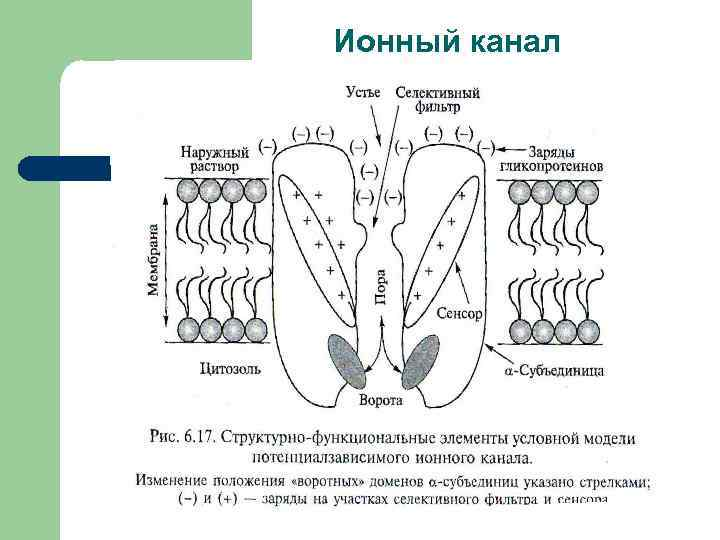
2. Ионные каналы (Channels)
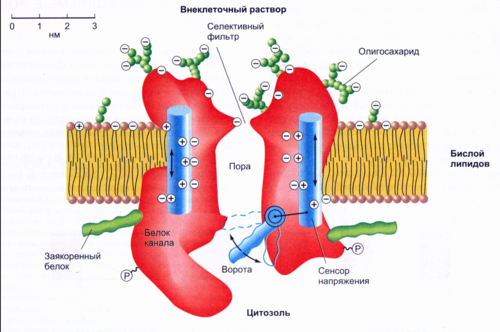
Строение:
Представляют собой порообразующие белки, состоящие из нескольких субъединиц.
Центральный канал выстлан гидрофильными аминокислотами, что облегчает прохождение ионов.
Имеют "ворота" (gates), которые открываются и закрываются в ответ на стимулы (напряжение, лиганды, механическое воздействие).
Функции:
Обеспечивают быстрый транспорт ионов (например, Na⁺, K⁺, Cl⁻, Ca²⁺) через мембрану.
Участвуют в генерации и поддержании мембранного потенциала, передаче нервных импульсов и мышечном сокращении.
Механизм:
Канал остаётся закрытым до получения сигнала.
Под воздействием стимула канал открывается, позволяя ионам проходить по градиенту концентрации или заряда.
Канал закрывается, когда стимул прекращается.
Пример:
Натриевые каналы (Na⁺-каналы): участвуют в генерации потенциала действия в нейронах.
3. Первичные активные транспортеры (Primary Active Transporters)
Строение:
Состоят из нескольких субъединиц, одна из которых обладает АТФазной активностью (расщепляет АТФ).
Имеют сайты связывания для АТФ и субстрата.
Функции:
Обеспечивают перенос веществ против их градиента концентрации.
Используют энергию, получаемую от гидролиза АТФ.
Механизм:
Субстрат связывается с белком на одной стороне мембраны.
АТФ гидролизуется, высвобождая энергию.
Белок изменяет свою конформацию, перемещая субстрат через мембрану.
После высвобождения субстрата белок возвращается в исходное состояние.
Пример:
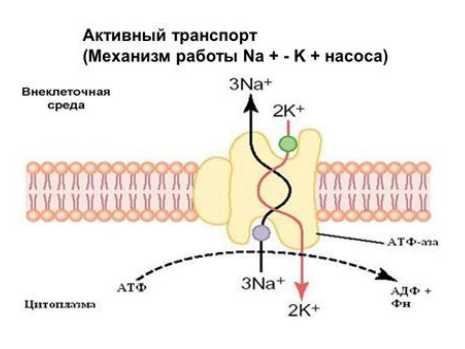
Na⁺/K⁺-АТФаза(аденозинтрифосфатаза): перекачивает 3 Na⁺ из клетки и 2 K⁺ в клетку, поддерживая ионный баланс и мембранный потенциал.
Реакция:
![]()
Na⁺/K⁺-АТФаза – это гетеромультимерный белковый комплекс, состоящий из нескольких субъединиц:
Альфа-субъединица (α):
Основной каталитический компонент, содержащий сайты связывания для:
Na⁺ и K⁺
АТФ
Ионов Mg²⁺, необходимых для активации.
Претерпевает конформационные изменения (E1 и E2), что позволяет транспорту ионов.
Бета-субъединица (β):
Гликопротеин, необходимый для правильной сборки и функциональной активности фермента.
Участвует в стабилизации альфа-субъединицы и её встраивании в мембрану.
Гамма-субъединица (или FXYD-белки):
Регуляторный компонент, модулирующий активность Na⁺/K⁺-АТФазы в зависимости от физиологических условий.
Функции Na⁺/K⁺-АТФазы
Поддержание ионного градиента:
Удаляет 3 Na⁺ из клетки и вводит 2 K⁺ внутрь клетки.
Создаёт электрохимический градиент, который используется для транспорта других молекул (например, глюкозы через Na⁺-зависимые симпортеры).
Обеспечение мембранного потенциала:
Генерирует отрицательный заряд внутри клетки, необходимый для передачи нервных импульсов и сокращения мышц.
Осморегуляция:
Регулирует содержание воды в клетке, предотвращая её набухание или сжатие.
Энергетическая роль:
Расходует около 30-50% всей энергии клетки в состоянии покоя для поддержания градиента Na⁺/K⁺.
Механизм работы
Фаза E1 (связывание Na⁺):
Внутри клетки Na⁺ связывается с активными участками α-субъединицы.
АТФ гидролизуется с образованием фосфорилированного промежуточного состояния.
Фосфорилирование и конформационные изменения:
Связывание фосфата изменяет конформацию белка (E1 → E2).
Это вызывает высвобождение Na⁺ во внеклеточное пространство.
Фаза E2 (связывание K⁺):
K⁺ связывается с белком на внеклеточной стороне.
Фосфатная группа отделяется, и белок возвращается в состояние E1.
Дефосфорилирование и транспорт K⁺:
K⁺ переносится внутрь клетки, завершая цикл.
Регуляция активности
Ионы и молекулы:
Mg²⁺: Необходим для активации фермента.
Na⁺ и K⁺: Концентрация ионов влияет на скорость работы фермента.
Гормоны:
Инсулин: Увеличивает активность Na⁺/K⁺-АТФазы, способствуя поглощению калия.
Адреналин: Может стимулировать работу фермента в стрессовых условиях.
Факторы окружающей среды:
Изменения pH и температуры могут повлиять на активность фермента.
Ингибиторы Na⁺/K⁺-АТФазы
Сердечные гликозиды (дигоксин, строфантин):
Ингибируют фермент, повышая внутриклеточную концентрацию Na⁺, что приводит к увеличению Ca²⁺ внутри клетки и усилению сердечных сокращений.
Ванадаты:
Блокируют активный центр Na⁺/K⁺-АТФазы.
4. Вторичные активные транспортеры (Secondary Active Transporters)
Строение:
Состоят из трансмембранных доменов, образующих участки связывания для нескольких молекул.
Не имеют прямой АТФазной активности.
Функции:
Используют энергию, накопленную в виде градиента ионов (например, Na⁺ или H⁺), для транспорта других веществ против их градиента.
Типы и механизм:
Симпортеры:
Перемещают два вещества в одном направлении.
Пример: Na⁺/глюкоза симпортер, который использует Na⁺-градиент для переноса глюкозы в клетку.
Антипортеры:
Перемещают два вещества в противоположных направлениях.
Пример: Na⁺/Ca²⁺ антипортер, выводящий Ca²⁺ из клетки с помощью Na⁺-градиента.
5. Унипортеры (Uniporters)
Строение:
Содержат один или несколько трансмембранных доменов, образующих специфический сайт связывания.
Конформационные изменения белка позволяют переносить одно вещество.
Функции:
Переносят одну молекулу или ион через мембрану по градиенту концентрации.
Относятся к пассивным переносчикам.
Механизм:
Субстрат связывается с белком на одной стороне мембраны.
Белок изменяет свою конформацию.
Субстрат высвобождается на противоположной стороне мембраны.
Пример:
GLUT1: переносит глюкозу по градиенту концентрации.
АТФ-синтаза – фермент, катализирующий образование аденозинтрифосфата (АТФ) из аденозиндифосфата (АДФ) и неорганического фосфата (Pi). Этот процесс требует энергии, которая обеспечивается электрохимическим градиентом протонов. АТФ-синтаза расположена во внутренней мембране митохондрий, тилакоидной мембране хлоропластов или плазматической мембране бактерий.
Реакция:
![]()
Структура АТФ-синтазы
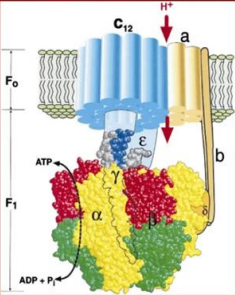
АТФ-синтаза состоит из двух основных частей:
F₁-область – гидрофильная, ответственная за синтез и гидролиз АТФ.
F₀-область – гидрофобная, встроена в мембрану и участвует в трансмембранном движении протонов.
1. F₁-область
Расположение: Выступает в матрикс митохондрий (или строму хлоропластов).
Структура:
Гексамер из субъединиц α и β, образующих 6 связывающих сайтов.
Три сайта каталитически активны, участвуют в синтезе АТФ.
Три сайта неактивны, связывают АДФ.
Субъединицы γ, δ и ε:
γ – вращается, передавая движение от F₀ к F₁.
δ и ε участвуют в стабилизации структуры и передаче вращательного момента.
Функция:
Генерация АТФ из АДФ и Pi через конформационные изменения α- и β-субъединиц (открытое, полуоткрытое и закрытое состояния).
2. F₀-область
Расположение: Встроена во внутреннюю мембрану митохондрий.
Структура:
Трансмембранное кольцо из субъединиц c:
Каждая субъединица связывает протон, что вызывает их вращение.
Субъединица a: Образует канал для протонов и соединяет кольцо с периферической ножкой.
Субъединица b: Формирует периферическую ножку, соединяющую F₀ и F₁.
Функция:
Протонный градиент через мембрану приводит к вращению кольца субъединиц c, что передаёт вращение на γ-субъединицу F₁.
Механизм работы
Протонный градиент:
В процессе клеточного дыхания (или фотосинтеза) создаётся электрохимический градиент протонов: высокая концентрация протонов в межмембранном пространстве (или в просвете тилакоида) и низкая – в матриксе митохондрий (или строме хлоропластов).
Трансляция протонов через F₀:
Протоны проходят через канал F₀, вызывая вращение кольца из субъединиц c.
Передача вращения на F₁:
Вращение кольца c передаётся γ-субъединице, вызывая её вращение внутри гексамера αβ.
Синтез АТФ:
Вращение γ-субъединицы вызывает последовательные конформационные изменения β-субъединиц (открытое, полуоткрытое, закрытое состояния), что приводит к связыванию АДФ и Pi, синтезу АТФ и его высвобождению.
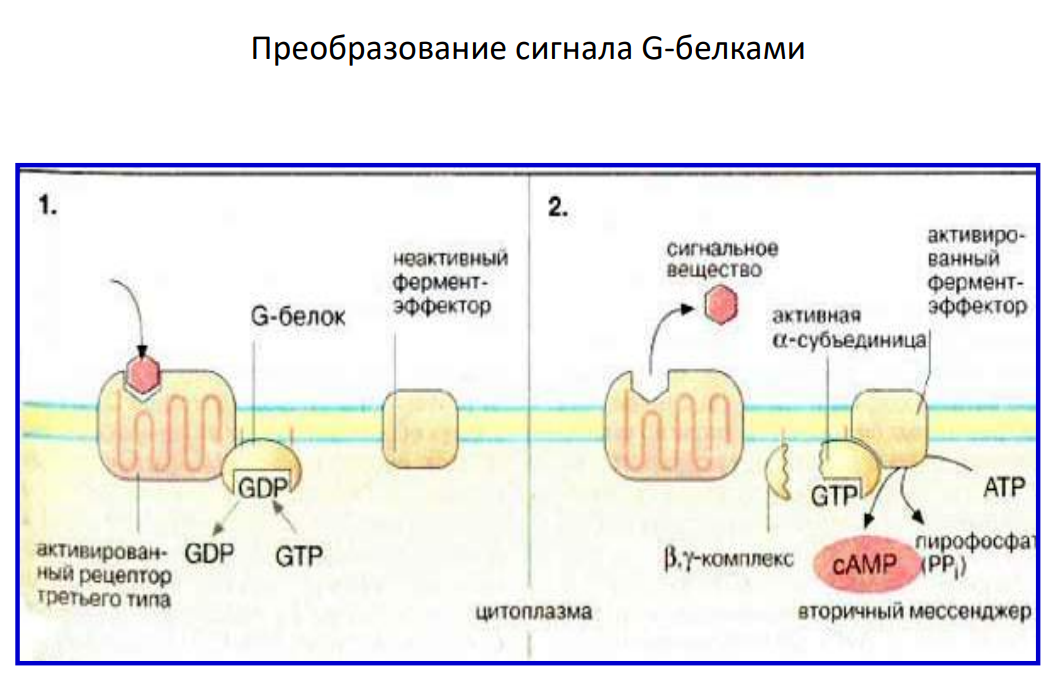
37. Типы мембранных рецепторов: каналообразующие, тирозинпротеинкиназные (трк)-рецепторы, рецепторы, ассоциированные с g-белками; механизм действия.
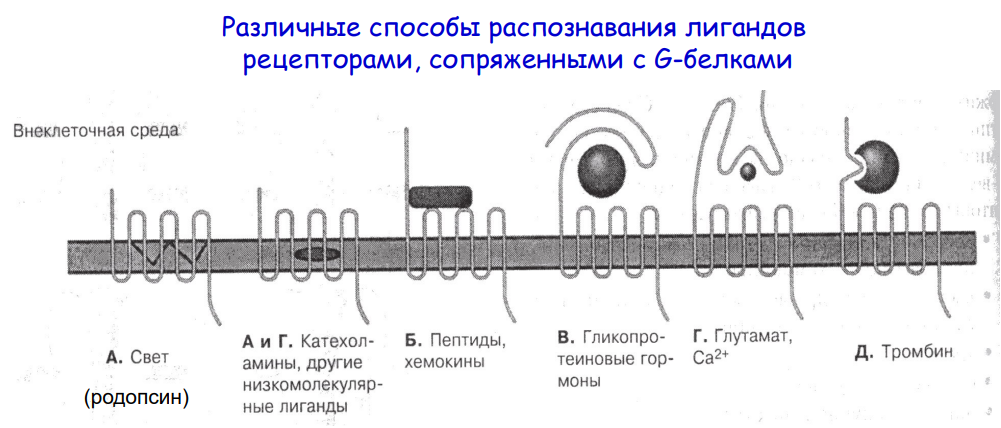
Виды мембраносвязанных рецепторов:
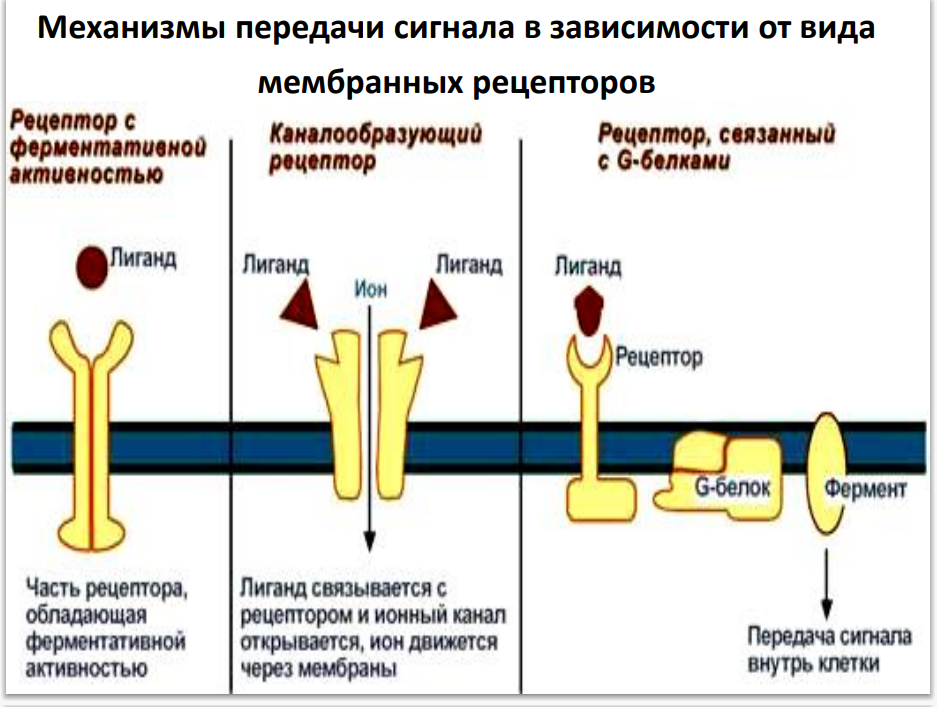
- Рецепторы, обладающие каталитической активностью (рецептор первого типа, или ТРК-рецепторы) – при взаимодействии лиганда с рецептором активируется внутриклеточная часть (домен) рецептора, имеющего тирозинкиназную, тирозинфосфатазную или гуанилатциклазную активность (СТГ, инсулин, пролактин, интерлейкины, интерфероны α, β, γ).
- Каналообразующие рецепторы – присоединение лиганда к рецептору вызывает открытие ионного канала на мембране. Таким образом действуют нейромедиаторы (ацетилхолин, глицин, ГАМК, серотонин, гистамин, глутамат);
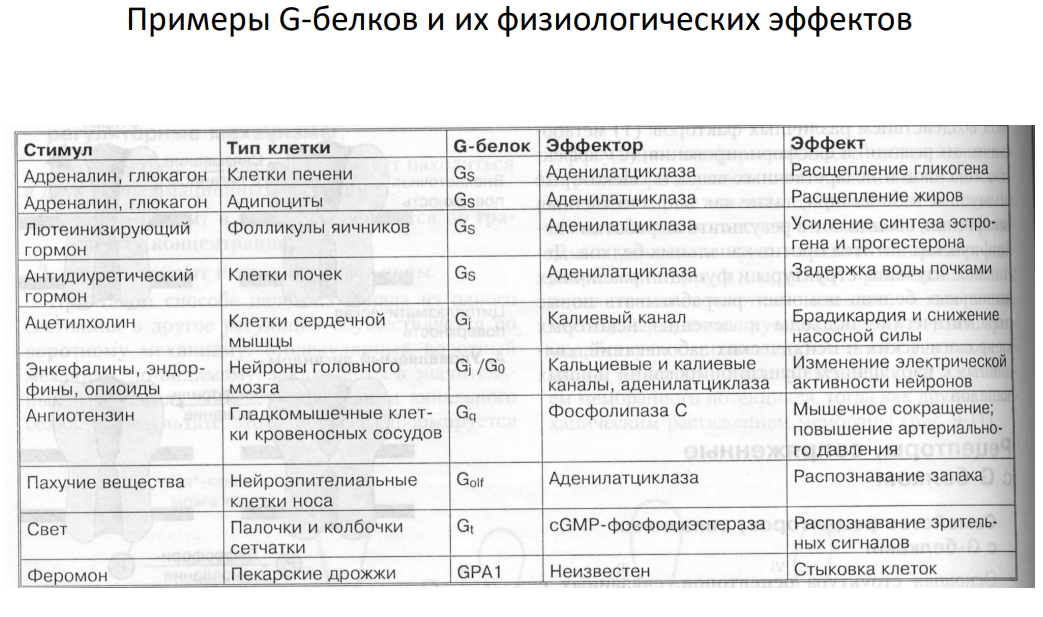
-Рецепторы, связанные с G-белками (рецептор третьего типа) – передача сигнала от гормона происходит при посредстве G-белка. G-белок влияет на ферменты, образующие вторичные мессенджеры (посредники). Последние передают сигнал на внутриклеточные белки. Большинство гормонов действуют именно по данному механизму.
Вторичные мессенджеры (посредники) - небольшие молекулы, которые быстро и в больших количествах синтезируются в клетке в ответ на активацию рецептора и служат для усиления молекулярного сигнала.
Системы вторичных посредников:
• аденилатциклаза - циклический аденозинмонофосфат (цАМФ или cAMP);
• гуанилатциклаза - циклический гуанозинмонофосфат (цГМФ или cGMP);
• фосфолипаза С - инозитолтрифосфат (ИФ3 или IP3 );
• ионизированный кальций (Са2+).
• Диацилглицерин (DAG) и др
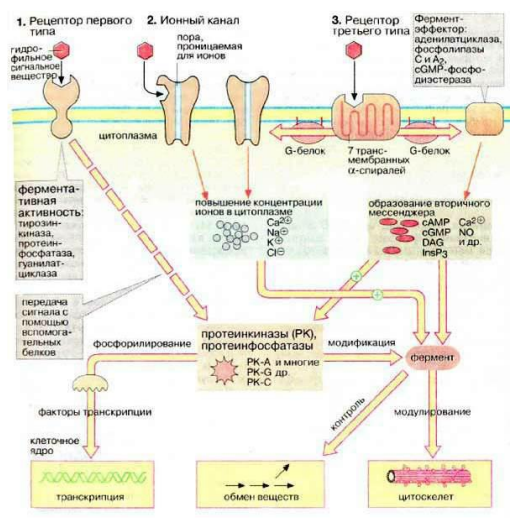
Более подробно
Тирозинпротеинкиназные рецепторы (трк-рецепторы)
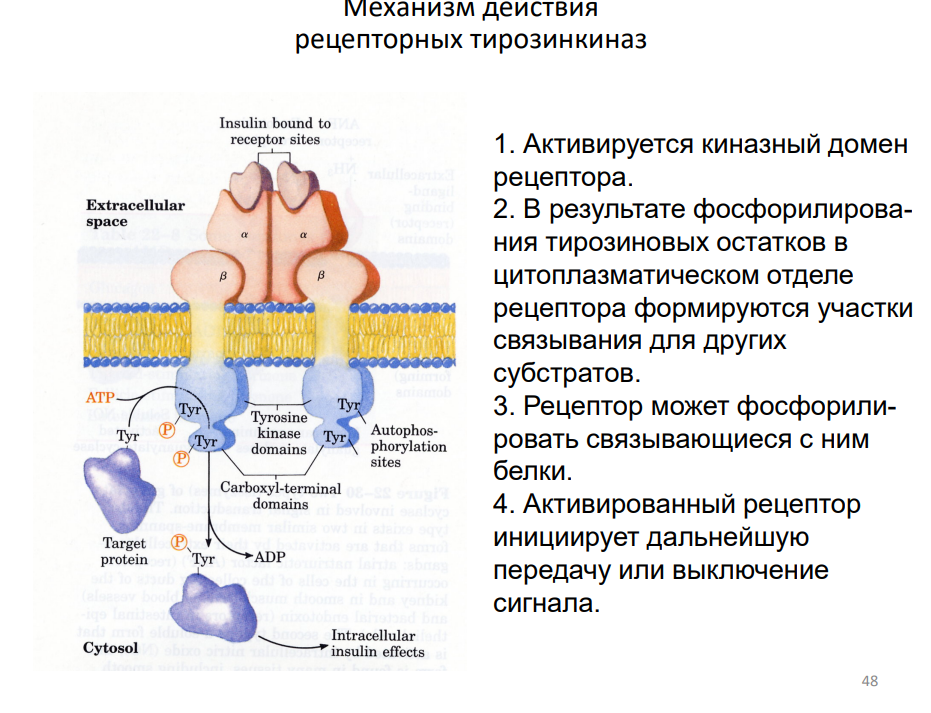
Структура и принцип работы:
ТРК-рецепторы имеют внеклеточный домен для связывания лиганда, трансмембранный домен и внутриклеточный домен с тирозинкиназной активностью.
Лиганды (обычно гормоны или факторы роста) инициируют димеризацию рецепторов, что активирует тирозинкиназную функцию.
Ключевые этапы:
Сигнал: Лиганд связывается с внеклеточным доменом рецептора.
Димеризация: Два рецептора объединяются в димеры.
Аутотрансфосфорилирование:
Внутриклеточные тирозиновые остатки рецепторов фосфорилируются.
Фосфорилированные тирозины служат участками связывания для адаптерных белков и ферментов.
Активация сигнальных каскадов:
Связывание адаптерных белков (например, Grb2, SOS) запускает внутриклеточные сигнальные пути.
Основные пути:
RAS-MAPK: Регулирует клеточную пролиферацию и дифференцировку.
PI3K-Akt: Участвует в регуляции метаболизма и выживания клеток.
PLCγ: Приводит к активации внутриклеточных вторичных мессенджеров, таких как IP₃ и DAG.
Особенности:
Относительно медленный ответ (секунды и дольше).
Обеспечивает долгосрочную регуляцию, например, рост и пролиферацию клеток.
2. Каналообразующие рецепторы (лиганд-зависимые ионные каналы)

Структура и принцип работы:
Эти рецепторы состоят из нескольких субъединиц, которые формируют пору, проходящую через мембрану.
В неактивном состоянии канал закрыт.
При связывании лиганда (например, нейромедиатора) с рецептором, он изменяет свою конформацию, открывая пору для определенных ионов.
Поток ионов через канал изменяет мембранный потенциал клетки, что приводит к активации или ингибированию клеточной активности.
Ключевые этапы:
Сигнал: Лиганд (например, нейромедиатор) связывается с рецептором.
Конформационные изменения: Связывание лиганда вызывает изменения в рецепторе, открывая канал.
Ионный ток: Ионы проходят через мембрану вдоль своего электрохимического градиента.
Ответ клетки:
Изменение мембранного потенциала (деполяризация или гиперполяризация).
Активация внутриклеточных процессов, чувствительных к изменению концентрации ионов, например, Ca²⁺-зависимых ферментов.
Особенности:
Время реакции очень короткое (миллисекунды).
Регулируют быструю передачу сигналов, особенно в нервной и мышечной системах.
3. Рецепторы, ассоциированные с G-белками (GPCR)
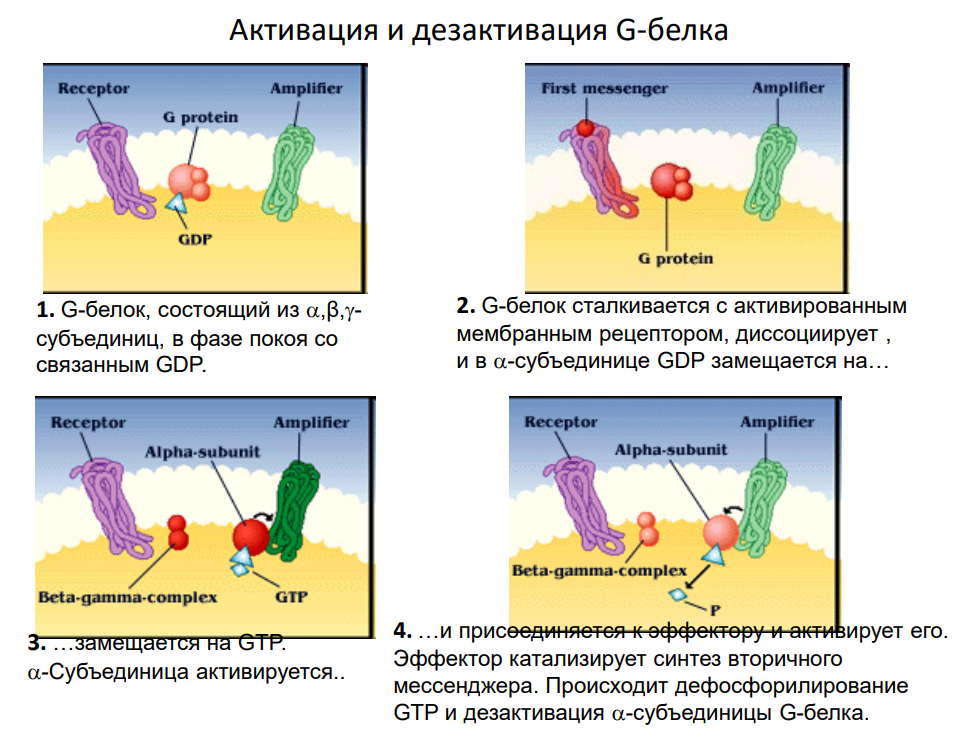
Структура и принцип работы:
Эти рецепторы имеют семь трансмембранных доменов. Они связаны с гетеротримерными G-белками, которые состоят из субъединиц α, β и γ.
G-белки активируются в результате связывания лиганда с рецептором, после чего запускают каскад вторичных мессенджеров.
Ключевые этапы:
Сигнал:
Лиганд связывается с рецептором, вызывая изменение его конформации.
Рецептор взаимодействует с G-белком, вызывая замену GDP на GTP на α-субъединице.
Диссоциация субъединиц:
Активированная α-субъединица отделяется от βγ-комплекса.
Активированные субъединицы взаимодействуют с эффекторными белками.
Активация эффекторных молекул:
Аденилатциклаза: Преобразует АТФ в цАМФ, который активирует протеинкиназу А (PKA).
Фосфолипаза C (PLC): Генерирует IP₃ и DAG, которые регулируют высвобождение Ca²⁺ из эндоплазматического ретикулума и активируют протеинкиназу С (PKC).
Ионные каналы: Некоторые субъединицы регулируют ионные каналы напрямую.
Деактивация:
Гидролиз GTP до GDP α-субъединицей завершает сигнализацию.
Субъединицы реассоциируются, возвращаясь в неактивное состояние.
Особенности:
Время реакции — от секунд до минут.
Универсальность: регулируют широкий спектр физиологических процессов, включая зрение, обоняние, сердечный ритм и метаболизм.
Итоговые отличия механизмов:
Каналообразующие рецепторы обеспечивают быстрые изменения мембранного потенциала через прямой поток ионов.
ТРК-рецепторы запускают каскадные реакции через фосфорилирование белков, что приводит к долгосрочным изменениям в клетке.
GPCR включают активацию вторичных мессенджеров через G-белки, что позволяет гибко регулировать широкий спектр процессов.
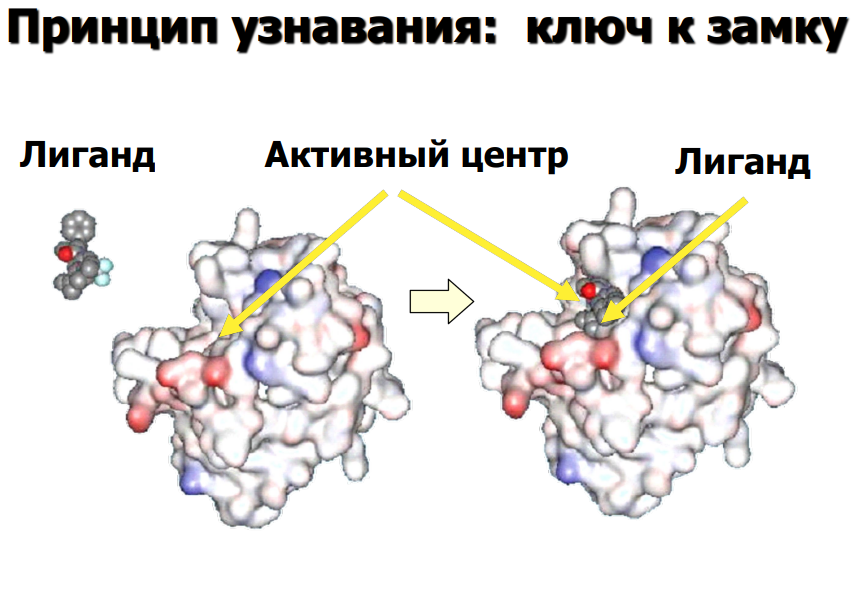
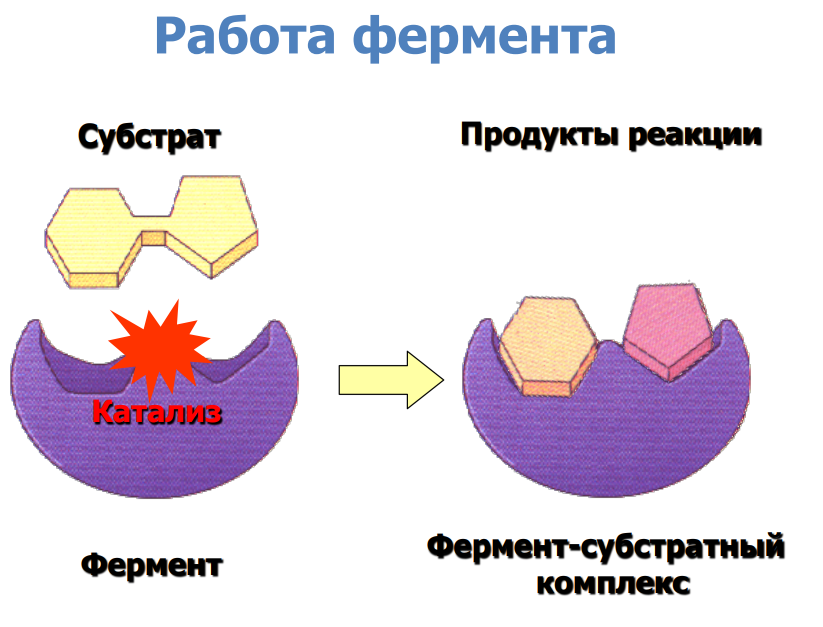
Пусть тоже будет:
Простетическая группа — компонент неаминокислотной природы, прочно соединённый с белком (например, при помощи ковалентной связи).
Простетические группы выполняют важную роль в биологической активности соответствующего белка.
Могут быть двумя видами:
Органическими. К ним относятся витамины, углеводы, липиды.
Неорганическими. Например, ионы металлов.
Пример простетической группы: гем, который является простетической группой в молекуле гемоглобина.
ПРОСТЕТИЧЕСКИЕ ГРУППЫ:
-гликопротеины(содержат углеводы)
-липопротеины(содержат липиды)
-фосфопротеины(содержат фосфорную кислоту)
-хромопротеины(содержат окрашенную простетическую группу)
-металлопротеины(содержат ионы различных металлов)
-нуклеопротеины(содержат нуклеиновые кислоты)
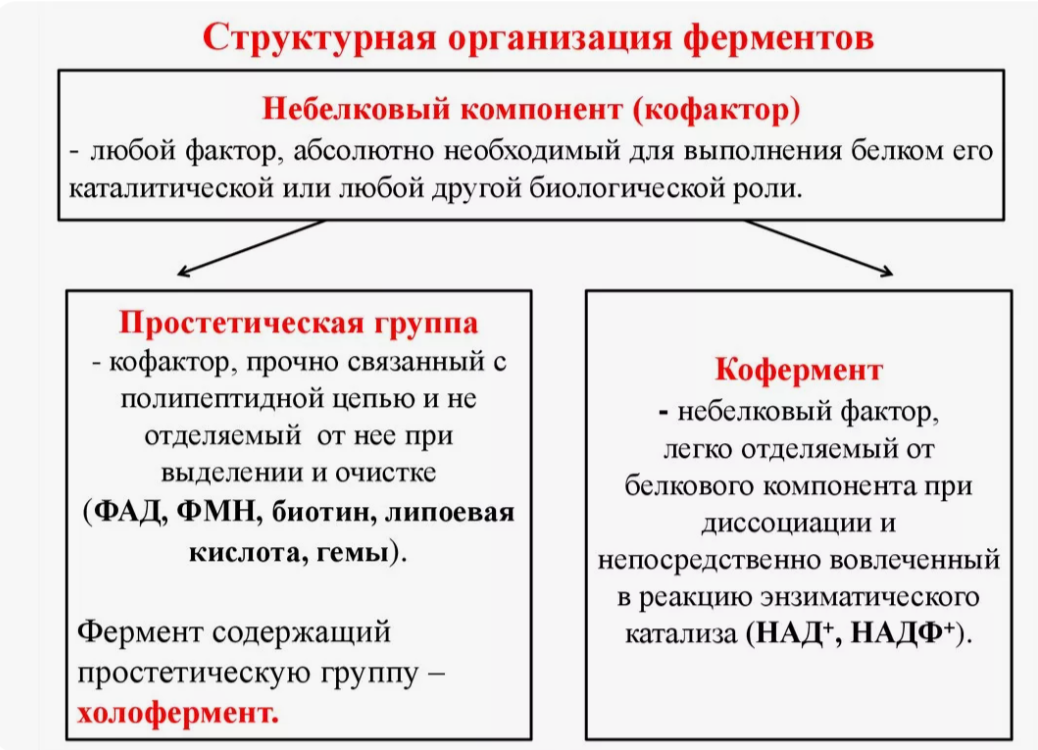
Кофактор
Любая небелковая молекула или ион в активном центре, необходимая для работы фермента
Кофермент - органический кофактор
Простетическая группа - кофактор, соединенный с белком ковалентной связью
