
- •3. Третичная структура
- •28. Супервторичная структура. Мотивы вторичной структуры (на примере днк-связывающих белков). Силы, стабилизирующие пространственную структуру белков.
- •2. Строение β-белков
- •4. Характерные мотивы укладки белковой цепи
- •30. Структурные классы белков, типичные архитектуры и типичные мотивы укладки цепи (топологии).
- •10. Doubly wound:Двойная рана….
- •31. Складывание (folding) белков, роль молекулярных посредников. Факторы, влияющие на скорость сворачивания белков. Теория расплавленной глобулы.
- •Фолдинг белков:
- •Фолдинг белков: решеточная модель
- •Фолдинг белков: фрагментная сборка
- •32. Двигательные белки: актин, миозин, особенности их структуры, взаимодействие в процессе мышечного сокращения. Вспомогательные белки акто-миозиновой системы подвижности.
- •1.Тропомиозин:
- •2. Тропонин:
- •3. Небулин:
- •4. Титин (коннектин (сисин, конект с мужчиннами)):
- •6. Миомезин:
- •33. Глобулярные белки, выполняющие структурообразующие функции (тубулин, динеин). Строение микротрубочек, устройство аксонемы ресничек. Динамическая нестабильность микротрубочек. Map-белки.
- •34. Фибриллярные белки: коллаген (особенности первичной структуры, коллагеновая спираль; особенности сборки).
- •1. Синтез предшественника
- •2. Посттрансляционные модификации
- •3. Секреция и преобразование проколлагена
- •4. Формирование фибрилл
- •5. Созревание и формирование поперечных связей
- •35. Фибриллярные белки: a- и b-кератины, фиброин, эластин – особенности структуры, функциональная роль.
- •1. Типы мембранных белков
- •2. Суперсемейства транспортных белков
- •1. Переносчики (Carriers)
- •2. Ионные каналы (Channels)
- •3. Первичные активные транспортеры (Primary Active Transporters)
- •4. Вторичные активные транспортеры (Secondary Active Transporters)
- •5. Унипортеры (Uniporters)
- •37. Типы мембранных рецепторов: каналообразующие, тирозинпротеинкиназные (трк)-рецепторы, рецепторы, ассоциированные с g-белками; механизм действия.
- •Тирозинпротеинкиназные рецепторы (трк-рецепторы)
/
\27. Уровни структурной организации белков. Основные параметры пептидной связи. Торсионные углы φ и ψ. Конформационные карты Рамачандрана. Элементы вторичной структуры (α-спираль, другие типы спиральных структур, β-складки, β-поворот).
Белки-природные высокомолекулярные неразветвленные (линейные) полимеры, построенные из остатков α-аминокарбоновых кислот, соединенных амидной (пептидной) связью.

1. Первичная структура
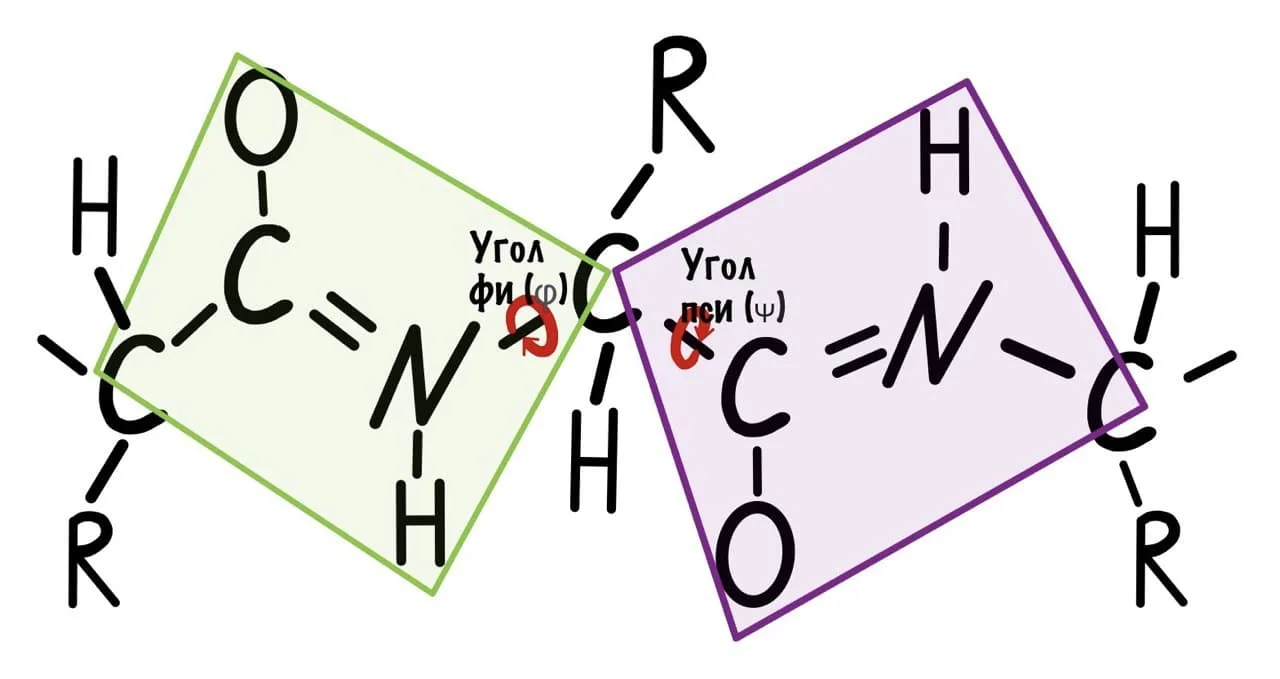
Это линейная последовательность аминокислот, соединённых ковалентными пептидными связями. Пептидная связь – не двойная и не одинарная, а полуторная!
Определяется генетической информацией (последовательностью нуклеотидов в ДНК).
Влияет на все остальные уровни структуры, так как порядок аминокислот определяет их взаимодействие и свёртывание.
В первичной структуре важны такие свойства, как химическая природа боковых групп аминокислот (гидрофобность, заряд, полярность).
2. Вторичная структура
Регулярные структуры, образуемые за счёт водородных связей между атомами пептидной цепи (между атомами C=O и N—H)разных ак остатков. Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных, более или менее протяженных ее участках.
цис-транс изомерия пептидной группы- все только транс кроме пролина у него есть 10% цис. Связь имеет кето-енольную форму.
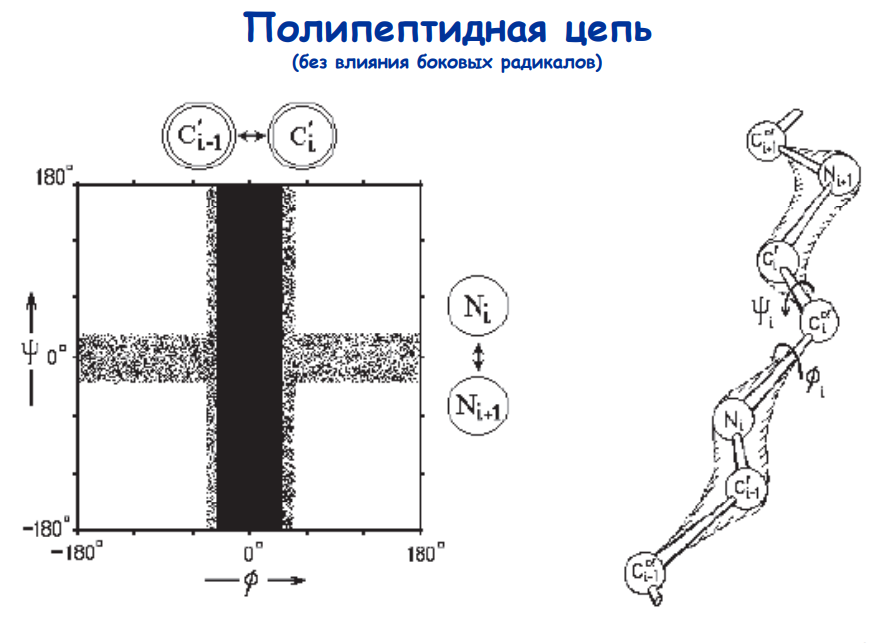

При появлении боковых радикалов углы меняются. На основании этого снимаются карты Рамачандрана. Эти карты представляют собой способ визуализирования энергетически разрешенных областей для двугранных углов ψ основной цепи в зависимости от φ аминокислотных остатков в структуре белка. третичная структура белка — или конформация глобулы — может быть определена как совокупность торсионных углов ϕ и ψ всех составляющих его аминокислотных остатков.
Как правило, карты Рамачандрана описывают конформацию целых молекул белка; каждая точка на карте обозначает один аминокислотный остаток. На практике карты Рамачандрана используются для демонстрации присутствия в белке тех или иных вторичных и сверхвторичных структур (структурных мотивов); строго говоря, карты Рамачандрана позволяют обнаружить так называемые регулярные структуры. Примерами регулярных структур являются α-спирали и β-листы.
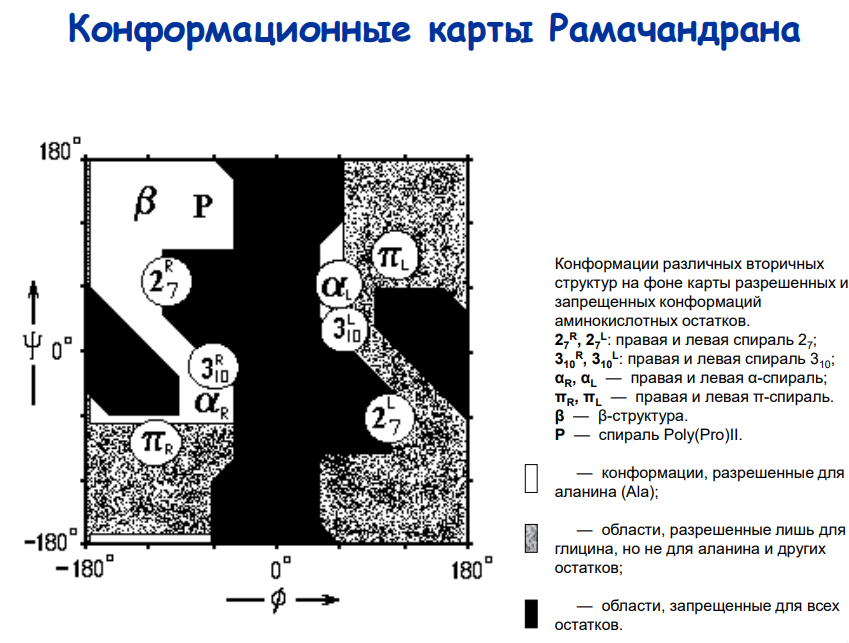

Основные элементы:
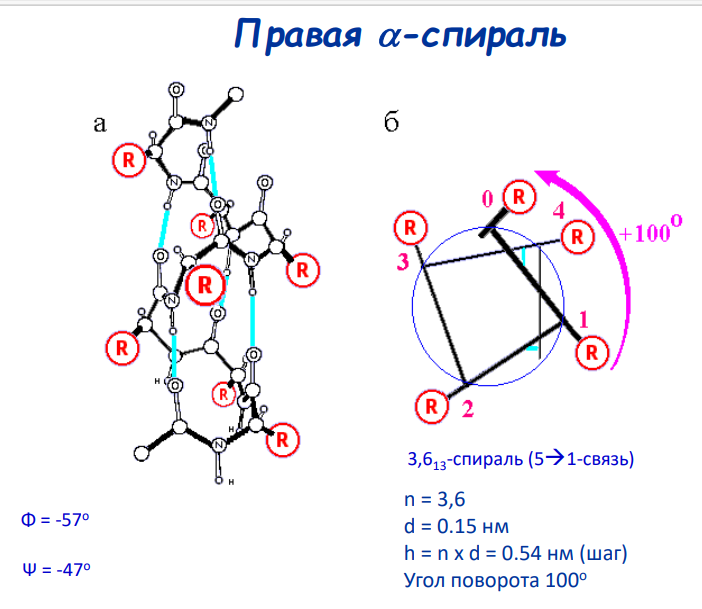
α-спираль 3.613 Правозакрученная спираль, стабилизированная водородными связями между каждым n-ым и (n+4)-ым остатками, стабилизированная водородными связями между атомом водорода группы -NH и атомом кислорода группы -C=O, расположенными на главной цепи с интервалом в 3,6 аминокислотных остатка.(левая тоже есть, как минимум по карте ромачпыпыпыпыр выделяется, хз почему матвеев не упомяняет)
Спираль характеризуется: 1. Количество АК-остатков на виток (n) 2. Период идентичности (шаг) (h) 3. Количество атомов, входящих «кольцо» формируемое внутримолекулярной водородной связью.
Углы торсионных углов φ ≈ -60°(фи) и ψ ≈ -45°(пси) (обр при вращении), иногда описывается угол омега .
3.6 аминокислотных остатков на виток. Водородная связь образует 13 –членное «кольцо»
Шаг спирали — 0,54 нм
диаметр 1.5 нм
угол поворота 100
Обозначение:3,613-Р-спираль
Стабильность: Укрепляется короткими боковыми цепями (например, аланин), ослабляется большими или заряженными боковыми группами. Критерии дестабилизации и стабилизации спирали 1. Стерические факторы (Asp, Asn, Ser, Thr, Cys, Gly - ослабляют) 2. Электростатические взаимодействия боковых радикалов (Glu, Asp, Lys, Arg - ослабляют) 3. Присутствие остатков Pro и Gly - ослабляют 4. Взаимодействие между радикалами АК i – i+3 или i – i+4 (Glu-Lys, 2 аром. АК - усиливают) 5. Взаимодействие остатков концевых АК с электрическим диполем спирали - зависит от АК.
Примеры белков: Миоглобин, гемоглобин.
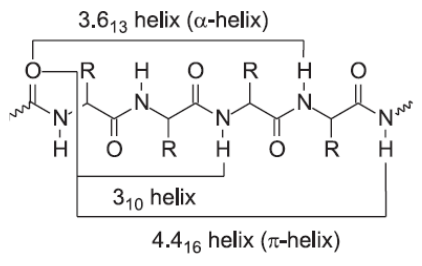
Другие типы спиральных структур
310-спираль Тоже правозакрученная, но более вытянутая спираль. Водородные связи образуются между каждым третьим аминокислотным остатком. Шаг спирали: 0,6 нм.
π-спираль 4.416 Правозакрученная спираль с более свободным шагом. Водородные связи формируются между каждым пятым остатком. Шаг спирали: 0,45 нм.
β-конформации
β-складка Формируется при взаимодействии двух или более β-цепей, соединённых водородными связями между карбонильными и амидными группами соседних цепей.
Типы β-листов:
Параллельные: Цепи ориентированы в одном направлении; водородные связи наклонены.
Антипараллельные: Цепи противоположно направлены; водородные связи перпендикулярны.
Углы φ и ψ зависят от ориентации цепей.
Фиброин шёлка, иммуноглобулины
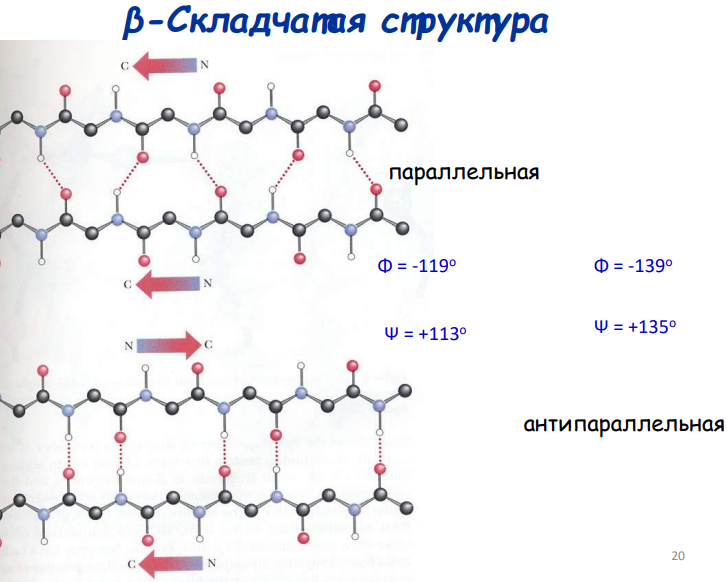
Основные критерии стабилизации складчатой структуры 1. Требуется наличие гидрофобных боковых радикалов 2. Ароматические АК 3. Небольшие заместители R в АК 4. Pro не участвуют в образовании складчатой структуры
β-повороты (или бета изгибы)
Описание: Короткий участок цепи (4 остатка), изменяющий направление полипептидной цепи обычно на 180°.Стабилизация: Водородные связи между первым и четвёртым остатками. Классификация: Типы I, II, III, IV (в зависимости от углов φ и ψ и пространственного положения атомов). Часто встречается в белках, связывая β-листы и другие элементы структуры (альфа-спирали). Необходимы для того, чтобы белок смог образовывать компактные структуры.
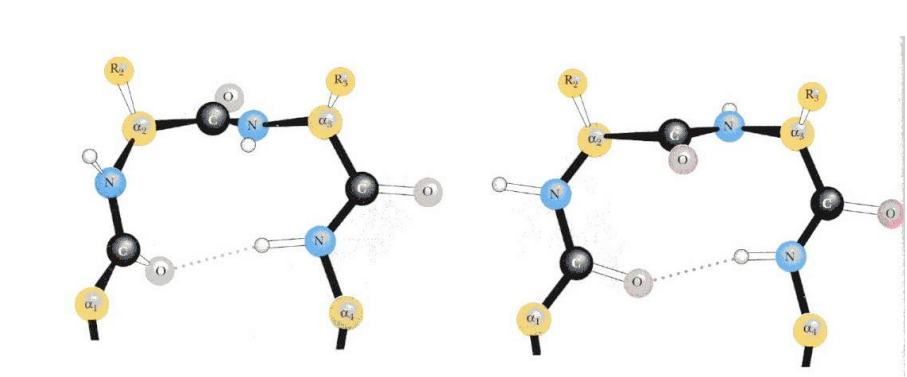
3. Третичная структура
Трёхмерная укладка полипептидной цепи, включающая все вторичные структуры.
Основные типы взаимодействий:
Гидрофобные взаимодействия между неполярными боковыми цепями.
Ионные взаимодействия между заряженными группами.
Водородные связи.
Дисульфидные мостики (ковалентные связи между остатками цистеина).
Координационные связи
Структура определяется также наличием доменов — функциональных областей белка.
Третичная структура – основа функциональности белка.
4. Четвертичная структура
Сложная структура, формируемая несколькими полипептидными цепями (субъединицами). Очень часто связываются бета-субъединицы различных белков
Примеры:
Гемоглобин (четыре субъединицы).
Вирусные капсиды.
Стабилизируется теми же взаимодействиями, что и третичная структура.
Имеют большое влияние гидрофобные силы в больших белках, так как они создают большой заряд ( если около 18 гидрофобных остатков), в основном гидрофобные белки конденсируются на поверхности и играю большую роль.
28. Супервторичная структура. Мотивы вторичной структуры (на примере днк-связывающих белков). Силы, стабилизирующие пространственную структуру белков.
Супервторичная структура представляет собой комбинации элементов вторичной структуры (α-спирали, β-листы, повороты и петли), которые формируют устойчивые пространственные мотивы. Эти мотивы являются промежуточным уровнем между вторичной и третичной структурами, участвуют в формировании активных центров и обеспечивают стабильность белка.
По наличию а-спиралей и b-структур глобулярные белки могут быть разделены на 4 категории:
1. только а-спирали, например миоглобин и гемоглобин .
2. а-спирали и b-структуры. ЛДГ.
3. только b-структуру. Такие структуры обнаружены в иммуноглобулинах, в ферменте супероксиддисмутазе
4. лишь незначительное количество регулярных вторичных структур. К таким белкам можно отнести небольшие богатые цистином белки или металлопротеины.
В ДНК-связывающих белках имеются общие виды супервторичных структур: «спираль— поворот—спираль», «лейциновая застежка-молния», «цинковые пальцы». ДНК-связывающие белки содержат центр связывания, комплементарный участку ДНК с определенной нуклеотидной последовательностью.
Домен – это часть полипептидной цепи (или вся цепочка), которая сворачивается независимо в стабильную третичную структуру. Доменами в белках называют области в третичной структуре, которым свойственна определенная автономия структурной организации.
Классификация типов глобулярных белковых структур («чистые» α-белки, «чистые» β-белки, и «смешанные» α/β и α+β белки) относится к малым белкам, а также к отдельным доменам (т.е. к компактным субглобулам, из которых сложены большие белки).
α-белки- цитохром с, хемэритин, геммаглютин Н2
β-белки- ингибитор субтилизина из Streptomyces, Флаводоксин и какие-то истеразы что-ли, Рубредоксин
α-Спираль:
Широко представлена в ДНК-связывающих белках, таких как белки спирально-поворотно-спирального мотива (helix-turn-helix).
Взаимодействует с большим желобком ДНК, обеспечивая специфичность связывания - одна более короткая, другая более длинная, соединенные поворотом полипептидной цепи.

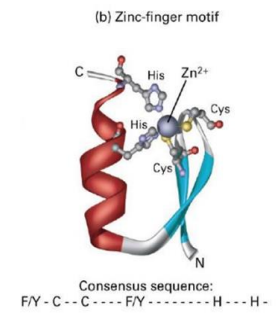
«Цинковый палец» –(ДНКсвязывающие белки) фрагмент белка, содержащий около 20 аминокислотных остатков. Атом цинка связан с радикалами 4 аминокислот: 2 остатков цистеина и 2 — гистидина. В некоторых случаях вместо остатков гистидина находятся остатки цистеина. Этот участок белка образует а-спираль, которая может специфично связываться с регуляторными участками большой бороздки ДНК.
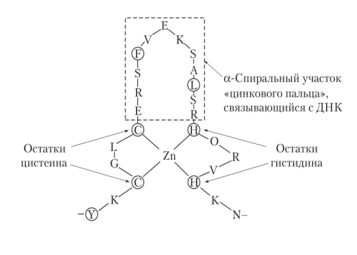
«Лейциновая застежка-молния»
Взаимодействующие белки имеют а-спиральный участок, содержащий по крайней мере 4 остатка лейцина. Лейциновые остатки расположены через 6 аминокислот один от другого. Так как каждый виток а-спирали содержит 3,6-аминокислотного остатка, радикалы лейцина находятся на поверхности каждого второго витка. Лейциновые остатки а-спирали одного белка могут взаимодействовать с лейциновыми остатками другого белка (гидрофобные взаимодействия), соединяя их вместе.
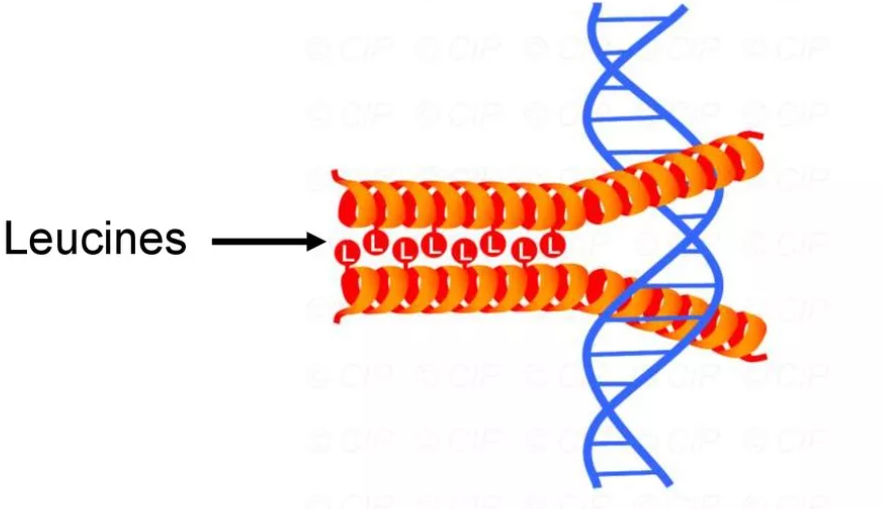
Примером таких белков могут служить гистоны. Гистоны — ядерные белки, в состав которых входит большое количество положительно заряженных аминокислот — аргинина и лизина (до 80%). Молекулы гистонов объединяются в олигомерные комплексы, содержащие 8 мономеров с помощью «лейциновых застежек», несмотря на сильный положительный заряд этих молекул
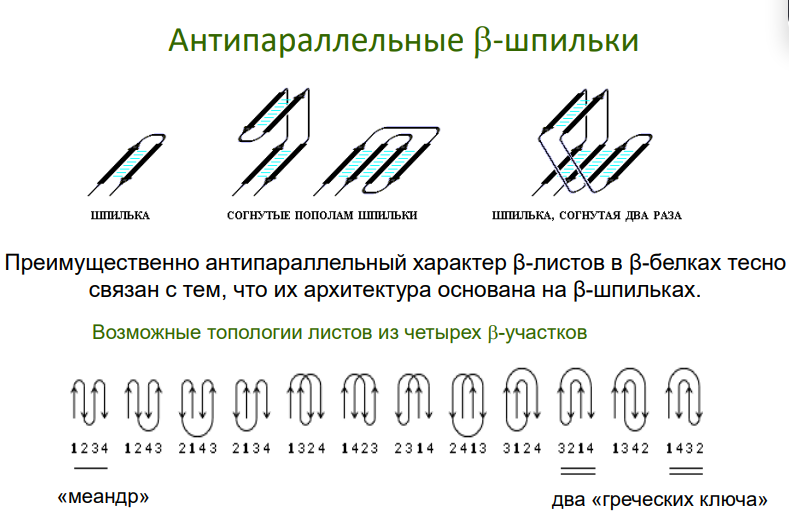
Есть еще бета-шпилька
Силы стабилизирующие пространственную структуру
1. Ковалентные связи:
Дисульфидные мостики:
Образуются между остатками цистеина (–SH группы), обеспечивая прочную связь между частями полипептидной цепи или разными цепями.
Особо важны для стабилизации третичной и четвертичной структуры белков.
2. Водородные связи:
Вносят вклад в формирование вторичной структуры:
Между атомом водорода в амидной группе и атомом кислорода в карбонильной группе.
Стабилизируют α-спирали и β-листы.
Также играют роль в удержании специфических структурных мотивов.
3. Гидрофобные взаимодействия:
Гидрофобный эффект:
Неполярные боковые цепи аминокислот стремятся избегать контакта с водой, что приводит к их укладке внутрь белковой глобулы.
Влияет на стабилизацию третичной структуры.
4. Ионные взаимодействия (электростатические):
Все гидрофильные группы радикалов аминокислот, оказавшиеся внутри гидрофобного ядра, взаимодействуют друг с другом с помощью ионных и водородных связей.
Включают взаимодействие между заряженными боковыми цепями аминокислот (например, аспартат и лизин).
Стабилизируют как третичную, так и четвертичную структуры.
5. Вандерваальсовы силы:
Слабые взаимодействия между всеми атомами белка.
Особенно важны в областях плотной упаковки атомов, где они вносят вклад в общую стабильность структуры.
6. Металлические связи:
В некоторых белках присутствуют металлические ионы (например, Zn²⁺, Fe²⁺), которые координируются с определёнными боковыми цепями аминокислот.
Пример: цинковые пальцы, стабилизирующие ДНК-связывающие домены.
7. Пи-стэкинг и дипольные взаимодействия:
Возникают между ароматическими остатками (например, фенилаланин, тирозин, триптофан) и другими элементами структуры.
29. Супервторичная структура. Структурные мотивы для α,-спиральных белков. Строение β-белков. Строение α,- и a–β-белков. Характерные мотивы укладки белковой цепи в α, β, α/β и α+β белках.
β-Структуры:
Могут образовывать β-листы, которые часто участвуют в связывании молекул ДНК через водородные связи или гидрофобные взаимодействия.
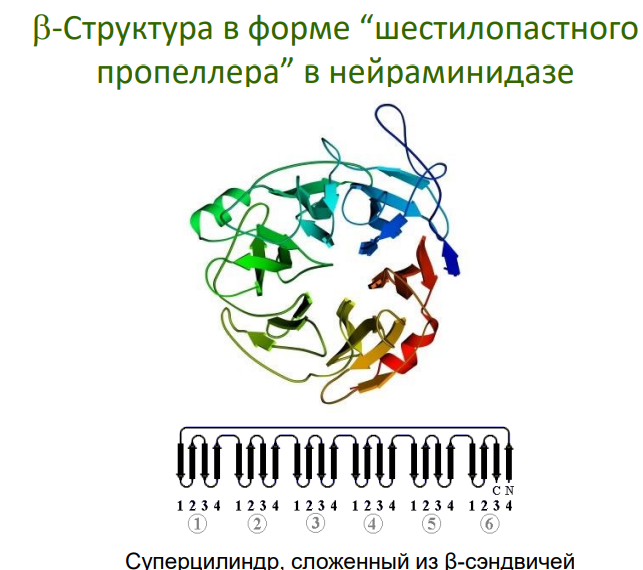
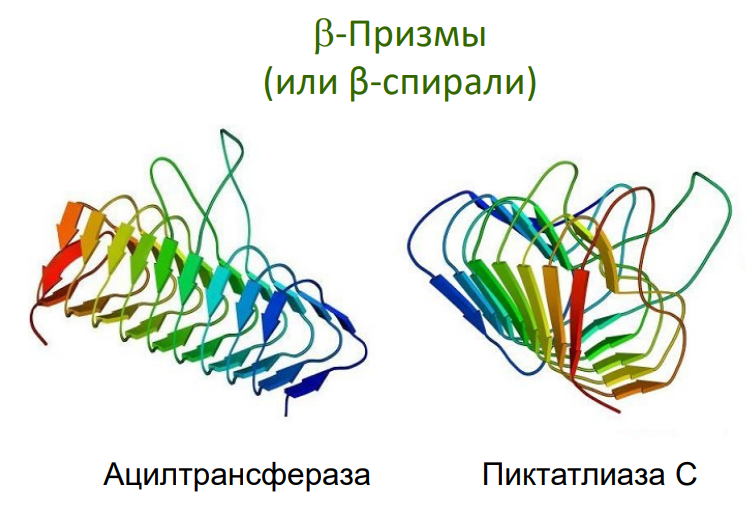
Примеры: "греческий ключ", β-цилиндры, β-сэндвичи.
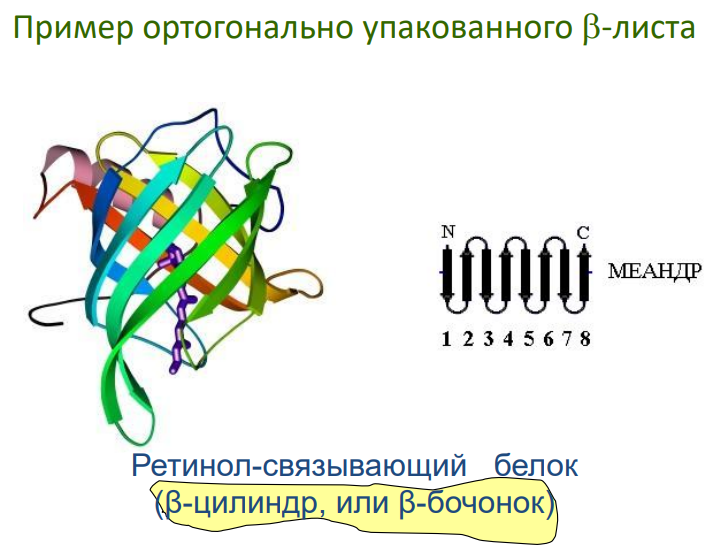
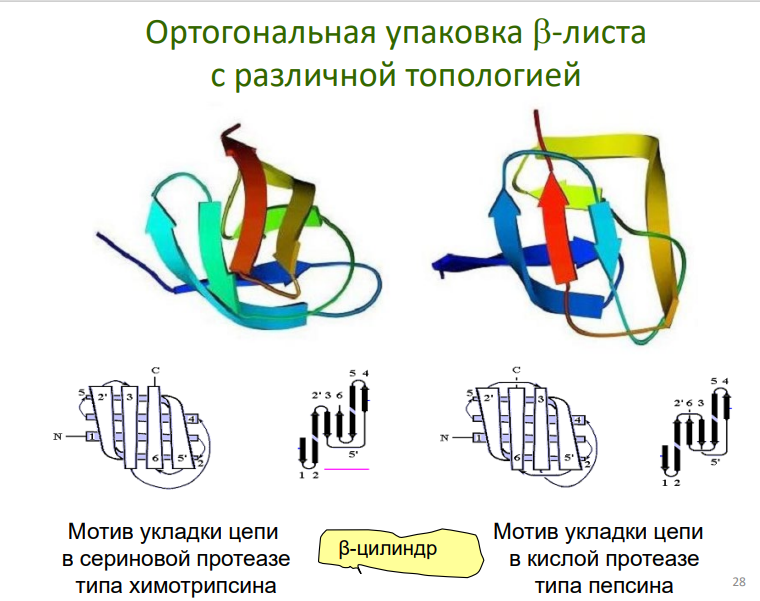
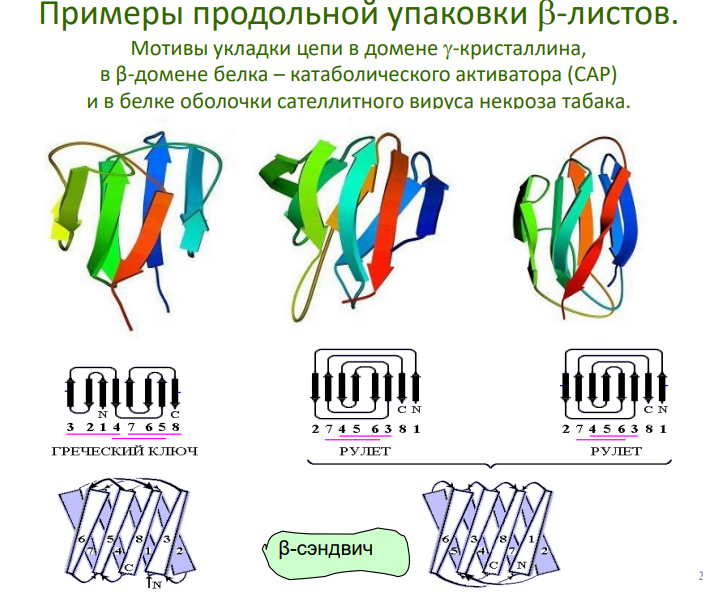
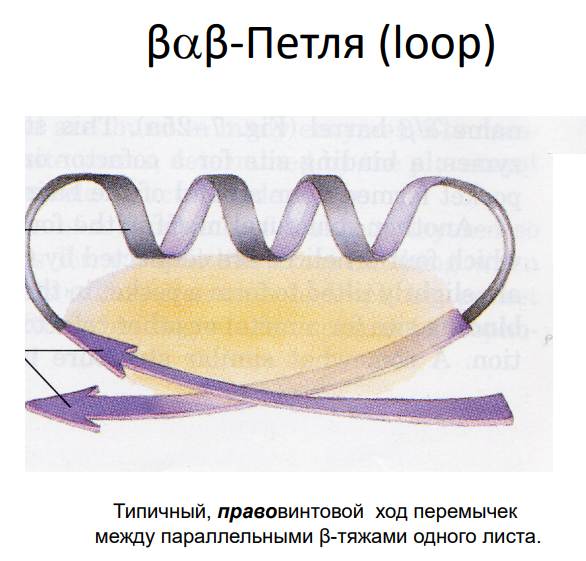
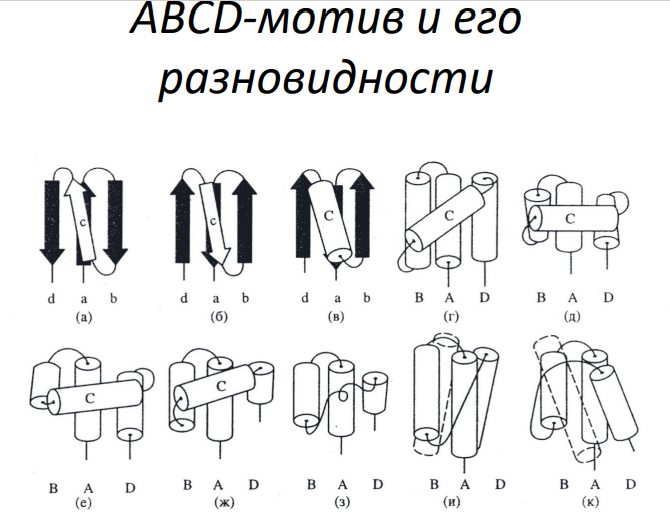
Мотивы типа βαβ:
β-петли, часто образующиеся между β-листами и α-спиралями, являются структурными элементами в ДНК-связывающих доменах, например, в цинковых пальцах.
"Греческий ключ":
Пространственный мотив, который встречается в β-листах. Такой мотив может участвовать в формировании взаимодействий между белком и ДНК.

Мотивы abcd

1. Структурные мотивы(супервторичная структура и есть) для α-спиральных белков
α-Спиральные белки характеризуются преобладанием α-спиралей в их вторичной структуре. Такие белки формируют компактные, часто симметричные глобулы, стабилизированные различными взаимодействиями.
Примеры структурных мотивов:
Спираль-поворот-спираль (helix-turn-helix):
Характерен для ДНК-связывающих белков.
Состоит из двух α-спиралей, связанных коротким поворотом.

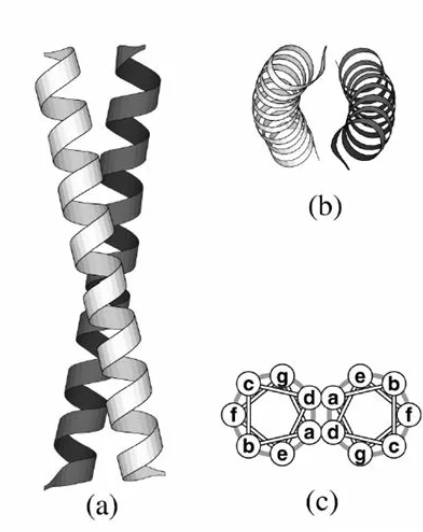
Коилд-койл (coiled coil):
Представляет собой две α-спирали, закрученные друг вокруг друга.
Пример: белок миозина, фибриллярные белки.
Пучок спиралей (4-helix bundle):
Несколько α-спиралей, упакованных параллельно или антипараллельно.
Пример: миоглобин.
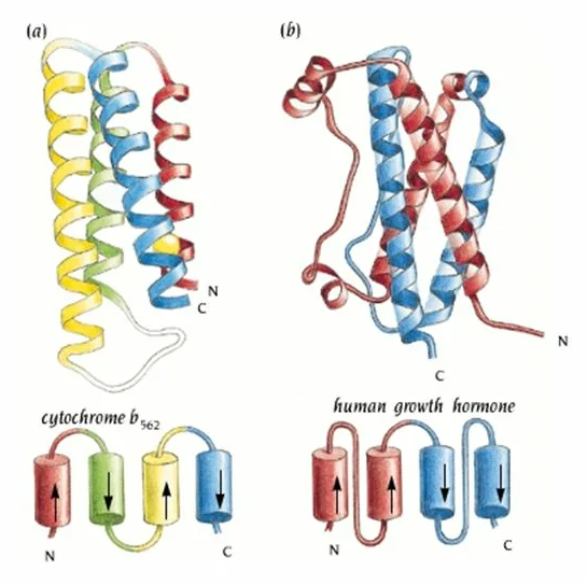
Гемоглобиновый мотив:
Объединяет несколько α-спиралей в функциональный белок, взаимодействующий с ионами металлов или органическими молекулами.

