
- •Разделение и определение меди и железа (III) при их совместном присутствии
- •Цель: Создание
- •Часть I. Определение фактора разделения меди и железа (III)
- •Составы смесей
- •*Титрование меди комплексоном III с индикатором ПАН
- •Часть II. Построение кривых элюирования
- •Процесс элюирования смоделированного раствора
- •Кривая элюирования зависимости массы элемента
- •Часть III – Применение методики на исследуемом растворе
- •Спасибо за внимание!
- •Библиографический

Разделение и определение меди и железа (III) при их совместном присутствии
Хитрых А.В. Сапунов А.Г.
Екатеринбург
2024

Цель: Создание |
методики разделения и определения меди (II) и |
железа (III), при их |
совместном присутствии. |
Задач
и:
1.Определения подходящих условий разделения на основе фактора разделения;
2.Проверка подобранных условий на смоделированной задаче;
3.С использованием созданной методики, провести количественный анализ исследуемого раствора.

Часть I. Определение фактора разделения меди и железа (III)
Приготовленные смеси с раствором соли м
готовленные смеси с раствором соли железа (III)

Составы смесей
№ Пробы |
1 |
2 |
3 |
4 |
Vсоли металла , мл |
10 |
10 |
10 |
10 |
лимонная кислота |
5 |
5 |
5 |
5 |
Vлимонная кислота, мл |
||||
(ω=20%) |
10 |
1 |
- |
- |
VNH4OH, мл |
||||
NH4OH |
|
|
|
|
(ω=10%) |
- |
9 |
10 |
- |
VH2O, мл |
||||
H2O |
- |
- |
- |
10 |
VHCl, мл |
||||
HCl |
|
|
|
|
(С=1М) |
|
|
|
|
Масса КУ-2, г |
0,2016 |
0,2060 |
0,2000 |
0,2100 |
Масса КУ-2, г |
0,2401 |
0,2072 |
0,2200 |
0,2000 |

*Титрование меди комплексоном III с индикатором ПАН
Результаты
Формула дляизмеренийрасчета коэффициента распределения:
, где:
М0 – общее кол-во элемента в исходном р-ре М – равновесное содержание элемента в р-ре V – суммарный объем раствора
m – масса ионита
Рассчитанные данные
№ опыта |
(Fe) |
(Cu) |
α |
1 |
5,23 |
121,53 |
23,24 |
2 |
16,38 |
38,84 |
2,37 |
3 |
35,41 |
184,38 |
5,19 |
4 |
5,62 |
19,60 |
3,49 |

Часть II. Построение кривых элюирования
На основе результатов предыдущей части, было принято решение об использовании условий первого опыта, так как именно в этих условиях наблюдается наибольшее значение фактора.
Перед началом работы, необходимо
подготовить хроматографическую
‘’Индикаторна
Установка’’
Хроматографическая колонка

Процесс элюирования смоделированного раствора
Начало фильтрации Железа (III)Начало фильтрации Меди
Внешний вид колонки в начале процесса
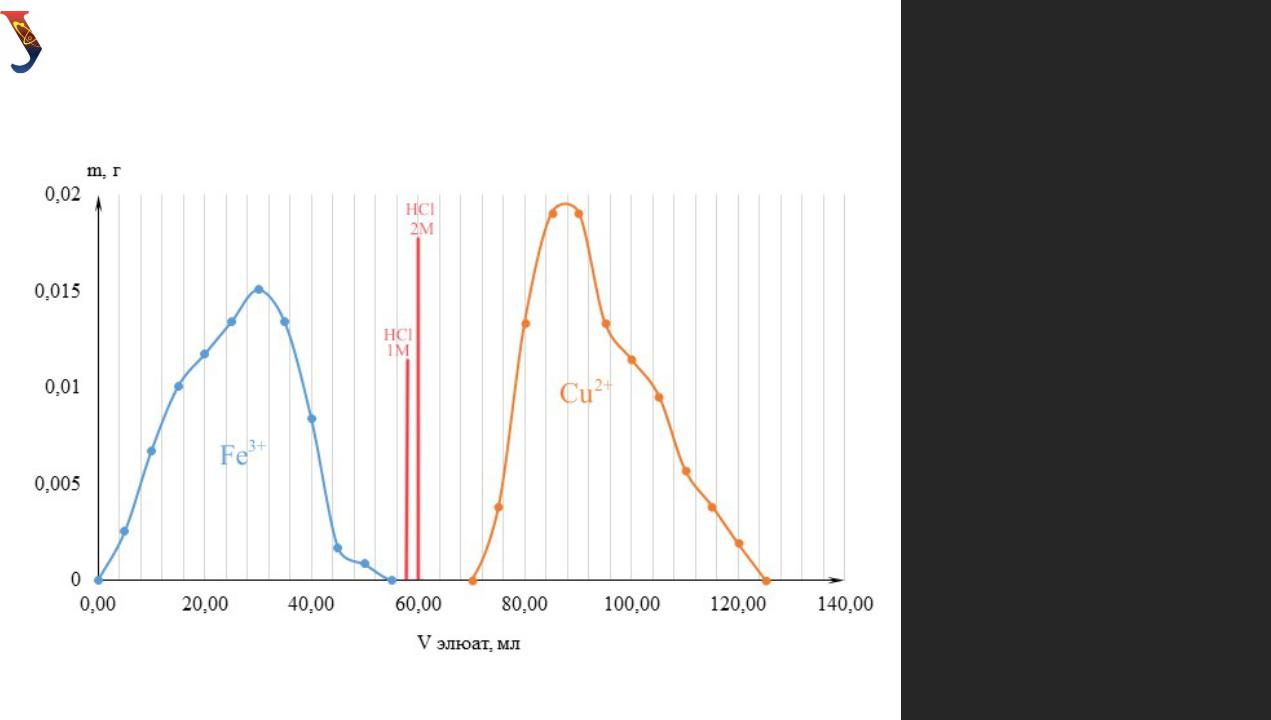
Кривая элюирования зависимости массы элемента
Объёмы
элюента, необходимые для полного элюирования
разделяемых
ионов:
V Fe3+ = 55 мл
V2+= 70 мл

Часть III – Применение методики на  исследуемом растворе
исследуемом растворе
Исследуемый раствор Фильтрат с ионами железаФильтрат с ионами меди

Fe(3+)
Cu(2+)
**Титрование железа (III) с сульфосалициловой кислотой
и меди комплексоном III с индикатором ПАН
Заключение
На основе предложенных методов, удалось создать методику разделения и определения меди и железа (III) при их совместном присутствии. Удалось проверить работоспособность методики на смоделированной смеси.
Применяя созданную методику, удалось разделить ионы Fe(3+) и Cu(2+), и количественно определить содержание ионов в анализируемой смеси, с погрешностью определения до 5%, для каждого элемента.
В дальнейшем, хотелось бы довести методику до идеала в части количественного определения, снизив погрешность до приемлемых
значений.
