
Часть III. Разделение и определение меди и железа (III) при их совместном присутствии.
Цель: Провести количественный анализ исследуемой смеси, применяя разработанную методику.
Задачи: 1. С помощью хроматографической колонки разделить ионы меди и железа (III) анализируемой смеси.
2. Провести титрование комплексонометрическим методом.
3. Рассчитать погрешность.
Оборудование: Хроматографическая колонка, бюретка, электрическая плитка, конические колбы, мерные пипетки, груша, мерные цилиндры, химический стакан, индикаторная бумага.
Реактивы: анализируемая смесь, ра-с HCl (C=2М), Трилон Б (C=0,05М), ра-р NH4OH (1:1), ра-с NH4OH (ω=10%), ра-р лимонной кислоты (ω=20%), ра-р ПАН (ω=10%), Катионит КУ-2 в NH4+ -форме, ра-р KSCN, Фенолфталеин.
Основная часть:
На результатах первой и второй части, была основа и проверена на моделируемой смеси, методика по разделению ионов меди и железа (III), при их совместном присутствии.
Применяя созданную методику, необходимо провести количественный анализ исследуемой смеси.
Методика прикреплена в отдельном приложении.
Результаты титрования:
При титровании, использовались аликвоты на 5 мл, из общего объёма, равному 100. Результаты титрования представлены в таблице
Таблица 5 – Результаты титрования.
VT,мл |
1-я параллель |
2-я параллель |
Fe3+ |
0,4 |
0,5 |
Cu2+ |
0,4 |
0,4 |
Анализ полученных результатов:
1) Расчёт массы ионов в растворе:



2) Расчёт погрешности:
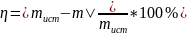


Выводы: Применяя созданную методику, удалось выполнить разделение ионов. Однако, при титровании, следует отметить, что результаты с меньшей погрешностью, могли быть получены, если бы титрование проводилось на микробюретке.
В связи со спешкой выполнения последней части, попробовать оттитровать растворы на микробюретке не удалось.
Эффективность в численном выражении определяется значениями числа теоретических тарелок и высотой, эквивалентной теоретической тарелке.
Заключение
На основе предложенных методов, удалось создать методику разделения и определения меди и железа (III) при их совместном присутствии. Удалось проверить работоспособность методики на смоделированной смеси.
Применяя созданную методику, удалось разделить ионы Fe(3+) и Cu(2+), и количественно определить содержание ионов в анализируемой смеси, с погрешностью определения до 5%, для каждого элемента.
В дальнейшем, хотелось бы довести методику до идеала в части количественного определения, снизив погрешность до приемлемых значений.
Библиографический список
Радиусы по Белову и Бокию (https://www.freechemistry.ru/sprav/out/ionradBB.htm)
Ю. Ю. Лурье – Справочник по аналитической химии
В.И. Наумов, Ж.В. Мацулевич, О.Н. Ковалева – КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ (с.131)
В.Н.Филимонов - Хроматографические методы анализа (с 48.)
В.Н.Подчайнов, Л.Н.Сиомонова - Аналитическая химия элементов (МЕДЬ)
ПРИЛОЖЕНИЕ 1
Константы распределения для меди:

= 121,53

= 38,84

= 184,38

= 19,60
Константы распределения для железа:

= 5,23

= 16,38

= 35,51

= 5,62
Фактор разделения:


ПРИЛОЖЕНИЕ 2
Таблица pH работы и цветовых переходов, применяемых индикаторов в работе.
Индикатор |
pH |
Переход окраски |
Мурексид |
7 – 9 11 – 12 |
Красная (оранжевая) – Фиолетовая |
ПАН (пиридилазонафтол) |
1,8 – 3,5 3 – 5 4 – 6 |
Красная (розовая) – Жёлтая (желто – зелёная) |
Сульфосалициловая кислота |
1,8 - 2,5 4 – 8 9 - 11,5 |
Красно-фиолетовый Красно-бурый Жёлтый |
