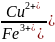Уральский Федеральный Университет
Физико-технологический институт
Кафедра Физико-Химических Методов Анализа
Отчёт по лабораторной работе
«Разделение и определение меди и железа (III)
при их совместном присутствии.»
Преподаватели: Данилов Д.А.
Кубрина Е.Д.
Студенты: Сапунов А.Г.
Хитрых А.В.
Екатеринбург
2024 г.
Теоретическое введение
Ионообменная хроматография
В основе метода лежит обмен ионами между двумя фазами, одна из которых является неподвижной, в качестве которой выступает неорганический или синтетический органический ионообменник, а другая, является подвижной, которую непрерывно пропускают через неподвижную фазу.
В качестве подвижной фазы выступают растворы кислот, солей, оснований, буферные растворы с различным значением pH, растворы комплексообразующих реагентов и т.д.
В качестве неподвижной фазы чаще всего применяются синтетические органические ионообменники (иониты). Иониты можно представить себе состоящем из основы, матрицы, которая содержит фиксированные функциональные группы. Часть этих функциональных групп жестко связана с матрицей, вследствие чего последняя несет на себе тот или иной заряд. Этот заряд компенсируется подвижными ионами функциональных групп, которые называют противоионами, что в свою очередь обуславливает способность ионита к обмену ионов на ионы, находящиеся в растворе. В соответствии с природой функциональных групп иониты бывают катионообменниками или катионитами, анионообменниками или анионитами, амфолитами, проявляющими склонность к обмену как катионов, так и анионов, и комплексообразующими иониты, в которых помимо ионной связи происходит образование дополнительной координационной связи с обмениваемым ионом.
RH
+ Na+
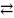 RNa
+ H+
- катионный обмен
RNa
+ H+
- катионный обмен
R`OH + Cl- R`Cl + OH- - анионный обмен
(R –полианион катионообменника, R’ – поликатион анионообменника)
Коэффициент селективности характеризует относительное удерживание или относительную подвижность двух разделяемых веществ:
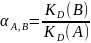
Если αА,В >1, то это означает, что находящийся в растворе ион В имеет большее сродство к иониту, чем ион А. Если αА,В<1, то будет преобладать противоположный процесс.
Коэффициент селективности ионного обмена зависит от природы ионита и обмениваемых ионов, от концентрации иона в растворе, pH, комплексообразования, температуры и т.д. Ограничением органических ионообменных материалов является их не высокая селективность.
Наиболее значительными факторами, влияющими на селективность, являются величина заряда иона и его размер. Ионы, имеющие одинаковые заряд, будут сорбироваться ионообменником тем лучше, чем больше радиус иона. При сравнении степени сродства ионов с разными зарядами, можно сказать, что с увеличением заряда иона увеличивается и сорбция.
С разбавлением раствора увеличивается сорбция с более высоким зарядом.
Ионообменное равновесие зависит от ионной силы раствора. Это особенно резко выражено при её небольших значениях. Чем меньше ионная сила раствора, тем лучше
В данной работе используется ионообменная смола - КУ-2 (в NH 4 + - форме), на которой, необходимо реализовать разделение ионов меди и железа (III).
Часть I. Определение фактора разделения меди и железа (III).
Цель: Нахождение оптимальных условий хроматографического разделения элементов – определение фактора разделения αА/В.
Задачи: 1. Провести ряд измерений сорбции ионов на катионите статическим способом, в предложенных условиях.
2. На основе полученных результатов, рассчитать коэффициент распределения KD, для каждого из ионов.
3. Определить факторы разделения меди и железа, выбрать оптимальные условия разделения этих элементов.
Оборудование: Бюретка, электрическая плитка, конические колбы, пластиковые пробирки с крышками, мерные пипетки, груша, мерные цилиндры, химический стакан, индикаторная бумага.
Реактивы: ра-р CuSO4 (C~0,05М), ра-р FeCl3(C~0,05М), ра-р HCl (C=1М), Трилон Б(C=0,05М), ра-р NH4OH (1:1), ра-р NH4OH (ω=10%), ра-р лимонной кислоты (ω=20%), ра-р NH4Сl (C=0,1M), Мурексид (насыщ.рас-р), ра-р ПАН (ω=10%), Катионит КУ-2 в NH4+ -форме.
Подготовительная часть:
Перед началом измерений, были определены концентрации солей меди и железа, комплексонометрическим методом.
Условия титрования железа (III):
Среду выравнивают до pH=1 добавляя HCl 1M, затем раствор нагревают до 60-70°C, вводят пару капель раствора сульфосалициловой кислоты и титруют раствором комплексона III, до перехода тёмно-красной окраски в жёлтую.
Условия титрования меди:
а) Когда отсутствуют цветовые наложения: исследуемый раствор нейтрализуют до pH=8, помощью раствора аммиака (1:1) до тех пор, пока от одной капли аммиака не появляется голубое окрашивание, затем добавляют 10мл 1М раствора NH4Cl, 8-10 капель насыщенного раствора мурексида и титруют раствором комплексона III до перехода жёлтой окраски в фиолетовую.
* Раствор CuSO4 имеет характерный голубоватый цвет, Мурексид, как правило, имеет переход из красно-фиолетового – в фиолетовый, однако, такой переход нельзя увидеть, если медь находится в растворе, в виде обычных ионов. Получается переход из слабо-фиолетового в фиолетовый, такой переход практически невозможно установить визуально.
б) В случае, когда есть наложение цветов: исследуемый раствор нейтрализуют до pH=6, помощью раствора аммиака (1:1), проверяя среду универсальной индикаторной бумагой, затем добавляют 1-3 капель 10% раствора ПАН и титруют раствором комплексона III до перехода индикатора из фиолетового в зеленовато-голубой цвет.
Результаты титрования:
Таблица 1 - Установленные концентрации солей.
Соль |
CuSO4 |
FeCl3 |
Концентрация, М |
0,0495 |
0,525 |
Произведённые расчёты:
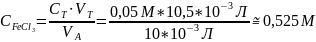
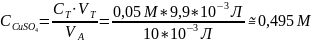
Где: СТ = 0,05 М концентрация титранта;
VT объём, затраченный на титрование;
VA = 10 мл, объём аликвоты соли, взятой на титрование.
*Параллели титрований было 2, каждая из параллелей не имела расхождений в объёме затраченного титранта.
Основная часть:
Для каждого элемента были подготовлены 4 пробы, отличающихся составом смеси, в которой проводилась сорбция. Информация, о составе каждой, представлена в таблице 2.
Таблица 2 – Составы смесей проб.
№ Пробы |
1 |
2 |
3 |
4 |
Vсоли металла , мл |
10 |
10 |
10 |
10 |
Vлимонная кислота, мл (ω=20%) |
5 |
5 |
5 |
5 |
VNH4OH, мл (ω=10%) |
10 |
1 |
- |
- |
VH2O, мл |
- |
9 |
10 |
- |
VHCl, мл (С=1М) |
- |
- |
- |
10 |
Масса КУ-2, г
|
0,2016
0,2401 |
0,2060
0,2072 |
0,2000
0,2200 |
0,2100
0,2000 |
Приготовленные пробы периодически встряхивали вручную. Спустя один час, из проб были отобраны аликвоты и оттитрованы, в соответствии с необходимыми условиями. Результаты представлены в таблице 3.
Таблица 3 - Результаты титрования проб.
Элемент |
Cu2+ |
Fe3+ |
||||||||
№ Пробы |
1 |
2 |
3 |
4 |
1 |
2 |
3 |
4 |
|
|
VA, мл |
5 |
5 |
5 |
5 |
5 |
5 |
10 |
10 |
|
|
VT, мл |
2,0 |
1,5 |
0,8 |
1,7 |
2,0 |
2,0 |
3,2 |
4,0 |
|
|
CT, M |
0,025 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
0,05 |
|
|
Индикатор |
Мурексид |
ПАН |
Сульфосалициловая кислота |
|
||||||
На основе полученных данных, был произведён расчёт коэффициента распределения KD. Исходная формула:
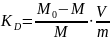
где: M0 – общее количество элемента, содержащегося в исходном растворе, г
М – равновесное содержание элемента в растворе, г
V – суммарный объём раствора, мл
m – масса ионита, г.
Пример расчёта для первой пробы соли меди:
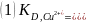
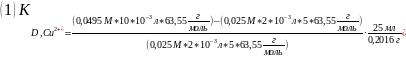
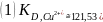
где, А – учёт соотношения взятой аликвоты к общему объёму раствора
МCu – молекулярная масса элемента
**выкладки расчётов по остальным пробам, представлены в Приложении 1.
Таблица 4 – Результаты расчётов коэффициента распределения и фактора разделения меди и железа (III).
№ опыта |
KD(Fe) |
KD(Cu) |
α |
1 |
5,23 |
121,53 |
23,24 |
2 |
16,38 |
38,84 |
2,37 |
3 |
35,51 |
184,38 |
5,19 |
4 |
5,62 |
19,60 |
3,49 |
Анализ полученных результатов:
В условиях первого опыта, наблюдается лучшее разделение элементов – разберём почему так:
Для меди, наблюдается лучшая сорбция. Медь, в данном растворе находится в форме комплексного иона (раствор имеет характерную синюю окраску) - аммиаката меди [Cu(NH6)4]2+ (lgK4=12.03), положительно заряженный ион с очень большим радиусом, (по сравнению с радиусом иона меди) в теории, может хорошо сорбироваться на ионите, что подтверждается практикой. При этом протекает реакция:
![]()
Железо (III), при тех же условиях может образовывать кислую соль FeC6H5O7·(NH4)2C6H6O7 – железо лимонноамичное зелёное, нейтральное соединение (плохо-растворимо в спирте), которое в теории плохо сорбируется на ионите, что подтвердилось и на практике.
Выводы: На основе рассчитанных факторов разделения, было принято решение об использовании условий первого опыта, так как именно в этих условиях наблюдается наибольшее значение фактора.