
Хроматография / metodichka
.docxУрФУ
Физико-технологический институт
Кафедра физико-химических методов анализа
МЕТОДИКА РАЗДЕЛЕНИЯ И ОПРЕДЕЛЕНИЯ МЕДИ (II) И ЖЕЛЕЗА (III) ПРИ ИХ СОВМЕСТНОМ ПРИСУТСТВИИ
Преподаватели: Данилов Д.А.
Кубрина Е.Д.
Студенты: Хитрых А.В.
Сапунов А.Г.
Екатеринбург
2024
Теоретическая часть:
В основе метода лежит обмен ионами между двумя фазами, одна из которых неподвижная, в качестве которой выступает в данной работе синтетический органический ионообменник - ионообменная смола – катионит КУ-2. В качестве подвижной выступают растворы солей, кислот, оснований, буферные растворы и т.д.
Для нахождения оптимальных условий хроматографического разделения элементов определяют фактор разделения αA/B = KD(A)/KD(B). Условие хроматографического разделения элементов α ≠ 1.
Коэффициент распределения KD определяют путем встряхивания точной навески воздушно-сухого ионита с определенным объемом исследуемого раствора до достижения равновесия. Затем в аликвотной части раствора определяют количество непоглощенного сорбентом элемента. Вычисляют по формуле:
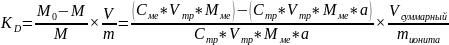
Цель: разделить и определить медь (II) и железо (III) при их совместном присутствии, методом ионообменной хроматографии с погрешностью Δr=±1%.
Реактивы: ра-р HCl (C=2M), ра-р NH3*H2O (1:1), ра-р NH3*H2O (ω=10%), ра-р лимонной кислоты (ω=20%), ра-р сульфосалициловой кислоты, рас-р ПАН (ω=10%), ра-р Комплексона III (C=0,05М), Катионит КУ-2 в NH4+ - форме, фенолфталеин, универсальная индикаторная бумага, ра-р KCSN.
Приборы: Электрическая плитка, хроматографическая колонка, микробюретка, стеклянная палочка, мерный стакан, пипетка, груша, капилляр, конические колбы, мерные колбы, мерные цилиндры.
Порядок работы:
В хроматографическую колонку поместить ионообменник КУ-2, так, чтобы между частицами не было пузырьков воздуха. В случае их наличия, снять колонку со штатива, закрыть сверху пробкой, и переворачивать до полного удаления пустого пространства между частицами. Также, можно не снимая колонку со штатива, избавиться от пузырьков с помощью стеклянной палочки, перемешав раствор с ионитом внутри колонки.
В растворе с неизвестным содержанием металлов создать условия, необходимые для проведения ионообменной хроматографии: данная методика выполняется созданием в растворе щелочной среды, для исследуемого раствора, в присутствии лимонной кислоты. В химический стакан, вместимостью 100 мл помещают: 10 мл раствора солей металлов, 5 мл 20% раствора лимонной кислоты, 10 мл 10% раствора аммиака.
Создать те же условия в хроматографической колонке. Приготовить раствор с таким же соотношением лимонной кислоты и аммиака. В работе, предлагается следующий объём: 75 мл 20% раствора лимонной кислоты и 150 мл 10% раствора аммиака. Достижение pH фиксируется либо с помощью универсальной индикаторной бумагой, либо с помощью кислотно-основного индикатора фенолфталеина. Заполняем подготовленным раннее раствором хроматографическую колонку, настраивая скорость капания 1 капля в 2 секунды, под колонку поместить мерный цилиндр (50 мл), предварительно в который, внести пару капель фенолфталеина. Изначально раствор бесцветный, но вскоре в зоне падения капли будет наблюдаться розовое окрашивание и изменение окраски раствора на малиновую. Тогда колонка будет считаться готовой к работе.
Через хроматографическую колонку пропускают подготовленный анализируемый раствор со скоростью 1 капля в 4 секунды. Элюат набирают в мерный цилиндр №1 (100 мл). Постепенно прибавляя в колонку новую порцию элюента, если разница в колонке между верхней границей раствора и катионита составляет менее 2 мл. Элюирование совершают до полного вымывания первого компонента из колонки, железо полностью вымывается по достижению 55 мл элюата. (Чтобы проверить полноту вымывания железа, рекомендуется воспользоваться качественной реакцией из приложения) После поменять цилиндр на мерный цилиндр №2 (100 мл), заменить элюент на HCl (2M) и элюировать до полного вымывания раствора меди из колонки. (Для проверки на наличие следовых количеств меди, рекомендуется воспользоваться качественной реакцией из приложения)
Полученный раствор с ионами железа переносят в мерную колбу (200 мл), доводят до метки дистиллированной водой. Тщательно перемешивают, после чего, отбирают аликвоту на 10 мл и помещают в коническую колбу (100 мл). К раствору добавить 1М раствора HCl до достижения pH=1, зафиксировать с помощью универсальной индикаторной бумаги. Далее приготовленный раствор нагревают на до 60-70 С, измеряя температуру градусником. После нагревания вводят несколько капель раствора сульфосалициловой кислоты и титруют раствором комплексона III до перехода тёмно-красной окраски раствора в желтую.
Полученный раствор с ионами меди переносят в мерную колбу (200мл), доводят до метки дистиллированной водой. Тщательно перемешивают, после чего, необходимо отобрать аликвоту на 10 мл и поместить в коническую колбу (100 мл). К раствору добавляют раствор аммиака 1:1 до достижения pH=6 – проверять индикаторной бумагой. После вводят несколько капель индикатора ПАН и титруют раствором комплексона III до перехода окраски из фиолетовой в зелено-голубую.
По полученным данным рассчитывают содержание меди и железа в анализируемом растворе в граммах, по следующей формуле:
 ,
где:
,
где:
CT – концентрация титранта, М
VT – объём титранта, ушедшего на титрование, Л
M – молекулярная масса элемента, г/моль
A – учёт аликвоты.
ПРИЛОЖЕНИЕ
Качественная реакция на Fe3+:
Поместить 1 каплю раствора в пробирку, добавить каплю HCl (С=1М) и добавить каплю KCNS. В случае присутствия железа раствор окрасится в кроваво-красный цвет.
Качественная реакция на Cu2+:
Поместить 1 каплю раствора в пробирку, добавить несколько капель раствора аммиака (1:1). В случае присутствия меди, раствор окрасится в синий цвет.
