
Экзамен / GMA_shpora
.docxПромывные растворы Дистиллированная вода
Р-ры электролитов
Переосаждение ( если промывка не помогла)
|
Общая схема гравиметрического анализа: 1.Осаждение (навеску пробы растворяют и добавляют небольшой избыток реагента-осадителя.) 2.Фильтрование (осадок фильтруют (центрифугируют), т.е. отделяют от «маточного» раствора в котором содержатся все остальные компоненты.) 3.Промывка (обязательная операция для удаления остатков маточного раствора, содержащегося в осадке, и замещения примесей ионами промывного раствора, легко удаляемыми при прокаливании.) 4.Высушивание,прокаливание (обязательная операция для получения стехиометрической гравиметрической формы.) 5.Взвешивание (на аналитических весах определяют массу гравиметрической формы.) 6.Расчет результатов анализа (рассчитывают массу определяемого компонента в анализируемой пробе.) |
Требование к гравиметрической форме 1.Гравиметрическая форма должна быть известного стехиометрического состава. 2.Не должен реагировать с О2 и СО2 воздуха, заметно поглощать влагу и самопроизвольно разлагаться. 3.Чем меньше F(чем больше молярная масса гр.ф.), тем лучше, поскольку увеличивается чувствительность 4.Mгр.ф. min= 0,1 г( не меньше) Требование к осаждаемой форме 1.Аналит доолжен осадиться быстро и полностью, его концентрация в растворе после осаждения не должна превышать 10-6 М. Потери не более 0,1 отн %. 2.Осадок должен быстро и хорошо отделяться от маточного раствора и хорошо промываться. 3.Осадок должен быть чистым, т.е. не содержать посторонних примесей не удаляющихся при прокалке mприм ≤0,1 отн % от массы анатила. |
Гравиметрический анализ – метод количественного химического анализа, основанный на измерении массы определяемого компонента в ходе аналитической химической реакции. Методы выделения. Определяемый компонент в ходе химической реакции количественно выделяют в свободном состоянии и взвешивают. Методы отгонки. Определяемый компонент количественно отгоняют в виде летучего соединения. Методы осаждения. Определяемый компонент количественно осаждают из раствора химическими способами в виде малорастворимого соединения (осаждаемая форма). Фактор пересчета По
массе гравиметрической формы с учетом
химической формулы полученного
соединения и на основании законов
стехиометрии рассчитывают массу
определяемого компонента в анализируемом
объекте: При
расчете массы Th
по массе ThO2
(пример 5) гравиметрический фактор
будет равен:
При
расчете массы U
по массе U3O8
(пример 4) гравиметрический фактор
равен:
Чем больше молекулярная масса гр. Ф. и меньше массовая доля опр. компонента в ней (т.е. чем меньше гравиметрический фактор), тем меньше будут сказываться погрешности взвешивания на результатах анализа. |
Условия осаждения осадков 1) Кристаллические осадки (Добавляем по каплям, постоянно перемешивая, разбавленный р-р реагента-осадителя, осаждаем из горячего р-ра, фильтрация через 10÷20 ч( происходит Оствальдское созревание) Оствальдовское созревание – перенос вещества от мелких частиц к крупным. Мелкие частицы растворяются, а крупные растут за их счет.) 2) Аморфные осадки (Из концентрированных р-ров и реагент-осадитель и аналит, после: разбавление, фильтрация, сразу фильтруем после осаждения (промываем) Механизм соосаждения Адсорбция – концентрирование вещества на поверхности раздела фаз ( за счет электр. Поля ионов находящихся на пов-ти осадка). В первую очередь адсорбир-ся ионы входящие в состав осадка и имеющ-ся в р-ре в избытке. Окклюзия – захват посторонних ионов в процессе образования осадка (основной вид загрязнения) -адсорбционная окклюзия. Адсорбция ионов на пов-ти растущих кристаллов, приводит к тому, что примеси оказываются внутри осадка. -механическая окклюзия. Захват маточного р-ра попадающего в трещины и полости осадка в процессе его роста. Изоморфное осаждение– св-ва ионов замещать друг друга в кристалле с образованием физ. Переменного состава. Ионы должны иметь близкий радиус. Например, К+ замещает NH4+ в MgNH4PO4; SO42 замещают СrO42 в PbCrO4. Для уменьшения загрязнения осадка проводят промывки. Цель ее отделить нелетучую адсорбированную примесь на летучую, которая удаляется при последующей прокалке.
|
Загрязнение осадков Образующийся осадок всегда увлекает с собой примеси 1. При совместном осаждении одновременно превышается произведение растворимости осаждаемого соединения и соединений примесных компонентов. Например, при осаждении BaSO4 (ПР ~ 10-10) в присутствии избытка ионов SO4-2 возможно совместное осаждение примесных элементов, образующих труднорастворимые сульфаты: PbSO4 (ПР ~ 10-8), SrSO4 (ПР ~ 10-7). Сводят к минимуму путем предварительного разделения компонентов. 2. Соосаждение – загрязнение осадка веществами, которые в данных условиях не должны осаждаться, т.е. происходит захват примесей из ненасыщеных р-ров. 3. Последующее осаждение – осаждение элементов-примесей на готовом сформировавшемся осадке при его длительном контакте с маточным раствором. Например, на осадке CaC2O4 может осаждаться MgC2O4. Причина заключается в адсорбции оксалат-ионов осадком и достижении пересыщения поверхностного слоя, достаточном для осаждения оксалата магния. Для предупреждения последующего осаждения необходимо предварительное разделение элементов. |
Коэффициент активности индивидуальных ионов можно оценить по приближенным формулам Дебая-Хюккеля:
Для воды при 298К константы равны: А 0,5; В 0,33; тогда формулы Дебая-Хюккеля имеют следующий вид:
С ростом ионной силы раствора коэффициенты активности уменьшаются.
2.Влияние кислотности (рН) на растворимость осадка Если осаждаемое соединение является солью слабой кислоты или слабого основания, то на растворимость осадка существенно влияет концентрация ионов водорода или гидроксила. МАm – труднорастворимая соль слабой кислоты НА. HX – сильная кислота. Принимаем коэффициенты активности ионов равными 1. ПР (МАm) = M+mA-nm M+mmM+mm = S(mS)m S(m+1)mm. В растворе устанавливаются следующие равновесия: MAm
= M+m
+ mA;
A
+
H+
= HA,
Таким образом, часть ионов А связывается с ионами Н+ в малодиссоциированную кислоту НА и, следовательно, увеличивается концентрация ионов М+m в растворе, осадок растворяется (равновесие смещается в сторону реакции растворения). Суммарная концентрация всех форм аниона слабой кислоты в растворе: CA = A HA mM+m. Введем понятие – относительная доля ионов А в растворе - X(A):
Таким образом, X(A) можно рассчитать, зная Н+ и КНА. Равновесная концентрация иона [А-] в растворе будет определяться как: A = XCA = XmM+m; ПР = M+m(XmM+m)m = XmmmM+m(m+1) = XmmmS(m+1). В общем случае для осадка состава MnAm: ПР = XmmmnnS(m+n). 3.Влияние комплексообразования на растворимость осадка Рассмотрим растворимость бинарного осадка MА в присутствии лигандов L. Суммарная концентрация всех форм металла в растворе: CM = MMLML2ML3+[MLn]– уравнение материального баланса. Выразим долю ионов металла в растворе:
|
Механизм образования осадков Равновесие малорастворимого соединения MnAm количественно характеризуется ПР: 1 стадия. Образование зародышей кристаллов ( 5-100 атомов) Чтобы начать процесс образования зародышей нужно привысить сверхрастворимость или вывести центр кристаллизации, далее добавляем реагент осадитель в кол-ве не превышающих сверхрастворимость. Новые зародыши не образуются, а растут старые – получаем крупнокристаллический осадок. Если сверхрастворимость постоянно превышается, то появляются, то появляются новые зародыши , осадок образуется мелкокристаллическим или аморфным. Сверхрастворимость –предельная концентрация, не может быть превышена даже при полном отсутствии центров кристаллизации. Критический зародыш – мельчайшая частица с максимальным поверхностным натяжением, способная к самопроизвольному росту. Индукционный период – интервал времени от момента смешивания анализируемого раствора с реагентом-осадителем в условиях превышения сверхрастворимости до момента появления зародышей. Формирование зародышей – начальная стадия образования осадка. 2 стадия. Рости и укрепление частиц осадка. Дисперсность осадка зависит от: образования центров кристаллизации и роста центров кристаллизации. Для
уменьшения относительного пересыщения
раствора проводить из разбавленных
растворов для уменьшения Со,
а для
увеличения
3 стадия. Стадия созревания (старения) осадков. Для уменьшения загрязнения осадка адсорбированными примесями кристаллический осадок выдерживают в маточном растворе некоторое время. В процессе настаивания в осадке происходят необратимые структурные изменения, называемые старением (созреванием) осадка. Перекристаллизация первичных частиц, растворение мелких и рост крупных кристаллов, термическое старение, превращение в более устойчивую форму, химическое старение. Длительность старения от 0,5 до 10-20 часов. При перекристаллизации кристаллы растворяются и снова кристаллизуются. Обменная адсорбция, сущность заключается в замене адсорбированных ионов, не удаляющихся при прокаливании осадка, на ионы, которые при прокаливании образуют газообразные продукты разложения (соли аммония, галогеноводороды, азотная кислота) и не вносят погрешности при взвешивании осадка. У аморфного осадка ( время ≤0÷0,5ч). Минусы: начинают заряжаться частицы и они уходят в р-р( и проходят через фильтр( процесс пиптизации/коллоидообразования) Для коагуляции вводят электролит (обратный процесс)
|
Факторы, влияющие на растворимость осадка Полнота осаждения определяется растворимостью осадка во время осаждения и во время промывки. MnAm = nM+m + mA-n Согласно принципу Ле-Шателье, увеличение концентрации ионов A-n приводит к смещению равновесия в сторону обратной реакции => концентрация ионов M+m уменьшается. Равновесие характеризуется концентрационной константой равновесия, называемой произведением растворимости: Ks = ПР = [M+m]n·[A-n]m.
С увеличением концентрации реагентов возрастает сила электростатического взаимодействия между ионами. В результате кинетическая энергия движения уменьшается, т.е. уменьшается активность ионов («кажущаяся концентрация» ионов).
Активность
каждого сорта ионов, участвующих в
реакции, можно рассчитать по формуле: Коэффициент активности fi характеризует отклонение свойств иона в реальном растворе от его свойств в идеальном растворе, возникающее вследствие электростатического взаимодействия с окружающими ионами.
Коэффициент
активности зависит от заряда иона,
параметров ионной атмосферы (ее
размеров и плотности), которые определяют
ионную силу раствора
(или I).
Ионную силу рассчитывают по формуле: Для электролита MnAm концентрационная константа растворимости: Ks = [M]n·[A]m = (nS)n(mS)m = nnmmS(m+n). С учетом активностей ионов термодинамическая константа растворимости имеет следующий вид: Kso
= ПР
=
|


 .
. .
. ,
(для 0,01);
,
(для 0,01); ,
(для = 0,01 0,1),
,
(для = 0,01 0,1), ,
(для 0,01);
,
(для 0,01); ,
(для = 0,01 0,1).
,
(для = 0,01 0,1). ;
; ,
SSo.(с
учетом ионной силы)
,
SSo.(с
учетом ионной силы) ;
MAm
+ mHX
= M+m
+ mHA
+ mX
;
MAm
+ mHX
= M+m
+ mHA
+ mX .
.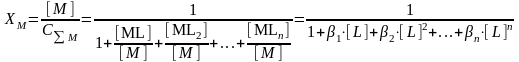
 рекомендуется
нагреть раствор, а также ввести
электролит или подкислить раствор.
рекомендуется
нагреть раствор, а также ввести
электролит или подкислить раствор.
 ,
, ,
, = Mn[M]n·Am[A]m = MnAmKs
= Mn
AmnnmmS(m+n).
= Mn[M]n·Am[A]m = MnAmKs
= Mn
AmnnmmS(m+n).