
пособие_2_2022
.pdf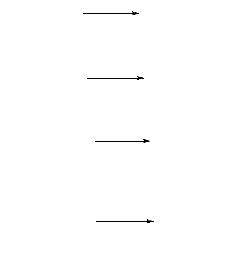
менее прочна, чем связь С–Н, последняя разрывается легче, так как более доступна для атаки реагента. Химические превращения алканов сопровождаются гомолитическим расщеплением связей С–Н с последующим замещением атома водорода другими атомами или группами, т. е. для них характерны реакции замещения, происходящие по радикальному механизму (SR). При высоких температурах может наблюдаться гомолитический разрыв связей С–С.
Реакции радикального замещения. Галогенирование. Алканы реаги-
руют с галогенами (кроме йода) с образованием моно- и полигалогеналканов. Галогены по способности реагировать с алканами располагаются в следующий ряд: F2 > Сl2 > Вr2. Прямое фторирование алканов является трудно контролируемой экзотермической реакцией. Энергия, выделяющаяся при замещении атома водорода атомом фтора, превышает энергию диссоциации связи С–С. При фторировании алканов наряду с замещением атомов водорода атомами фтора происходит разрыв углерод-углеродных связей и образуется сложная смесь фторалканов. Именно поэтому прямое фторирование алканов применяется ограниченно.
В ходе взаимодействия метана с хлором, протекающего при освещении или нагревании (300 °С), атомы водорода постепенно замещаются атомами хлора:
хлорметан
дихлорметан
трихлорметан (хлороформ)
тетрахлорметан (четыреххлористый углерод)
Реакция протекает по цепному свободнорадикальному механизму, который был изучен советским академиком, лауреатом Нобелевской премии Н. Н. Семеновым.
В цепной реакции выделяют 3 последовательные стадии: инициирование, рост цепи и обрыв цепи.
21

Инициирование. Молекула галогена под действием квантов света (h ) или при нагревании претерпевает гомолитический разрыв связи с образованием свободных радикалов:
Рост цепи. Образовавшиеся свободные радикалы хлора атакуют связь С–Н в молекуле СН4 и отрывают атом водорода с образованием НСl и сво-
бодного метильного радикала СН3•:
Метильный радикал атакует молекулу хлора, отрывает атом галогена и образует хлорметан СН3Сl и свободный радикал хлора:
Образовавшийся радикал хлора повторяет цикл указанных превращений, т. е. происходит цепная реакция, в которой атом хлора, прореагировавший на предыдущей стадии роста цепи, способствует высвобождению нового радикала хлора на последующей стадии. Образуется смесь моно-, ди-, три- и тетрахлорпроизводных метана.
хлора повторяет цикл указанных превращений, т. е. происходит цепная реакция, в которой атом хлора, прореагировавший на предыдущей стадии роста цепи, способствует высвобождению нового радикала хлора на последующей стадии. Образуется смесь моно-, ди-, три- и тетрахлорпроизводных метана.
Цепная реакция завершается только после исчезновения всех образовавшихся в ходе превращений свободных радикалов.
Обрыв цепи происходит в результате рекомбинации (димеризации) свободных радикалов:
Следует обратить внимание на региоселективность (избирательность) галогенирования (особенно бромирования) алканов. В первую очередь замещается атом водорода при третичном атоме углерода, затем – при вторичном и в последнюю очередь – при первичном:
2-метилбутан 2-бром-2-метилбутан
22

Такая последовательность замещения определяется устойчивостью образующихся свободных радикалов. Региоселективность галогенирования алканов возрастает при понижении температуры реакции. Чем активнее галогенирующий реагент, тем ниже избирательность процесса.
Нитрование алканов проводят разбавленной азотной кислотой (10…20 %) при 110…140 °С и повышенном давлении (реакция Коновалова):
нитроэтан
Эта реакция протекает по свободнорадикальному механизму:
Нитрование алканов характеризуется высокой региоселективностью. Следует отметить, что алканы в обычных условиях не взаимодействуют
с концентрированной азотной кислотой.
Сульфохлорирование. При совместном действии оксида серы (IV) и хлора в условиях УФ-облучения алканы образуют алкансульфонилхлориды
(R–SO2Cl):
метансульфохлорид
Реакция протекает по свободнорадикальному механизму (SR):
Сульфохлорирование алканов позволяет получить смесь первичных и вторичных алкансульфохлоридов. Третичные алкансульфохлориды в силу пространственных препятствий не образуются.
23
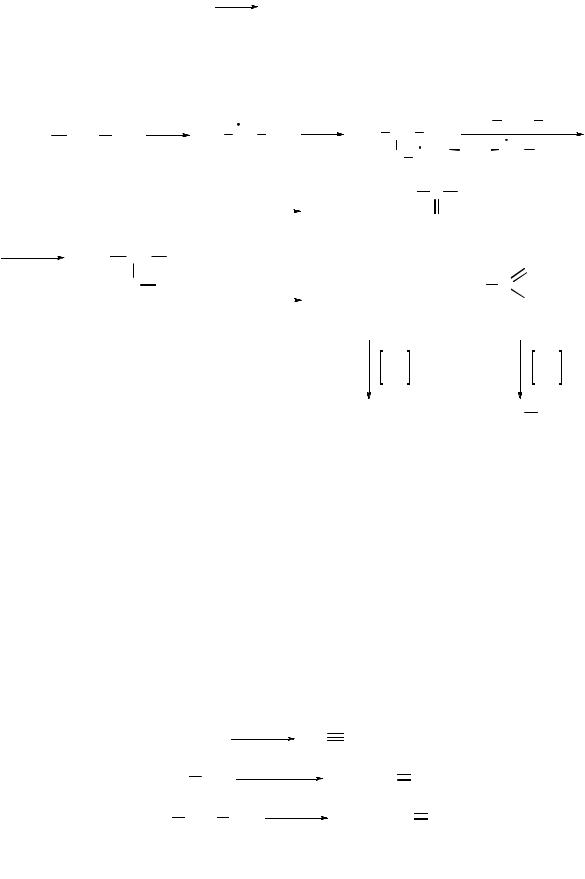
Оксидирование алканов. Горение. Алканы в избытке кислорода или на воздухе горят с выделением большого количества теплоты:
Оксидирование алканов в присутствии катализатора (соли марганца,
катализатора (соли марганца,
хрома и др.) и при нагревании (150…200 °С) протекает по радикальному механизму и сопровождается разрывом С–С связей:
CH3 CH |
CH3 |
|
|
ацетон |
|
|
|
||
|
||||
O |
OH |
|
|
|
|
|
|
|
метанол уксусный альдегид |
|
|
|
|
|
муравьиная кислота уксусная кислота
Реакция оксидирования используется для промышленного получения метанола, формальдегида, ацетальдегида и уксусной кислоты из пропана и бутана, а также для получения высших жирных кислот из алканов с длиной цепи более 25 атомов углерода.
Крекинг алканов – это процесс их расщепления. Термический крекинг проводят при 800 °С и выше, каталитический – при 450...550 °С в присутствии алюмосиликатных катализаторов.
Высшие алканы в условиях термического крекинга образуют смесь низших алканов и алкенов. Термический крекинг протекает по радикальному механизму:
24
При каталитическом крекинге расщепление углерод-углеродной связи сопровождается преимущественно изомеризацией н-алканов в алканы с разветвленной цепью.
Крекинг-процесс имеет важное промышленное значение для получения высокооктановых бензинов, непредельных и ароматических углеводородов.
1.7. Идентификация алканов
Химические методы для идентификации алканов не используются. Алканы идентифицируют по физическим константам (температуры кипения и плавления, показатель преломления, удельное оптическое вращение для оптически активных веществ и др.) и спектральным характеристикам.
Алканы поглощают УФ-излучение в области менее 200 нм, поэтому жидкие алканы используют в качестве растворителей для измерения электронных спектров других веществ. Для ИК-спектров алканов характерны полосы поглощения в области 3000…2850 см–1, отвечающие валентным колебаниям связей С–Н, и в области 1470…1370 см–1, характеризующие деформационные колеба- ниясвязейС–Н.
В ПМР-спектрах алканов разные по расположению протоны имеют близкие значения химических сдвигов (0,5…2 млн–1), что затрудняет интерпретацию ПМР-спектров.
В последние годы достигнуты большие успехи в идентификации алканов методом масс-спектрометрии.
Контрольные вопросы и упражнения по гл. 1
1. Назовите углеводороды по рациональной и заместительной номенкла-
турам IUPAC:
а |
б |
в
25
2. Назовите алканы, образующиеся в результате следующих реакций:
а
б
в
г
д
е
3. Напишите уравнения реакций, с помощью которых можно осуществить следующие химические превращения: а) СН3–СН2СООН → 2-нитробутан; б) пропан → 2,3-диметилбутан; в) Аl3С4 → н-бутан.
4.Приведите схему реакции Коновалова для следующих углеводородов: а) н-пентана; б) 2-метилбутана, в) метана. В каких условиях протекает взаимодействие? На примере реакции б опишите механизм реакции.
5.С какими из приведенных соединений реагирует пропан в заданных условиях? Напишите уравнения реакций. Опишите механизмы взаимодей-
ствия с реагентами, отмеченными звездочками: а)* Н2SO4 (конц.), 20 °С; б)* Вr2, темнота, 20 °С; в)* Вr2, освещение, 20 °С; г)* I2, освещение, 20 °С; д)* SO2 + Cl2, освещение; е)* HNO3 (разб.), 140 °С, давление.
26
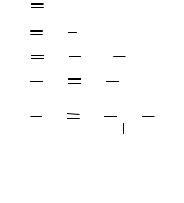
2. АЛКЕНЫ
Алкены – это углеводороды алифатического ряда, содержащие одну двойную связь. Общая формула алкенов CnH2n. Родоначальником гомологического ряда алкенов является этилен, что обусловило еще одно их название – «этиленовые углеводороды». Сохранилось также исторически сложившееся название «олефины» (маслообразующие), поскольку низшие гомологи этой группы соединений при взаимодействии с хлором или бромом образуют маслянистые жидкости.
2.1. Номенклатура алкенов
Простейшим представителем углеводородов ряда этилена является сам этилен, или этен: С2Н4, Н2С=СН2. По заместительной номенклатуре IUPAС
названия алкенов образуют замещением суффикса -ан в названии предельного углеводорода на –ен. Кроме того:
1.Выбирают самую длинную углеродную цепь, включающую двойную связь (главную углеродную цепь).
2.Атомы углерода главной углеродной цепи нумеруют, начиная с того конца цепи, к которому ближе расположена двойная связь.
3.Составляют название алкена, перечисляя вначале в алфавитном порядке углеводородные заместители с указанием их положения в главной углеродной цепи. Затем называют углеводород, которому соответствует главная углеродная цепь. Перед названием углеводорода через дефис ставят цифру (локант), указывающую положение двойной связи (номер первого из двух атомов углерода, образующихдвойнуюсвязь):
этен (этилен) пропен 1-бутен 2-бутен
4-метил-2-пентен
Для низших членов гомологического ряда алкенов более популярны тривиальные названия – этилен, пропилен, бутилен и т. д., причем название первого представителя – этилен – принято правилами IUPAС как более предпочтительное, чем этен.
27

Иногда используют рациональную номенклатуру. По ней углеводород рассматривают как производное этилена, в котором атомы водорода замещены радикалами, например:
изопропилэтилен метилэтилен
Название одновалентных радикалов этого ряда углеводородов получают добавлением к названию алкена суффикса –ил; атом углерода со свободной валентностьюдолжениметьнаименьшийномер, например:
пропен-1-ил 1-метилэтенил
Для некоторых радикалов используются тривиальные названия:
винил (этенил) аллил (пропен-2-ил)
2.2. Изомерия алкенов
Дляалкеновхарактерныструктурнаяигеометрическаяизомерии. Структурная изомерия может быть обусловлена различной последова-
тельностью связывания атомов углерода в молекуле (изомерия цепи) и различным положением двойной связи при одном и том же углеродном скелете (изомерия положения). Такой вид изомерии возможен, начиная с бутена С4Н8, который может существовать в виде трех структурных изомеров:
Изомерия положения
1-бутен |
2-бутен |
|
Изомерия цепи |
1-бутен 2-метилпропен
Геометрическая изомерия (цис-транс-изомерия) обусловлена различ-
ным расположением атомов или групп в пространстве относительно плоскости двойной связи. Так, 2-бутен может существовать в виде двух геометрических изомеров – цис-изомера (2 одинаковых заместителя при атомах углерода двойной связи расположены по одну сторону от плоскости π-связи) и транс-изомера (2 одинаковых заместителя расположены по разные стороны относительно плоскости π-связи):
28

цис-2-бутен |
транс-2-бутен |
Если у атомов углерода, |
связанных двойной связью, имеется 3 или |
4 разных заместителя, то используют Е, Z-систему обозначения конфигурации геометрических изомеров:
Z-3-метил-4-этил-3-гептен E-3-метил-4-этил-3-гептен
Как видно, 3-метил-4-этил-3-гептен может иметь Z-конфигурацию (старшие заместители при атомах углерода с двойной связью расположены по одну сторону плоскости π-связи) и Е-конфигурацию (старшие заместители расположены по разные стороны плоскости π-связи).
E, Z-система более универсальна и используется для обозначения геометрических изомеров с различным набором заместителей.
2.3.Способы получения алкенов
Внебольших количествах алкены встречаются в некоторых месторождениях нефти и природного газа, откуда могут быть выделены в чистом виде. Большинство методов их синтеза основано на элиминировании (отщеплении) атомов или атомных групп от молекул алканов, галогеналканов и спиртов.
Крекинг высших алканов – это термическое разложение предельных углеводородов с образованием низкомолекулярных предельных и непредельных соединений:
Дегидратация предельных одноатомных спиртов осуществляется при нагревании с сильными минеральными кислотами (серной или фосфорной), в результате чего отщепляется молекула воды и образуются соответствующие алкены:
спиртов осуществляется при нагревании с сильными минеральными кислотами (серной или фосфорной), в результате чего отщепляется молекула воды и образуются соответствующие алкены:
этанол этилен
29
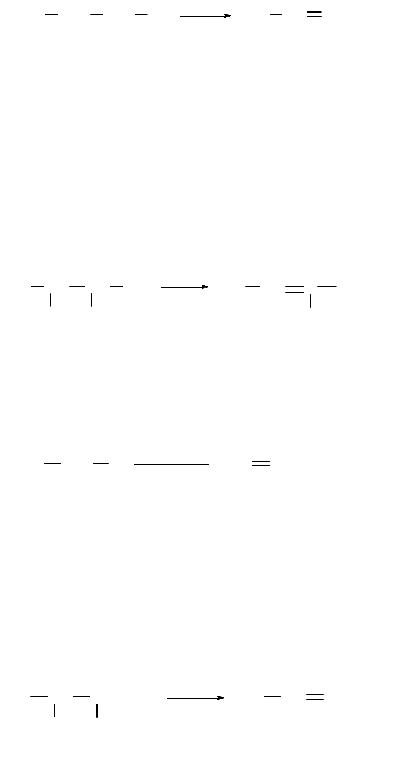
В промышленности в качестве катализатора применяют оксид алюминия. Пары пропилового спирта пропускают над катализатором при 300…400 ºС:
1-пропанол пропен
В данной реакции легче отщепляют воду вторичные и особенно третичные спирты. При этом, если атом углерода связан с неравноценными между собой атомами углерода, то отщепление воды происходит преимущественно таким образом, что вместе с гидроксилом уходит атом водорода от менее гидрогенизированного соседнего атома углерода. Эта закономерность, установленная в 1875 г. русским химиком Александром Михайловичем Зайцевым, получила название «правила Зайцева»:
3-метил-2-бутанол 3-метил-2-бутен
Дегидрогалогенирование моногалогеналканов. При действии спиртово-
го раствора щелочи на моногалогенопроизводные отщепляется галогеноводород и образуются алкены:
спирт. р-р 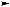
Как и в случае со спиртами, порядок отщепления галогеноводорода от вторичных и третичных галогеналканов определяется правилом Зайцева, т. е. вместе с атомом галогена уходит атом водорода, находящийся при менее гидрогенизированномсоседнематомеуглерода.
Дегалогенирование дигалогеналканов. Дигалогеналканы с атомами гало-
гена у соседних атомов углерода при действии цинка или магния в водноспиртовом растворе отщепляют 2 атома галогена, образуя алкены:
2,3-дибромпропан пропен
Дегидрирование алканов – это промышленный метод получения алкенов. При 300…500 °С в присутствии катализаторов (мелкодиспергированный никель, Сr2O3 и др.) алканы отщепляют водород, образуя алкены:
30
