
пособие_2_2022
.pdf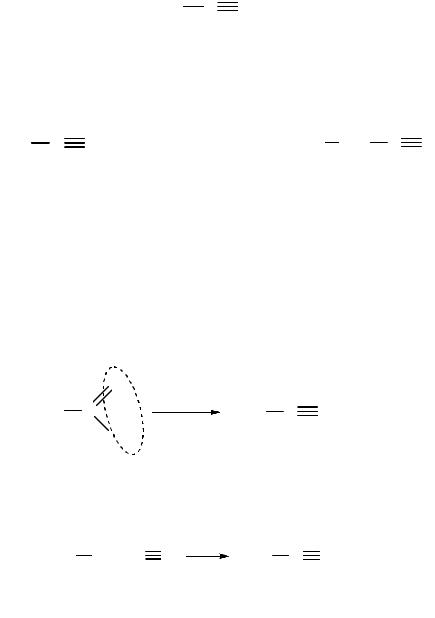
Гидразиды карбоновых кислот широко применяются в органическом синтезе.
14.6. Нитрилы
Нитрилы (цианиды) – это органические соединения, содержащие одну или несколько цианогрупп –C≡N, связанных с углеводородным радикалом.
От других функциональных производных карбоновых кислот нитрилы отличаются отсутствием карбонильной группы. Общая формула нитрилов имеет следующий вид:
Названия нитрилов образуют из тривиальных названий ацильных остатков карбоновых кислот или систематических названий карбоновых кислот с аналогичным количеством атомов углерода (включая атом углерода группы –C≡N), к которым добавляется суффикс -нитрил:
ацетонитрил (этанонитрил, |
фенилацетонитрил (фенилэтанонитрил, |
нитрил уксусной кислоты) |
нитрил фенилуксусной кислоты) |
Нитрилы – жидкие или твердые вещества, не растворимые в воде, но растворимые в нейтральных органических растворителях.
14.6.1. Способы получения нитрилов
Дегидратация амидов сильными водоотнимающими средствами происходит следующим образом:
ацетамид ацетонитрил
Взаимодействие галогеналканов с цианидами щелочных металлов
можно представить в следующем виде:
Дегидратация альдоксимов. При взаимодействии альдегидов с гидроксиламином образуются альдоксимы, которые в присутствии минеральных кислот дегидратируются, образуя нитрилы:
271
альдегид |
альдоксим |
нитрил |
|
14.6.2. Химические свойства нитрилов |
|
Реакционная способность нитрилов обусловлена наличием в их структуре цианогруппы –C≡N, которая имеет линейное строение. Атомы углерода и азота в ней находятся в sp-гибридизации и образуют между собой полярную тройную связь, электронная плотность которой смещена к атому азота. Проявляя отрицательный индуктивный эффект, цианогруппа смещает на себя электронную плотность с углеводородного радикала и тем самым увеличивает подвижность атомов водорода при α-атоме углерода (CH-кислотность). По месту разрыва тройной связи нитрилы вступают в реакции нуклеофильного присоединения. За счет α-атомов углеродадля них характерныреакции конденсации:
Гидролиз нитрилов. При нагревании с водными растворами кислот или щелочей нитрилы гидролизуются с образованием карбоновых кислот. Гидролиз идет в две стадии. Вначале по месту разрыва кратной связи присоединяется одна молекула воды, в результате чего образуются амиды, которые могут быть выделены в индивидуальном состоянии. Дальнейший гидролиз амидов приводит к карбоновым кислотам:
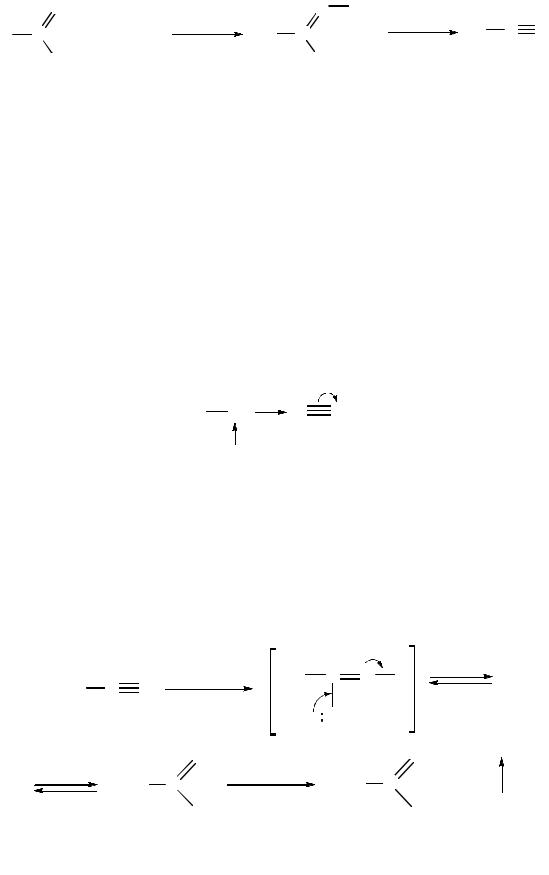
Взаимодействие со спиртами. Реакции со слабыми нуклеофилами обычно катализируются кислотами:
272
гидрохлорид иминоэфира
Конденсация нитрилов (реакция Торпа). В присутствии оснований, та-
ких, как алкоксиды или амиды металлов (C2H5ONa, NaNH2 и др.), нитрилы конденсируются с образованием β-иминонитрилов. Реакция аналогична альдольной конденсации, т. е. присоединению α-атома углерода одной молекулы нитрила к α-атому углерода группы молекулы:
β-иминонитрил
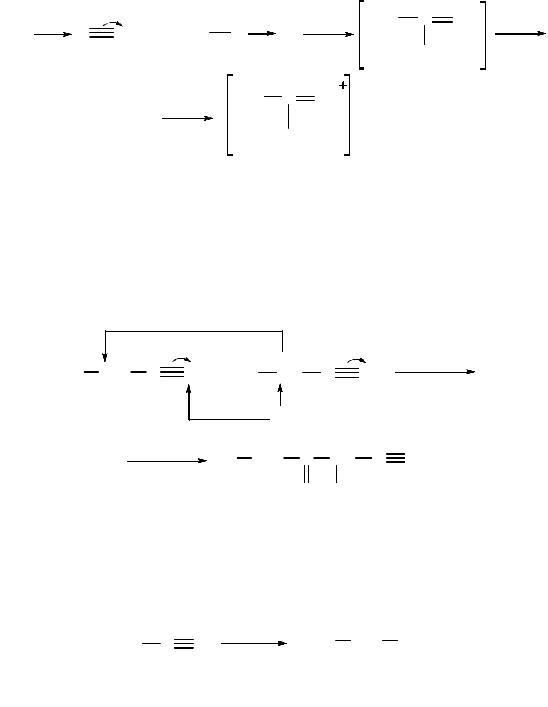
Восстановление. При восстановлении нитрила алюмогидридом лития (LiAlH4) или водородом в присутствии катализатора образуются первичные амины:
14.7. Идентификация функциональных производных карбоновых кислот
Галогенангидриды и ангидриды. Химические методы идентификации этих соединений основаны на реакциях гидролиза, а также на реакциях образования амидов и гидразидов – кристаллических веществ с четко выраженными температурами плавления. В галогенангидридах атом галогена переводят в ионное состояние и определяют известными методами.
Галогенангидриды и ангидриды поглощают в УФ-области (менее 220 нм), поэтому их УФ-спектры малопоказательны.
273
В ИК-спектрах ангидридов наблюдаются две полосы поглощения, связанные с валентными колебаниями карбонильных групп при 1820 см–1 (асимметричные) и 1760 см–1 (симметричные). Валентные колебания карбонильной группы хлорангидридов проявляются при более высоких частотах в области 1815…1790 см–1, что связано с сильным –I-эффектом атома хлора и увеличением частичного положительного заряда на карбонильном атоме углерода.
Галогенангидриды и ангидриды не содержат протонов, непосредственно связанных с карбонильной группой, и поэтому функциональные группы этих соединений не могут быть определены с помощью ПМР-спектров. Однако эти группы вызывают сдвиг сигнала протонов, находящихся в α-положении по отношениюккарбонильнойгруппе.
Сложные эфиры. Для идентификации сложных эфиров используют реакции гидролиза либо реакции образования амидов или гидразидов – кристаллических веществ с четко выраженными температурами плавления.
УФ-спектры сложных эфиров неинформативны, так как слабое поглощение, связанное с переходомn → π*, наблюдается при ~210 нм.
В ИК-спектрах проявляются валентные колебания карбонильной группы в области 1750…1735 см–1 и две интенсивные полосы поглощения при
1275…1185 см–1 и1160…1050 см–1, соответствующиеvC–O.
Амиды. Идентификацию амидов чаще осуществляют по продуктам гидролиза – карбоновым кислотам и аммиаку или аминам.
Амиды поглощают в УФ-области спектра при 210…220 нм (переход
n→ π*).
ВИК-спектре амидов проявляется интенсивная полоса поглощения в
области 1700…1680 см–1, соответствующая vC=O. Кроме того, для первичных и вторичных амидов наблюдается полоса валентных колебаний связи
N–H в области 3500…3000 см–1.
Амидная группа первичных и вторичных амидов содержит протон, ПМР-сигнал которого проявляется при 5…6,5 и 6…9,4 млн–1 соответственно.
Нитрилы. Характерной реакцией нитрилов является их гидролиз в присутствии щелочи до карбоновых кислот с выделением аммиака. Используется также реакция нитрилов с гидроксиламином. Образующиеся амидоксимы дают устойчивые соли с кислотами.
В УФ-диапазоне алифатические нитрилы поглощают в вакуумной области спектра.
274
В ИК-спектре проявляется полоса средней интенсивности в области 2275…2215 см–1, связанная с vC≡N.
Контрольные вопросы и упражнения по гл. 14
1.Напишите структурные формулы следующих соединений: а) пропионилхлорид; б) бензоилбромид; в) ангидрид бензойной кислоты; г) этилформиат; д) фенилбензоат; е) N-этилацетамид; ж) гидразид бензойной кислоты; з) пропанонитрил.
2.Напишите схемы получения этилпропаноата, используя 3 разных ацилирующих реагента.
3.Приведите схемы получения ацетамида с применением четырех различных ацилирующих реагентов.
4.Напишите схемы получения фенилгидразида уксусной кислоты, используя 3 разных ацилирующих реагента.
5.На примере этилпропионата приведите механизмы кислотного и щелочного гидролиза сложных эфиров карбоновых кислот.
6.Напишите схему реакции получения 2-метилпропановой кислоты, используя в качестве исходного вещества малоновый эфир.
7.На примере ацетамида напишите механизмы кислотного и щелочного гидролиза амидов карбоновых кислот.
8.Исходя из электронного строения карбоновых кислот, галогенангидридов, ангидридов, сложных эфиров и амидов, охарактеризуйте сравнительно их активность во взаимодействии с нуклеофильными реагентами.
9.Напишите схемы реакции получения этиламина: а) из соответствующего амида карбоновой кислоты; б) соответствующего нитрила.
275
15. СЕРАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Сераорганические соединения – это органические соединения, содержащие в молекуле связь C–S.
В зависимости от природы функциональной группы сераорганические соединения подразделяют на тиолы, сульфиды, дисульфиды, сульфоксиды, сульфокислоты, сульфоны и др.:
тиолы |
сульфиды |
дисульфиды |
сульфоксиды |
сульфоны |
сульфоновые кислоты |
В данной главе будут рассмотрены тиолы, сульфиды, сульфокислоты.
15.1. Тиолы
Тиолы – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены меркаптогруппой –SH, которую иногда называют тиольной или сульфгидрильной группой. Тиолы можно также рассматривать как тиоаналоги гидроксильных производных углеводородов, в молекулах которых атом кислорода группы (–OH) заменен атомом серы. Для соединений этого класса используют еще название «меркаптаны».
Тиолы, в которых меркаптогруппа связана с алифатическим радикалом, называют тиоспиртами, а с ароматическим радикалом — тиофенолами:
тиоспирт тиофенол
Номенклатура тиолов аналогична номенклатуре гидроксильных производных с той лишь разницей, что вместо суффикса -ол используется суффикс -тиол, а вместо префикса гидрокси- применяется префикс меркапто-:
метантиол метилмеркаптан |
1,2-этандитиол |
тиофенол меркаптобензол |
2-метилтиофенол |
276
Тиолы (за исключением метантиола) – это жидкие или твердые вещества. Как правило, их температуры плавления и кипения ниже гидроксианалогов, что связано с меньшей электроотрицательностью атома серы по сравнению с атомом кислорода и соответственно с меньшей склонностью к образованию водородных связей. По этой же причине тиолы по сравнению со спиртами и фенолами хуже растворяются в воде. Как правило, меркаптаны ядовиты и обладают чрезвычайно неприятным запахом.
15.1.1. Способы получения тиолов
Взаимодействие галогеналканов с гидросульфидами щелочных ме-
таллов. При действии на первичные и вторичные галогеналканы гидросульфида калия или натрия образуются тиоспирты. Реакция протекает по механизму SN:
хлорэтан  этантиол
этантиол 
Эта реакция невозможна с третичными галогеналканами, так как в данном случае преобладает процесс элиминирования.
Взаимодействие спиртов с сероводородом. При обработке спиртов се-
роводородом в присутствии катализатора Al2O3 при температуре 350…400 °С образуются тиоспирты:
этанол |
этантиол |
В реакцию вступают только первичные спирты.
Восстановление аренсульфокислот и аренсульфонилхлоридов приво-
дит к образованию тиофенолов. В качестве восстановителей используют цинк в растворе серной кислоты или алюмогидрид лития LiAlH4:
бензолсульфокислота тиофенол
277

бензолсульфохлорид тиофенол
15.1.2. Химические свойства тиолов
По химическим свойствам тиолы во многом сходны с гидроксильными производными углеводородов. Особенности их химического поведения обусловлены уменьшением прочности связи S–Н по сравнению со связью O–H в спиртах и фенолах. Именно поэтому тиолы обладают более выраженными кислотными свойствами, чем соответствующие им гидроксианалоги. Реакции тиолов в основном обусловлены ионизацией связи S–H и нуклеофильными свойствами атома серы.
Образование тиолятов (меркаптидов). Тиолы как более сильные кис-
лоты, чем аналогичные OH-кислоты, легко образуют соли – тиоляты (меркаптиды) – не только со щелочными металлами, но и с ионами тяжелых металлов:
этантиол |
|
этантиолят натрия |
|
|
|
этантиол |
этантиолят ртути (II) |
|
Взаимодействие тиолов с алкенами. В присутствии пероксидов или под действием УФ-излучения тиолы присоединяются к алкенам по месту разрыва двойной связи с ориентацией против правила Марковникова. Реакция протекает по механизму AR:
метантиол |
пропен |
метилпропилсульфид |
Ацилирование тиолов. Реакция тиолов с карбоновыми кислотами катализируется сильными кислотами и приводит к образованию тиоэфиров карбоновых кислот:
уксусная кислота этантиол |
этиловый эфир |
|
тиоуксусной кислоты |
|
278 |

Окисление тиолов. В отличие от спиртов тиолы окисляются не по атому углерода, а по атому серы. Продукты реакции зависят от условий окисления.
При окислении тиолов в мягких условиях (H2O2, CuCl2 и др.) образуются диалкилдисульфиды:
тиол  диалкилдисульфид
диалкилдисульфид
При окислении сильными окислителями (KMnOu, HNO3 и др.) образуются сульфоновые кислоты:
тиол |
сульфоновая кислота |
|
(сульфокислота) |
15.2. Сульфиды
Сульфиды (тиоэфиры) – это производные сероводорода Н2S, в молекуле которого 2 атома водорода замещены углеводородными радикалами.
Сульфиды являются аналогами простых эфиров, их общая формула
Названия сульфидов по радикально-функциональной номенклатуре обычно образуют из названий углеводородных радикалов R и R' (в алфавитном порядке) и слова «сульфид».
По заместительной номенклатуре IUPAC сульфиды рассматривают как производные углеводородов, в которых один из атомов водорода замещен R-тиогруппой. За родоначальную структуру принимают более сложный по строению радикал:
диэтилсульфид (этилтиоэтан) фенилэтилсульфид (этилтиобензол)
Сульфиды – бесцветные вещества с неприятным запахом, практически не растворимы в воде.
15.2.1. Способы получения сульфидов
Алкилирование тиолятов. Этод метод аналогичен синтезу простых эфиров по Вильямсону:
279
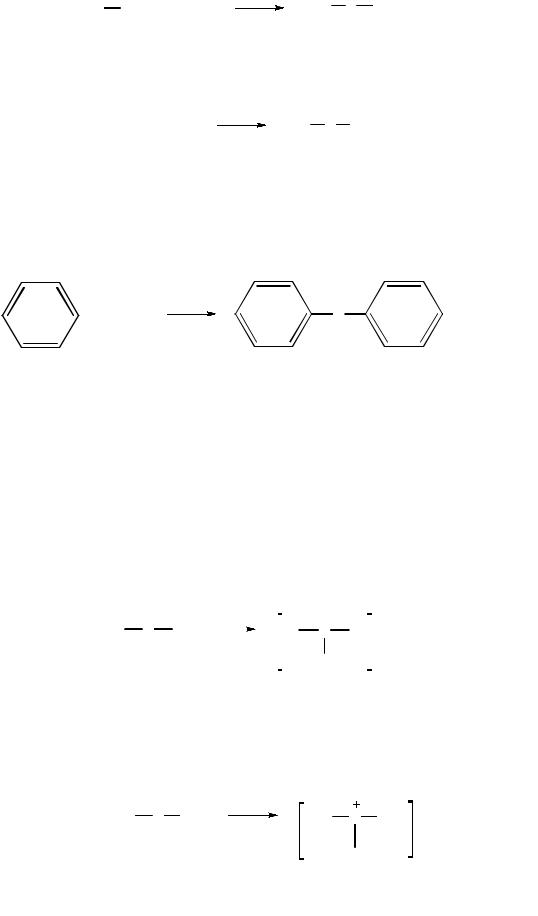
метилэтилсульфид
Действие сульфида натрия на галогеналканы используется для полу-
чения симметричных сульфидов:
диметилсульфид
Взаимодействие галогенидов серы с аренами. Для получения диарил-
сульфидов используют реакцию электрофильного замещения в аренах. В качестве электрофильного реагента используют галогениды серы в присутствии кислот Льюиса:
дифенилсульфид
15.2.2. Химические свойства сульфидов
Сульфиды по своим химическим свойствам во многом напоминают простые эфиры. Однако для них характерны особенности, связанные с большей поляризуемостью атома серы по сравнению с атомом кислорода.
Образование солей сульфония. Сульфиды, как и простые эфиры, являются слабыми основаниями. Они способны протонироваться в кислой среде. При взаимодействии сульфидов c концентрированной серной кислотой образуются соли сульфония:
R S R |
H2SO4 |
|
|
|
|
|
|
|
|
|
|
R S |
R' |
HSO4 |
|||||||
|
|
|
||||||||
|
|
|
|
H |
|
|
||||
сульфид |
|
|
соль сульфония |
|||||||
Алкилирование сульфидов. Сульфиды сравнительно легко реагируют с галогеналканами с образованием весьма стабильных галогенидов триалкилсульфония:
диметилсульфид |
триметилсульфония йодид |
280
