
пособие_2_2022
.pdf
Щелочь выступает не в роли катализатора, а в роли реагента. Гидролиз начинается с нуклеофильной атаки гидроксид-ионом атома углерода карбонильной группы. Образуется промежуточный анион, который отщепляет ал- коксид-ион и превращается в молекулу карбоновой кислоты. Алкоксид-ион, как более сильное основание, отрывает протон от молекулы кислоты и превращается в молекулу спирта:
Щелочной гидролиз необратим потому, что карбоксилат-анион имеет высокую делокализацию отрицательного заряда и не восприимчив к атаке спиртового гидроксила.
Часто щелочной гидролиз сложных эфиров называют омылением. Термин произошел от названия продукта щелочного гидролиза жиров – мыла.
Взаимодействие с аммиаком (аммонолиз) и его производными протека-
ет по механизму, аналогичному механизму щелочного гидролиза. При действии на сложные эфиры аммиака, первичных и вторичных аминов, гидразинов и гидроксиламина образуются соответственно незамещенные, N-замещенные и N,N-дизамещенные амиды, гидразиды и гидроксиамиды карбоновых кислот:
|
|
|
NH3 |
|
O |
+ R'OH |
|
|
|
|
R |
C |
|||
|
|
|
|
амид NH2 |
|
||
|
|
|
R"NH2 |
|
O |
|
|
|
|
|
R |
C |
+ R'OH |
||
O |
|
|
|
||||
|
|
|
|
NHR" |
|||
R C |
|
|
|
|
|||
|
|
NH2 NH |
R |
O |
+ R'OH |
||
|
|
||||||
O |
R' |
C |
|||||
|
|||||||
|
|
|
|
|
NH |
NH |
|
|
|
|
|
|
фенилгидразид |
||
|
|
|
|
|
O |
|
|
|
|
|
NH2OH |
R |
C |
+ R'OH |
|
|
|
|
|
|
NH |
OH |
|
|
|
|
|
|
гидроксиамид |
||
261
Поскольку многие сложные эфиры легкодоступны и их сравнительно легко синтезировать, эта реакция широко используется в синтезе амидов карбоновых кислот.
Взаимодействие со спиртами (реакция переэтерификации). При взаи-
модействии со спиртами в молекуле сложного эфира один спиртовой остаток заменяется другим. Эта реакция получила название реакции переэтерификации. Она катализируется минеральными кислотами или щелочами и является обратимой. Для смещения равновесия вправо отгоняют более летучий спирт, поэтому практическое значение переэтерификация имеет в том случае, когда в состав исходного сложного эфира входит остаток низкокипящего спирта (часто – метилового). Тогда образующийся в результате переэтерификации метиловый спирт может быть отогнан из реакционной среды, и равновесие сместится в сторону конечных продуктов:
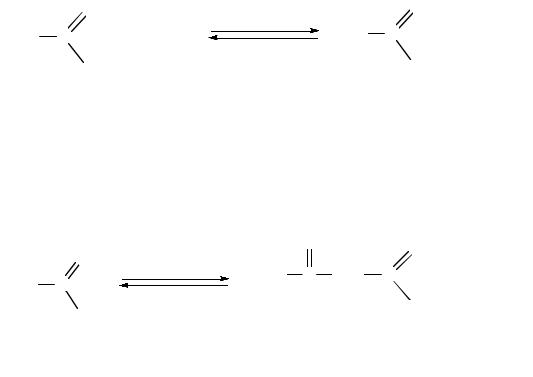
Сложноэфирная конденсация Кляйзена. Сложные эфиры карбоновых кислот, содержащие атомы водорода в α-положении, в присутствии сильных оснований (таких, как алкоксиды) вступают в реакцию конденсации с образованием сложных эфиров β-оксокислот (β-кетоэфиров). Данная реакция называется конденсацией Кляйзена:
ацетоуксусный эфир (β-кетоэфир)
Механизм реакции включает 3 стадии. На первой стадии алкоголят-ион отщепляет от α-атома углерода молекулы сложного эфира протон, образуя мезомерно стабилизированный карбанион (І). На второй стадии карбанион, выступая в роли нуклеофила, атакует атом углерода карбонильной группы второй молекулы сложного эфира с образованием продукта присоединения (ІІ), который на третьей стадии отщепляет алкоксид-ион, превращаясь в конечный продукт реакции (ІІІ):
262
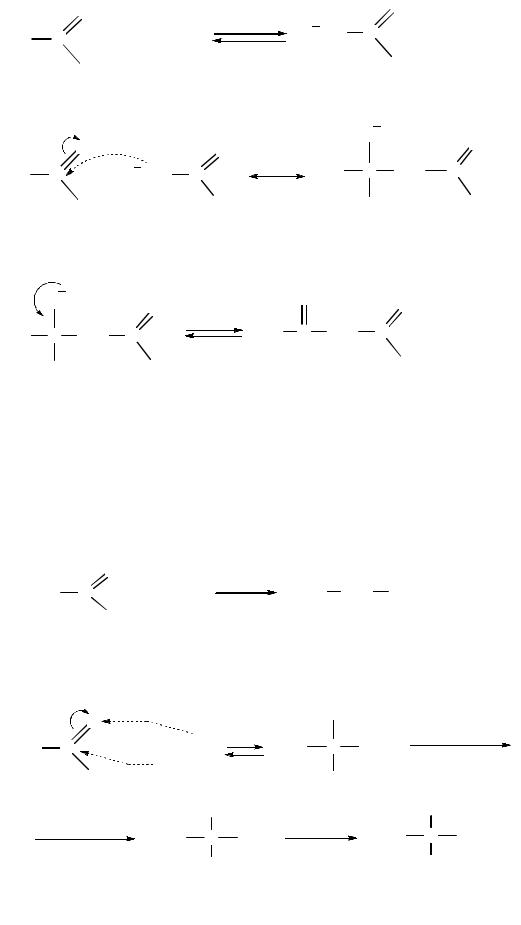
–стадияI:
–стадияII:
–стадияIII:
Если в реакцию вступают 2 сложных эфира, содержащих α-атомы водорода, то образуется смесь четырех возможных продуктов. Реакция используется для промышленногополученияацетоуксусногоэфира.
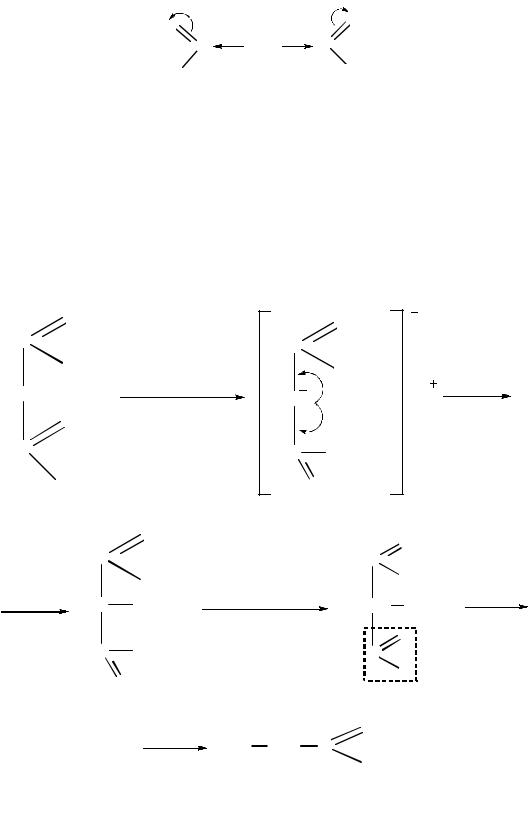
Восстановление сложных эфиров. Первичные спирты образуются при действии газообразного водорода в присутствии скелетного никелевого катализатора (никель Ренея):
Действие магнийорганических соединений с последующим гидроли-
зом приводит к образованию третичных спиртов:
263
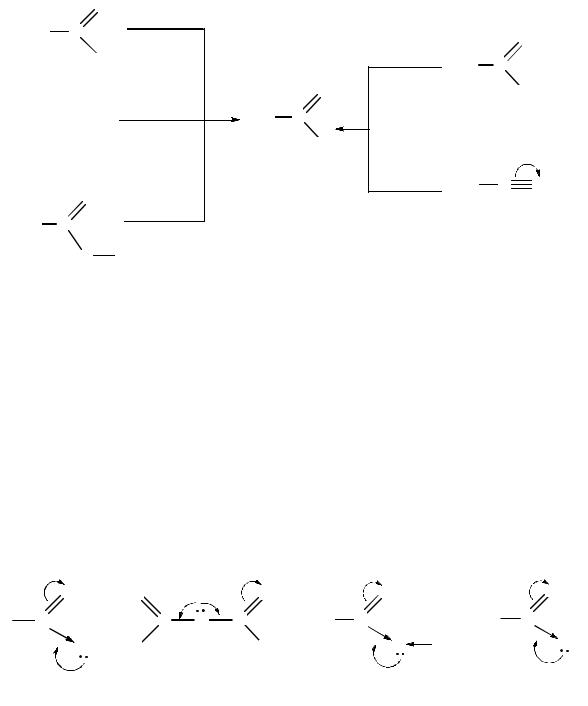
Алкилирование малонового эфира. Важное значение в органическом синтезе имеет диэтиловыи эфир малоновой кислоты (малоновый эфир):
В результате электроноакцепторного влияния двух сложноэфирных групп за счет –I-эффекта возрастает подвижность атомов водорода метиленовой группы, что обусловливает наличие кислотного СН-центра. При действии на малоновый эфир алкоголята натрия образуется натриймалоновый эфир, который взаимодействует с электрофильными реагентами. Так, при алкилировании малонового эфира образуется алкилмалоновый эфир, который, гидролизуясь, дает алкилмалоновую кислоту. Поcледняя легко декарбоксилируется и образует монокарбоновую кислоту:
натрийметилмалоновый эфир
метилмалоновый эфир |
метилмалоновая кислота |
пропионовая кислота
Алкилированию может подвергаться и второй атом водорода метиленовой группы, что дает возможность осуществлять синтез разнообразных монокарбоновых кислот.
264

При ацилировании натриймалонового эфира α-галогенкарбоновыми кислотами образуются различные дикарбоновые кислоты.
14.4. Амиды карбоновых кислот
Амиды – это производные карбоновых кислот, в молекулах которых гидроксильная группа карбоксила замещена на аминогруппу. Общая формула амидов карбоновых кислот имеет следующий вид:
Эти соединения можно рассматривать как ацильные производные аммиака, а также первичных и вторичных аминов.
Названия амидов образуют от названий соответствующих кислот и аминов. В тривиальных названиях ацилов заменяют суффикс -ил на -амид. Согласно заместительной номенклатуре IUPAC в названиях соответствующих кислот буквосочетание -овая кислота заменяется на суффикс -амид. Символом N обозначают положения заместителей у атома азота амидной группы:
амид уксусной кислоты N-метиламид уксусной кислоты (ацетамид, этанамид) (N-метилацетамид,
N-метилэтанамид)
N,N-диметиламид муравьиной кислоты (N,N-диметилформамид)
Амиды – кристаллические вещества или жидкости, растворимые в воде и органических растворителях. Это ассоциированные соединения, в которых π-электроны карбонильной группы смещаются к наиболее электроотрицательному атому (атому кислорода), пара электронов азота также смещена в сторону кислорода. За счет этого водород, находящийся при атоме азота, становится способным образовывать водородную связь с другой молекулой амида:
265
Поскольку амиды являются ассоциированными соединениями, то они имеют более высокие, по сравнению с соответствующими карбоновыми кислотами, температуры плавления и кипения.
14.4.1. Способы получения амидов карбоновых кислот
Амиды получают в результате взаимодействия галогенангидридов, ангидридов или сложных эфиров карбоновых кислот с аммиаком, первичными или вторичными аминами, а также при нагревании аммонийных солей карбоновых кислот и при гидролизе нитрилов:
14.4.2. Химические свойства амидов карбоновых кислот
Реакционная способность амидов обусловлена наличием в их структуре амидной группы. По электронному строению амидная группа сходна с карбоксильной. Неподеленная пара электронов атома азота находится в сопряжении с p, π-электронами карбонильной группы (р, π-сопряжение). В результате такого сопряжения связь C–N становится короче, а связь C=O длиннее, чем у несопряженных соединений. За счет сильного смещения неподеленной пары электронов атома азота (+M-эффект) к группе C=O частичный положительный заряд на атоме углерода карбонильной группы в амидах меньше, чем у галогенангидридов, ангидридов и сложных эфиров:
266
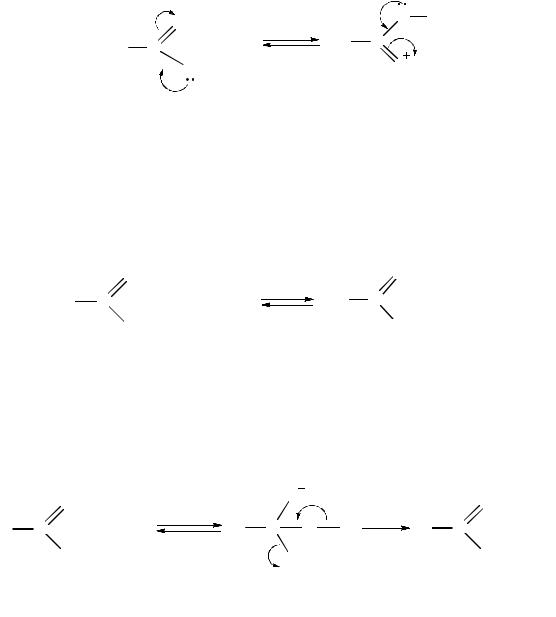
Вследствие такого электронного строения амиды карбоновых кислот практически не вступают в реакции с нуклеофильными реагентами и, в отличие от аминов, являются очень слабыми основаниями. Амиды, имеющие в своей структуре связь N–H, являются слабыми NH-кислотами.
Кислотно-основные свойства. Амиды проявляют амфотерный характер. Как слабые основания, они образуют соли лишь с сильными минеральными кислотами, причем протонированию подвергается атом кислорода карбонильной группы, так как образующийся при этом катион стабилизируется за счет сопряжения:
Протонированная форма амидов является сильной OH-кислотой. В результате сопряжения неподеленной пары электронов атома азота с π-электро- нами карбонильной группы в молекулах незамещенных и N-замещенных амидов атом водорода связи N–H приобретает подвижность. Такие амиды проявляют свойства слабых NH-кислот и при взаимодействии с металлическим натрием или с амидом натрия (NaNH2) образуют соли:
Гидролиз амидов. Амиды гидролизуются намного труднее, чем другие функциональные производные карбоновых кислот. В нейтральной среде гидролиз идет очень медленно. В присутствии минеральных кислот или щелочей амиды гидролизуются довольно легко. В щелочной среде амиды превращаются в соль карбоновой кислоты и аммиак или в амины:
Впроцессе гидролиза в кислой среде амиды образуют карбоновые кислоты
иаммониевые соли. Под действием минеральной кислоты сначала образуется протонированная форма амида, которая затем вступает в реакцию с водой:
267
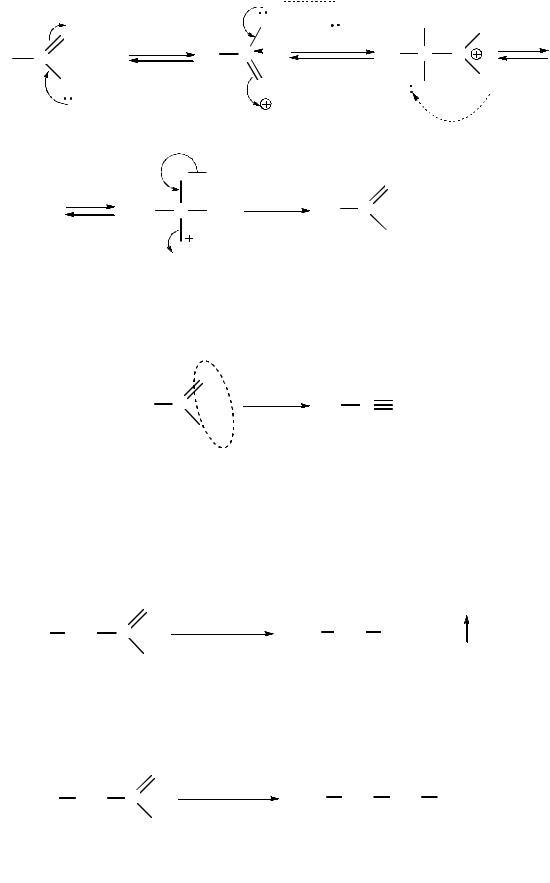
протонированная форма амида
Дегидратация незамещенных амидов. При нагревании незамещенных амидов с сильными водоотнимающими средствами (P2O5 или РОСl3) образуются нитрилы:
Расщепление незамещенных амидов до первичных иминов. Реакция амидов со щелочными растворами галогенов (йода, брома или хлора) известна как реакция (перегруппировка) Гофмана с 1881 г. Она реализуется с амидами как жирных, так и ароматических кислот и позволяет получить первичные амины, содержащие на один атом углерода меньше, чем исходный амид:
этанамин
Восстановление. Под действием алюмогидрида лития (LiAlH4) амиды карбоновых кислот восстанавливаются до аминов:
1-пропанамин
N-замещенные амиды дают вторичные или третичные амины.
268

Замещение атома водорода в группе NH2 галогеном обычно проходит в присутствии оснований:
Полученные N-галогенамиды – нестабильные соединения со свойствами окислителя. Они используются в качестве галогенирующих реагентов.
14.5. Гидразиды карбоновых кислот
Гидразиды – это функциональные производные карбоновых кислот, в которых гидроксильная группа, входящая в состав карбоксильной группы, замещена остатком молекулы гидразина, алкилили арилгидразинов. Общая формула гидразидов карбоновых кислот имеет следующий вид:
Названия гидразидов чаще образуют из названий соответствующих карбоновых кислот и гидразинов. По заместительной номенклатуре IUPAC названия гидразидов составляют заменой буквосочетания -овая кислота на суффикс -гидразид:
гидразид уксусной кислоты |
N'-фенилгидразид |
N',N'-диметилгидразид |
(этаногидразид) |
уксусной кислоты |
бензойной кислоты |
Гидразиды – кристаллические вещества с четко выраженной температурой плавления, что позволяет использовать их для идентификации карбоновых кислот.
14.5.1. Способы получения гидразидов карбоновых кислот
Гидразиды карбоновых кислот получают взаимодействием гидразина, алкил- или арилгидразинов с галогенангидридами, ангидридами или сложными эфирами карбоновых кислот. В качестве побочных продуктов при этом могут образоваться N, N΄-диацилгидразины:
269
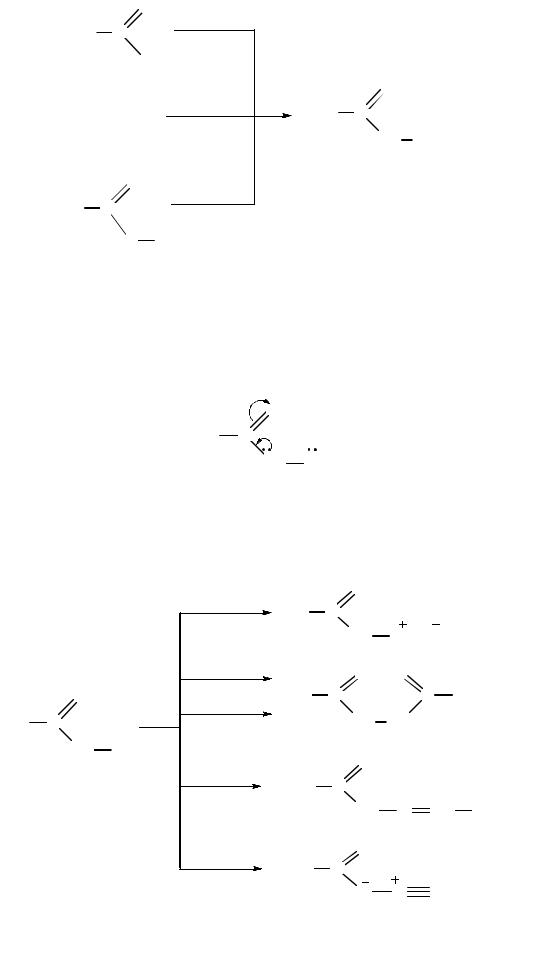
14.5.2. Химические свойства гидразидов карбоновых кислот
По химическим свойствам гидразиды карбоновых кислот во многом напоминают амиды. Вместе с тем в молекуле гидразидов неподеленная пара электронов β-атома азота не участвует в сопряжении с карбонильной группой:
За счет этого гидразиды проявляют основные и нуклеофильные свойства. Они образуют соли с минеральными кислотами, вступают в реакцию ацилирования с галогенангидридами и ангидридами карбоновых кислот, реагируют с карбонильными соединениями, взаимодействуют с азотистой кислотой:
270 |
