
пособие_2_2022
.pdf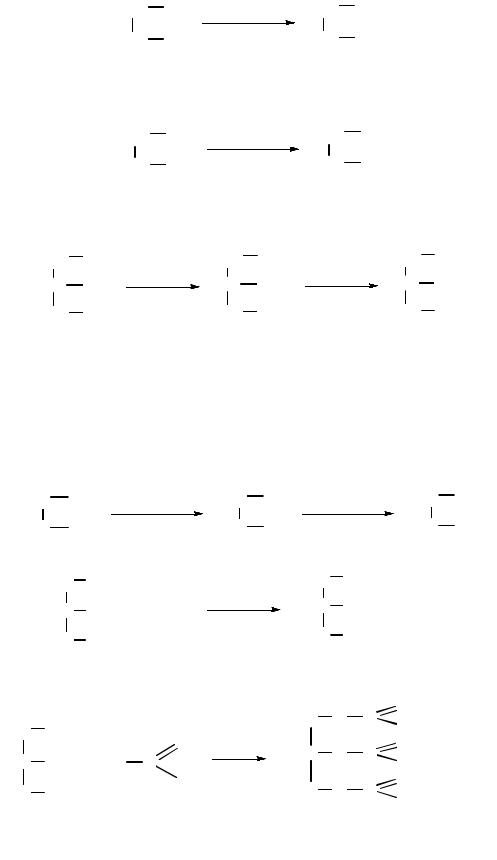
Взаимодействие с галогеноводородами. При взаимодействии гликолей с галогеноводородами (HCl или HBr) образуются хлорили бромгидрины:
Вторая гидроксильная группа замещается труднее (лучше использовать
PCl5 или SOCl2):
При взаимодействии глицерина с галогеноводородами образуется смесь моно- и дигалогенозамещенных продуктов:
глицерин |
глицерина |
глицерина |
|
монохлоргидрин |
дихлоргидрин |
||
|
Образование простых и сложных эфиров. Гликоли образуют неполные и полные производные при взаимодействии со спиртами (простые эфиры), кислородсодержащими минеральными или карбоновыми кислотами (сложные эфиры):
простой эфир
глицерина тринитрат (нитроглицерин)
глицеринтриацетат
181
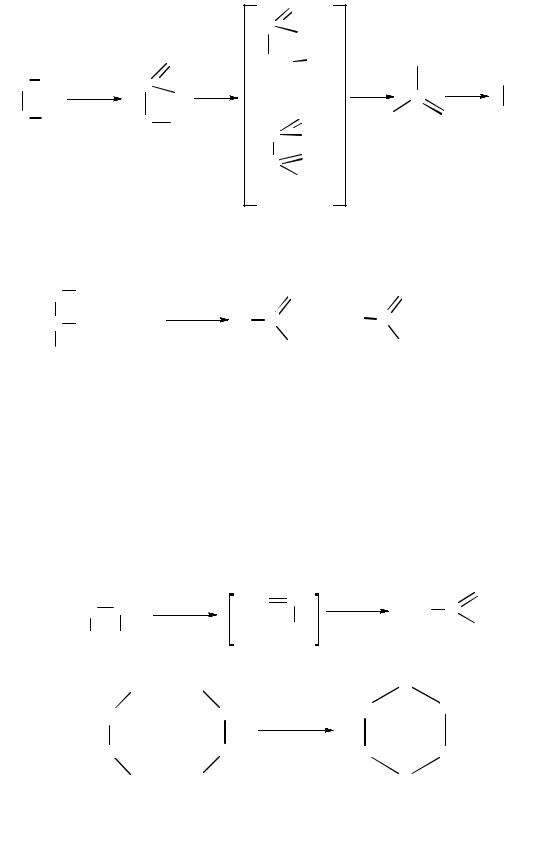
Окисление. Окисление гликолей в зависимости от природы окислителя может протекать по-разному:
Для идентификации α-гликолей используют реакцию окисления йодной кислотой НIO4:
пропиленгликоль |
метаналь |
этаналь |
При окислении разрывается химическая связь между атомами углерода α-гликольного фрагмента и образуются соответствующие карбонильные соединения. По продуктам окисления устанавливают положение диольного фрагмента в молекуле.
Дегидратация. Гликоли под действием водоотнимающих реагентов подвергаются внутри- и межмолекулярной дегидратации. Направление реакций определяется условиями их проведения:
виниловый спирт |
уксусный альдегид |
диоксан
Глицерин подвергается внутримолекулярной дегидратации с образованием непредельного альдегида акролеина.
182
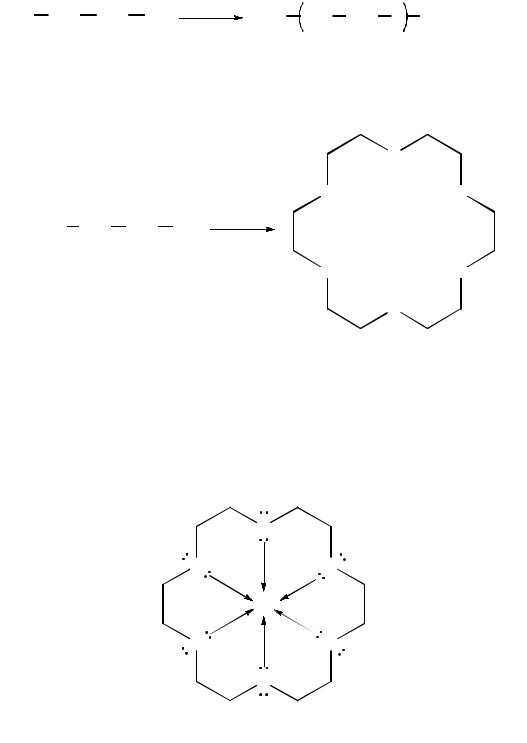
Поликонденсация. Этиленгликоль в результате реакции поликонденсации способенобразовыватьполиэфир– полиэтиленгликольHO–[–CH2–CH2–O]n–H:
 полиэтиленгликоль
полиэтиленгликоль 
Поликонденсация этиленгликоля в щелочной среде приводит к образованию краун-эфиров:
[18]-краун-6
Важным свойством краун-эфиров является способность образовывать устойчивые липофильные комплексы с катионами щелочных и щелочноземельных металлов. Они используются для улучшения растворимости неорганических солей в органических растворителях, в качестве межфазных катализаторов, экстрагентов и т. д.:
[18]-краун-6
При поликонденсации этиленгликоля с терефталевой кислотой образуется полиэфир – полиэтилентерефталат, который используется для изготовления синтетического волокна – лавсана:
183

этиленгликоль |
|
терефталевая кислота |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
полиэтилентерефталат
11.2.5. Идентификация двух- и трехатомных спиртов
Обнаружить гидроксильные группы в диолах и триолах можно по образованию синего раствора комплексной соли меди.
Для обнаружения глицерина можно использовать реакцию дегидратации с образованием акролеина – вещества с резким раздражающим запахом.
Для идентификации α-гликолей используют реакцию окисления йодной кислотой HIO4 (гликольное расщепление). При окислении разрывается хи-
мическая связь между атомами углерода, связанными с группами –ОН, и образуются соответствующие карбонильные соединения, по которым можно установить место расположения диольного фрагмента молекулы.
11.3. Фенолы
Фенолы – это производные ароматических углеводородов, у которых один или несколько атомов водорода в ароматическом ядре замещены гидроксильной группой.
По количеству гидроксильных групп фенолы делят на одно-, двух-, трех-
иполиатомные.
Кодноатомным фенолам относятся гидроксилсодержащие ароматические соединения, имеющие в своем составе одну гидроксильную группу:
фенол (гидроксибензол) 1-гидроксинафталин (α-нафтол)
11.3.1. Номенклатура и изомерия фенолов
Для названия фенолов применяют заместительную номенклатуру, в этом случае перед названием арена ставится префикс -гидрокси.
184
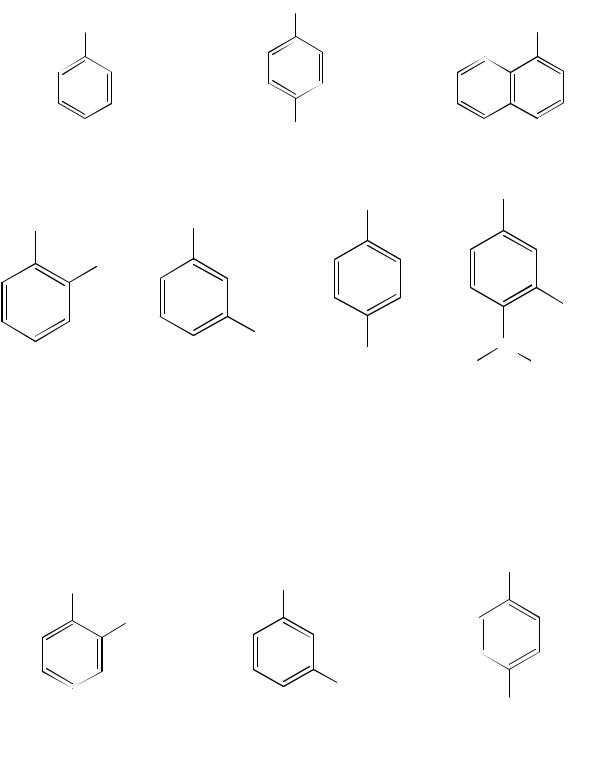
При наличии заместителей в ароматическом ядре за родоначальную структуру берут фенол.
Наряду с заместительной номенклатурой в ряду фенолов широко применяются тривиальные названия. Метильные производные фенола называют крезолами, а 2-изопропил-5-метилфенол называют тимолом.
Для некоторых фенолов чаще используют тривиальные названия (ксилол, тимол и т. д.):
фенол (гидроксибензол, |
4-этилфенол (n-этилфенол, |
1-гидроксинафталин |
карболовая кислота) |
1-гидрокси-4-этилбензол) |
(1-нафтол, α-нафтол) |
2-метилфенол |
3-метилфенол, |
4-метилфенол |
2-изопропил-5- |
(о-метилфенол, |
(м-метилфенол, |
(n-метилфенол, |
метилфенол |
1-гидрокси-2- |
1-гидрокси-3- |
1-гидрокси-4- |
(1-гидрокси-2- |
метилбензол, |
метилбензол, |
метилбензол, |
изопропил-5- |
о-крезол) |
м-крезол) |
n-крезол) |
метилбензол, тимол) |
Названия многоатомных фенолов образуют по общим правилам номенклатуры IUPAC, а для простейших представителей используют и тривиальные названия:
OH
|
OH |
|
1,2-дигидроксибензол |
1,3-дигидроксибензол |
1,4-дигидроксибензол |
(пирокатехин) |
(резорцин) |
(гидрохинон) |
|
185 |
|
Структурная изомерия фенолов обусловлена изомерией положения заместителей, как и в случае трех изомерных крезолов. Однако возможен и другой вариант, когда изомерия вызвана структурными изменениями заместителей:
4-пропилфенол |
4-изопропилфенол |
3-метил-4-этилфенол 3,4,5-триметилфенол
11.3.2. Способы получения фенолов
Природным источником фенолов является каменноугольная смола, из которой в 1834 г. Фридлиб Фердинанд Рунге впервые получил фенол и назвал его карболовой кислотой. Из каменноугольной смолы также выделяют крезолы. Кроме того, фенол и крезолы образуются при крекинге нефти. Однако чаще всего фенол получают синтетическими методами.
Нагревание галогенопроизводных бензола со щелочами в присутствии катализатора:
Па
хлорбензол |
фенолят натрия |
фенол |
Сплавление натриевых солей сульфокислот со щелочами:
бензолсульфокислота |
натриевая соль |
фенолят натрия |
бензолсульфокислоты |
фенол
186
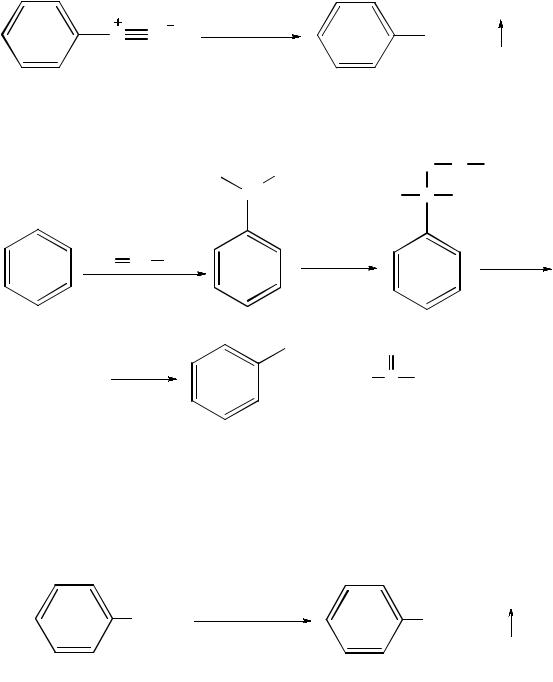
Разложение солей диазония. Фенолы можно получить при нагревании водных растворов солей арилдиазония:
бензолдиазония хлорид
Окисление кумола. В качестве исходных продуктов используют бензол и пропилен. Это основной промышленный способ получения фенола:
бензол |
кумол |
гидропероксид кумола |
фенол ацетон
Этот способ экономически эффективен, так как позволяет кроме фенола получить и другой важный продукт – ацетон.
Окислительное декарбоксилирование ароматических карбоновых кислот. При нагревании аренкарбоновых кислот до 200…300 °С в присутствии солей меди (II) образуются фенолы:
бензойная кислота |
фенол |
11.3.3. Физические свойства фенолов
Простейшие фенолы представляют собой вязкие жидкости или легкоплавкие твердые вещества с устойчивым запахом «карболки». Есть фенол, растворимый в воде (9 частей на 100 частей воды), другие фенолы в воде малорастворимы. Большинство фенолов – бесцветные вещества, однако при хранении они могут оксидироваться кислородом воздуха и темнеть за счет появления примеси продуктов оксидирования.
187
11.3.4. Химические свойства фенолов
Для фенолов характерны 2 направления (вида) реакций: реакции по фенольному гидроксилу и реакции по ароматическому ядру.
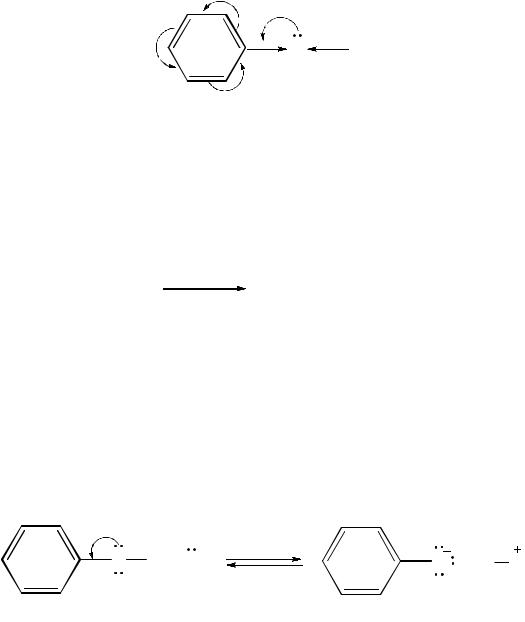
Реакции по фенольному гидроксилу. В молекуле фенола происходит со-
пряжение неподеленной пары электронов атома кислорода гидроксильной группы с π-электронами бензольного ядра. Это поляризует связь O←Н, чем и объясняется более выраженный кислотный характер фенолов в сравнении со спиртами. Атомы водорода гидроксильной группы приобретают подвижность и довольно легко замещаются другими атомами или атомными группами.
Наличие +М-эффекта укорачивает связь С–ОН, что делает практически невозможными реакции замещения фенольного гидроксила.
Замещение OH-группы галогеном. Только при действии PCl3 или PCl5 в
жестких условиях гидроксильная группа замещается атомом галогена, а основным продуктом является эфир фосфорной или фосфористой кислоты соответственно:
фенол |
трифенилфосфат хлорбензол |
Кислотные свойства. Фенолы – более сильные ОН-кислоты, чем спирты. Это вызвано тем, что неподеленная пара электронов атома кислорода в молекуле фенола смещена к ядру (+М-эффект OH-группы), что приводит к образованию частичного положительного заряда δ+ на атоме кислорода и увеличению поляризации связи O–H по сравнению со спиртами. Кроме того, образующийся фенолят-ион (феноксид-ион) имеет повышенную стабильность за счет делокализации отрицательного заряда по ароматическому радикалу:
кислота |
основание |
сопряженное |
сопряженная |
|
основание |
кислота |
|||
|
|
188
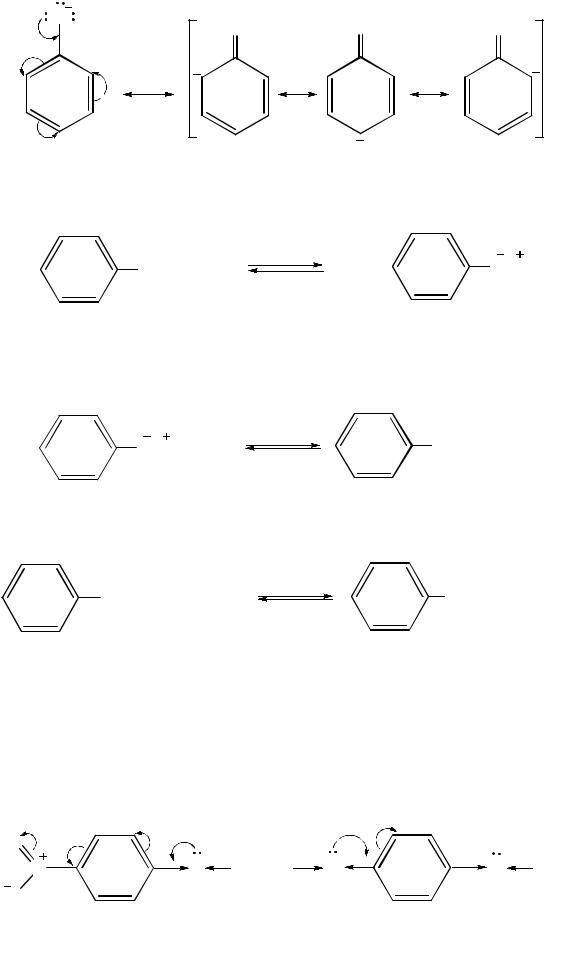
Доказательством более сильных кислотных свойств фенолов по сравнению со спиртами может служить их реакция с водными растворами щелочей с образованием солей – фенолятов (феноксидов):
фенолят натрия
В водном растворе феноляты подвергаются частичному гидролизу, так как они образованы слабой кислотой и сильным основанием. По этой причине их растворы имеют щелочную реакцию:
фенолят натрия
Минеральные кислоты, в том числе и угольная, вытесняют фенолы из их солей:
фенолят натрия
На кислотность фенола влияют заместители в ароматическом ядре. При наличии в п-положении электроноакцепторных заместителей (–NO2, –Br,
–Cl, –CN и др.) кислотные свойства усиливаются. Если в п-положение ввести электронодонорные заместители (–NH2, –ОСН3 и др.), то кислотные свойства
снижаются, поскольку уменьшается смещение электронов связи О–Н к атому кислорода, что затрудняет отрыв протона:
189
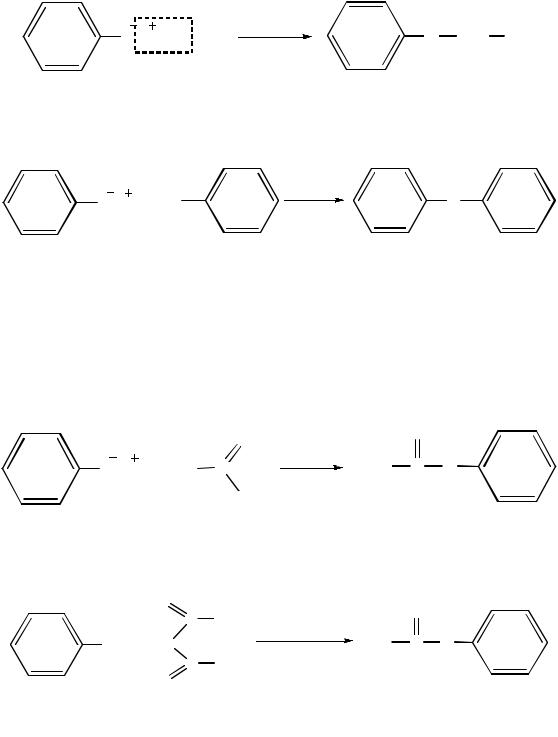
Образование простых и сложных эфиров. Простые эфиры фенола непосредственно из фенола не получить, поэтому используют реакцию Вильямсона: взаимодействие феноксида натрия с галоидными алкилами или арилами. Такие реакции называют O-алкилированием, так как при этом алкилируется атом кислорода:
фенилэтиловый эфир (фенетол)
При взаимодействии фенолятов с галогенаренами образуются ароматические простые эфиры:
дифениловый эфир
Дифениловый эфир имеет запах герани. Ароматические простые эфиры имеют химические свойства, схожие со свойствами простых эфиров алифатического ряда. Они не взаимодействуют со щелочами, разложить их можно только йодоводородной кислотой.
Взаимодействие фенолятов с галогенангидридами и ангидридами карбоновых кислот приводит к образованию сложных эфиров (О-ацилирование):
ацетилхлорид |
фенилацетат |
Аналогичные продукты получают также по реакции ацилирования самих фенолов с ангидридами карбоновых кислот:
уксусный ангидрид
В отличие от спиртов фенолы не этерифицируются непосредственно карбоновыми кислотами из-за недостаточной электронной плотности на атоме кислорода.
190
