
пособие_2_2022
.pdf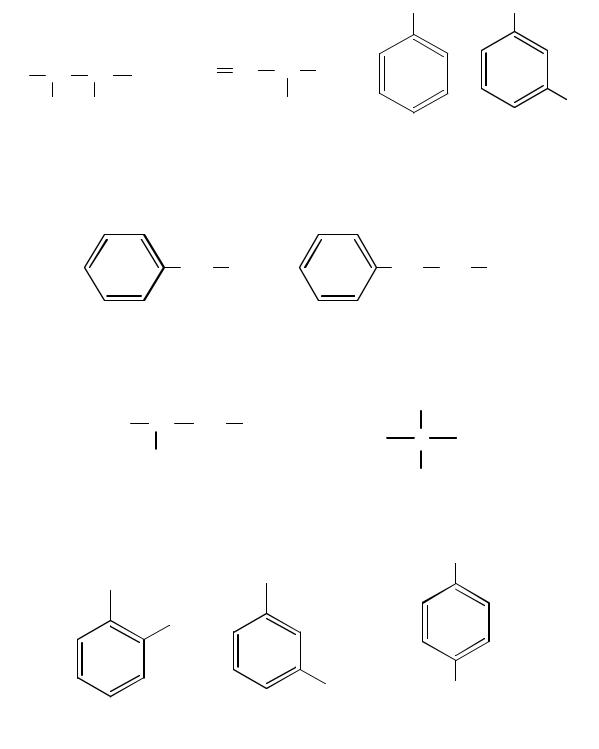
Вданной главе рассмотрены нитроалканы и нитроарены с нитрогруппой
вбензольном кольце, а также нитроарены с нитрогруппой в боковой цепи.
8.1. Номенклатура и изомерия нитросоединений
По заместительной номенклатуре названия нитроалканов и нитросоединений с нитрогруппой в бензольном кольце образуют добавлением префикса нитро- к названию родоначального углеводорода с указанием положения нитрогруппы в углеродной цепи:
2-метил-3-нитробутан |
3-нитро-1-бутен |
нитробензол |
3-нитротолуол |
Нитросоединения с нитрогруппой в боковой цепи рассматривают как производные нитроалканов, содержащие в качестве заместителя ароматический радикал:
фенилнитрометан 1-нитро-2-фенилэтан
Изомерия нитросоединений может быть обусловлена разной структурой углеродного скелета (изомерия цепи):
2-нитробутан 2-нитро-2-метилпропан
и разнымположением нитрогруппы в углеродной цепи (изомерия положения):
2-нитротолуол 3-нитротолуол 4-нитротолуол
121
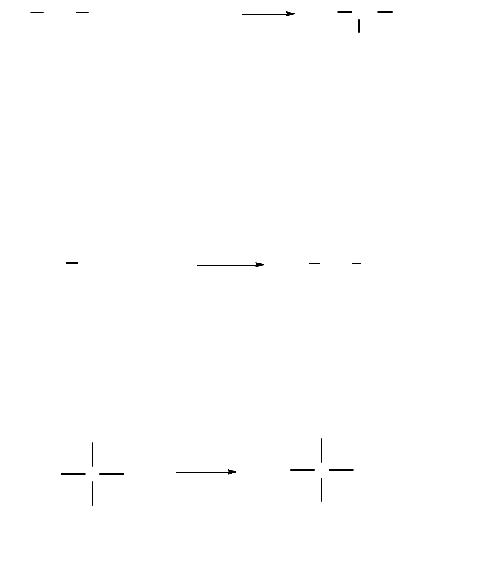
8.2. Нитроалканы
Нитроалканами называют насыщенные алифатические нитросоединения.
8.2.1. Способы получения нитроалканов
Нитрование алканов (реакция Коновалова) протекает при действии на алканы разбавленной (10…25 %) азотной кислотой при повышенных температуре и давлении:
пропан |
2-нитропропан |
Взаимодействие галогеналканов с солями азотистой кислоты позво-
ляет получить первичные и вторичные нитроалканы. Для уменьшения образующейся в процессе реакции примеси эфиров азотистой кислоты взаимодействие первичных и вторичных галогеналканов с солями азотистой кислоты (АgNО2, NаNО2, КNО2) осуществляют в среде апротонного растворителя – диметилсульфоксида (СН3)2SO или диметилформамида HCON(CH3)2:
йодэтан |
нитроэтан |
Окисление трет-алкиламинов используют только для получения третичных нитросоединений. Первичные амины, содержащие трет-алкильный углеводородный остаток, в присутствии органических пероксикислот окисляются, образуя нитроалканы:
8.2.2. Физические свойства нитроалканов
По физическим свойствам нитросоединения данного ряда – это жидкие или кристаллические бесцветные либо окрашенные в желтый цвет вещества. Причиной окрашивания является наличие хромофора (группы –NO2). Нитросоединения имеют приятный запах, ядовиты, мало растворимы в воде, но хорошо растворимы в большинстве органических растворителей.
122

8.2.3. Химические свойства нитроалканов
Реакционная способность нитроалканов определяется наличием в их структуре нитрогруппы. Вследствие сильных электроноакцепторных свойств нитрогруппа активирует атомы водорода при α-атоме углерода углеводородного радикала:
В связи с этим первичные и вторичные нитроалканы являются СН-кисло- тами. Химические превращения нитроалканов происходят с участием нитрогруппы и α-атома углерода.
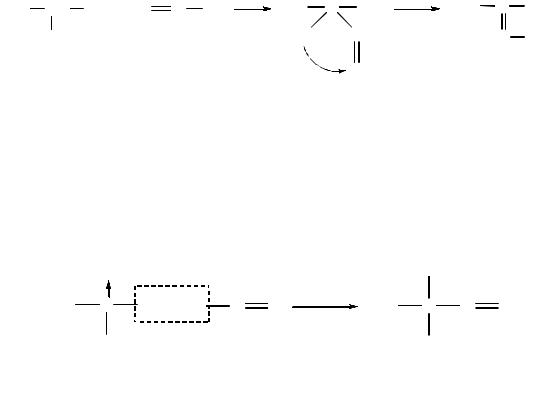
Таутомерия и образование солей. Благодаря наличию подвижных атомов водорода при α-атоме углерода первичные и вторичные нитросоединения являются таутомерными веществами:
нитроформа аци-нитроформа
В растворе между этими формами устанавливается динамическое равновесие. Такой вид таутомерии называется аци-нитро-таутомерией. В нейтральной среде равновесие почти полностью смещено в сторону нитроформы. В щелочной среде равновесие смещается в сторону аци-нитроформы (нитроновой кислоты). Так, первичные и вторичные нитроалканы растворяются в водном растворе щелочи, образуя соли нитроновых кислот:
2-нитропропан |
натриевая соль |
|
диметилнитроновой кислоты |
Эти соли легко разрушаются минеральными кислотами с образованием исходных нитроалканов.
123
Третичные нитросоединения ввиду отсутствия подвижных атомов водорода при α-атоме углерода не способны к таутомерии, а следовательно, не взаимодействуют со щелочами.
Реакция с азотистой кислотой. Первичные, вторичные и третичные нитросоединения по-разному относятся к действию азотистой кислоты. В реакцию с НNO2 вступают только те нитросоединения, у которых есть подвижные атомы водорода при α-атоме углерода.
Первичные нитропроизводные образуют алкилнитроловые кислоты:
нитрозонитросоединение метилнитроловая кислота
Нитроловые кислоты растворяются в щелочах, образуя соли, окрашенные в красный цвет.
Вторичные нитросоединения, реагируя с азотистой кислотой, образуют псевдонитролы (нитрозонитросоединения):
псевдонитрол (2-нитрозо-2-нитропропан)
Псевдонитролы – это бесцветные вещества, которые в кристаллическом состоянии являются ассоциированными соединениями, но в растворе или в расплаве ассоциаты разрушаются и появляется синее окрашивание.
Третичные нитросоединенияне реагируют с азотистой кислотой. Реакцию с азотистой кислотой используют для отличия первичных, вто-
ричных и третичных нитросоединений друг от друга.
Реакция конденсации с альдегидами и кетонами. За счет подвижных атомов водорода в α-положении нитросоединения способны в слабощелочной среде вступать в реакции конденсации с альдегидом с образованием нитроспиртов (нитроалканолов):
124

этаналь |
|
1-нитро-2-пропанол |
|
|
|
1-нитро-1-пропен
Нитроспирты легко дегидратируются с образованием непредельных нитросоединений.
Реакция восстановления. При восстановлении нитроалканов образуются алкиламины:
метиламин
В качестве восстановителей применяют хлорид олова (II), железо в присутствии хлороводородной кислоты, сульфиды щелочных металлов и т. п.
8.3. Ароматические нитросоединения
Ароматические нитросоединения – это производные ароматических углеводородов, содержащие в своем составе одну или несколько нитрогрупп. Они могут содержать нитрогруппу, непосредственно связанную с бензольным ядром (нитроарены), и нитрогруппу в боковой цепи (нитроалкиларены).
8.3.1. Способы получения ароматических нитросоединений
Нитросоединения, содержащие нитрогруппу, связанную с ароматическим радикалом, получают нитрованием аренов смесью концентрированных азотной и серной кислот, называемой нитрующей смесью. Реакция протекает по механизму электрофильного замещения (SE):
бензол нитробензол
125
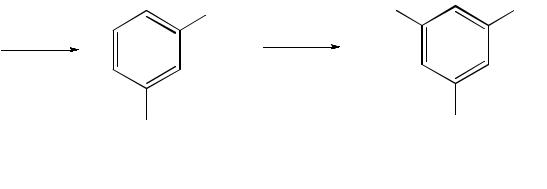
м-динитробензол |
1,3,5-тринитробензол |
Максимально в бензольное ядро можно ввести 3 нитрогруппы. Первая нитрогруппа настолько дезактивирует бензольное ядро, что для введения второй нитрогруппы требуются более жесткие условия, а третья вводится с большим трудом.
Для получения ароматических нитросоединений с нитрогруппой в боковой цепи применяют способы, аналогичные способам синтеза нитроалканов: нитрование гомологов бензола в условиях реакции Коновалова; взаимодействие арилалкилгалогенидов с солями азотистой кислоты и др.
8.3.2. Физические свойства ароматических нитросоединений
Нитроарены, содержащие в своем составе одну нитрогруппу, представляют собой жидкости или кристаллические вещества, бесцветные или окрашенные в бледно-желтый цвет, не растворимые в воде. Жидкие нитросоединения тяжелее воды. Нитроарены обладают запахом горького миндаля. Это полярные вещества, имеющие высокие температуры плавления.
Нитроарены, содержащие несколько нитрогрупп (полинитросоединения) – это кристаллические вещества, окрашенные в желтый цвет, взрывчатые.
8.3.3. Химичесие свойства ароматических нитросоединений Восстановление нитроаренов (реакция Зинина). При восстановлении
ароматических нитросоединений образуются ароматические амины.
В качестве восстановителей чаще используют железо, олово или цинк в хлороводородной кислоте, сульфид аммония (NН4)2S, гидросульфид натрия NаНS или гидразин H2N–NH2 в присутствии никеля Ренея.
Взависимости от рН реакционной среды процесс восстановления может идти по двум направлениям, различающимся образованием разных промежуточных соединений.
Внейтральной (рН = 7) и кислой (рН < 7) средах в качестве промежуточных соединений образуются ароматические нитрозосоединения и арилгидроксиламины:
126
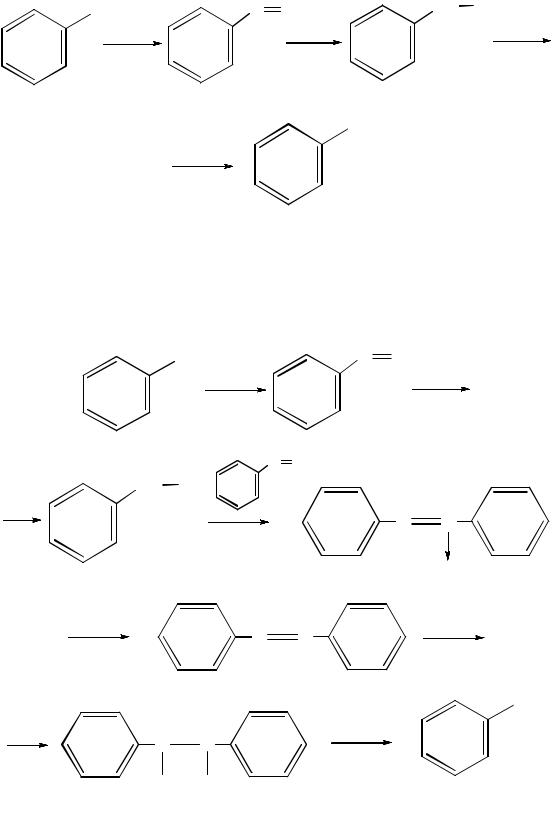
нитробензол нитрозобензол фенилгидроксиламин
анилин
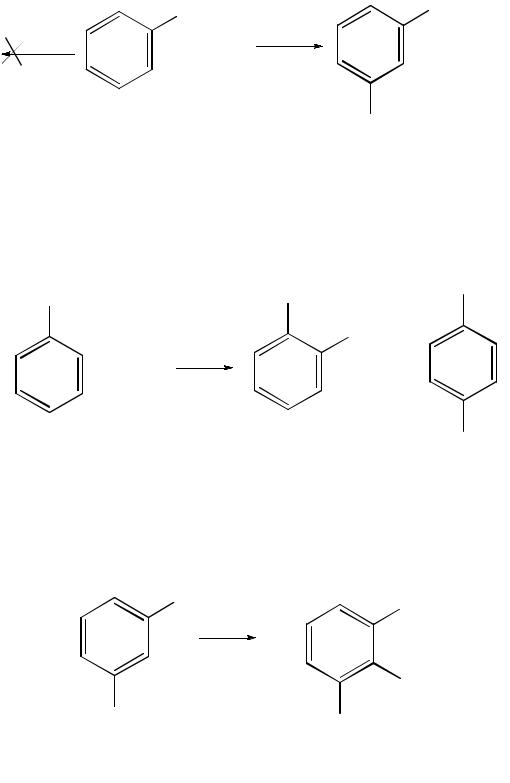
В щелочной среде (рН > 7) происходит конденсация образующихся в процессе реакции нитрозосоединений с арилгидроксиламином и образуются азоксисоединения. Последние присоединяют водород и превращаются в гидразосоединения, которые, в свою очередь, легко переходят в ариламины:
нитробензол нитрозобензол
фенилгидроксиламин |
азоксибензол |
азобензол
гидразобензол |
анилин |
Реакцию восстановления нитроаренов в щелочной среде можно остановить на любой из приведенных стадий. Она служит основным способом получения азо- и гидразосоединений. Реакция открыта в 1842 г. русским ученым Н. Н. Зининым.
127
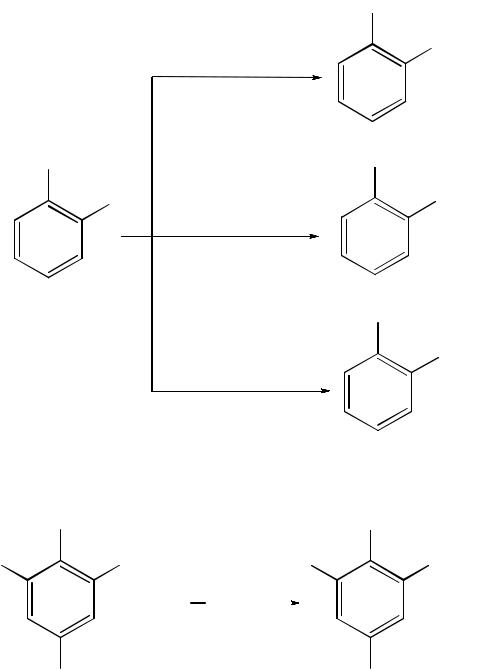
Реакции электрофильного замещения (SE ) в ароматическом ядре. Под влиянием нитрогруппы (–I; –М) понижается реакционная способность бензольного ядра в реакциях электрофильного замещения. Так, нитробензол не алкилируется в условиях реакции Фриделя–Крафтса, но может вступать в реакции нитрования, галогенирования, сульфирования с образованием мета- замещенных нитроаренов:
м-хлорнитробензол
Реакции нуклеофильного замещения (SN ) в ароматическом ядре. По-
ниженная электронная плотность в ароматическом ядре нитроаренов создает условия для реакции нуклеофильного замещения в аренах. В реакциях SN нитрогруппа направляет заместитель в орто- и пара-положения:
о-нитрофенолят калия |
п-нитрофенолят калия |
Соединения, содержащие две и более нитрогруппы, придают повышенную подвижность атомам водорода, находящимся в орто- и пара- положениях бензольного ядра. Так, сам нитробензол не окисляется, а динитробензол окисляется легко:
динитробензол 2,6-динитрофенол
128
По этой же причине легко замещается атом хлора в молекуле о-нитро- хлорбензола. Это позволяет получать различные нитропроизводные ароматического ряда:
При действии на тринитробензол гидроксиламина атом водорода легко замещается аминогруппой:
|
H |
|
|
NH2 |
O2N |
NO2 |
O2N |
NO2 |
|
|
+ H2N OH |
|
|
+ H2O. |
|
|
|
||
NO2 |
NO2 |
|
2,4,6-тринитроанилин |
Ароматические нитросоединения, содержащие нитрогруппу в боковой цепи, в реакциях, идущих при участии нитрогруппы, напоминают нитроалканы. Они легко восстанавливаются до аминов, растворяются в щелочах с образованием солей аци-нитроформы. Наличие ароматического радикала позволяет им вступать в различные реакции замещения по ароматическому ядру.
129
8.4. Идентификация нитросоединений
Для идентификации нитросоединений используют инструментальные (ИК-, УФ-спектроскопия, масс-спектрометрия) и химические методы анализа.
ИК-спектры нитросоединений характеризуются наличием интенсивных полос поглощения, отвечающих валентным колебаниям нитрогруппы. Для нитроалканов полоса поглощения отмечается при значениях около 1580 и 1375 см–1. В ИК-спектрах нитроаренов наблюдаются две сильные полосы поглощения в областях 1560…1490 и 1380…1320 см–1.
В УФ-спектрах нитросоединений присутствуют полосы поглощения, соответствующие π→π* переходу. В нитроалканах такой переход наблюдается в области 210 нм (ε = 1500). В УФ-спектрах нитроаренов присутствует полоса поглощения в области 250…300 нм (ε = 6000).
Для идентификации обычно используют химические реакции, которые позволяют отличать одно соединение от другого или различать группы соединений.
Чтобы отличить первичные, вторичные и третичные нитроалканы друг от друга, используют реакции со щелочью и азотистой кислотой. Эти же реакции позволяют отличить нитроалканы от нитроаренов, а также нитроарены от ароматических нитросоединений с нитрогруппой в боковой цепи.
Для идентификации ароматических нитросоединений, содержащих нитрогруппу в ядре, применяется реакция восстановления до аминов с последующим диазотированием и азосочетанием.
Контрольные вопросы и упражнения по гл. 8
1.Напишите структурные формулы следующих нитросоединений: а) 2-ме- тил-4-нитропентан; б) 1-нитро-2-фенилпропан; в) 3-метил-1-нитробутан. Укажите среди изображенных структур первичные, вторичные и третичные нитросоединения.
2.На примере 2-метил-1-нитропропана изобразите схему аци-нитро- таутомерии.
3.Какие из приведенных нитросоединений реагируют с азотистой кис-
лотой: а) 1-нитропропан; б) 2-метил-2-нитропропан; в) 2-нитропропан; г) нитробензол? Напишите схемы и назовите продукты реакций.
4. Какие продукты образуются при взаимодействии этилбензола: а) с конц. HNO3; б) с разб. HNO3, р, t? Напишите схемы реакций.
130
