
пособие_2_2022
.pdf
Прямое галогенирование ароматических углеводородов протекает по механизму SE в присутствии катализаторов хлоридов металлов (АlСl3, FeBr3,
SbCl3):
.
хлорбензол
Катализатор способствует образованию положительного иона галогена, который осуществляет замещение в бензольном ядре. В избытке галогена образуются ди- и тригалогенарены.
Замещение диазогруппы в солях арилдиазония на атом галогена (ре-
акция Зандмейера) происходит под воздействием хлорида меди (I):
бензолдиазония хлорид |
хлорбензол |
Для введения атома галогена в боковую углеродную цепь аренов используют такие методы, как галогенирование алкиларенов и реакция хлорметилирования.
Галогенирование алкиларенов. В отличие от галогенирования в ароматическое ядро галогенирование в боковую цепь происходит без катализатора при высоких температурах или при УФ-облучении. Реакция протекает по механизму SR:
|
h |
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
толуол бензилхлорид
|
h |
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бензилиденхлорид трихлорметилбензол
111
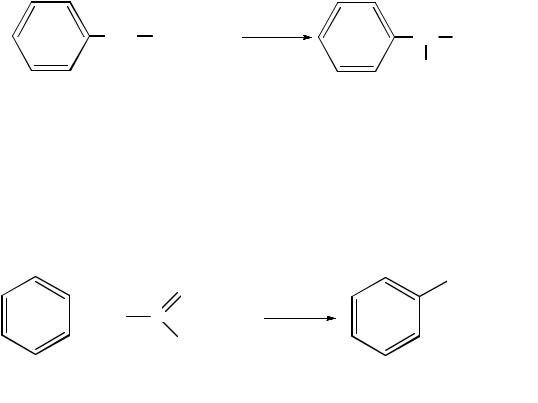
Галогенирование в боковую цепь идет, как правило, в α-положении относительно бензольного ядра, поскольку в этом случае образуется устойчивый свободный радикал бензильного типа:
h
.
1-фенил-1-хлорэтан
В избытке галогена все атомы водорода при α-атоме углерода в молекуле могут быть замещены на атомы галогена.
Реакция хлорметилирования используется для получения арилметилхлоридов. Она основана на взаимодействии аренов с формальдегидом и хлороводородом в присутствии катализатора (AlCl3, ZnCl2). В процессе реакции
атом водорода бензольного кольца замещается хлорметильной группой:
.
формальдегид |
бензилхлорид |
Для получения ароматических галогеноуглеводородов с атомами галогена в боковой цепи пригодны все методы получения галогенопроизводных алифатического ряда.
7.4.2. Физические свойства ароматических галогеноуглеводородов
Галогенопроизводные бензола и его гомологов являются жидкостями или кристаллическими веществами. Температуры кипения галогенаренов возрастают в ряду: фтор-, хлор-, бром-, йодпроизводные. Все соединения этого ряда не растворимы в воде, но легко растворяются в органических растворителях. Арилалкилгалогениды с атомами галогена в α-положении боковой цепи раздражают слизистые оболочки глаз, вызывая слезотечение.
7.4.3. Химические свойства ароматических галогеноуглеводородов
Для ароматических галогеноуглеводородов характерны реакции нуклеофильного замещения (SN) с участием связи C–Hal, реакции электрофиль-
ного замещения (SE) по ароматическому ядру и реакции с металлами (металлирование).
112
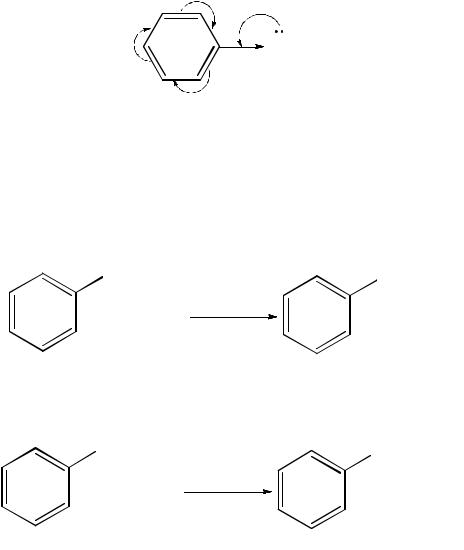
Реакции нуклеофильного замещения (SN ). Соединения, в которых га-
логен непосредственно связан с бензольным ядром, характеризуются низкой реакционной способностью связи С–Hal. Это обусловлено сопряжением неподеленной пары электронов атома галогена с π-электронной системой бензольного ядра:
В результате сопряжения происходит укорочение и уменьшение полярности связи «углерод–галоген», что упрочняет ее. Поэтому нуклеофильное замещение атома галогена в галогенаренах происходит лишь в очень жестких условиях. Так, в молекуле хлорбензола атом хлора замещается на гидроксильную группу под действием концентрированного раствора щелочи при температуре свыше 300 °С и давлении 15 · 106 Па:
хлорбензол |
фенол |
Реакция с аммиаком происходит при 200 °С в присутствии катализатора – порошка меди или солей одновалентной меди (реакция Ульмана):
хлорбензол |
анилин |
Все эти факты можно объяснить с позиций аринового механизма взаимодействия, согласно которому замещение атома галогена нуклеофилом идет не прямо, а через предварительное отщепление галогеноводорода и последующее присоединение нуклеофила. Сначала нуклеофильный реагент, будучи сильным основанием, отщепляет от молекулы галогенарена галогеноводород, образуя нестойкий и очень реакционноспособный промежуточный продукт – дегидробензол (арин), содержащий в своем составе тройную связь. Затем дегидробензол мгновенно присоединяет по месту тройной связи нуклеофильный реагент, причем ковалентную связь с нуклеофилом может образовать в равной степени любой из двух атомов углерода, связанных тройной связью:
113
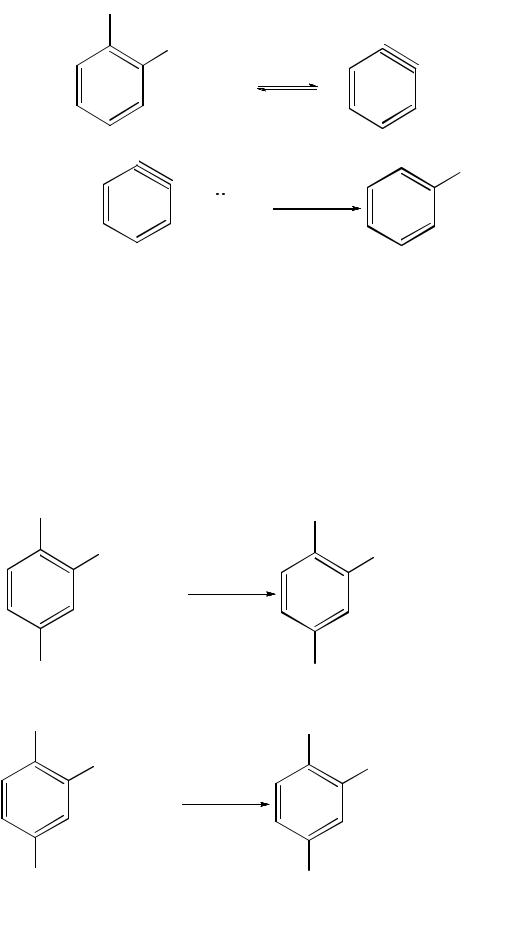
– стадия I
;
хлорбензол
NH2
– стадия II |
+ NH3 |
дегидробензол (арин) анилин
Этотмеханизмназываютещемеханизмомэлиминирования–присоединения. Вместе с тем подвижность атома галогена в галогенаренах резко возрастает при наличии в орто- или пара-положениях по отношению к атому галогена
сильных электроноакцепторных заместителей (–NO2, –NO, –CN, –COOH, –SO3H и др.). Такие соединения называют активированными галогенаренами. Повышение реакционной способности связи «углерод–галоген» в активированных галогенаренах связано с увеличением дробного положительного заряда на атакуемом атоме углерода под влиянием электроноакцепторного заместителя:
;
2,4-динитро-1-хлорбензол 2,4-динитрофенол
;
2,4-динитро-1-хлорбензол 2,4-динитроанилин
114
.
2,4-динитро-1-хлорбензол 2,4-динитро-1-метоксибензол
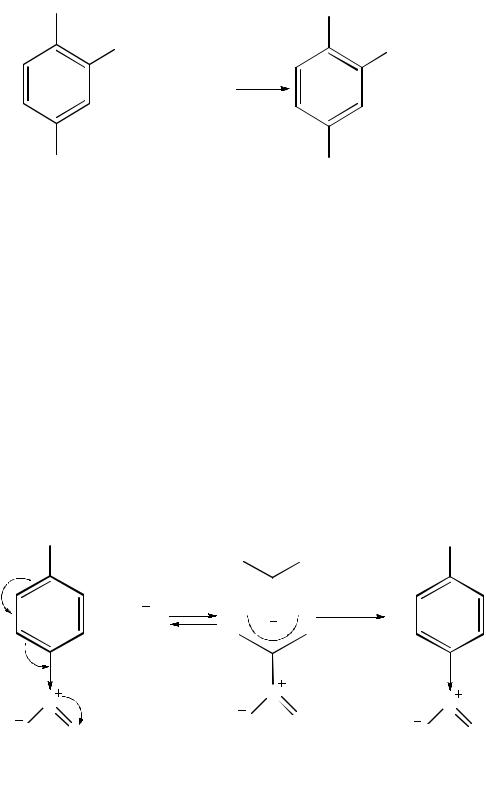
Реакции нуклеофильного замещения активированного атома галогена протекают по механизму SN2. Однако в отличие от реакций по этому механизму в алифатическом ряду, которые протекают в одну стадию и сопровождаются синхронными процессами разрыва связи C–Hal и образования связи C–Nu, бимолекулярное нуклеофильное замещение в ароматическом ряду происходит в две стадии. На стадии I атакующая нуклеофильная частица присоединяется к электрофильному атому углерода, который связывается с атомом галогена, образуя карбанион (σ-комплекс). Электроноакцепторные группы в составе карбаниона участвуют в делокализации отрицательного заряда и тем самым повышают его устойчивость. Первая стадия протекает медленно и лимитирует скорость всего процесса. На быстрой стадии реакции карбанион отщепляет галогенид-ион с образованием продукта замещения:
медленно 
 быстро
быстро
В отличие от реакций SN2 в алифатическом ряду при бимолекулярном
нуклеофильном замещении в ароматическом ряду процессы образования связи «углерод–нуклеофил» и разрыва связи «углерод–галоген» происходят несинхронно, поскольку новая связь образуется раньше, чем разрывается прежняя.
Ароматические галогеноуглеводороды с атомом галогена в боковой цепи легко вступают в различные реакции нуклеофильного замещения. Соединения, в которых атом галогена изолирован от бензольного кольца двумя и
115
более углерод-углеродными связями, по активности в реакциях SN напоми-
нают галогеналканы. Галогеноуглеводороды, содержащие атом галогена у α-атома углерода боковой цепи (бензилгалогениды), обладают повышенной реакционной способностью связи С–Hal. По активности в реакциях SN бензилгалогениды сходны с аллилгалогенидами. Нуклеофильное замещение атома галогена происходит в них по механизму SN1. Высокая подвижность
атома галогена в бензилгалогенидах обусловлена большой устойчивостью бензильного катиона, образующегося после отщепления галогенид-иона.
Реакции электрофильного замещения в ароматическом ядре (SE ). По ароматическому ядру галогенарены вступают в обычные реакции электрофильного замещения: галогенирование, нитрование, сульфирование и др. Как уже отмечалось, атом галогена, непосредственно связанный с ароматическим кольцом, проявляет отрицательный индуктивный и положительный мезомерный эффекты, причем в статическом состоянии –I-эффект сильнее +М-эффек- та. Поэтому атомы галогена в целом проявляют электроноакцепторные свойства по отношению к бензольному кольцу и тем самым снижают его реакционную способность в реакциях SЕ. Принимая участие в стабилизации σ-комп- лексов, образующихся при замещении в орто- и пара-положениях, атомы галогенов выступают как заместители I рода и направляют электрофильное замещение в орто- и пара-положения:
хлорбензол |
о-нитрохлорбензол п-нитрохлорбензол |
хлорбензол |
о-хлорбензол- |
п-хлорбензол- |
|
сульфокислота |
сульфокислота |
||
|
116
Реакции с металлами (металлирование). Галогенарены легко вступа-
ют в реакции с литием, натрием, магнием. При взаимодействии с магнием в среде диэтилового эфира образуются магнийорганические соединения (реактивы Гриньяра):
бромбензол фенилмагнийбромид
В условиях реакции Вюрца–Фиттига металлорганическое соединение образуется в качестве промежуточного продукта:
фенилнатрий
бифенил
7.5. Идентификация галогенопроизводных углеводородов
Наиболее простым способом обнаружения галогена в органическом соединении является проба Бейльштейна. Она основана на способности галогеноуглеводородов при нагревании с медью образовывать летучие галогениды меди (II), окрашивающие пламя горелки в зеленый цвет. Проба Бейльштейна очень чувствительна, однако она не позволяет определить природу галогена. Нельзя также с ее помощью определить фтор, поскольку фториды меди (II) нелетучи.
Для определения природы галогена в органическом веществе применяют метод сплавления с металлическим натрием. При сплавлении галогеноуглеводородов с натрием образуются галогениды натрия, в которых галогенидион определяют реакцией с нитратом серебра в азотнокислой среде.
В ИК-спектрах галогенопроизводных углеводородов наблюдаются полосы поглощения, обусловленные валентными колебаниями связи С–Hal. Связь C–F проявляется в области 1350…1000 см–1, связь C–Cl – в области 800…600 см–1. Валентные колебания связей C–Br и C–I находятся в диапазоне ниже 600 см–1, который не доступен для измерения большинством существующих ИК-спектрометров.
117
Химические сдвиги протонов в ПМР-спектрах галогеналканов зависят от природы галогена и разветвления углеродной цепи у атома углерода, с которым связан атом галогена. Вследствие дезэкранирующего эффекта атома галогена сигналы протонов, находящихся у того же атома углерода, что и атом галогена, сдвинуты в слабое поле и характеризуются химическим сдви-
гом 2,8…4,2 млн–1.
Для идентификации галогенаренов широко применяют метод масс-спект- рометрии. Ароматический характер этих соединений способствует образованию довольно стабильных молекулярных ионов, интенсивность пиков которых достаточна для качественного и количественного определения галогена.
Контрольные вопросы и упражнения по гл. 7
1. Назовите по заместительной номенклатуре IUPAC следующие соедине-
ния:
а |
б |
в |
г |
д |
е |
ж
2.Расположите следующие соединения в порядке увеличения подвижности атома галогена в их молекулах: а) хлорэтан; б) бромэтан; в) йодэтан. Ответ поясните.
3.Напишите схемы реакций 2-хлорбутана со следующими реагентами:
а) NaОН (Н2О); б) NaОН (в С2Н5ОН); в) С2Н5O–Na+; г) AgNO2; д) КCN;
е) Мg. В схемах «а»–«д» обозначьте механизмы реакций.
4.В каждой из приведенных пар выберите соединения с более подвижным атомом галогена: а) бензилхлорид и хлорбензол; б) аллилхлорид и винилхлорид; в) аллилхлорид и 1-хлорпропан.
118
5.Какие из перечисленных веществ реагируют с водным раствором NaОН и аммиака в обычных условиях: а) хлорбензол; б) хлорэтан; в) п-нит- робензол; г) п-хлортолуол; д) винилхлорид; е) аллилхлорид?
6.Напишите схемы реакций аллилхлорида, винилхлорида и 3,3,3-три- хлорпропена с хлороводородом. Объясните направления реакций.
7.Приведите схемы реакций, с помощью которых можно получить геминальные и вицинальные дигалогенопроизводные алканов.
8.Напишите уравнения реакций 2,2-дибромбутана и 1,1-дибромбутана с водным и спиртовым растворами NaOH.
9.Приведите механизмы реакций 1-хлорпропана и 2-метил-2-хлорпро- пана с водным и спиртовым растворами NaOH.
10.Назовите факторы, способствующие протеканию реакций по механизмам SN2 н SN1.
119

8. НИТРОСОЕДИНЕНИЯ
Нитросоединения – это производные углеводородов, содержащие в своем составе одну или несколько нитрогрупп (–NO2).
Нитрогруппа имеет плоское строение, атомы азота и кислорода в ней находятся в состоянии sр2-гибридизации. Электронное строение нитрогруппы можно представить с помошью граничных (резонансных) структур:
или
Один из атомов кислорода соединен с атомом азота двойной связью, а другой – семиполярной связью (от англ. semi – наполовину), т. е. связь нитрогруппы является полуполярной.
В действительности оба атома кислорода в нитрогруппе равноценны, поэтому ее строение можно представить следующимобразом:
Вещества с семиполярными связями имеют большой дипольный момент, они обычно кипят при более высоких температурах, чем изомерные им вещества без семиполярных связей.
В зависимости от природы углеводородного радикала, с которым связана нитрогруппа, различают алифатические и ароматические нитросоединения. Алифатические нитросоединения могут быть насыщенными (нитроалканы) и ненасыщенными (нитроалкены, нитроалкины). Ароматические нитросоединения могут содержать нитрогруппу, непосредственно связанную с бензольным ядром (нитроарены), и нитрогруппу в боковой цепи (нитроалкиларены). По расположению нитрогруппы в углеродной цепи нитроалканы и нитроарены с нитрогруппой в боковой цепи подразделяют на первичные, вторичные и третичные:
первичное |
вторичное |
третичное |
нитросоединение |
нитросоединение |
нитросоединение |
120
