
Окисление полупроводников
Планарная технология получила свое развитие благодаря широкому использованию в качестве базового процесса технологию локального окисления, развитую Фрошем и Дериком.
По назначению и выполняемым функциям слои окисла подразделяются на:
активный технологический слой – источник диффузанта;
пассивный технологический слой – маска при диффузии и ионной имплантации, пассиватор (подавитель эрозии) поверхности;
пассивный диэлектрик – защита поверхности и межслоевая изоляция;
активный конструкционный материал – подзатворный и конденсаторный диэлектрик.
С точки зрения областей применения окисла могут быть выделены следующие требования к его свойствам:
максимальная плотность;
высокое пробивное напряжение;
низкий тангенс угла диэлектрических потерь;
для изоляционного и подзатворного диэлектрика желательно низкое значение ε, для конденсаторного – высокое;
толщина подзатворного диэлектрика должна быть 5 – 10 нм;
низкая плотность поверхностных состояний.
Комплиментарные диэлектрики: SiO2, Si4N4, Al2O3, Ta2O5, TiO2, полиимид. Сочетание SiO2 и Si4N4 применяется для обеспечения резких границ маски, поскольку оксид кремния травится в тех травителях, к которым стоек нитрид кремния.
Al2O3 находит применение в качестве изолирующих слоев, защитного покрытия окон космических кораблей, полиимид чрезвычайно стоек к внешним воздействиям – из него изготавливают стекла для истребителей.
Методы окисления:
термическое;
ионно-плазменные (корпускулярные);
электрохимические.
Термическое окисление. Способы реализации и особенности
Выделяют разновидности методики:
окисление в сухом кислороде;
окисление в сухом кислороде в присутствии паров HCl (хлорное окисление). В окислителе присутствуют ионы, в частности, ионы Na+, которые могут мигрировать в окисле. Хлор связывает ионы натрия и подавляет их миграцию;
влажное окисление (в присутствии кислорода и паров воды). Применяется для увеличения скорости окисления, однако в результате получается менее плотный окисел;
окисление при высоком давлении (до 25 атм.). Позволяет снизить температуру процесса, повысить скорость, увеличить плотность окисла и уменьшить количество незаполненных связей, получать радиационно- и термически стойкие окислы;
быстрое термическое окисление при повышенной интенсивности нагревания. Цель такого процесса – уменьшить продолжительность процесса окисления, уменьшить изменение диффузионных профилей.
Процесс окисления кремния описывается реакциями:
Si + O2 → SiO2тв
Si + 2H2O → SiO2тв + 2H2↑
В начальный момент взаимодействия окислителя с кремнием происходит химическая реакция с образованием оксида на поверхности подложки. Скорость реакции высокая, образуется тонкий окисел (4 – 5 нм), который называют естественным окислом. При низких температурах процесс на этом останавливается. При высоких температурах толщина окисла будет увеличиваться. Однако скорость роста оксида ограничивается уже не скоростью протекания химической реакции, а скоростью диффузии кислорода сквозь образовавшийся оксид до границы с кремнием, где и происходит реакция.
Теоретические основы процесса окисления были разработаны Дилом и Гроувом в 1965 году.
Процесс термического окисления кремния подчиняется линейно-параболическому закону:
![]() , (1.1)
, (1.1)
где х0 – толщина выращенного слоя SiO2, xn – первоначальная толщина оксида (обычно составляет 0,02 – 0,05 нм), t – продолжительность процесса окисления, kp – константа параболического роста, характеризующая процесс окисления за счет диффузии окислителя через SiO2, kl – константа линейного роста, характеризующая скорость процесса химической реакции кислорода с кремнием.
Выражение (1.1) удобнее представить в виде:
![]() ,
,
где k = kp/(2kl).
Коэффициенты kp и kl зависят от ряда факторов. Наиболее значимые из них: природа окисляемого материала, температура процесса и давление окислителя в атмосфере реакционной камеры.
Оптимальные условия окисления: Т = 700 – 1000 ºС, Р(О2) = 0,2 – 1·105 Па. Поскольку по мере увеличения толщины окисла имеет место замедление процесса диффузии, то наблюдается переход от линейного к параболическому закону роста окисла.
При окислении в среде влажного кислорода константы окисления вычисляются с использованием следующих выражений:
![]() ;
;
![]()
Константа параболического роста kп не зависит от поверхностной концентрации легирующей примеси Ns при концентрации меньше 5·1018 см-3, а константа линейного роста – при концентрации меньше 1·1019 см-3. Скорости окисления поверхности пластин с ориентацией <100> и <111> относятся как: k<100>/k<111> =0,59.
Пренебрегая концентрационной зависимостью и влиянием ориентации подложки, получим:
![]() ;
;
![]() ,
,
где значение давления подставляется в Паскалях, при этом толщина оксида получается в сантиметрах.
Перераспределение примесей при разгонке с одновременным окислением
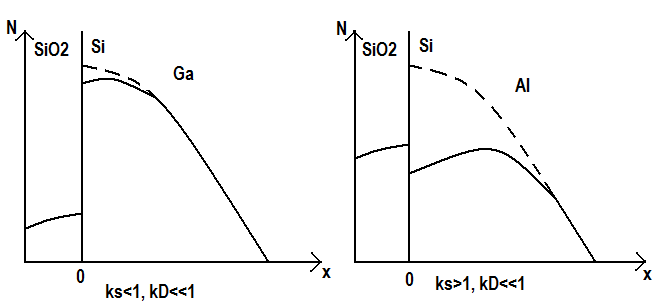
Константы сегрегации для основных легирующих примесей на границе между кремнием и оксидом (ks):
бор - 2…10, алюминий - ~ 103, галлий – 0,001…0,05, фосфор, мышьяк и сурьма – 0,001…0,1.
На рис. представлены профили распределения примесей в кремнии и оксиде, полученном во время разгонки примеси с одновременным окислением. В профилях учтено испарение примеси с поверхности. Пунктиром обозначено распределение примеси при диффузии из ограниченного источника без окисления. Независимо от коэффициента сегрегации происходит обеднение приповерхностного слоя кремния.

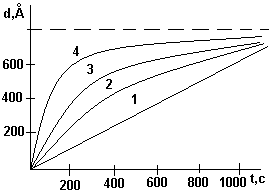
Переход от линейного закона роста (прямая 1) к параболическому и изменение крутизны кривой (кривые 1 – 4) происходит с повышением давления и температуры. Чем выше температура и давление, тем больше скорость насыщения.
Часто для описания процессов окисления пользуются эмпирическими формулами:
![]() ,
Т > 1100 К, сухое окисление
,
Т > 1100 К, сухое окисление
![]() ,
влажное окисление.
,
влажное окисление.
При окислении в парах воды большое значение имеет присутствие в растущей пленке водорода, который играет роль разрыхлителя. За счет образования связей Si —H пленка SiO2 имеет нанопустоты, через которые происходит диффузия окислителя. Поскольку пленка более пористая в этом случае уменьшается значение пробивного напряжения Eпр. Скорости сухого и влажного окисления относятся как 1:10, а изменение Епр происходит в десятки раз.
