
Орг_Хим_Все лекции_презы
.pdfФизические свойства дикарбоновых кислот
•Насыщенные дикарбоновые кислоты представляют собой кристаллические вещества.
•Низшие гомологи хорошо растворимы в воде. С увеличением молекулярной массы кислоты ее растворимость уменьшается.
•Температуры плавления кислот с четным числом атомов углерода выше температур плавления соседних кислот с нечетным числом атомов углерода.
•Малеиновая и фумаровая кислоты представляют собой белые кристаллические вещества. Малеиновая кислота в отличие от фумаровой легко растворяется в воде и спиртах.
•Фталевые кислоты являются белыми кристаллическими веществами с высокими температурами плавления. Фталевая и терефталевая кислоты малорастворимы в воде, изофталевая кислота – легко растворима в воде.
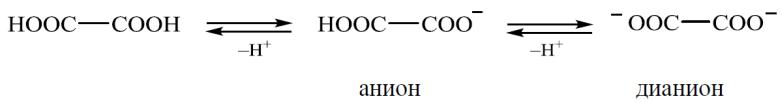
Химические свойства дикарбоновых кислот
Кислотные свойства
Имея в своем составе две карбоксильные группы, дикарбоновые кислоты диссоциируют ступенчато, образуя анион и дианион.
Высокая кислотность по первой ступени объясняется взаимным влиянием второй карбоксильной группы. По мере удаления карбоксильных групп ослабевает их взаимное влияние и кислотность по первой ступени падает.
От второй карбоксильной группы протон отрывается труднее вследствие низкой стабильности дианиона.
Химические свойства дикарбоновых кислот
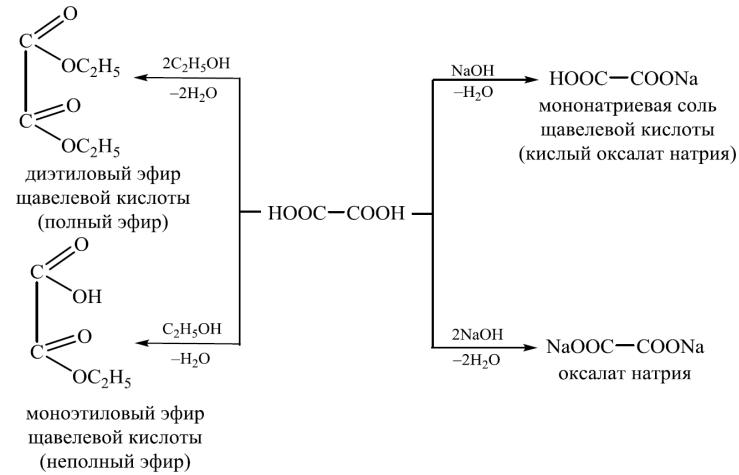
По химическим свойствам дикарбоновые кислоты, как и монокарбоновые, способны образовывать одни и те же функциональные производные. Только в зависимости от того, одна или две карбоксильные группы участвуют в реакции, получают кислые или средние соли, полные или неполные, а также эфиры, галогенангидриды, амиды и другие соединения
Химические свойства дикарбоновых кислот
Дикарбоновые кислоты проявляют и ряд специфических свойств.
Превращения дикарбоновых кислот при нагревании
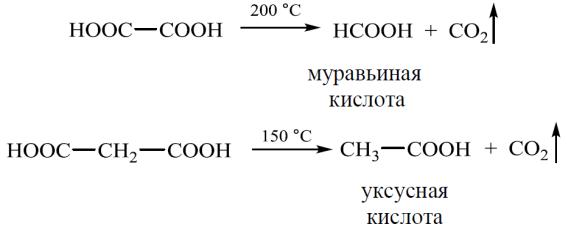
Щавелевая и малоновая кислоты при нагревании выше температуры плавления отщепляют оксид углерода (IV) и превращаются в монокарбоновые кислоты
Химические свойства дикарбоновых кислот
Превращения дикарбоновых кислот при нагревании
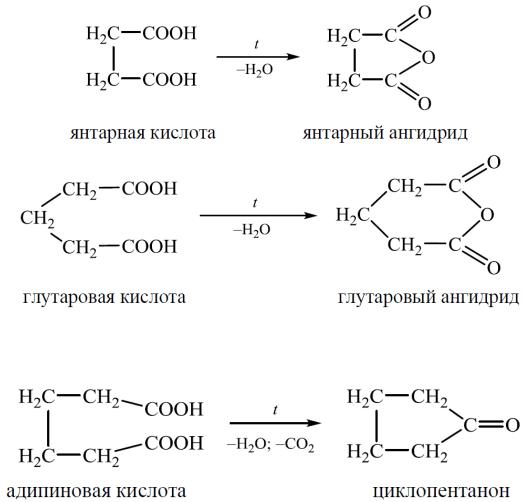
При нагревании янтарной и глутаровойкислот, взаимное влияние карбоксильных групп которых слабее, идет внутримолекулярная дегидратация с образованием циклических ангидридов:
Адипиновая кислота в этих условиях подвергается декарбоксилированию и дегидратации с образованием циклического кетона
Химические свойства дикарбоновых кислот
Превращения дикарбоновых кислот при нагревании
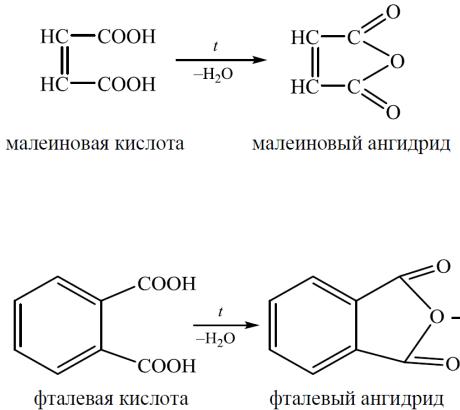
Малеиновая кислота при нагревании легко подвергается внутримолекулярной дегидратации и образует циклический ангидрид
Фталевая кислота в отличие от своих изомеров при нагревании легко теряет молекулу воды с образованием ангидрида
Химические свойства дикарбоновых кислот
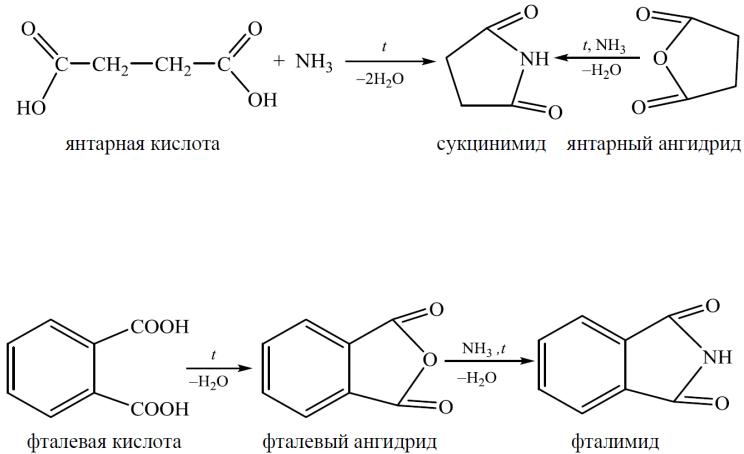
Образование циклических амидов
При нагревании янтарной и глутаровой кислот или их ангидридов с аммиаком образуются циклические имиды
Фталевая кислота при нагревании легко теряет молекулу воды с образованием ангидрида, который при взаимодействии с аммиаком образует фталимид
Органическая химия
Тема 20: Функциональные производные
карбоновых кислот
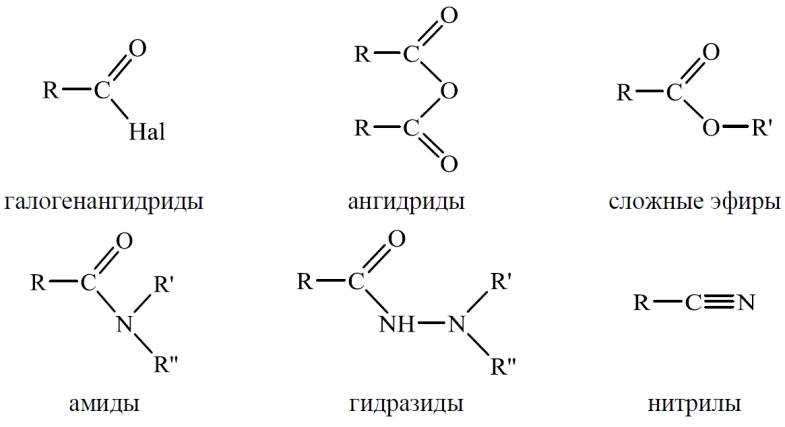
Функциональные производные карбоновых кислот
К функциональным производным карбоновых кислот относятся
•галогенангидриды
•ангидриды
•сложные эфиры
•амиды
•гидразиды
•нитрилы
•соли
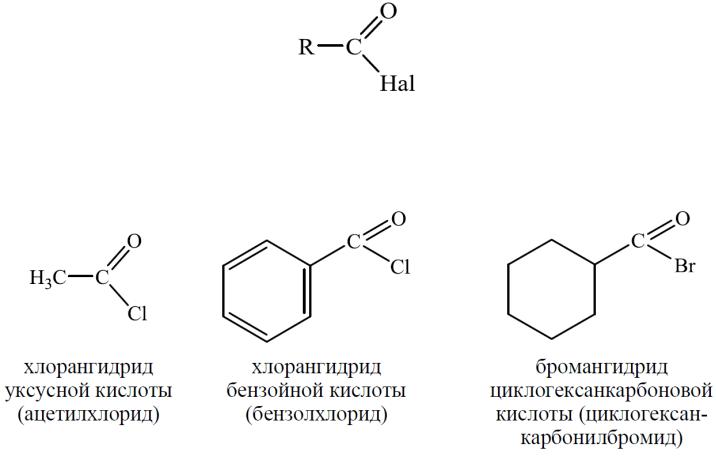
Галогенангидриды карбоновых кислот
Галогенангидриды карбоновых кислот (ацилгалогениды) – это производные карбоновых кислот, в которых гидроксильная группа, входящая в состав карбоксильной группы, замещена атомом галогена (хлора или брома, реже – фтора или йода).
Названия ацилгалогенидов образуют из названий соответствующих кислот или ацильных групп и названий галогенов
